Method Article
Une approche semi-quantitative pour évaluer la formation de biofilms utilisant le développement des colonies ridée
Dans cet article
Résumé
Nous fournissons un simple, méthode semi-quantitative pour étudier la formation de biofilm In vitro. Cette méthode tire parti de l'STEMI Zeiss 2000-C microscope à dissection (avec pièce jointe caméra) pour surveiller la fois le calendrier et les modalités de la formation de biofilm, tel qu'évalué par le développement des colonies ridées.
Résumé
Les biofilms, ou attachée sur la surface des communautés de cellules encapsulées dans une matrice extracellulaire, représentent un mode de vie commune pour de nombreuses bactéries. Dans un biofilm, les cellules bactériennes présentent souvent altéré la physiologie, y compris une résistance accrue aux antibiotiques et d'autres stress environnementaux 1. En outre, les biofilms peuvent jouer des rôles importants dans les interactions hôte-microbe. Les biofilms se développent lorsque les bactéries de transition de l'individu, les cellules planctoniques pour former complexes, multi-cellulaires communautés 2. Dans le laboratoire, les biofilms sont étudiés en évaluant le développement de phénotypes spécifiques du biofilm. Un phénotype biofilm commune implique la formation de rides ou rugueux colonies bactériennes sur gélose solide médias 3. La formation de colonies ridée fournit un moyen particulièrement simple et utile pour identifier et caractériser les souches bactériennes présentant des phénotypes modifiés biofilm, et d'enquêter sur les conditions environnementales que la formation de biofilms d'impact. Wrila formation de colonies nkled sert d'indicateur de la formation de biofilm dans une variété de bactéries, y compris les deux bactéries gram-positives, comme Bacillus subtilis, 4 et bactéries à Gram négatif, comme Vibrio cholerae 5, 6 Vibrio parahaemolyticus, Pseudomonas aeruginosa 7, et Vibrio fischeri 8.
La bactérie marine V. fischeri est devenu un modèle pour la formation de biofilm en raison du rôle critique de biofilms au cours de colonisation de l'hôte: les biofilms produite par V. fischeri promouvoir sa colonisation de les 8-10 hawaïennes bobtail calmars scolopes Euprymna. Il est important, les phénotypes observés in vitro de biofilm en corrélation avec la capacité de V. cellules fischeri efficacement coloniser les animaux d'accueil: les souches ayant une déficience pour la formation de biofilm in vitro possèdent un défaut 9,11 colonisation, alors que les souches présentant augmentéphénotypes biofilm sont améliorées pour la colonisation 8,12. V. fischeri fournit donc un système modèle simple pour évaluer les mécanismes par lesquels les bactéries régulent la formation de biofilm et comment biofilms colonisation de l'hôte d'impact.
Dans ce rapport, nous décrivons une méthode semi-quantitative pour évaluer la formation de biofilms en utilisant V. fischeri comme un système modèle. Cette méthode implique l'attention des taches de cultures bactériennes à des concentrations définies et des volumes sur des supports solides agar; une culture tachetée est synonyme d'une seule colonie bactérienne. Cette technique de 'la culture tachetée »peut être utilisé pour comparer les phénotypes biofilm bruts simples, à un calendrier précis points de point final des essais), ou d'identifier et de caractériser les phénotypes biofilm subtiles à travers le temps-cours des essais de développement du biofilm et les mesures du diamètre colonie , qui est influencé par la formation de biofilm. Ainsi, cette technique fournit une analyse semi-quantitative de la formation de biofilm, parmitting évaluation de la synchronisation et la structuration de développement de la colonie ridée et la taille relative de la structure de développement, des caractéristiques qui vont au-delà de la morphologie générale simple.
Protocole
1. Caractérisation initiale et considérations
- La formation du biofilm est généralement influencée par la densité cellulaire et le taux de croissance. Par conséquent, il est nécessaire de déterminer le taux de croissance (augmentation de la densité optique (DO) au fil du temps) et le rendement (nombre de cellules final) de la souche (s) d'intérêt en effectuant la courbe de croissance simple et essais de placage de cellules. Défauts de la croissance, ou une absence de corrélation entre OD et le nombre de cellules, doivent être prises en considération lors de l'interprétation des résultats de repérer les expériences.
- Inclure les contrôles appropriés positifs et négatifs sur la même plaque lors de l'évaluation la formation de colonies ridée, comme mineur de plaque à plaque de variation peut influer sur le développement du biofilm.
- Identifier les meilleures conditions pour repérer, à savoir ceux qui révèlent les différences les plus marquées entre le contrôle et mutant (s) d'intérêt. Cultiver des souches en culture liquide dans des conditions diverses, telles que les différents médias ou à des températures et à des stades différentss de croissance (phase exponentielle ou stationnaire) avant spotting. Spot 10 ul de la culture à des densités cellulaires différentes sur les médias appropriés, et incuber à la température désirée jusqu'à morphologies des colonies deviennent apparents.
- Le dosage de point final comprend l'évaluation de la formation de colonies ridée en un point temps prédéterminé après spotting (soit 48 heures). Cette évaluation est utile pour les souches qui présentent (ou sont proposés à exposer) de graves défauts dans la formation de biofilm.
- Le test évalue évolution dans le temps la formation de colonies ridée sur une période de temps (c.-à-toutes les heures) post-spotting. Ce dosage permet une évaluation semi-quantitative de la formation de biofilm en permettant la détermination du début de la formation de colonies ridée et le développement motif sur une période de temps. La durée de l'expérience et le nombre de points de collecte pour un cours moment donné doit être déterminée dans des expériences préliminaires.
- Pour garder facilement la trace du temps post-spotting, fixé àimer à compter jusqu'à.
2. Évaluation microscopique de la morphologie des colonies froissé dans V. fischeri
- Inoculer V. cellules fischeri dans 5 ml de LB-Sel (LBS) moyenne 13 (1% [w / v] tryptone, 0,5% [w / v] extrait de levure, 2% [w / v] de chlorure de sodium, 50 mM Tris-HCl [ pH 7,5]) contenant des antibiotiques nécessaires et à incuber, en secouant, une nuit à 28 ° C. Dans la matinée, repiquer les cellules avec une dilution de 1:100 dans 5 ml de milieu LB frais et incuber dans les mêmes conditions jusqu'à ce que les cellules ont atteint la DO 600 désiré (par exemple, DO600 = 0,2 ou 0,5).
- Introduire à la pipette 1 ml de la culture dans un tube de micro centrifugeuse et dans un ensemble de micro à la vitesse maximale pendant une minute. Eliminer le surnageant par aspiration. Laver les cellules de retirer les supports et les composants résiduels extracellulaires en remettant en suspension le culot dans 1 ml de stériles 70% eau de mer artificielle (ASW) (35 mM MgSO 4-7H 2 O, 7 mM de CaCl2-2H 2 O, 210 mM de NaCl, 7 mM de KCl), et répéter la centrifugation. Remettre en suspension le culot lavé dans 1 ml de 70% ASW.
- Assurez-vous que chaque échantillon contient le même nombre de cellules, selon les estimations de la DO à 600 nm. Faire les ajustements nécessaires en diluant des échantillons plus concentrés avec plus de 70% ASW. Dans des expériences préliminaires, les cultures diverses au comptant des valeurs de DO initiale afin de déterminer un optimal OD de départ pour un ensemble donné de souches ou de conditions. Les meilleurs résultats sont obtenus pour V. fischeri lorsque les taches sont générés à partir de cultures avec une DO d'environ 0,2.
- Spot 10 pi des cellules lavées sur des plaques contenant des antibiotiques LBS nécessaires. Lorsque des taches d'une culture sur une plaque, assurez-vous que pour stabiliser la pipette (avec votre doigt) juste au-dessus de la surface de la gélose. Repérer verticalement, pas à un angle, et éjecter le liquide lentement pour une distribution uniforme de la tache. Typiquement, chaque souche est repéré une fois par plaque (jusqu'à 6 points par plaque), de l'espritplaques multiples h (2-3) par l'expérience.
- Pour veiller à ce que la culture tachetée reste uniformément répartie, permettre à l'endroit pour sécher avant de passer la plaque dans l'incubateur. Inverser les plaques et les incuber à 28 ° C.
- Surveiller la morphologie de la place croissante début horaire à 12-15 heures suivant l'inoculation. Nous utilisons un microscope à dissection (Zeiss Stemi 2000-C) avec un module appareil photo (PROGRES C10 PLUS) et le CapturePro Progrès et logiciels ImageJ d'observer et de documenter la morphologie des colonies et d'évaluer le début et la progression de la formation de colonies ridée.
- Pour la configuration spécifique répertoriée dans l'étape 2.5, les points sont éclairés par en dessous par une étape en verre transparent avec une source de CL 1500 CE de lumière froide, tandis que les images sont capturées par le haut. Cette configuration est optimale pour le développement d'imagerie colonie ridée parce V. colonies fischeri (taches) sont translucides.
- En l'absence de l'équipement spécifique prévue à rep 2,5, la morphologie moniteur colonie ridée en utilisant n'importe quel microscope de dissection, permettant la visualisation colonie complète et comporte une source de lumière réglable et, idéalement, une caméra ci-joint. Si nécessaire, un appareil photo numérique peut également être utilisé en l'absence d'une caméra connectée, mais ce n'est pas optimale.
- Pour mieux visualiser le développement des colonies ridée, il est nécessaire de régler à la fois l'intensité de l'éclairage et l'angle de réflexion sous les colonies bactériennes telles que la morphologie tridimensionnelle des biofilms en développement peuvent être discernés. Déterminer les conditions optimales d'éclairage qui fournissent le plus fort contraste entre la colonie repéré et l'arrière-plan gélose entourant, de telle sorte que l'architecture (rides) de la colonie se distingue nettement.
- Dans certains cas, la couleur de la colonie tachetée doivent également être pris en considération, comme des altérations de couleur des colonies peut se produire pendant la formation de biofilm. Ajuster l'intensité et l'angle de la source d'éclairage pour révélerces changements subtils dans la coloration. Une fois les paramètres appropriés sont atteints, les maintenir pendant toute la durée de l'expérience.
- Notez combien de temps s'écoule entre le moment de l'inoculation à l'heure à laquelle la formation de colonies ridée initie pour chaque souche ou d'une condition. Définir le début de la formation de colonies ridée que l'instant temporel auquel la formation d'un motif et les structures 3D (c.-à-stries formant sur le bord extérieur ou "rides" se produisant dans le centre) est d'abord apparente. Cellules mutantes peuvent présenter une diminution ou une augmentation du temps de début de la formation de colonies ridé (par exemple, fig. 2).
- Documenter le début et le développement de la formation de colonies ridée par la capture des images numériques appropriés. Il est important d'utiliser le même grossissement lors de la collecte des images tout au long de l'expérience. Mettez le point de vue de l'oculaire du microscope à l'écran de l'ordinateur en utilisant le levier situé à l'arrière de la caméra. Lors de la commutation entre l'oculaireet l'affichage écran de l'ordinateur, régler le point de vue et de se concentrer en conséquence.
- Avant cultures tachetés d'imagerie, le couvercle de la boîte de Pétri est généralement enlevé pour fournir l'image la plus. Toutefois, cette étape est facultative, en tant que cultures tachetés peuvent être imagées par le couvercle en utilisant la configuration décrite dans les étapes 2.5 et 2.6.
- A chaque point de temps après le début de la formation de colonies ridée, notez le modèle de développement de la colonie ridée. L'architecture peut se développer de l'intérieur dehors, ou à l'extérieur po Cette évaluation fournit un mécanisme pour distinguer les biofilms formés par des souches différentes ou dans des conditions différentes.
- Mesurer le diamètre de la colonie en développement à chaque instant. Cela peut être fait manuellement ou numériquement en utilisant un logiciel associé. Si cela est fait numériquement, utilisez le programme ProgRes logiciels CapturePro et d'abord étalonner la barre d'échelle à l'agrandissement spécifique utilisé dans l'expérience. Inclure la barre d'échelle dans chaque image capturée.
- Pour calculer le diamètre des colonies à l'aide du logiciel ImageJ, ouvrir chaque fichier image. Normaliser la barre d'échelle comme suit: Sélectionnez l'option «ligne droite» de la barre d'outils. Superposer la barre d'échelle intégré avec une ligne droite de la même longueur et en largeur. Sélectionnez "Définir l'échelle" de l'onglet "Analyser". Dans la "distance connue" boîte, insérez la longueur correspondante (tel que déterminé à partir de la barre d'échelle d'origine, c'est à dire, 2 mm) et sélectionnez "OK".
- Utilisez la "ligne droite" option pour insérer une ligne horizontale à travers la place. Sous l'onglet Analyser, sélectionnez "mesure". Dans la nouvelle fenêtre des résultats, la longueur calculée sera fourni. Obtenir une seconde mesure en insérant une ligne perpendiculaire à travers le champ. Re-calculer le diamètre. Noter la moyenne des deux mesures. Graphique du diamètre moyen pour chaque spot à chaque point de temps en utilisant un logiciel comme Excel.
- La fin de l'expérience se fait soit à un moment spécifié ou lorsqu'il n'y a pas encorele développement du biofilm. Une fois que la fin est atteinte, de consolider les images dans une figure (s) de visualiser le développement du patron au fil du temps en utilisant un logiciel tel que Powerpoint.
3. Les résultats représentatifs
Dans ces expériences, nous avons utilisé V. fischeri comme un organisme modèle pour étudier la formation de biofilms en évaluant le développement des colonies ridées sur une surface de la gélose solide. Biofilm-souches productrices de V. forment des colonies fischeri avec l'architecture 3D vaste au sein de 40 h (Fig. 1). 8,9,14 Si l'on examine sur une évolution dans le temps, il devient évident que la formation de colonies ridée par la souche de contrôle déclenche dès environ 12 h après l'inoculation (en fonction des conditions spécifiques) (Fig. 2) 9. En revanche, la formation de biofilm par un mutant représentant est retardée d'environ 4 h, ne pas engager jusqu'à environ 16 h après l'inoculation 9. REPEAts de ces expériences suggèrent que le moment était relativement stable, ce qui rend cette évaluation semi-quantitative 9. Un second élément semi-quantitative mesure de la formation de biofilm fait usage de la variation du diamètre de la colonie de développement dans le temps. Comme le montre la Fig. 3A, un représentant biofilm compétente souche forme des colonies que l'augmentation de la complexité et le diamètre par rapport à une souche représentative qui ne former des biofilms. Des mesures précises dans le temps des diamètres des colonies formées par ces deux souches révélé que la taille des colonies biofilm compétentes augmenté à un taux plus élevé que les colonies biofilm-négatives, et à l'instant final les deux diffère de près de 2 - pliage (figure 3B). Ainsi, bien que des images d'un temps représentant de la fin ou «point final» la morphologie des colonies sont fréquemment montré dans la littérature, supplémentaires, données semi-quantitatives peuvent être collectées afin de permettre une meilleure compréhension de la défectuosité du biofilm.
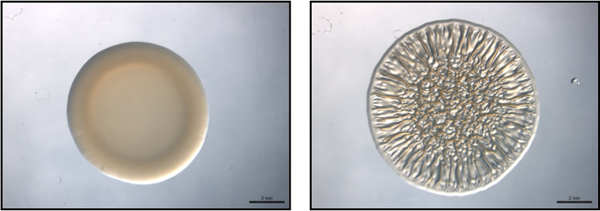
Figure 1. Point final du dosage. Ce chiffre est un exemple d'un essai point final à l'aide représentatifs non-formant les biofilms (à gauche) et le biofilm formation (à droite) des souches de V. fischeri. Ces images ont été recueillies à 40 h post-spotting. Ces images ont été générées avec le type sauvage V. fischeri contenant une lutte contre les vecteurs (non-biofilm formation) ou d'une partie RSCS surexprimant plasmide (biofilm formation) et étaient de l'ensemble des données recueillies pour Morris et al., 2011.
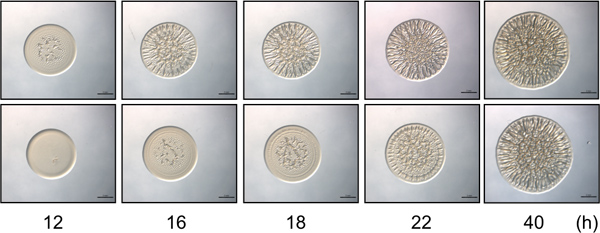
Figure 2. Temps-cours du dosage. Le panneau supérieur contient des images représentatives de la formation de biofilm par une souche de contrôle compétente de biofilm V. fischeri sur une évolution dans le temps sélectionné. Initiation de la formation de biofilm est évident à 12 h. Le panneau inférieur contient représentant images d'une souche mutante de V. fischeri qui présente un retard (4 h) dans le début de la formation de colonies ridée le temps, avec la formation de biofilm ouverture à 16 h après l'inoculation. Notez qu'à 40 heures les souches ressembler dans l'intensité et la structuration de la formation de biofilm, tandis que les différences subtiles entre ces souches ne sont observées que dans les points de temps antérieurs. Ces images ont été générées avec RSCS surexprimant de type sauvage et mutant Sype V. cellules fischeri et qui faisaient partie de l'ensemble des données recueillies pour Morris et al., 2011.
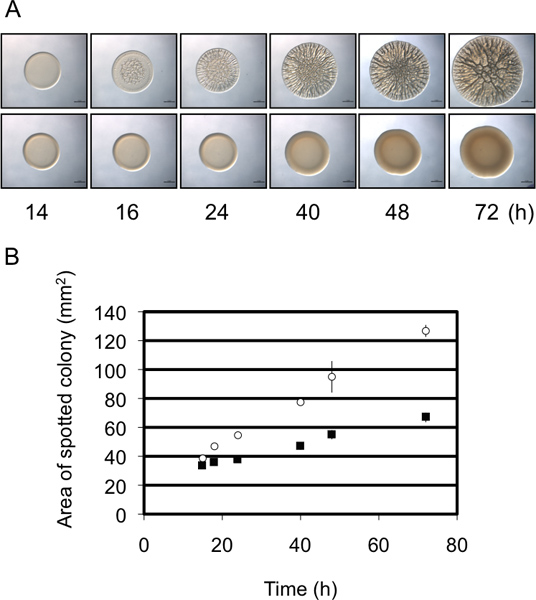
Diamètre des colonies Figure 3. Comme une analyse semi-quantitative de la formation de biofilm. Évolution dans le temps (A) de la formation de biofilm par représentatifs formant les biofilms (panneau supérieur) et non-biofilm formation (panneau inférieur) des souches de V. fischeri. Notez que la souche biofilm formation présente une plus grande augmentationde diamètre dans le temps par rapport à la souche non-biofilm formage. Ces images ont été générées avec le type sauvage V. fischeri contenant une partie RSCS surexprimant plasmide (biofilm formation) ou d'une lutte contre les vecteurs (non-biofilm formation) et étaient de l'ensemble des données recueillies pour Morris et al., 2011. (B) Une représentation graphique de l'augmentation de diamètre des colonies au fil du temps par les deux souches dans le panneau A. Ces données ont été générées à l'aide du logiciel ImageJ et Excel comme indiqué dans le protocole.
Discussion
Dans ce travail, nous décrivons une méthode semi-quantitative pour évaluer la formation de biofilms en utilisant V. fischeri comme un organisme modèle. Plus précisément, nous utilisons un microscope à dissection avec fixation caméra pour surveiller la formation de biofilms et le développement comme la formation de colonies ridée au fil du temps sur une surface de la gélose solide. Dans ce protocole, nous présentons deux types spécifiques de méthodes que nous utilisent couramment pour évaluer la formation de colonies ridée. Le premier est le test de point final, ce qui nous permet d'observer la finale, l'architecture globale 3D, modélisation, et le diamètre d'une culture tacheté à un point sélectionné le temps "finale". Cette approche est plus utile pour évaluer les souches mutantes ou des conditions qui conduisent à des défauts dramatiques dans la formation de biofilm. Cependant, cette approche ne fait pas de distinction entre les plus subtiles différences qui se produisent à des moments avant la fin du point sélectionné. Pour suivre de plus près la formation de colonies ridée, nous utilisons un test de cours à temps, ce qui nous permet d'identifier le début de wrinkled la formation de colonies et de regarder son développement au fil du temps. En conséquence de cette approche, les différences plus subtiles dans le calendrier de la formation de colonies ridée, architecture 3D, et les motifs peuvent être identifiés. Nous avons utilisé ce test bien sûr du temps pour générer deux dosages semi-quantitatifs de la formation de biofilm. Tout d'abord, l'heure à laquelle une souche commence à développer une architecture 3D peut être comparée à celle des souches de contrôle. Nous avons trouvé que le retard dans la formation de biofilms d'un mutant particulier dans les mêmes conditions est assez uniforme 9. Par exemple, dans les données présentées dans la figure. 2, le mutant a constamment fait preuve d'un retard de 4 h à initier la formation de biofilm. Un second élément semi-quantitative mesure de la formation de biofilm est le changement de la taille du diamètre de la colonie ridée (tache). Nous avons constaté que le diamètre des colonies ridées diffère progressivement de celle des non-biofilm colonies, pour atteindre une différence d'environ un facteur 2 à l'instant final (Fig. 3 ) (Morris et Visick, données non publiées). À ce jour, nous n'avons pas observé un phénotype sans l'autre (c.-à-la formation de biofilm, sans une augmentation de diamètre des colonies) (données non publiées), bien qu'il reste possible que certains mutants se comportent différemment. En effet, il a été rapporté pour V. cholerae que certains résultat ridée colonies à une augmentation substantielle de diamètre colonie tandis que d'autres ne le font pas 15. Pourtant, l'évaluation de la variation du diamètre au fil du temps pourrait aider à la caractérisation de mutants biofilm potentiels et / ou de fournir une mesure quantitative supplémentaire de mutants avec des retards dans le développement. Parmi les deux mesures de la formation de biofilm (temps et diamètre), la détermination du début de la formation de colonies ridée est plus sensible, mais aussi plus subjective, que de déterminer le diamètre de la tache. Même si, les deux mesures fournissent une évaluation semi-quantitative d'un phénotype qui est extrêmement utile aux chercheurs biofilm, mais pas de définir aisément des quantification.
Lors de l'exécution des essais de culture repéré, il est important de tenir compte des conditions environnementales dans lesquelles les souches sont cultivées repérés. La formation de colonies froissé est souvent influencée par diverses conditions environnementales, y compris la disponibilité des nutriments, la température et l'humidité. Pour réduire la variabilité entre les expériences, il est utile de normaliser ces conditions le plus possible (c.-à-standardisation des plaques de gélose à une quantité prédéterminée et la culture des souches repérées à une température contrôlée). Pour un contrôle supplémentaire de la variabilité entre les expériences de détachage, est important d'inclure les souches de contrôle appropriés au sein de chaque série d'expériences. Enfin, lors de l'interprétation des données provenant de ces essais, il est nécessaire d'effectuer une expérience d'un à plusieurs reprises (3 +), en particulier lors de l'évaluation des différences subtiles dans la formation de colonies (par exemple, ridée, un retard dans la formation de biofilm ou les différences de structuration). Certaines limitations de ce protocole sont les suivants: 1) détermiING si les cellules ont un défaut de la croissance peut être difficile: la croissance des cellules en culture liquide peut ne pas refléter avec précision les taux de croissance sur des supports solides, et une détermination précise de la croissance du biofilm formant cellules, qui peuvent se collent ensemble, peuvent ne pas être possible; 2) des souches présentant des défauts de croissance sera difficile à analyser; 3) il ne peut pas être possible de distinguer les différences de diamètre entre les souches présentant des phénotypes biofilm subtiles; 4) pour les souches qui ne poussent pas dans un anneau concentrique, il peut ne pas être possible de mesurer avec précision changements de diamètre, 5), tandis que de motifs peuvent être observés au cours de la formation de biofilms, il n'existe aucun moyen de quantifier la structuration du biofilm qui en résulte; et 6) il n'existe aucun moyen de mesurer la dimension Z du biofilm avec ce dispositif expérimental . Malgré ces limites, ce protocole prévoit néanmoins un moyen d'obtenir des données numériques pour aider à évaluer la formation de colonies ridée.
Dans ce protocole, nous utilisons un système d'imagerie spécifiquesystème (c.-à-un microscope Zeiss dissection et ProgRes CapturePro logiciel d'imagerie) pour observer et évaluer la formation de colonies ridée. Le système d'imagerie décrite ici est puissante: la capacité de détecter le début de la formation de colonies ridée, et donc d'évaluer le développement avec une approche bien sûr le temps, est grandement améliorée par l'utilisation d'un microscope à dissection. Toutefois, si cette technologie n'est pas disponible, le protocole peut être adapté pour une utilisation avec d'autres équipements, y compris un simple appareil photo numérique avec un accent de zoom. Alors que ce protocole met l'accent sur l'évaluation de développement de la colonie ridée, il pourrait également être modifié pour évaluer formation de pellicule, une forme de biofilm qui se développe lorsque des cellules sont de plus en plus statique dans une culture liquide. Ce protocole peut également s'avérer utile dans l'évaluation d'autres indicateurs de la formation de biofilm, y compris l'incorporation de colorants spécifiques dans les colonies tachetés au cours du développement du biofilm. Il s'agit notamment, mais ne sont pas limités à, des colorants tels que le Congo-Rouge et du calcofluou qui peuvent se lier à la cellulose, un composant commun des biofilms bactériens 16. En outre, ce protocole, bien que développé pour une utilisation avec V. fischeri, ne se limite pas à cet organisme, mais peut être généralisée à l'étude de la formation de biofilms dans de nombreux organismes différents, tels que 4 Bacillus subtilis, Vibrio cholerae 5, Vibrio parahaemolyticus 6, et Pseudomonas aeruginosa 7, toute formation colonie exposition ridée. Enfin, il peut également être adapté pour étudier la morphologie des colonies d'autres qui ont un modèle de développement, tels que, potentiellement, la structuration qui se produit pendant la croissance de Myxococcus xanthus 17 et développement de la structure aérienne en Pseudomonas aeruginosa 18. Ce protocole est donc d'usage général pour les chercheurs en microbiologie et le biofilm.
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Ce travail a été soutenu par l'INSA bourse R01 GM59690 attribué à KLV.
matériels
| Name | Company | Catalog Number | Comments |
| Nom de l'équipement | Entreprise | Numéro de catalogue | Commentaires |
| Zeiss Stemi 2000-C microscope à dissection | Zeiss | 45505300000000000 | (Obtenu à travers un microscope Lukas) |
| ProgRes C10 PLUS | JENOPTIK Systems GmbH optique | 017953-602-26 | Fixation de l'appareil (obtenu à travers un microscope Lukas) |
| CL 1500 CE Source de lumière froide | Zeiss | 4355400000000000 | (Obtenu à travers un microscope Lukas) |
| ProgRes CapturePro | JENOPTIK Systems GmbH optique | Le logiciel libre avec l'appareil photo enregistrée | Programme informatique pour la capture d'image |
| Image J | NIH | Le logiciel libre à partir de:ij / download.html "target =" _blank "> http://rsb.info.nih.gov/ij/download.html | Programme informatique pour les mesures de diamètre |
Références
- Donlan, R. M., Costerton, J. W. Biofilms: survival mechanisms of clinically relevant microorganisms. Clin. Microbiol. Rev. 15, 167-167 (2002).
- Stoodley, P., Sauer, K., Davies, D. G., Costerton, J. W. Biofilms as complex differentiated communities. Annu. Rev. Microbiol. 56, 187 (2002).
- Branda, S. S., Vik, S., Friedman, L., Kolter, R. Biofilms: the matrix revisited. Trends Microbiol. 13, 20 (2005).
- Branda, S. S. Fruiting body formation by Bacillus subtilis. Proc. Natl. Acad. Sci. U.S.A. 98, 11621-11621 (2001).
- Beyhan, S. Regulation of rugosity and biofilm formation in Vibrio cholerae: comparison of VpsT and VpsR regulons and epistasis analysis of vpsT, vpsR, and hapR. J. Bacteriol. 189, 388 (2007).
- Enos-Berlage, J. L., Guvener, Z. T., Keenan, C. E., McCarter, L. L. Genetic determinants of biofilm development of opaque and translucent Vibrio parahaemolyticus. Mol. Microbiol. 55, 1160 (2005).
- Merritt, J. H., Brothers, K. M., Kuchma, S. L., O'Toole, G. A. SadC reciprocally influences biofilm formation and swarming motility via modulation of exopolysaccharide production and flagellar function. J. Bacteriol. 189, 8154-8154 (2007).
- Yip, E. S., Geszvain, K., DeLoney-Marino, C. R., Visick, K. L. The symbiosis regulator rscS controls the syp gene locus, biofilm formation and symbiotic aggregation by Vibrio fischeri. Mol. Microbiol. 62, 1586-1586 (2006).
- Morris, A. R., Darnell, C. L., Visick, K. L. Inactivation of a novel response regulator is necessary for biofilm formation and host colonization by Vibrio fischeri. Mol. Microbiol. 82, 114 (2011).
- Nyholm, S. V. Roles of Vibrio fischeri and nonsymbiotic bacteria in the dynamics of mucus secretion during symbiont colonization of the Euprymna scolopes light organ. Appl. Environ. Microbiol. 68, 5113 (2002).
- Yip, E. S., Grublesky, B. T., Hussa, E. A., Visick, K. L. A novel, conserved cluster of genes promotes symbiotic colonization and σ54-dependent biofilm formation by Vibrio fischeri. Mol. Microbiol. 57, 1485 (2005).
- Mandel, M. J. A single regulatory gene is sufficient to alter bacterial host range. Nature. 458, 215 (2009).
- Graf, J., Dunlap, P. V., Ruby, E. G. Effect of transposon-induced motility mutations on colonization of the host light organ by Vibrio fischeri. J. Bacteriol. 176, 6986 (1994).
- Geszvain, K., Visick, K. L. The hybrid sensor kinase RscS integrates positive and negative signals to modulate biofilm formation in Vibrio fischeri. J. Bacteriol. 190, 4437 (2008).
- Krasteva, P. V. Vibrio cholerae VpsT regulates matrix production and motility by directly sensing cyclic di-GMP. Science. 327, 866 (2010).
- Romling, U. Characterization of the rdar morphotype, a multicellular behaviour in Enterobacteriaceae. Cell Mol. Life. Sci. 62, 1234 (2005).
- Berleman, J. E., Chumley, T., Cheung, P., Kirby, J. R. Rippling is a predatory behavior in Myxococcus xanthus. J. Bacteriol. 188, 5888 (2006).
- Lee, K., Veeranagouda, Y. Ultramicrocells form by reductive division in macroscopic Pseudomonas aerial structures. Environ. Microbiol. 11, 1117 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon