Method Article
Un approccio semi-quantitativo per valutare la formazione di biofilm mediante lo sviluppo spiegazzato Colony
In questo articolo
Riepilogo
Noi forniamo un semplice, semi-quantitativa metodo per studiare la formazione di biofilm In vitro. Questo metodo sfrutta il STEMI Zeiss 2000-C dissezione Microscopio (con l'attacco della fotocamera) per monitorare sia i tempi e il modello di formazione di biofilm, come dimostrato dallo sviluppo di colonie rugose.
Abstract
Biofilm, o superficie collegati comunità di cellule incapsulate in una matrice extracellulare, rappresentano uno stile di vita comune per molti batteri. All'interno di un biofilm, le cellule batteriche spesso mostrano alterata fisiologia, anche una maggiore resistenza agli antibiotici e altri stress ambientali 1. Inoltre, i biofilm possono svolgere ruoli importanti in interazioni ospite-microbo. I biofilm si sviluppano quando i batteri passaggio da individuo, le cellule planctoniche a formare complessi e multi-cellulari comunità 2. In laboratorio, biofilm sono studiate valutando lo sviluppo di biofilm fenotipi specifici. Un fenotipo biofilm comune comporta la formazione di colonie batteriche o rugose rugose su agar solido media 3. Formazione di colonie Rugosa fornisce uno strumento particolarmente semplice e utile per identificare e caratterizzare i ceppi batterici che presentano fenotipi alterati biofilm, e per studiare le condizioni ambientali che la formazione di biofilm impatto. Wrila formazione di colonie nkled serve come un indicatore della formazione di biofilm in una varietà di batteri, inclusi sia batteri Gram-positivi, come Bacillus subtilis 4, e batteri Gram-negativi, come Vibrio cholerae 5, Vibrio parahaemolyticus 6, Pseudomonas aeruginosa 7, e Vibrio fischeri 8.
Il batterio marino V. fischeri è diventato un modello per la formazione del biofilm a causa del ruolo cruciale dei biofilm durante la colonizzazione host: biofilm prodotto da V. fischeri promuovere la sua colonizzazione delle Hawaii Bobtail calamari Euprymna 8-10 scolopes. È importante sottolineare che, fenotipi biofilm osservati in vitro correlano con la capacità di V. fischeri cellule di colonizzare efficacemente animali ospiti: ceppi di handicap per la formazione del biofilm in vitro in possesso di un difetto colonizzazione 9,11, mentre i ceppi esibendo un aumentofenotipi biofilm sono stati migliorati per la colonizzazione 8,12. V. fischeri fornisce quindi un sistema semplice modello per valutare i meccanismi con cui i batteri regolano la formazione di biofilm e come biofilm ospite colonizzazione impatto.
In questo rapporto, descriviamo un metodo semi-quantitativo per valutare la formazione di biofilm utilizzando V. fischeri come sistema modello. Questo metodo comporta l'attenta individuazione di colture batteriche a concentrazioni e volumi definiti su un supporto di agar solido, una cultura maculato è sinonimo di una singola colonia batterica. Questa tecnica di 'cultura spotted' può essere utilizzato per confrontare i fenotipi biofilm lordi a singoli, specifici punti temporali (end-point saggi), o per identificare e caratterizzare i fenotipi biofilm sottili attraverso il tempo portate saggi di sviluppo biofilm e misurazioni del diametro colonia , che è influenzata dalla formazione di biofilm. Così, questa tecnica fornisce una analisi semiquantitativa di formazione di biofilm, permitting valutazione dei tempi e patterning di sviluppo della colonia rugosa e le dimensioni relative della struttura in via di sviluppo, caratteristiche che si estendono al di là della semplice morfologia complessiva.
Protocollo
1. Caratterizzazione e considerazioni
- Formazione di biofilm è generalmente influenzata dalla densità delle cellule e il tasso di crescita. Pertanto, è necessario determinare il tasso di crescita (aumento della densità ottica (OD) nel tempo) e resa (numero di cellule finale) del ceppo (s) di interesse eseguendo semplice curva di crescita delle cellule e saggi di placcatura. Difetti di crescita, o una mancanza di correlazione tra OD e il numero di cellulare, deve essere preso in considerazione quando si interpretano i risultati di esperimenti di macchie.
- Includere gli opportuni controlli positivi e negativi sulla stessa lastra al momento di valutare la formazione di rughe colonia, di importanza minore piastra-to-plate variazione può influenzare lo sviluppo di biofilm.
- Identificare le condizioni migliori per avvistare, cioè quelli che rivelano le differenze più distinte tra il controllo e il mutante (s) di interesse. Coltivare ceppi in coltura liquida in varie condizioni, quali mezzi diversi o temperature, e per diverso stadios di crescita (fase esponenziale e stazionaria) prima di spotting. Spot 10 pl di cultura a densità cellulari vari sui mezzi di comunicazione appropriati, e incubare alla temperatura desiderata morfologie di colonia fino a diventare evidente.
- Il punto finale saggio comporta la valutazione della formazione della colonia rugosa in un punto predeterminato tempo dopo aver individuato (cioè, 48 ore). Questa valutazione è utile per i ceppi che presentano (o si propone di esporre) gravi difetti nella formazione del biofilm.
- Il test valuta corso del tempo la formazione di rughe colonia per un periodo di tempo (cioè, ogni ora) post-spotting. Questo saggio permette una valutazione semiquantitativa di formazione di biofilm, consentendo la determinazione di inizio della formazione di colonie rugose e sviluppo pattern su un periodo di tempo. La durata dell'esperimento e numero di punti di raccolta per un corso di tempo è determinata in esperimenti preliminari.
- Per tenere facilmente traccia del tempo post-spotting, fissato aimer a contare.
2. La valutazione microscopica di Morfologia Colony spiegazzato in V. fischeri
- Inoculare V. cellule fischeri in 5 ml di LB-Salt (LBS) media 13 (1% [w / v] triptone, 0,5% [w / v] di estratto di lievito, 2% [w / v] di cloruro di sodio, 50 mM Tris-HCl [ pH 7.5]) che contiene gli antibiotici necessari e incubare, con agitazione, per tutta la notte a 28 ° C. Al mattino, sottocolture le cellule con una diluizione 1:100 in 5 ml di terreno fresco LBS e incubare alle stesse condizioni finché le cellule hanno raggiunto la desiderata OD 600 (ad esempio, OD 600 = 0,2 o 0,5).
- Pipettare 1 ml di coltura in una provetta da microcentrifuga e centrifuga in un insieme microcentrifuga alla massima velocità per un minuto. Eliminare il surnatante tramite aspirazione. Lavare le cellule per rimuovere eventuali residui e componenti extracellulari risospendendo il pellet in 1 ml di acqua di mare sterili 70 sulla artificiali (ASW) (35 mM MgSO 4-7H 2 O, 7 mM CaCl2-2H 2 O, 210 mM NaCl, 7 mM KCl) e ripetendo la centrifugazione. Risospendere il pellet lavato in 1 ml del 70% ASW.
- Assicurarsi che ogni campione contiene lo stesso numero di cellule, come stimato dalla DO a 600 nm. Apportare le modifiche necessarie diluendo i campioni più concentrati con l'aggiunta del 70% ASW. In esperimenti preliminari, culture loco a vari valori iniziali di DO per determinare una ottimale OD di partenza per un dato insieme di ceppi o condizioni. I migliori risultati sono ottenuti per V. fischeri, quando i punti sono generati da colture con un diametro esterno di circa 0,2.
- Spot 10 microlitri di cellule lavate LBS su piastre contenenti gli antibiotici necessari. Quando si macchia di una cultura su un piatto, assicurarsi di costante la pipetta (con il dito) appena sopra la superficie agar. Spot verticalmente, non ad angolo, ed espellere il liquido lentamente per la distribuzione uniforme della macchia. In genere ogni ceppo è macchiato una volta per piastra (fino a 6 punti per piastra), with piastre multiple (2-3) per esperimento.
- Per assicurare che la cultura maculato rimane uniformemente distribuito, consentono il punto di asciugare prima di spostare la piastra alla incubatrice. Capovolgere le piastre e incubare a 28 ° C.
- Monitorare la morfologia del luogo dell'inizio crescente oraria a 12-15 ore dopo l'inoculazione. Usiamo un ambito dissezione (Zeiss STEMI 2000-C) con un attacco della fotocamera (Progres C10 PLUS) e la CapturePro Progres e programmi software ImageJ per osservare e documentare la morfologia delle colonie e per valutare l'inizio e la progressione della formazione di colonie rugosa.
- Per la configurazione specifiche di cui al punto 2.5, i punti vengono illuminate dal basso attraverso una fase di vetro trasparente con una sorgente di luce CL 1500 CE fredda, mentre le immagini vengono catturate da sopra. Questa configurazione è ottimale per lo sviluppo delle colonie di imaging rugosa perché V. colonie fischeri (macchie) sono traslucidi.
- In assenza di attrezzature specifiche di cui vep 2,5, monitor colonia morfologia rugosa con qualsiasi microscopio da dissezione, che consente la visualizzazione completa delle colonie e ha una sorgente di luce regolabile e, idealmente, una fotocamera collegata. Se necessario, una fotocamera digitale può essere utilizzato anche in assenza di una fotocamera collegata, ma questo non è ottimale.
- Per visualizzare meglio sviluppo rugosa colonia, è necessario regolare sia l'intensità luminosa e l'angolo di riflessione sotto le colonie batteriche tali che la morfologia tridimensionale delle biofilm sviluppo possono distinguere. Determinare le ottimali condizioni di illuminazione che forniscono il più forte contrasto tra la colonia individuato e lo sfondo agar circostante, in modo tale che l'architettura (rughe) della colonia è chiaramente distinguibile.
- In alcuni casi, il colore della colonia maculato devono essere prese in considerazione, come alterazioni di colore colonia può verificarsi durante la formazione di biofilm. Regolare l'intensità e l'angolo della sorgente luminosa per rivelarequesti cambiamenti sottili nella colorazione. Una volta che le impostazioni appropriate vengono raggiunti, a mantenere per tutta la durata dell'esperimento.
- Nota quanto tempo trascorre dal momento dell'inoculazione al momento in cui la formazione di colonie rugosa avvia per ogni ceppo o condizione. Definire l'inizio della formazione della colonia rugosa come il punto temporale in cui la formazione di patterning e strutture 3D (cioè, striature formando sul bordo esterno o 'increspature' che si verificano nel centro) è prima apparente. Le cellule mutanti possono mostrare ridotto o aumentato il tempo di inizio di formazione di colonie rugosa (ad esempio, Fig. 2).
- Documentare l'avvio e lo sviluppo della formazione di colonie spiegazzata catturando appropriate immagini digitali. È importante utilizzare lo stesso ingrandimento quando la raccolta di immagini durante l'esperimento. Passare la vista dal oculare del microscopio allo schermo del computer utilizzando la leva posta sul retro della macchina. Quando si passa tra ocularee la visualizzazione sullo schermo del computer, regolare la visualizzazione e mettere a fuoco di conseguenza.
- Prima di imaging culture macchiati, il coperchio della piastra di Petri è tipicamente rimosso per fornire l'immagine più chiara. Tuttavia, questo passaggio è facoltativo, in quanto le culture maculati possono essere esposte attraverso il coperchio con la configurazione descritta nei passi 2.5 e 2.6.
- Ad ogni punto di tempo dopo l'inizio della formazione di colonie rugosa, prendere nota del modello di sviluppo della colonia rugosa. L'architettura può svilupparsi dall'interno verso l'esterno, o fuori pollici Questa valutazione fornisce un meccanismo per distinguere i biofilm formati da differenti ceppi o in condizioni diverse.
- Misurare il diametro della colonia sviluppo in ogni punto. Questo può essere fatto manualmente, o digitale utilizzando un programma software associato. Se fatto in digitale, utilizzare il software Progres CapturePro programma e prima calibrare la barra di scala per l'ingrandimento specifico utilizzato nell'esperimento. Includere la barra della scala in ogni immagine catturata.
- Per calcolare il diametro colonia utilizzando il programma software ImageJ, aprire ogni file di immagine. Standardizzare la barra della scala come segue: Selezionare l'opzione "linea retta" dalla barra degli strumenti. Sovrapporre il barra della scala incorporato con una linea retta della stessa lunghezza e larghezza. Selezionare "Scala Set" dalla scheda "Analizza". Nella "nota distanza" box, inserire la lunghezza corrispondente (come determinato dalla barra scala originale, cioè, 2 mm) e selezionare "OK".
- Utilizzare la "linea retta" opzione per inserire una linea orizzontale attraverso il posto. Sotto la scheda Analizza, selezionare "Measure". Nella nuova finestra risultati, la lunghezza calcolata sarà fornita. Ottenere una seconda misura inserendo una linea perpendicolare attraverso il punto. Ricalcolare il diametro. Registrare la media delle due misure. Grafico del diametro medio per ogni posto ad ogni momento utilizzando un programma software come Excel.
- La fine dell'esperimento si verifica sia in un punto temporale specificato o quando vi è alcuna altrasviluppo del biofilm. Una volta che il fine è raggiunto, consolidare le immagini in una figura (s) per visualizzare il modello di sviluppo nel tempo utilizzando un programma di software come Powerpoint.
3. Risultati rappresentativi
In questi esperimenti abbiamo usato V. fischeri come organismo modello per studiare la formazione di biofilm valutando lo sviluppo di colonie rugose su una superficie solida agar. Biofilm producono ceppi di V. formano colonie fischeri con una vasta architettura 3D all'interno di 40 h (Fig. 1) 8,9,14. Quando esaminata per un corso di tempo, risulta evidente che la formazione di colonie rugosa dal ceppo di controllo inizia già circa 12 h post-inoculazione (a seconda delle condizioni specifiche) (Fig. 2) 9. Al contrario, la formazione di biofilm da un mutante rappresentante è ritardato di circa 4 h, non avviare fino a circa 16 h post-inoculazione 9. Ripetts di questi esperimenti suggerito che la temporizzazione era relativamente costante, rendendo questa valutazione semi-quantitativa 9. Un secondo semi-quantitativa misura della formazione del biofilm fa uso della variazione di diametro della colonia sviluppo nel tempo. Come mostrato in Fig. 3A, un rappresentante biofilm-competente ceppo forma colonie che aumento di complessità e diametro rispetto a un ceppo rappresentativo che non forma biofilm. Misurazioni accurate nel tempo dei diametri delle colonie formate da questi due ceppi ha rivelato che la dimensione dei biofilm-competenti colonie aumentata ad un tasso maggiore dei biofilm-negativi colonie, e nel punto di tempo finale di due differiva di circa il 2 - piega (Fig. 3B). Pertanto, anche se le immagini di un tempo rappresentativo tardiva o morfologia "end-point" colonia frequentemente sono riportati nella letteratura, supplementari semi-quantitativi dati possono essere raccolti che permetterà una migliore comprensione del difetto biofilm.
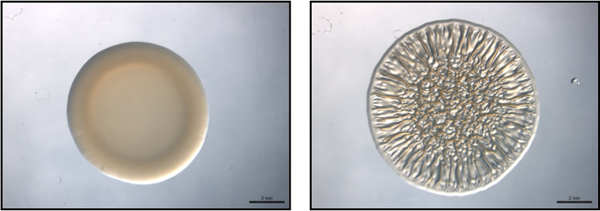
Figura 1. End-point saggio. Questa figura è un esempio di un end-point dosaggio con rappresentativi non-biofilm formanti (sinistra) e biofilm-formatura (destra) ceppi di V. fischeri. Queste immagini sono state raccolte in 40 h post-spotting. Queste immagini sono state generate con wild-type V. fischeri contenente un controllo vettoriale (non-biofilm di formazione) o una parte PSR sovraespressione plasmide (biofilm di formazione) e sono dei set di dati raccolti per Morris et al., 2011.
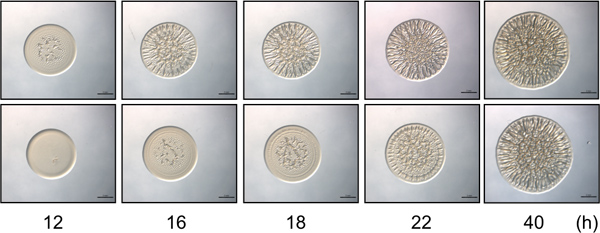
Figura 2. Time-corso test. Il pannello superiore contiene immagini rappresentative della formazione di biofilm da un biofilm-competente ceppo di controllo di V. fischeri su un percorso di tempo selezionato. Avvio della formazione di biofilm è evidente a 12 h. Il pannello inferiore contiene rappresentante imaghi di un ceppo mutante di V. fischeri che presenta un ritardo (4 h) l'inizio della formazione della colonia rugosa nel tempo, con formazione di biofilm avvio a 16 h post-inoculazione. Si noti che in 40 ore i ceppi simile nell'intensità ed il modello della formazione di biofilm, mentre le differenze sottili tra questi ceppi sono osservati solo in corrispondenza dei punti temporali precedenti. Queste immagini sono state generate con sovraespressione PSR wild-type e mutante sypE V. cellule fischeri e facevano parte del set di dati raccolti per Morris et al., 2011.
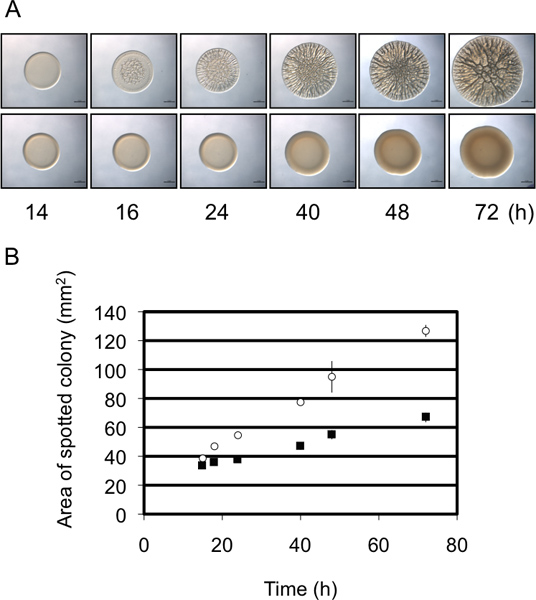
Figura 3. Diametro Colony come analisi semiquantitativa di formazione di biofilm. (A) Naturalmente il tempo della formazione di biofilm da un rappresentante biofilm di formazione (pannello superiore) e non-biofilm di formazione (pannello inferiore) ceppi di V. fischeri. Si noti che il biofilm-formatura ceppo mostra un aumento maggioredi diametro nel corso del tempo rispetto al ceppo non-biofilm formatura. Queste immagini sono state generate con wild-type V. fischeri contenente una parte PSR sovraespressione plasmide (biofilm di formazione) o un controllo vettoriale (non-biofilm di formazione) e sono dei set di dati raccolti per Morris et al., 2011. (B) Una rappresentazione grafica l'aumento del diametro delle colonie nel corso del tempo dai due ceppi nel pannello A. Questi dati sono stati generati utilizzando il software ImageJ ed Excel, come indicato nel protocollo.
Discussione
In questo lavoro, si descrive un metodo semi-quantitativo per valutare la formazione di biofilm utilizzando V. fischeri come organismo modello. In particolare, ci avvaliamo di un microscopio da dissezione con attacco telecamera per monitorare la formazione di biofilm e sviluppo, formazione di colonie rugosa nel corso del tempo su una superficie solida agar. In questo protocollo, si delineano due tipi specifici di metodi usiamo comunemente per valutare la formazione di rughe colonia. Il primo è il test end-point, che ci permette di osservare il finale, architettura complessiva 3D, modellazione, e il diametro di una cultura macchiato in un punto di scelta "finale" del tempo. Questo approccio è particolarmente utile per valutare i ceppi mutanti o condizioni che portano a difetti drammatici nella formazione di biofilm. Tuttavia, questo approccio non distingue tra più sottili differenze che si verificano ad intervalli di tempo prima della scelta end-point. Per monitorare più da vicino la formazione di rughe colonia, si usa un saggio di sviluppo nel tempo, che ci permette di identificare l'inizio di wrinkled formazione di colonie e guardare il suo sviluppo nel tempo. Come risultato di questo approccio, più sottili differenze nei tempi di formazione della colonia rugosa, architettura 3D, e patterning può essere identificato. Abbiamo usato questo test andamento nel tempo di generare due semi-quantitative saggi di formazione di biofilm. In primo luogo, il tempo in cui un ceppo inizia a svilupparsi architettura 3D può essere paragonato a quello di ceppi di controllo. Abbiamo trovato che il ritardo nella formazione di biofilm di un mutante particolare nelle stesse condizioni è abbastanza consistente 9. Ad esempio, nei dati mostrati nella fig. 2, il mutante costantemente esposto su un ritardo 4 h in avviare la formazione di biofilm. Un secondo semi-quantitativa misura della formazione del biofilm è il cambiamento delle dimensioni del diametro della colonia rugosa (spot). Abbiamo trovato che il diametro delle colonie rugose progressivamente differisce da quella di non-biofilm colonie, raggiungendo circa 2 volte differenza nel punto di fine (Fig. 3 ) (Morris e Visick, dati non pubblicati). Fino ad oggi, non abbiamo osservato un fenotipo senza l'altra (cioè la formazione di biofilm senza un aumento del diametro delle colonie) (dati non pubblicati), anche se rimane possibile alcuni mutanti si comporterà in modo diverso. Infatti, è stato riportato per V. cholerae che qualche risultato rugosa colonie in un sostanziale aumento del diametro delle colonie, mentre altri no 15. Tuttavia, valutando la variazione di diametro nel corso del tempo potrebbe aiutare nella caratterizzazione di mutanti biofilm potenziali e / o fornire un'ulteriore misura quantitativa di mutanti con ritardi nello sviluppo. Dei due misure della formazione di biofilm (tempo e diametro), determinando l'inizio della formazione della colonia rugosa è più sensibile, ma anche più personale, di determinare il diametro dello spot. Anche così, entrambe le misure forniscono una valutazione semiquantitativa di un fenotipo che è estremamente utile per i ricercatori biofilm ma non facilmente suscettibili di quantification.
Quando si esegue maculati test in coltura, è importante considerare le condizioni ambientali in cui vengono coltivati i ceppi maculati. Formazione di colonie Rugosa è spesso influenzata da varie condizioni ambientali, compresa la disponibilità di nutrienti, temperatura e umidità. Per ridurre la variabilità tra esperimenti, è utile standardizzare queste condizioni il più possibile (cioè standardizzazione delle piastre di agar a un determinato volume e coltivando i ceppi maculati a temperatura controllata). Per un ulteriore controllo per la variabilità tra esperimenti avvistamento, è importante includere i appropriati ceppi di controllo all'interno di ciascuna serie di esperimenti. Infine, l'interpretazione dei dati ottenuti in questi test, è necessario eseguire una qualsiasi esperimento più volte (3 +), specialmente nel valutare sottili differenze di formazione di colonie rugosa (ad esempio, un ritardo nella formazione di biofilm o differenze patterning). Alcune limitazioni di questo protocollo sono: 1) deterING se le cellule hanno un difetto nella crescita può essere difficile: la crescita delle cellule in coltura liquida possono non corrispondere accuratamente i tassi di crescita su terreni solidi, e una determinazione accurata di crescita del biofilm che formano le cellule, che possono stare insieme, potrebbe non essere possibile; 2) ceppi con difetti di crescita sarà problematico da analizzare; 3) può non essere possibile distinguere differenze di diametro tra ceppi con fenotipi biofilm sottili, 4) per ceppi che non crescono in un anello concentrico può non essere possibile misurare accuratamente cambiamenti di diametro, 5) mentre patterning possono essere osservati durante la formazione di biofilm, non vi è alcun modo per quantificare il modellamento del biofilm risultante, e 6) non c'è modo per misurare la Z-dimensione del biofilm con questa configurazione sperimentale . Nonostante questi limiti, questo protocollo prevede tuttavia un mezzo per ottenere dati numerici per aiutare a valutare la formazione di rughe colonia.
In questo protocollo, ci avvaliamo di un imaging specifichesistema (ad esempio, un microscopio Zeiss dissezione e Progres CapturePro software di imaging), di osservare e valutare la formazione di rughe colonia. Il sistema di imaging descritto qui è potente: la capacità di rilevare l'inizio della formazione della colonia rugosa, e quindi valutare lo sviluppo con un approccio corso di tempo, è notevolmente aumentata con l'uso di un microscopio da dissezione. Tuttavia, se questa tecnologia non è disponibile, il protocollo può essere adattato per l'uso con altre apparecchiature, tra cui una semplice macchina fotografica digitale con un obiettivo zoom. Mentre questo protocollo si concentra sulla valutazione di sviluppo colonia rugosa, potrebbe anche essere modificato per valutare la formazione di pellicola, una forma di biofilm che si sviluppa quando le cellule crescono staticamente in coltura liquida. Questo protocollo può rivelarsi utile anche per valutare altri indicatori della formazione di biofilm, tra cui l'incorporazione di coloranti specifici nelle colonie macchiati durante lo sviluppo di biofilm. Questi includono, ma non sono limitati a, coloranti come Congo Red e calcofluo che possono legarsi alla cellulosa, un componente comune di biofilm batterici 16. Inoltre, questo protocollo, anche se sviluppato per l'uso con V. fischeri, non è limitata a questo organismo, ma può essere generalizzato per studiare la formazione di biofilm in numerose differenti organismi, come Bacillus subtilis 4, 5 Vibrio cholerae, Vibrio parahaemolyticus 6, 7 e Pseudomonas aeruginosa, che mostra tutti formazione di colonie rugosa. Infine, può anche essere adattato per studiare morfologie di colonia altri che hanno un modello di sviluppo, come, potenzialmente, il patterning che si verifica durante la crescita del Myxococcus xanthus 17 e sviluppo struttura aerea in Pseudomonas aeruginosa 18. Questo protocollo è quindi di uso generale per i ricercatori di microbiologia e di biofilm.
Divulgazioni
Non ci sono conflitti di interesse dichiarati.
Riconoscimenti
Questo lavoro è stato supportato da NHI R01 concessione GM59690 assegnato a KLV.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome delle apparecchiature | Azienda | Numero di catalogo | Comments |
| Zeiss STEMI 2000-C dissezione Microscopio | Zeiss | 45505300000000000 | (Ottenuta tramite microscopio Lukas) |
| Progres C10 PLUS | JENOPTIK Optical Systems GmbH | 017953-602-26 | Attacco per fotocamera (ottenuta tramite microscopio Lukas) |
| CL 1500 CE sorgente a luce fredda | Zeiss | 4355400000000000 | (Ottenuta tramite microscopio Lukas) |
| Progres CapturePro | JENOPTIK Optical Systems GmbH | Il software libero con la telecamera registrata | Programma per computer per l'acquisizione di immagini |
| Immagine J | NIH | Software gratuito da:ij / download.html "target =" _blank "> http://rsb.info.nih.gov/ij/download.html | Programma informatico per la misurazione del diametro |
Riferimenti
- Donlan, R. M., Costerton, J. W. Biofilms: survival mechanisms of clinically relevant microorganisms. Clin. Microbiol. Rev. 15, 167-167 (2002).
- Stoodley, P., Sauer, K., Davies, D. G., Costerton, J. W. Biofilms as complex differentiated communities. Annu. Rev. Microbiol. 56, 187 (2002).
- Branda, S. S., Vik, S., Friedman, L., Kolter, R. Biofilms: the matrix revisited. Trends Microbiol. 13, 20 (2005).
- Branda, S. S. Fruiting body formation by Bacillus subtilis. Proc. Natl. Acad. Sci. U.S.A. 98, 11621-11621 (2001).
- Beyhan, S. Regulation of rugosity and biofilm formation in Vibrio cholerae: comparison of VpsT and VpsR regulons and epistasis analysis of vpsT, vpsR, and hapR. J. Bacteriol. 189, 388 (2007).
- Enos-Berlage, J. L., Guvener, Z. T., Keenan, C. E., McCarter, L. L. Genetic determinants of biofilm development of opaque and translucent Vibrio parahaemolyticus. Mol. Microbiol. 55, 1160 (2005).
- Merritt, J. H., Brothers, K. M., Kuchma, S. L., O'Toole, G. A. SadC reciprocally influences biofilm formation and swarming motility via modulation of exopolysaccharide production and flagellar function. J. Bacteriol. 189, 8154-8154 (2007).
- Yip, E. S., Geszvain, K., DeLoney-Marino, C. R., Visick, K. L. The symbiosis regulator rscS controls the syp gene locus, biofilm formation and symbiotic aggregation by Vibrio fischeri. Mol. Microbiol. 62, 1586-1586 (2006).
- Morris, A. R., Darnell, C. L., Visick, K. L. Inactivation of a novel response regulator is necessary for biofilm formation and host colonization by Vibrio fischeri. Mol. Microbiol. 82, 114 (2011).
- Nyholm, S. V. Roles of Vibrio fischeri and nonsymbiotic bacteria in the dynamics of mucus secretion during symbiont colonization of the Euprymna scolopes light organ. Appl. Environ. Microbiol. 68, 5113 (2002).
- Yip, E. S., Grublesky, B. T., Hussa, E. A., Visick, K. L. A novel, conserved cluster of genes promotes symbiotic colonization and σ54-dependent biofilm formation by Vibrio fischeri. Mol. Microbiol. 57, 1485 (2005).
- Mandel, M. J. A single regulatory gene is sufficient to alter bacterial host range. Nature. 458, 215 (2009).
- Graf, J., Dunlap, P. V., Ruby, E. G. Effect of transposon-induced motility mutations on colonization of the host light organ by Vibrio fischeri. J. Bacteriol. 176, 6986 (1994).
- Geszvain, K., Visick, K. L. The hybrid sensor kinase RscS integrates positive and negative signals to modulate biofilm formation in Vibrio fischeri. J. Bacteriol. 190, 4437 (2008).
- Krasteva, P. V. Vibrio cholerae VpsT regulates matrix production and motility by directly sensing cyclic di-GMP. Science. 327, 866 (2010).
- Romling, U. Characterization of the rdar morphotype, a multicellular behaviour in Enterobacteriaceae. Cell Mol. Life. Sci. 62, 1234 (2005).
- Berleman, J. E., Chumley, T., Cheung, P., Kirby, J. R. Rippling is a predatory behavior in Myxococcus xanthus. J. Bacteriol. 188, 5888 (2006).
- Lee, K., Veeranagouda, Y. Ultramicrocells form by reductive division in macroscopic Pseudomonas aerial structures. Environ. Microbiol. 11, 1117 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon