Method Article
Un enfoque semi-cuantitativo para evaluar la formación de biopelículas Con el desarrollo de colonias arrugada
En este artículo
Resumen
Ofrecemos una manera simple, semi-cuantitativo método para investigar la formación de biopelículas In vitro. Este método se aprovecha de la STEMI Zeiss 2000-C Microscopio de disección (con el accesorio de cámara) para monitorear tanto el tiempo y el patrón de la formación de biopelículas, según lo evaluado por el desarrollo de colonias rugosas.
Resumen
Las biopelículas, o adjuntos de superficie comunidades de células encapsuladas en una matriz extracelular, representan un estilo de vida común para muchas bacterias. Dentro de un biofilm, las células bacterianas presentan a menudo alterado la fisiología, incluyendo una mayor resistencia a los antibióticos y otros problemas ambientales 1. Además, los biofilms pueden desempeñar papeles importantes en las interacciones huésped-microbio. Las biopelículas se desarrollan cuando las bacterias de la transición individual, las células planctónicas para formar complejos multicelulares comunidades 2. En el laboratorio, los biofilms son estudiados por la evaluación del desarrollo de fenotipos específicos de biofilm. Un fenotipo biopelícula común implica la formación de colonias bacterianas arrugadas o rugosa en agar sólido medios 3. La formación de colonias arrugada proporciona un medio particularmente simple y útil para identificar y caracterizar las cepas bacterianas que presentan fenotipos alterados biofilm, y para investigar las condiciones ambientales que la formación de biofilm impacto. Wrila formación de colonias nkled sirve como un indicador de la formación de biopelículas en una variedad de bacterias, incluyendo tanto bacterias Gram-positivas, tales como 4 Bacillus subtilis y bacterias Gram-negativas, tales como Vibrio cholerae 5, 6 Vibrio, Pseudomonas aeruginosa 7, y Vibrio fischeri 8.
La bacteria marina V. fischeri se ha convertido en un modelo para la formación de biopelículas, debido al papel crítico de las biopelículas durante la colonización de acogida: biofilms producidos por V. fischeri promover la colonización de las hawaianas autotanques 10.08 calamar Euprymna scolopes. Es importante destacar que, fenotipos biofilm observados in vitro se correlaciona con la capacidad de V. fischeri células para colonizar efectivamente los animales de acogida: las cepas con discapacidad para la formación de biofilm in vitro poseen un defecto de la colonización 9,11, mientras que las cepas exhiben mayorfenotipos biofilm se han mejorado para la colonización de 8,12. V. fischeri por lo tanto, proporciona un sistema sencillo modelo para evaluar los mecanismos mediante los cuales las bacterias regulan la formación de biopelículas y cómo los biofilms la colonización impacto en el host.
En este reporte se describe un método semi-cuantitativo para evaluar la formación de biopelículas con V. fischeri como un sistema modelo. Este método implica el cuidado de manchado de cultivos bacterianos en concentraciones y volúmenes definidos sobre medios de agar sólidos; un cultivo manchado es sinónimo de una sola colonia bacteriana. Esta técnica de "cultura manchada 'puede ser utilizado para comparar los fenotipos graves de biopelículas en individuales y específicas, los puntos de tiempo (de punto final ensayos), o para identificar y caracterizar los fenotipos sutiles biofilm a través de ensayos del curso de tiempo de desarrollo de los mismos y las mediciones del diámetro de las colonias , que está influenciado por la formación de biopelículas. Así, esta técnica proporciona un análisis semi-cuantitativo de la formación de biopelículas, pormitting evaluación de los tiempos y patrones de desarrollo de la colonia arrugada y el tamaño relativo de la estructura de desarrollo, características que van más allá de la morfología general sencillo.
Protocolo
1. Caracterización inicial y consideraciones
- La formación de biopelículas es generalmente influenciada por la densidad celular y tasa de crecimiento. Por lo tanto, es necesario determinar la tasa de crecimiento (aumento de la densidad óptica (OD) en el tiempo) y el rendimiento (número de células final) de la cepa (s) de interés mediante la realización de la curva de crecimiento simple y ensayos de célula de recubrimiento. Los defectos en el crecimiento, o una falta de correlación entre el DO y el número de células, hay que tener en cuenta a la hora de interpretar los resultados de los experimentos de localización.
- Incluye los controles apropiados positivos y negativos en el mismo plato la hora de evaluar la formación de colonias arrugada, como menor de placa a placa de variación puede afectar el desarrollo del biofilm.
- Identificar las mejores condiciones para detectar, es decir, los que revelan las diferencias más marcadas entre el control y mutante (s) de interés. Crecer las cepas en cultivo líquido en diversas condiciones, tales como los diferentes medios o las temperaturas, y las diferentes etapass de crecimiento (fase exponencial o estacionaria) antes de la localización. Punto 10 l de la cultura en las densidades de células diferentes en los medios apropiados, y se incuba a la temperatura deseada hasta las morfologías de colonias se hacen evidentes.
- El ensayo de punto final implica la evaluación de la formación de colonias arrugada en un punto predeterminado de tiempo después de detectar (es decir, 48 horas). Esta evaluación es útil para las cepas que presentan (o se han propuesto para exhibir) graves defectos en la formación de biopelículas.
- El ensayo evalúa curso del tiempo la formación de colonias arrugado durante un período de tiempo (es decir, cada hora) post-manchado. Este ensayo permite una evaluación semi-cuantitativa de la formación de biopelículas, al permitir la determinación del comienzo de la formación de colonias arrugada y desarrollo patrón durante un período de tiempo. La duración del experimento y el número de puntos de recogida para un curso de tiempo dado debe ser determinado en experimentos preliminares.
- Para perder de vista fácilmente el tiempo posterior a la localización, fijado enimer a contar.
2. Evaluación microscópica de morfología de la colonia arrugada en V. fischeri
- Inocular V. fischeri células en 5 ml de LB-Sal (FTCM) mediano 13 (1% [w / v] triptona, 0,5% [w / v] extracto de levadura, 2% [w / v] cloruro de sodio, 50 mM Tris-HCl [ pH 7,5]), que contiene los antibióticos necesarios y la incubación, con agitación, durante la noche a 28 ° C. Por la mañana, subcultivar las células con una dilución 1:100 en 5 ml de medio fresco LBS y se incuba en las mismas condiciones hasta que las células han alcanzado el deseado OD 600 (por ejemplo, 600 OD = 0,2 o 0,5).
- Pipeta 1 ml de cultivo en un tubo de microcentrífuga y se centrifuga en un conjunto de microcentrífuga a máxima velocidad durante un minuto. Eliminar el sobrenadante por aspiración. Lavar las células para eliminar los medios residuales y componentes extracelulares por resuspender el sedimento en 1 ml de estériles 70% agua de mar artificial (ASW) (35 mM de MgSO 4-7H 2 O, 7 mM de CaCl2-2H 2 O, 210 mM de NaCl, 7 mM de KCl) y repitiendo la centrifugación. Resuspender el sedimento lavado en 1 ml de 70% ASW.
- Asegúrese de que cada muestra contiene el mismo número de células, según las estimaciones de la DO a 600 nm. Haga los ajustes necesarios mediante la dilución de las muestras más concentradas, con más del 70% ASW. En experimentos preliminares, los cultivos in situ en los diversos valores de DO iniciales para determinar un óptimo OD de partida para un conjunto dado de cepas o condiciones. Los mejores resultados se obtuvieron para V. fischeri cuando las manchas se generan a partir de cultivos con un diámetro exterior de aproximadamente 0,2.
- 10 l de detectar las células lavadas hasta unas placas que contienen los LBS antibióticos necesarios. Al detectar una cultura en un plato, asegúrese de estabilizar la pipeta (con el dedo) justo por encima de la superficie del agar. Detectar verticalmente, no en un ángulo, y expulsar el líquido lentamente para la distribución uniforme de la mancha. Normalmente, cada cepa se vio una vez a la placa (hasta 6 puntos por placa), el ingenioh múltiples placas (2-3) por experimento.
- Para asegurar que el cultivo manchado permanece uniformemente distribuido, permitir que el punto de secar antes de mover la placa a la incubadora. Invertir las placas e incubar ellas a 28 ° C.
- Vigilar la morfología del comienzo mancha creciente por hora a 12-15 horas después de la inoculación. Nosotros usamos un microscopio de disección (Zeiss Stemi 2000-C) con un accesorio de cámara (ProgRes C10 PLUS) y el CapturePRO ProgRes y los programas de software ImageJ para observar y documentar la morfología de la colonia y para evaluar el inicio y la progresión de la formación de colonias arrugada.
- Para la configuración específica incluida en el paso 2.5, los puntos están iluminados desde abajo por una etapa de vidrio transparente con una fuente de luz CL 1500 CE frío, mientras que las imágenes son capturadas desde arriba. Esta configuración es óptima para el desarrollo de imagen de colonias arrugada por V. colonias fischeri (puntos) son translúcidos.
- En ausencia del equipo específica incluida en cPE 2.5, monitor de colonias de morfología rugosa utilizando cualquier microscopio de disección que permite la visualización de la colonia completa y tiene una fuente de luz regulable e, idealmente, una cámara conectada. Si es necesario, una cámara digital se pueden utilizar también en ausencia de una cámara conectada, pero esto no es óptima.
- Para visualizar mejor desarrollo de colonias arrugada, es necesario ajustar tanto la intensidad de iluminación y el ángulo de reflexión debajo de las colonias bacterianas tales que la morfología tridimensional de las biopelículas en desarrollo se puede discernir. Determinar las condiciones óptimas de iluminación que proporcionan el fuerte contraste entre la colonia manchado y el fondo de agar que rodea, de tal manera que la arquitectura (arrugas) de la colonia es claramente distinguible.
- En algunos casos, el color de la colonia manchado también debe tomarse en consideración, como alteraciones en el color de la colonia puede ocurrir durante la formación de biopelículas. Ajustar la intensidad y el ángulo de la fuente de iluminación para revelarestos sutiles cambios en su coloración. Una vez que los valores adecuados se logran, a mantener durante la duración del experimento.
- Nota cuánto tiempo transcurre desde el momento de la inoculación con el momento en que la formación de colonias arrugada inicia para cada cepa o condición. Definir el inicio de la formación de colonias arrugado como el punto de tiempo en el cual la formación de patrones y estructuras 3D (es decir, formando estrías en el borde exterior o "ondulaciones 'que ocurre en el centro) es primero aparente. Las células mutantes pueden exhibir disminución o aumento del tiempo para el inicio de la formación de colonias arrugada (por ejemplo, la fig. 2).
- Documentar el comienzo y el desarrollo de la formación de colonias arrugada por la captura de imágenes digitales apropiados. Es importante utilizar el mismo aumento en la recogida de imágenes durante todo el experimento. Cambiar la vista desde el ocular del microscopio a la pantalla de la computadora usando la palanca situada en la parte posterior de la cámara. Al cambiar entre oculary la visualización de la pantalla del ordenador, ajustar la vista y el enfoque en consecuencia.
- Antes de imagen culturas manchados, la tapa de la placa de Petri se retiran típicamente para proporcionar la imagen más clara. Sin embargo, este es un paso opcional, como cultivos manchados se pueden obtener imágenes a través de la tapa con la configuración que se describe en los pasos 2.5 y 2.6.
- En cada punto de tiempo después del inicio de la formación de colonias arrugada, tenga en cuenta el patrón de desarrollo de la colonia arrugada. La arquitectura se puede desarrollar desde el interior, o de afuera hacia adentro Esta evaluación proporciona un mecanismo para distinguir los biofilms formados por cepas diferentes o en diferentes condiciones.
- Medir el diámetro de la colonia en desarrollo en cada momento. Esto puede hacerse manualmente, o digitalmente mediante un programa de software asociado. Si se hace digitalmente, utilice el programa Progresa de CapturePRO software y primera calibración de la barra de escala para la ampliación específico utilizado en el experimento. Incluye la barra de escala en cada imagen capturada.
- Para calcular el diámetro de las colonias con el programa de software ImageJ, abrir cada archivo de imagen. Estandarizar la barra de escala de la siguiente manera: Seleccione la opción "opción de la línea recta" de la barra de herramientas. Superposición de la barra de escala incrustado con una línea recta de la misma longitud y anchura. Seleccione "Escala de Ajuste" en la pestaña "Analizar". En la "distancia conocida" caja de texto, insertar la longitud correspondiente (según lo determinado en la barra de escala original, es decir, 2 mm) y seleccione "Aceptar".
- Utilice la "línea recta" opción para insertar una línea horizontal a través de la mancha. En la ficha Analizar, seleccione "medida". En la ventana Resultados nuevo, la longitud calculada será proporcionado. Obtener una segunda medición mediante la inserción de una línea perpendicular a través de la mancha. Vuelva a calcular el diámetro. Registrar el promedio de las dos mediciones. Gráfico del diámetro promedio de cada punto en cada momento utilizando un programa de software como Excel.
- El final del experimento se produce bien en un punto de tiempo especificado o cuando no hay másdesarrollo de la biopelícula. Una vez que se llega al final, la consolidación de las imágenes en una figura (s) para visualizar el desarrollo de los patrones en el tiempo usando un programa de software como PowerPoint.
3. Los resultados representativos
En estos experimentos se utilizó V. fischeri como un organismo modelo para estudiar la formación de biopelículas, evaluando el desarrollo de colonias rugosas en una superficie de agar sólido. Productoras de biofilm de cepas de V. fischeri forman colonias con una arquitectura 3D extensa dentro de 40 h (fig. 1) 8,9,14. Cuando se examina en un transcurso de tiempo, se hace evidente que la formación de colonias arrugada por la cepa de control se inicia tan pronto como aproximadamente 12 h después de la inoculación (dependiendo de las condiciones específicas) (fig. 2) 9. En contraste, la formación de biopelículas por un mutante representante se retrasa en aproximadamente 4 horas, no iniciar hasta aproximadamente 16 horas después de la inoculación 9. REPITEct de estos experimentos sugieren que el momento era relativamente constante, por lo que esta evaluación semi-cuantitativa 9. Un segundo semi-cuantitativo medida de la formación de biopelículas hace uso del cambio en el diámetro de la colonia en desarrollo en el tiempo. Como se muestra en la fig. 3A, un representante de biofilm cepa competente forma colonias que aumento de la complejidad y el diámetro en relación con una cepa representativa que no forma biopelículas. Las mediciones cuidadosas lo largo del tiempo de los diámetros de las colonias formadas por estas dos cepas reveló que el tamaño de las colonias competentes biopelícula-aumentó a un ritmo mayor que las colonias negativas biofilm, y en el punto final del tiempo dos diferían en casi un 2 - veces (Fig. 3B). Así, aunque las imágenes de un tiempo representativo tardía o "punto final" morfología de las colonias con frecuencia se muestran en la literatura, adicionales, semi-cuantitativa de datos pueden ser recogidos, que permita una mejor comprensión del defecto biopelícula.
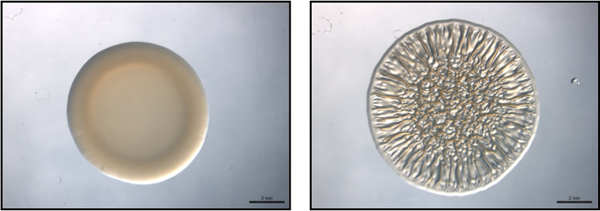
Figura 1. Punto final del ensayo. Esta figura es un ejemplo de un ensayo de punto final utilizando representativos no formadoras de biopelícula (izquierda) y la biopelícula formador-(derecha) de las cepas de V. fischeri. Estas imágenes se recogieron en 40 horas después de la localización. Estas imágenes fueron generadas con la naturaleza de tipo V. fischeri que contiene un control de vectores (no formación de biofilm) o una parte RSCS sobreexpresión plásmido (formación de biofilm) y eran del conjunto de datos recogidos de Morris et al., 2011.
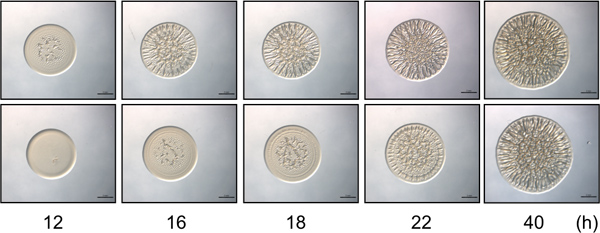
Figura 2. Tiempo-curso del ensayo. El panel superior contiene imágenes representativas de la formación de biopelículas por una cepa de control de biofilm competente de V. fischeri durante un transcurso de tiempo seleccionado. La iniciación de la formación de biopelículas es evidente a las 12 h. El panel inferior contiene representante ilos magos de una cepa mutante de V. fischeri que presenta un retraso (4 h) en el inicio de la formación de colonias arrugada con el tiempo, con la formación de biopelículas de iniciar a las 16 h después de la inoculación. Tenga en cuenta que a las 40 horas, las cepas de aspecto similar en la intensidad y patrón de la formación de biopelículas, mientras que las diferencias sutiles entre estas cepas sólo se observan en los puntos temporales anteriores. Estas imágenes se generaron con RSCS sobreexpresión de tipo salvaje y mutante Sype V. fischeri células y que formaban parte del conjunto de datos recogidos de Morris et al., 2011.
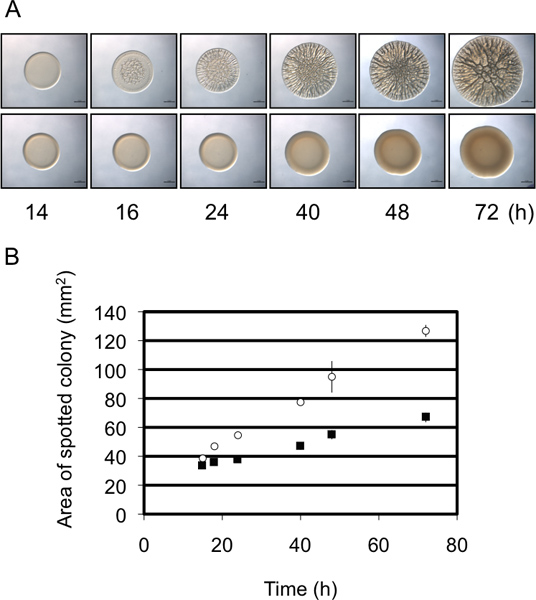
Figura 3. Diámetro colonia como un análisis semi-cuantitativo de la formación de biopelículas. (A) Evolución temporal de la formación de biopelículas por el representante de formación de biofilm (panel superior) y no-formación de biofilm (panel inferior) de las cepas de V. fischeri. Nótese que la cepa biopelícula formador exhibe un aumento mayorde diámetro con el tiempo en relación con la cepa no formadora de biofilm. Estas imágenes fueron generadas con la naturaleza de tipo V. fischeri que contiene una parte RSCS sobreexpresión plásmido (formación de biofilm) o un control de vectores (no formación de biofilm) y eran del conjunto de datos recogidos por Morris et al., 2011. (B) Una representación gráfica del aumento de diámetro de las colonias con el tiempo por las dos cepas en el panel A. Estos datos se generaron utilizando el software ImageJ y Excel como se indica en el protocolo.
Discusión
En este trabajo se describe un método semi-cuantitativo para evaluar la formación de biopelículas con V. fischeri como organismo modelo. Específicamente, utilizamos un microscopio de disección con el accesorio de cámara para controlar la formación de biopelículas y el desarrollo como la formación de colonias arrugada en el tiempo sobre una superficie de agar sólido. En este protocolo, se exponen dos tipos específicos de los métodos que comúnmente se utilizan para evaluar la formación de colonias arrugada. El primero es el ensayo de punto final, que nos permite observar la arquitectura final, en general 3D, modelado, y el diámetro de una cultura manchada en un punto seleccionado "final" del tiempo. Este enfoque es más útil para la evaluación de las cepas mutantes o condiciones que conducen a defectos dramáticos en la formación de biopelículas. Sin embargo, este método no distingue entre diferencias más sutiles que ocurren en puntos de tiempo antes de que el seleccionado de punto final. Para seguir más de cerca la formación de colonias arrugada, se utiliza un ensayo de evolución en el tiempo, lo que nos permite identificar el inicio de wrinkled la formación de colonias y observar su evolución en el tiempo. Como resultado de este enfoque, las diferencias más sutiles en el momento de la formación de colonias arrugado, arquitectura 3D, y el patrón puede ser identificado. Se utilizó este ensayo curso del tiempo para generar dos semi-cuantitativa de los ensayos de la formación de biopelículas. En primer lugar, el momento en que una cepa comienza a desarrollar una arquitectura 3D puede ser comparada con la de las cepas de control. Hemos encontrado que el retraso en la formación de biopelículas de un mutante particular, en las mismas condiciones es bastante constante 9. Por ejemplo, en los datos mostrados en la figura. 2, el mutante consistentemente exhiben un retraso de 4 horas en la iniciación de la formación de biopelículas. Un segundo semi-cuantitativo medida de la formación de biopelículas es el cambio en el tamaño del diámetro de la colonia arrugado (mancha). Hemos encontrado que el diámetro de las colonias arrugadas progresivamente difiere de la de no-biofilm colonias, alcanzando aproximadamente una diferencia de 2 veces en el punto de tiempo extremo (Fig. 3 ) (Morris y Visick, datos no publicados). Hasta la fecha, no hemos observado un fenotipo sin el otro (es decir, la formación de biopelículas, sin un aumento en el diámetro de las colonias) (datos no publicados), aunque sigue siendo posible que algunos mutantes se comportan de manera diferente. De hecho, se ha informado para V. cholerae que algún resultado colonias arrugada en un aumento sustancial en diámetro de las colonias, mientras que otros no lo hacen 15. Sin embargo, la evaluación del cambio en el diámetro con el tiempo podría ayudar en la caracterización de mutantes biofilm potencial y / o proporcionar una medida cuantitativa adicional de mutantes con retrasos en el desarrollo. De las dos medidas de la formación de biopelículas (tiempo y diámetro), para determinar el inicio de la formación de colonias arrugado es más sensible, pero también más subjetivo, que a la determinación del diámetro de la mancha. Aun así, ambas medidas proporcionan una evaluación semi-cuantitativa de un fenotipo que es extremadamente útil para los investigadores del biofilm, pero no se presta fácilmente a quantification.
Al realizar los ensayos de cultivos de manchas, es importante tener en cuenta las condiciones ambientales en las que las cepas detectadas se cultivan. La formación de colonias arrugada es a menudo influenciado por diversas condiciones ambientales, incluyendo la disponibilidad de nutrientes, temperatura y humedad. Para reducir la variabilidad entre los experimentos, es útil para normalizar estas condiciones tanto como sea posible (es decir, la normalización de las placas de agar a un volumen determinado y el cultivo de las cepas detectadas a una temperatura controlada). Para un mayor control de la variabilidad entre los experimentos de localización, es importante incluir las cepas de control adecuados dentro de cada serie de experimentos. Finalmente, al interpretar los datos de estos ensayos, es necesario realizar ningún experimento un varias veces (3 +), especialmente cuando la evaluación de las diferencias sutiles en la formación de colonias arrugada (por ejemplo, un retraso en la formación de biopelículas o diferencias de modelado). Algunas de las limitaciones de este protocolo son: 1) deterIng. si las células tienen un defecto en el crecimiento puede ser difícil: el crecimiento de células en cultivo líquido no pueden reflejar con precisión las tasas de crecimiento en medios sólidos, y una determinación exacta del crecimiento de las células formadoras de biopelículas, que pueden adherirse entre sí, puede no ser posible; 2) las cepas con defectos de crecimiento será problemático para analizar; 3) puede que no sea posible distinguir las diferencias de diámetro entre las cepas con fenotipos biofilm sutiles; 4) para las cepas que no crecen en un anillo concéntrico puede que no sea posible medir con precisión cambios en el diámetro, 5), mientras que los patrones pueden ser observadas durante la formación de biopelículas, no hay manera de cuantificar el patrón de la biopelícula resultante, y 6) no hay manera de medir la dimensión Z de la biopelícula con este montaje experimental . A pesar de estas limitaciones, sin embargo, este protocolo ofrece un medio para obtener datos numéricos para ayudar a evaluar la formación de colonias arrugada.
En este protocolo, que utilizan una imagen específicasistema (es decir, un microscopio Zeiss disección y ProgRes CapturePRO software de imágenes) para observar y evaluar la formación de colonias arrugada. El sistema de imagen descrito aquí es potente: la capacidad de detectar el inicio de la formación de colonias arrugada, y por lo tanto evaluar el desarrollo con un enfoque curso del tiempo, es mucho mayor a través del uso de un microscopio de disección. Sin embargo, si esta tecnología no está disponible, el protocolo puede ser adaptado para su uso con otros equipos, incluyendo una simple cámara digital con un zoom de enfoque. Si bien este protocolo se centra en la evaluación del desarrollo de colonias arrugada, también podría ser modificado para evaluar la formación de película, una forma de biopelícula que se desarrolla cuando las células están creciendo estáticamente en cultivo líquido. Este protocolo también puede ser útil en la evaluación de otros indicadores de la formación de biopelículas, incluyendo la incorporación de los tintes específicos en las colonias observadas durante el desarrollo del biofilm. Estos incluyen, pero no se limitan a, colorantes tales como Rojo Congo y calcofluo que puede unirse a la celulosa, un componente común de biopelículas bacterianas 16. Además, este protocolo, aunque desarrollado para su uso con V. fischeri, no se limita a este organismo, pero puede generalizarse a estudiar la formación de biopelículas en numerosos organismos diferentes, tales como Bacillus subtilis, 4 Vibrio cholerae 5, Vibrio 6, 7 y Pseudomonas aeruginosa, que toda la formación exhibición colonia arrugada. Finalmente, también se puede adaptar para estudiar otras morfologías de colonia que tienen un patrón de desarrollo, tales como, potencialmente, el patrón que se produce durante el crecimiento de Myxococcus xanthus 17 y desarrollo de la estructura aérea en Pseudomonas aeruginosa 18. Este protocolo es, pues, de uso general para los investigadores de microbiología y la biopelícula.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Este trabajo fue apoyado por el SNS R01 GM59690 subvención concedida a KLV.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del Equipo | Empresa | Número de catálogo | Comentarios |
| Zeiss Stemi 2000-C Microscopio de disección | Zeiss | 45505300000000000 | (Obtenido a través del microscopio Lukas) |
| ProgRes C10 PLUS | JENOPTIK Optical Systems GmbH | 017953-602-26 | Apego cámara (que se obtiene a través del microscopio Lukas) |
| CL 1500 CE Fuente de luz fría | Zeiss | 4355400000000000 | (Obtenido a través del microscopio Lukas) |
| ProgRes CapturePRO | JENOPTIK Optical Systems GmbH | El software libre con la cámara registrada | Programa informático para la captura de la imagen |
| Imagen de J | NIH | El software libre a partir de:ij / download.html "target =" _blank "> http://rsb.info.nih.gov/ij/download.html | Programa de Ordenador para mediciones de diámetros |
Referencias
- Donlan, R. M., Costerton, J. W. Biofilms: survival mechanisms of clinically relevant microorganisms. Clin. Microbiol. Rev. 15, 167-167 (2002).
- Stoodley, P., Sauer, K., Davies, D. G., Costerton, J. W. Biofilms as complex differentiated communities. Annu. Rev. Microbiol. 56, 187 (2002).
- Branda, S. S., Vik, S., Friedman, L., Kolter, R. Biofilms: the matrix revisited. Trends Microbiol. 13, 20 (2005).
- Branda, S. S. Fruiting body formation by Bacillus subtilis. Proc. Natl. Acad. Sci. U.S.A. 98, 11621-11621 (2001).
- Beyhan, S. Regulation of rugosity and biofilm formation in Vibrio cholerae: comparison of VpsT and VpsR regulons and epistasis analysis of vpsT, vpsR, and hapR. J. Bacteriol. 189, 388 (2007).
- Enos-Berlage, J. L., Guvener, Z. T., Keenan, C. E., McCarter, L. L. Genetic determinants of biofilm development of opaque and translucent Vibrio parahaemolyticus. Mol. Microbiol. 55, 1160 (2005).
- Merritt, J. H., Brothers, K. M., Kuchma, S. L., O'Toole, G. A. SadC reciprocally influences biofilm formation and swarming motility via modulation of exopolysaccharide production and flagellar function. J. Bacteriol. 189, 8154-8154 (2007).
- Yip, E. S., Geszvain, K., DeLoney-Marino, C. R., Visick, K. L. The symbiosis regulator rscS controls the syp gene locus, biofilm formation and symbiotic aggregation by Vibrio fischeri. Mol. Microbiol. 62, 1586-1586 (2006).
- Morris, A. R., Darnell, C. L., Visick, K. L. Inactivation of a novel response regulator is necessary for biofilm formation and host colonization by Vibrio fischeri. Mol. Microbiol. 82, 114 (2011).
- Nyholm, S. V. Roles of Vibrio fischeri and nonsymbiotic bacteria in the dynamics of mucus secretion during symbiont colonization of the Euprymna scolopes light organ. Appl. Environ. Microbiol. 68, 5113 (2002).
- Yip, E. S., Grublesky, B. T., Hussa, E. A., Visick, K. L. A novel, conserved cluster of genes promotes symbiotic colonization and σ54-dependent biofilm formation by Vibrio fischeri. Mol. Microbiol. 57, 1485 (2005).
- Mandel, M. J. A single regulatory gene is sufficient to alter bacterial host range. Nature. 458, 215 (2009).
- Graf, J., Dunlap, P. V., Ruby, E. G. Effect of transposon-induced motility mutations on colonization of the host light organ by Vibrio fischeri. J. Bacteriol. 176, 6986 (1994).
- Geszvain, K., Visick, K. L. The hybrid sensor kinase RscS integrates positive and negative signals to modulate biofilm formation in Vibrio fischeri. J. Bacteriol. 190, 4437 (2008).
- Krasteva, P. V. Vibrio cholerae VpsT regulates matrix production and motility by directly sensing cyclic di-GMP. Science. 327, 866 (2010).
- Romling, U. Characterization of the rdar morphotype, a multicellular behaviour in Enterobacteriaceae. Cell Mol. Life. Sci. 62, 1234 (2005).
- Berleman, J. E., Chumley, T., Cheung, P., Kirby, J. R. Rippling is a predatory behavior in Myxococcus xanthus. J. Bacteriol. 188, 5888 (2006).
- Lee, K., Veeranagouda, Y. Ultramicrocells form by reductive division in macroscopic Pseudomonas aerial structures. Environ. Microbiol. 11, 1117 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados