このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
タンジェンシャルフロー限外濾過:コロイダルシルバーナノ粒子の大きさの選択と集中のための "グリーン"メソッド
要約
タンジェンシャルフローろ過(TFU)はbiosamplesの重量ベースの分離のために使用される循環方式である。 TFUは、サイズ選択(1-20 nmの直径)に適応性の高い多分散銀ナノ粒子の大量(15.2μgのmlの4 Lを集中しました -1 8,539.9μgのmlの4ミリリットルにダウン -1)最小限の集合である。
要約
今日では、AgNPsは広範囲にその強力な抗菌特性に起因する消費者向け製品は、1水消毒、2治療薬、1、3、および生物医学装置4の製造で使用されています3月6日 、これらのナノ粒子のアプリケーションが強くAgNPサイズと凝集状態の影響を受けている。多くの課題は、制御された製造7、化学的に積極的なキャッピング/安定剤や有機溶剤などから解放された非機能性、均質AgNPsのサイズベースの分離4,8に存在しています。7月13日の制限がコスト高あるいは縮小、試薬の毒性から出てくるAgNP合成や分離方法( 例えば 、遠心分離、サイズ依存溶解性、サイズ排除クロマトグラフィー、等)の効率。10,14-18これを克服するために、我々は最近、TFUは大きいサイズ、濃度の制御とを許可することを示したクレイトンAgNPs(300の凝集状態そのような超遠心分離などの従来の方法に比べ198.7μgのml -1)を15.3μgのml -1の mlのダウンに10ミリリットル19
TFUは、一般的にタンパク質、ウイルスと細胞の重量ベースの単離に用いた再循環方式です。20,21簡単に言うと、液体試料はkDの1,000〜10kDの範囲の細孔径を有する中空糸膜のシリーズを介して渡されます。大きい成分が(保持)は保持されながら、サンプルの小さな懸濁または溶解成分は、(ろ)溶媒と共に多孔関門を通過することになる。 TFUは、それがどちらの損害賠償をサンプルとして "緑"の方法であると考えたり、有毒な過剰な試薬および副産物を除去するために追加の溶媒が必要とすることができる。疎水性と親水性の両方のフィルターが利用可能であるさらに、TFUは、ナノ粒子の大規模な様々に適用してもよい。
本研究の2つの主要な目的は、1)説明するためにコロイドナノ粒子と濃縮水の小さいボリュームの大きいボリュームのためTFU方式の実現可能性を実証するために招待されたビデオの経験と2を通してTFUアプローチの実験的側面)。まず、unfuctionalized AgNPsは(4リットル、15.2μgのml -1)をNaBH 4でAgNO 3の還元によって十分に確立されたクレイトン法22,23を用いて合成した。 AgNP多分散性は、その後、2つの100-KD(200 cm 2で 、20 cm 2)のフィルタに続いて50nmを超えるAgNPsとAgNP-凝集物を除去し、50 nmフィルター(460 cm 2)を 、使用して3つのステップTFUを介して最小化されたAgNPsを集中させる。代表的なサンプルは、透過型電子顕微鏡、紫外可視吸光光度法、ラマン分光法、誘導結合プラズマ発光分光法を用いて特徴付けた。最終残留物は高度に濃縮された(4ミリリットル、8,539.9μgのml -1)をさらに集約し、均質な卑しいから成っていた直径1から20 nmのAgNPs。これは、約62%の銀濃度の収率に相当する。
プロトコル
1。コロイドAgNPsの合成
クレイトン法(わずかに変更され、安価な)22の反応機構は、望ましくない加水分解室温以上でのNaBH 4の副反応と一緒に参照パベルet.alのサポート情報で非常に詳細に説明されています。23
- 4月12日40%エタノール浴中1.25 M NaOH中時間、そして最後にオートクレーブし、次いで、10%HNO 3浴で12〜24時間のためにすべてのガラスを清掃してください。ガラス製品は、酸と塩基のバスのステップの後、超純水(MΩ17以上)で完全に5回の最小値を洗い流してください。
- 2mMのNaBH 4の溶液および10℃に冷却オートクレーブ処理水を使用して1mMのAgNO 3溶液℃の100mlの300ミリリットルを準備低い温度では、NaBH 4の副反応を防ぐことができます。
- 500mlの三角反応フラスコCONTに2mMのNaBH 4の溶液300mlを追加攪拌棒をainingと銀の酸化を防ぐためにアルミホイルでフラスコを包む。撹拌プレート上で、氷浴中でフラスコを置き、10分間、325 rpmで溶液を攪拌。
- 首相、超純水の完全列でリンス25mlのビュレット。プライミング後、アルミ箔でAgNO 3溶液とラップでビュレットを埋める。
- 暗い部屋の中で、連続的に攪拌しながらのNaBH 4水溶液( 図1A)に1滴秒-1の速度で1mMのAgNO 3溶液50 mlを加える。 AgNO 3を加えて中に光曝露を最小限にするために、 "箔のテント"を備えた装置の中央部分をカバーしています。 AgNO 3を加えて30〜40分を必要とするでしょう。定期的に氷浴を補給してください。
- AgNO 3を添加終了後、氷浴を補給し、追加の45から50分間コロイド溶液を攪拌し続ける。コロイドAgNPsの形成は、無色から色の変化によって通知されますAgNPsの表面プラズモン共鳴最大( 図1B)の特徴である黄金色に。
- 反応が完了すると、コロイドを冷蔵。コロイドが一貫残っている場合はコロイドAgNPバッチが1週間後に組み合わせることができる、 すなわち 、コロイド溶液が集約されていないとバッチが可能な凝集や汚染物質を同定するために、紫外可視吸光光度法とラマン分光法を用いて特徴づけられている。
2。コロイドAgNPsのキャラクタリゼーション
ケーリー50 UV-VIS-NIR分光光度計(バリアン社製)とオリンパスBX41共焦点ラマン顕微鏡を装備LabRamHR 800ラマンシステム(ホリバ·ジョバンイボン社)を、AgNPの特性評価に利用された。ケーリーWinUVソフトウェア、LabSpec V.5とOrigin 8.0ソフトウェアは、データ収集と分析のために用いた。
注:取得パラメータは、foを最適化する必要がありますrの他のインスツルメンテーション·モデル。
紫外可視分光光度経由AgNPsコロイドの表面プラズモン共鳴の決定
- 1時10体積比でクレイトンコロイドと超純水で1cm 3の使い捨てキュベットを埋める。空白のベースライン補正のための超純水で別の1cm 3のキュベットを埋める。キムワイプで両方のキュベットの外側を拭きます。
- -0.5のY最小値から1.0のY最大に吸光度モードに分光光度計を設定します。 200から800 nmまでのXスキャンウィンドウを設定すると、ベースライン補正で4800 nmのmin -1の高速スキャンレートを選択します。
- 機器に水を充填したキュベットを挿入し、ベースラインスキャンを実行します。必要であれば、非ゼロベースラインコントロールが達成されるまで繰り返します。
- サンプルキュベットとキュベットブランクを交換して、コロイド状の試料のUV-Vis吸収スペクトル( 図1C)のコレクションの吸光度スキャンを開始します。
ラマン分光法を介したコロイドAgNPsの純度試験
デモビデオ(10〜15分のビデオ)とプロトコルのテキスト(最大3ページ)の容量の制限の時間制限のため、この実験の項をビデオテープに録画されません。
- 励起源(632.8nmでのHe-Ne)、フィルタ(フィルタなし、サンプルのレーザーパワー〜17 mW)を、共焦点穴(300μm)を、分光計(730 cm -1)を、ホログラフィックグレーティング次のようにインストゥルメント·パラメーターの設定を設定する(600木立/ mm)で、対物レンズ(50倍の長作動距離空気客観)、露光時間(30秒)、および蓄積サイクル(5)。
- コロイドと2ミリリットル石英キュベットを埋めるためにきれいなピペットを使用し、ゆっくりとプラグを差し込んでください。キュベットの表面から指紋、汚れやコロイドをきれいにキムワイプを使用しています。大幅顕微鏡ステージを下げてください。 50倍の対物レンズを選択して、ステージ上にキュベットを置く。
- ラスを集中直接楽器とオリンパス製カメラのビデオモードを使用してキュベットの内壁の下にAgNPコロイドにおけるERビーム。部屋の照明をオフにして、ラマンスペクトル( 図1D)を取得。
3。タンジェンシャルフロー限外ろ過(TFU)を介してコロイドAgNPsのサイズ - 選択と集中
KrosFlo IIリサーチフィルタリングシステム(スペクトラムラボラトリーズ、Rancho Dominguez、カリフォルニア州)はAgNP多分散性を制限するために、それらを( 図2)を濃縮するために使用された。 TFUプロセスの3つの手順は次のとおりだった:AgNPsおよび50 nmのMidiKrosポリスルホンモジュール(460 cm 2)と2を使用して直径と大きい方の50-nmのAgNP会合体(1)サイズ-選択)のサイズの選択と集中1月20日100-KD MidiKrosフィルタ(200 cm 2)を用いて、直径nm、および100 kDのMicroKrosポリスルホンフィルター(20センチ2)( 図3)を使用して、(3)さらに減容のAgNPs。
ステップ1
- 図2Aを参照するに従って、蠕動ポンプにサイズ17 MASTERFLEX送りチューブを接続します。 Yジャンクションとチューブの接合部は、セットアップに必要でしょう。 50nmのMidiKrosモジュールにチューブを取り付けます。タイラップを使用してフィルタリングするためのチューブを固定してください。 SIZEボタンを使用してチューブサイズ17を選択します。
- DIRボタンを使用して、ポンプの方向を反時計回りに選択します。 MODEボタンがINTにあることを確認します。
- ポンプを始動する前に、以下の300ミリリットル分-1にポンプ速度を下げます。ポンプ速度は、使用するチューブのサイズに応じて調整されるべきである。これは、オペレータが迅速に、潜在的なリークそれでもプライミングシステムの効果を持っているのに十分な大きさに反応することを許可するために小さな値を設定する必要があります。チューブとフィルタにリザーバからコロイドを描画するために必要な真空を生成するために、チューブの途中のY字路の頂部にフィルターの底部からつながるチューブをカット。
- リザーバーボトルにフィルターからつながる配管のセクションを置き、クランプまたは手でYジャンクションの近くにチューブの底部をオフにクランプします。ポンプの電源をオンにします。作成された真空はコロイドを吸い上げ開始する必要があります。
- 液体が管を通って自由に流れるされた後、ポンプをオフに配管接合とチューブの折れたセクションに参加して、タイラップで固定します。再びポンプの電源をオンにして、ろ過を続ける。
- リークのチューブ回路を確認してください。漏れが見つかった場合、フィッティングの調整やジップタイで再確保することによりリークを修正。一度配管システムは、漏れのない、ポンプ流量が大きくない700よりミリリットル分-1に増加させてもよいです。このポンプ速度値は、チューブ失敗を回避するために、配管サイズに合わせて最適化する必要があります。リザーバボトル内の液体がほぼ無になくなるまでろ過を続ける。
- ろ過が完了したら、50 nmの直径およびSmaIのAgNPsを含むろ液を回収LER。保持物を特定AgNPアプリケーションに応じて、さらなる分析のために保存されることがあります。
ステップ2
- 前に100-KD MidiKrosフィルタは50 nmのモジュールと同じ設定を使用してのインストール〜2%HNO 3および超純水でチューブを洗浄します。
- 100-KD MidiKrosモジュールを使用して3.3の手順を繰り返します。
- ろ過が完了したら、チューブとフィルタ(100-KD濃縮水)の内容を収集しています。容積は約50ミリリットルである必要があります。
ステップ3
- 図2Bに応じ蠕動ポンプにフィルターサイズ14 MASTERFLEXチューブおよび100 kDのMicroKrosを接続します。ジップタイを持つすべての接合部を固定します。 SIZEボタンを使用してポンプのチューブサイズ14を選択し、30ミリリットル分-1にポンプ速度を下げる。
- ろ過プロセスを開始します。リークのチューブ回路を確認してください。漏れが見つかった場合は、フィット感を調整することにより、リークを修正ティンまたは再確保ジップタイで。
- 一度配管システムがリークフリーで、ポンプ流量は大きくない90よりミリリットル分-1に増加させることができる。リザーバボトルに残っている液体は、濃縮物の最小量を含むようになるまでろ過を続ける。
- チューブとフィルタの残りの内容は、ポンプが作動している間にボトルから栄養チューブを除去することにより、貯水ボトルに収集することができる。チューブとフィルタ内容がリザーバボトルに入ったら、ポンプがオフにされるかもしれません。
4。誘導結合プラズマ発光分析法(ICP-OES)によるコロイドAgNPsにおける銀量の定量
各コロイド試料は化学的に消化した銀の量は710E分光計(バリアン社製)を用いて、ICP-OESで定量した。銀に対する線形回帰検量線( 図4)は 8銀の基準(0,3を使用して構築された、7、10、15、25、50、および100μgL-1)、微量金属分析用万μgのml -1の銀の標準(超科学)から調製された。
- 化学的にHNO 3を使用してサンプルを消化。代表的なサンプルは、元のコロイド(ステップ1)、50 nmのろ液(ステップ1)、100-KD濃縮水(ステップ2)、および最終的な100-KD濃縮液(ステップ3)( 図3)である。
- 50 nmのろ液は、最初の100 kDのリテンテート用1:25,000、および1:250,000用のオリジナルコロイド、1:1000 1:1000用:サンプルは次の体積比を用いて2%HNO 3を希釈してください最後の100 kDのリテンテート。銀の浸出を防止するために、すべてのサンプルは、低密度ポリプロピレン容器に格納する必要があります。
- 次のように、ICP-OESの機器パラメータを設定します。Agの波長(328.068 nm)を、電力(1.20キロワット)、プラズマ流(15.0 L分-1)、補助流量(1.50 L分-1)、およびネブライザー圧(200 kPaで)。
- 各SAmpleは10秒の複製時に三重に測定する必要があります。 15秒と30秒のサンプル取り込み遅延の間に、測定安定時間を使用する必要があります。メソッドブランクは交差汚染の可能性を低減するために、すべてのサンプルとの間に導入されるべきである。
5。透過型電子顕微鏡(TEM)を介してコロイドAgNPsのサイズ分布
フィリップスEM 208S TEMをコロイドAgNPsを視覚化するために使用されました。電子顕微鏡写真は、高解像度ガタンBioscanカメラで撮影すると、ImageJソフトウェアで分析した。24
- 超純水(1:100体積比)で100 kDのリテンテートサンプルを希釈します。 300メッシュformvar-被覆金グリッド(電子顕微鏡学)の元コロイドおよび希薄化後100-kDのリテンテート(ステップ3)のデポジットを20μl。グリッドはデシケーター中で乾燥することができます。 1日以内に表示します。
- AgNPsを可視化する70 kVで、TEM測定器の加速電位を設定します。 C言語高解像度カメラを用いた電子顕微鏡写真( 図5)aptureとタグ付けされた画像ファイル形式(TIFF)として保存します。
6。代表的な結果
コロイドAgNPsの合成とキャラクタリゼーション
クレイトンコロイドAgNPsの4リットルが正常に、図1Aに表示される設定を使用して合成した。最後のコロイド特性黄金色( 図1B)。22,23このコロイドのUV-Vis吸収スペクトルは394 nmの( 図1C)で典型的なシャープ、左右対称の表面プラズモンピーク(SPR)を持っていました。オリジナルクレイトンコロイドと最終100-KD濃縮水のラマンスペクトルは、3つだけ、すなわち振動モード、曲げ(1640 cm -1)をし、H 2 Oの対称および非対称伸縮振動(3245 cm -1のおよび3390 cm -1を提示、それぞれ)( 図1D)。</ P>
コロイドAgNPsのTFU
TFUのセットアップと3ステップTFUプロセスの概略を、それぞれ図2と図3に示されている。ステップ1では、50 nmフィルター(460 cm 2)を 、サイズを選択するとAgNPsと元のコロイド(50nmの濃縮水約100ml)から50 nmの直径と大きいのAgNP-凝集物を除去するために利用した。このステップは、50 nmの濾液の3.9 Lにダウン元のコロイド4Lのから小さい容積の減少を伴っていた。無洗またはフロー中断ステップは使用されませんでした。最大の体積減少( すなわち 、水の除去は、ステップ2)で得られた、50 nmのろ液は、その後、100 kDのフィルタ(200 cm 2)を介して実行されたとき。その結果、100 kDの残留物は50ミリリットルの総容積を持っていた。合成の副生成物及び過剰な試薬のほとんどは、水溶媒(100 kDの濾液の3.850ミリリットル)を介してこの工程で除去された。さらに、AgNP濃度はADDITによって達成された以前に報告された手順に第三濾過ステップ19この手順3でのイオン、小さい表面積の100 kDのフィルタ(20 cm 2)は 4.0ミリリットル〜100 kDの液量を減少させた。 TEMの測定は、この最後の100 kDの濃縮水は直径1から20 nmの卑しい集約AgNPsのほとんどが構成されていることを実証します。
コロイドAgNPsのICP-OESとTEM
銀に対する線形回帰検量線( 図4)は 8規格(0、3、7、10、15、25、50、および100μgL-1)から構築した。 4代表的なコロイド状の試料のそれぞれの銀の量は、外挿法により、ICP-OESの検量線から求めた:元コロイド(15.2 ppmで、 図3A)、最初の50 nmのろ液(14.1 ppmで、 図3B)、100 - kDのリテンテート(683.1 ppmで、 図3C)と最終的な100-kDのリテンテート(8,538.9 ppmで、 図3D)。15.2 ppmの実際の収量はクレイトン反応のための15.4 ppmの典型的な理論収率に非常に近いです。 AgNPs(8,538.9 ppmの4ml)の極端な濃度は、最終的な100-KD濃縮液のためにダークブラウンに元のコロイド( 図3、バイアルの写真の挿入図)のための黄金の黄色の色が劇的に変化することにより反映されていた。フィルタの品質は、ステップ1に、特にTFUプロセスにとって重要であることが判明した。最終リテンテート濃度は3,390.1 ppmからフィルタ(重真新しい対使用)の状態に応じ9,333.3 ppmの範囲であった。膜が侵害になる毛穴場合、50未満のnmの直径を有しAgNPsも保持され、その後、ろ液中に回収されAgNPsの全体量を減少させるであろう。圧力の監視と適切な洗浄が含まれるように濾過プロセスの最適化には、フィルターの寿命を向上させることができます。
の代表的なTEM写真オリジナルクレイトンコロイドと最終100-kDのリテンテート(ステップ3)を、それぞれ、 図5A及び図5Cに示されている。その集約されていない状態では、AgNPsは明るい灰色の背景に黒の丸い領域として表示されます。約800 AgNPs 2つの試料のそれぞれのTEM顕微鏡写真で同定されたとイメージJソフトを用いて分析した。一つの粒子が完全かつ同封境界によって定義されていました。面積閾値は、TEM写真の解像度に応じて2 1.0 nmに設定した。 AgNP数および面積データは、次にMicrosoft ExcelにエクスポートされたとAgNP径を外挿した。元のコロイドと最終100-KD濃縮水の平均AgNP径はそれぞれ9.3 nmと11.1 nmであると決定された。 AgNPsの直径測定値は、オリジン8.0ソフトウェアに輸出されたとTEMサイズのヒストグラム( 図5Bおよび5D)を各サンプルのために建設された。
1は "src =" / files/ftp_upload/4167/4167fig1.jpg "/>
図1)合成セットアップ、B)の特徴的な色、C)のUV-Vis吸収スペクトル、クレイトンコロイドAgNPsのD)のラマンスペクトル。

。)ステップ1と2については、 図2 TFU実験のセットアップ:私)タンククレイトンコロイドAgNPsを含む。ろ液収集用Ⅱ)貯水池。 Ⅲ)Y接合チューブインチIV)の蠕動ポンプヘッド。 V)が50 nmまたは100-kDのミディKROSフィルタのいずれかB)工程3:クレイトンコロイドAgNPsを含むI)貯水池。ろ液収集用Ⅱ)貯水池。 Ⅲ)、100 kDのマイクロKROSフィルター。
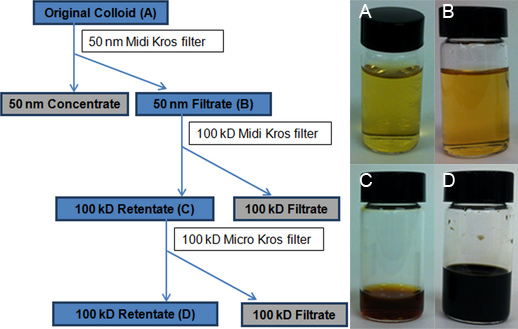
図3フローチャートTFUプロセスを描いた。青影付きボックスは、さらなる分析のために収集AgNPsのコロイド懸濁液をマーク。バイアルPhotographs))はオリジナルコロイドバッチA、B)を50nm濾液は50 nmのフィルタ(460 cm 2)であり、Cを介して元のコロイドを処理した後に回収し、100 kDのミディKROSを使用して減容した後に得られた最初の100 kDのリテンテートを表示フィルタ(200 cm 2)を、100 kDのマイクロKROSフィルタ(20 cm 2)を使用して、ボリューム減少によるD)は最終100-kDのリテンテート。 100-kDのろ液は水のように見えます。
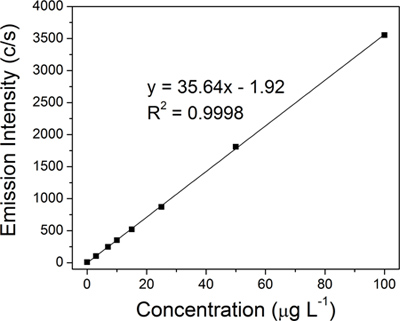
図4 8銀の基準を使用して構築され、ICP-OES、検量線の直線性:0、3、7、10、15、25、50、および100μgL-1を 。
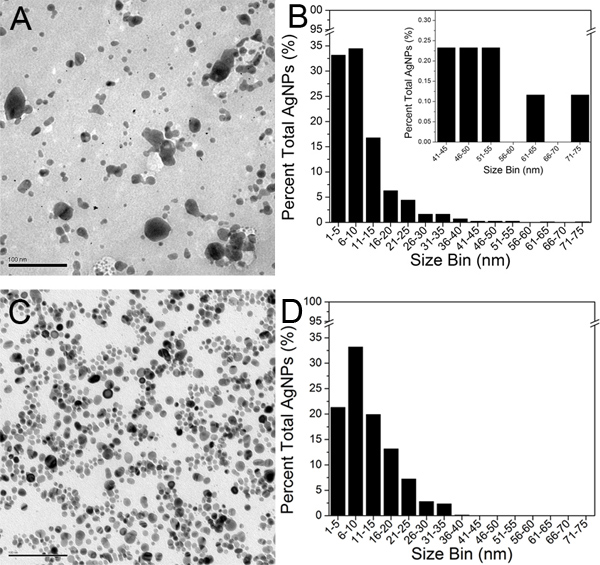
図5)は、元のクレイトンAgNPsとCのTEM顕微鏡写真)最後の100 kDのリテンテート(スケールバーです100nm)を。 Bの約800 AgNPsを分析することによって構築されたTEMサイズヒストグラム)オリジナルクレイトンのAgNPs、およびD)最後の100 kDのリテンテート。 図5Bの挿入図は、比較のために拡張された41から75 nmの大きさの範囲を示しています。 拡大図を表示するには、ここをクリックしてください 。
ディスカッション
UV-Vis吸収分光光度法とコロイドAgNPsのラマン分光
これはよくコロイドの吸収スペクトルにおける表面プラズモン共鳴ピークの数が増加AgNPsの対称として低下することが知られている。さらに、AgNP集約が広いまたは赤色シフトピークの出現につながる。25,26は 394 nmで、単一の鋭いと対称SPRピークの存在が適度な凝集や粒径分布の小さい、球状AgNPsの指標である。
開示事項
特別な利害関係は宣言されません。
謝辞
エンジニアリングとリーダーコンソーシアムプログラムにおけるNUE全米科学財団からの資金調達は感謝して承諾されます。
資料
| 硝酸銀(AgNO 3を ) | アクロスオーガニック株式会社 | CAS:7761-88-8 | |
| 水素化ホウ素ナトリウム(NaBH 4) | アクロスオーガニック株式会社 | CAS:16940-66-2 | |
| 硝酸(HNO 3、オプティマ) | フィッシャーサイエンティフィック株式会社 | A467-1 | ICP分析のための微量金属グレード |
| 万μgのml -1の標準銀、EnviroConcentrate | ウルトラ·サイエンティフィック | US-IAA-047 | |
| KrosFloリサーチII Iタンジェンシャルフロー· フィルトレーションシステム | スペクトラム·ラボラトリーズ | SYR2-U20-01N | |
| 0.05μmのPS(0.5ミリメートル)460 cm 2と | スペクトラム·ラボラトリーズ | X30S-900-02N | |
| ミディ100kDのPS 200センチメートル2 | スペクトラム·ラボラトリーズ | X3-100S-901-02N | |
| Micro100 kDのPSの20cm 2の | スペクトラム·ラボラトリーズ | X1AB-300-10N | |
| MASTERFLEX C-FLEXチューブL / Sサイズ17 | コール - パーマー楽器株式会社 | 06424から17 | |
| MASTERFLEX C-FLEXチューブL / Sサイズ14 | コール - パーマー楽器株式会社 | 06424から14 | |
| ケアリー50 UV-VIS-NIR分光光度計 | バリアン社 | ||
| LabRam HR 800システム | ホリバ·ジョバンイボン社 | ||
| バリアン710ES ICP-OES | バリアン社 |
表1に特異的な試薬や機器。
参考文献
- Savage, N., Diallo, M. S. Nanomaterials and Water Purification: Opportunities and Challenges. Journal of Nanoparticle Research. 7, 331-342 (2005).
- Jain, J. Silver Nanoparticles in Therapeutics: Development of an Antimicrobial Gel Formulation for Topical Use. Mol. Pharmaceutics. 6, 1388-1401 (2009).
- Dal Lago, V., Franca, d. O., de, A. G., Kobarg, J., Borba Cardoso, M. Size-selective silver nanoparticles: future of biomedical devices with enhanced bactericidal properties. J. Mater. Chem. 21, 12267-12273 (2011).
- Panacek, A. Silver Colloid Nanoparticles: Synthesis, Characterization, and Their Antibacterial Activity. J. Phys. Chem. B. 110, 16248-16253 (2006).
- Elechiguerra, J. Interaction of silver nanoparticles with HIV-1. Journal of Nanobiotechnology. 3, 6 (2005).
- Jana, N. R., Sau, T. K., Pal, T. Growing Small Silver Particle as Redox Catalyst. J. Phys. Chem. B. 103, 115-121 (1999).
- Tolaymat, T. M. An evidence-based environmental perspective of manufactured silver nanoparticle in syntheses and applications: A systematic review and critical appraisal of peer-reviewed scientific papers. Sci. Total Environ. 408, 999-1006 (2010).
- Willets, K. Surface-enhanced Raman scattering (SERS) for probing internal cellular structure and dynamics. Analytical and Bioanalytical Chemistry. 394, 85-94 (2009).
- Novak, J. P., Nickerson, C., Franzen, S., Feldheim, D. L. Purification of Molecularly Bridged Metal Nanoparticle Arrays by Centrifugation and Size Exclusion Chromatography. Anal. Chem. 73, 5758-5761 (2001).
- Hossain, M. K., Kitahama, Y., Huang, G. G., Han, X., Ozaki, Y. Surface-enhanced Raman scattering: realization of localized surface plasmon resonance using unique substrates and methods. Analytical and Bioanalytical Chemistry. 394, 1747-1760 (2009).
- Henglein, A., Giersig, M. Formation of Colloidal Silver Nanoparticles: Capping Action of Citrate. J. Phys. Chem. B. 103, 9533-9539 (1999).
- Sapsford, K. E., Tyner, K. M., Dair, B. J., Deschamps, J. R., Medintz, I. L. Analyzing Nanomaterial Bioconjugates: A Review of Current and Emerging Purification and Characterization Techniques. Anal. Chem. 83, 4453-4488 (2011).
- Al-Somali, A., Krueger, K. M., Falkner, J. C., Colvin, V. L. Recycling Size Exclusion Chromatography for the Analysis and Separation of Nanocrystalline Gold. Anal. Chem. 76, 5903-5910 (2004).
- Hanauer, M., Pierrat, S., Zins, I., Lotz, A., Sonnichsen, C. Separation of Nanoparticles by Gel Electrophoresis According to Size and Shape. Nano Lett. 7, 2881-2885 (2007).
- Sweeney, S. F., Woehrle, G. H., Hutchison, J. E. Rapid Purification and Size Separation of Gold Nanoparticles via Diafiltration. J. Am. Chem. Soc. 128, 3190-3197 (2006).
- Clarke, N. Z., Waters, C., Johnson, K. A., Satherley, J., Schiffrin, D. J. Size-Dependent Solubility of Thiol-Derivatized Gold Nanoparticles in Supercritical Ethane. Langmuir. 17, 6048-6050 (2001).
- Schaaff, T. G. Isolation of Smaller Nanocrystal Au Molecules: Robust Quantum Effects in Optical Spectra. J Phys Chem B. 101, 7885-7891 (1997).
- Trefry, J. C. Size Selection and Concentration of Silver Nanoparticles by Tangential Flow Ultrafiltration for SERS-Based Biosensors. J. Am. Chem. Soc. 132, 10970-10972 (2010).
- Bhattacharjee, S., Bhattacharjee, C., Datta, S. Studies on the fractionation of & beta-lactoglobulin from casein whey using ultrafiltration and ion-exchange membrane chromatography. J. Membr. Sci. 275, 141-150 (2006).
- Eppler, A., Weigandt, M., Schulze, S., Hanefeld, A., Bunjes, H. Comparison of different protein concentration techniques within preformulation development. Int. J. Pharm. 421, 120-129 (2011).
- Creighton, J. A., Blatchford, C. G., Albrecht, M. G. Plasma resonance enhancement of Raman scattering by pyridine adsorbed on silver or gold sol particles of size comparable to the excitation wavelength. J. Chem. Soc. Faraday Trans. 2, 790-798 (1979).
- Pavel, I. E. Estimating the Analytical and Surface Enhancement Factors in Surface-Enhanced Raman Scattering (SERS): A Novel Physical Chemistry and Nanotechnology Laboratory Experiment. J. Chem. Educ. , (2011).
- Rasband, W. S. . ImageJ. , (1997).
- Kelly, K. L., Coronado, E., Zhao, L. L., Schatz, G. C. The Optical Properties of Metal Nanoparticles: The Influence of Size, Shape, and Dielectric Environment. J. Phys. Chem. B. 107, 668-677 (2003).
- Śileikaitċ, A., Prosyčevas, I., Puišo, J., Juraitis, A., Guobienċ, A. Analysis of Silver Nanoparticles Produced by Chemical Reduction of Silver Salt Solution. Mater. Sci. (Medziagotyra). 12, 287-291 (2006).
- Lewis, L. N. Chemical catalysis by colloids and clusters. Chem. Rev. 93, 2693-2730 (1993).
- Li, Y., Wu, Y., Ong, B. S. Facile Synthesis of Silver Nanoparticles Useful for Fabrication of High-Conductivity Elements for Printed Electronics. J. Am. Chem. Soc. 127, 3266-3267 (2005).
- Sun, Y., Xia, Y. Shape-Controlled Synthesis of Gold and Silver Nanoparticles. Science. 298, 2176-2179 (2002).
- Han, X., Zhao, B., Ozaki, Y. Surface-enhanced Raman scattering for protein detection. Analytical and Bioanalytical Chemistry. 394, 1719-1727 (2009).
- Pavel, I. Label-Free SERS Detection of Small Proteins Modified to Act as Bifunctional Linkers. J. Phys. Chem. C. 112, 4880-4883 (2008).
- Ladner, D. A., Steele, M., Weir, A., Hristovski, K., Westerhoff, P. Functionalized nanoparticle interactions with polymeric membranes. J. Hazard. Mater. , (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved