Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Тангенциальный ультрафильтрации потока: "Зеленый" способ выбора размера и концентрации коллоидных наночастиц серебра
В этой статье
Резюме
Тангенциальный ультрафильтрации потока (ФПУ) является рециркуляция метод, используемый для веса на основе разделения биообъектов. TFU был адаптирован к размеру выберите (1-20 нм в диаметре) и очень сконцентрировать большое количество полидисперсных наночастиц серебра (4 л на 15,2 мкг мл -1 До 4 мл 8,539.9 мкг мл -1) С минимальным агрегации.
Аннотация
Nowadays, AgNPs are extensively used in the manufacture of consumer products,1 water disinfectants,2 therapeutics,1, 3 and biomedical devices4 due to their powerful antimicrobial properties.3-6 These nanoparticle applications are strongly influenced by the AgNP size and aggregation state. Many challenges exist in the controlled fabrication7 and size-based isolation4,8 of unfunctionalized, homogenous AgNPs that are free from chemically aggressive capping/stabilizing agents or organic solvents.7-13 Limitations emerge from the toxicity of reagents, high costs or reduced efficiency of the AgNP synthesis or isolation methods (e.g., centrifugation, size-dependent solubility, size-exclusion chromatography, etc.).10,14-18 To overcome this, we recently showed that TFU permits greater control over the size, concentration and aggregation state of Creighton AgNPs (300 ml of 15.3 μg ml-1 down to 10 ml of 198.7 μg ml-1) than conventional methods of isolation such as ultracentrifugation.19
TFU is a recirculation method commonly used for the weight-based isolation of proteins, viruses and cells.20,21 Briefly, the liquid sample is passed through a series of hollow fiber membranes with pore size ranging from 1,000 kD to 10 kD. Smaller suspended or dissolved constituents in the sample will pass through the porous barrier together with the solvent (filtrate), while the larger constituents are retained (retentate). TFU may be considered a "green" method as it neither damages the sample nor requires additional solvent to eliminate toxic excess reagents and byproducts. Furthermore, TFU may be applied to a large variety of nanoparticles as both hydrophobic and hydrophilic filters are available.
The two main objectives of this study were: 1) to illustrate the experimental aspects of the TFU approach through an invited video experience and 2) to demonstrate the feasibility of the TFU method for larger volumes of colloidal nanoparticles and smaller volumes of retentate. First, unfuctionalized AgNPs (4 L, 15.2 μg ml-1) were synthesized using the well-established Creighton method22,23 by the reduction of AgNO3 with NaBH4. AgNP polydispersity was then minimized via a 3-step TFU using a 50-nm filter (460 cm2) to remove AgNPs and AgNP-aggregates larger than 50 nm, followed by two 100-kD (200 cm2 and 20 cm2) filters to concentrate the AgNPs. Representative samples were characterized using transmission electron microscopy, UV-Vis absorption spectrophotometry, Raman spectroscopy, and inductively coupled plasma optical emission spectroscopy. The final retentate consisted of highly concentrated (4 ml, 8,539.9 μg ml-1) yet lowly aggregated and homogeneous AgNPs of 1-20 nm in diameter. This corresponds to a silver concentration yield of about 62%.
протокол
1. Синтез коллоидных AgNPs
Механизм реакции для метода Крейтон (слегка измененный, недорогой) 22 описан очень подробно в поддержку информации ссылка Павел et.al вместе с нежелательный гидролиз побочных реакции NaBH 4 при комнатной температуре или выше 23.
- Очистите все посуды в течение 12-24 ч в 10% HNO 3 бане, затем в течение 4-12 ч в 1,25 М NaOH в 40% этаноле ванну, и, наконец, автоклав. Посуда должна быть тщательно промыть, как минимум, в пять раз с особо чистой воды (17 МОм или выше) после того, как кислота и основание шаги ванны.
- Подготовьте 300 мл 2 мМ раствор NaBH 4 и 100 мл 1 мМ AgNO 3 решения с использованием автоклавного вода охлаждается на 10 ° C. Более низкие температуры будут препятствовать побочные реакции NaBH 4.
- Добавить 300 мл 2 мМ раствор NaBH 4 в 500 мл коническую колбу продолжение реакцииaining мешалкой и обернуть колбу с алюминиевой фольгой, чтобы предотвратить окисление серебра. Поместите колбу в ледяной бане на магнитной мешалки и перемешать раствор при 325 оборотов в минуту в течение 10 мин.
- Премьер-бюретки 25 мл путем промывки с полным колонке сверхчистой воды. После грунтовки, заполните бюретку раствор AgNO 3 и обернуть алюминиевой фольгой.
- В темной комнате, добавить 50 мл 1 мМ раствор AgNO 3 со скоростью 1 капля сек -1 до NaBH 4 раствор при непрерывном перемешивании (рис. 1А). Крышка средней части аппарата с "фольгой палатки", чтобы минимизировать воздействия света во время AgNO 3 сложения. AgNO 3 того потребует 30-40 мин. Пополнять ледяной бане периодически.
- После того AgNO 3 завершена, пополнить ледяную баню и продолжают перемешивание коллоидного раствора для дополнительных 45-50 мин. Образование коллоидных AgNPs сигнализируется изменением цвета от бесцветногодо золотисто-желтые, которая характерна для поверхностного плазменного резонанса максимум AgNPs (рис. 1б).
- После завершения реакции, охладите коллоида. Коллоидное партии ССПС могут быть объединены через неделю, если коллоидные оставалась неизменной, т. е. коллоидный раствор не агрегируются и партия были охарактеризованы с помощью UV-Vis-абсорбционной спектрофотометрии и спектроскопии комбинационного рассеяния света для выявления возможных агрегации или загрязняющие вещества.
2. Характеристика Коллоидное AgNPs
Cary 50 UV-VIS-NIR спектрофотометр (Varian Inc) и LabRamHR 800 комбинационного системы (Horiba Jobin Ивон, Inc), оборудованных Olympus BX41 конфокальной микроскопии комбинационного, были использованы для определения характеристик ССПС. Cary WinUV программного обеспечения, LabSpec v.5 и Происхождение 8,0 программного обеспечения были использованы для сбора и анализа данных.
Примечание: параметры измерения должны быть оптимизированы лГ другими моделями приборов.
Определение поверхностного плазменного резонанса коллоидных AgNPs с помощью UV-VIS спектрофотометрии
- Заполнить 1 см 3 одноразовых кювет с Крейтон коллоидной и сверхчистой воде в соотношении 1:10 объеме. Заполнить еще на 1 см 3 кюветы с особо чистой воды для пустых коррекция базовой линии. Протрите снаружи, так кювет с Kimwipe.
- Установить спектрофотометр для поглощения режиме с минимальным Y от -0,5 до Y максимум 1,0. Установить X окна сканирования на 200-800 нм и выберите высокую скорость сканирования 4800 нм мин -1 с исходным коррекции.
- Вставьте кювету наполненную водой в прибор и запустить базового сканирования. Повторить, если необходимо, пока ненулевой базовый контроль достигается.
- Замените пустую кювету с образцом кювет и инициировать поглощения сканирования для сбора UV-Vis спектр поглощения коллоидных образцов (рис. 1С).
Чистоту Тест коллоидных AgNPs с помощью спектроскопии комбинационного рассеяния света
Из-за ограничений по времени видео-демонстрации (10-15 минут видео) и ограничение на объем текста протокола (не более 3 страниц), это экспериментальный раздел не будет видеопленку.
- Установите инструмент настройки параметров следующим образом: источник возбуждения (632,8 нм He-Ne), фильтра (без фильтра, мощность лазера на образец ~ 17 мВт), конфокальный отверстие (300 мкм), спектрометр (730 см -1), голографические решетки (600 рощи / мм), объектив (50x долгого рабочего цель расстояние воздуха), время экспозиции (30 с), и накопления циклов (5).
- Используйте чистую пипетку, чтобы заполнить 2 мл кварцевую кювету с коллоидной и аккуратно вставьте вилку. Используйте Kimwipe очистить отпечатки пальцев, пятна или коллоидной от поверхности кюветы. Значительно ниже, столик микроскопа. Выберите 50x объектив и поместить кювету на сцену.
- Фокус-лас-э пучка на ССПС коллоидной непосредственно под внутренней стенкой кюветы с помощью видео режим прибора и камеры Olympus. Выключите огни комнаты и приобретать спектра комбинационного рассеяния (рис. 1D).
3. Размер отбора и концентрации коллоидных AgNPs через тангенциальную ультрафильтрацию Flow (ФПУ)
KrosFlo II Исследование фильтрации системы (Spectrum Laboratories, Rancho Dominguez, Калифорния) был использован для ограничения ССПС полидисперсности и сосредоточить их (рис. 2). Три стадии процесса TFU были: (1) Размер отбора AgNPs и ССПС-агрегаты 50-нм в диаметре и больше использовании 50-нм MidiKros полисульфона модуль (460 см 2), 2) Размер отбора и концентрации AgNPs из 1-20 нм в диаметре использованием 100-кДа MidiKros фильтр (200 см 2) и (3) Дальнейшее сокращение объемов помощи 100-кДа MicroKros полисульфона фильтра (20 см 2) (рис. 3).
Шаг 1
- Подключите размер 17 MasterFlex питания трубки к перистальтического насоса в соответствии с рисунком 2А. Y-соединение и соединение трубы будут необходимы для установки. Прикрепите трубки к 50-нм модулей MidiKros. Будьте уверены, чтобы обезопасить трубопровод для фильтрации использовании почтовый связей. Выбор труб размером 17 с использованием Размер кнопку.
- Выбор насоса против часовой стрелки направления использования DIR кнопку. Убедитесь, что кнопки РЕЖИМ на INT.
- Опустите насос скорости ниже 300 мл мин -1 до начала насоса. Насос ставка должна быть скорректирована в зависимости от размера используемой трубы. Она должна быть небольшой настройки, чтобы позволить оператору оперативно реагировать на возможные утечки, но достаточно большой, чтобы по-прежнему оказывать влияние грунтовки системы. Для того, чтобы создать вакуум, необходимых для рисования коллоидных из резервуара в трубы и фильтры, вырезать трубу, которая ведет от нижней части фильтра к верхней части Y-образном перекрестке в центре трубки.
- Поместите части трубки, которая ведет из фильтра в бутылью и зажим с нижней части трубы рядом с Y-образного перекрестка с помощью зажима или вручную. Включите насос. Создан вакуум должны начать несанкционированный коллоида.
- Как только жидкость течет свободно через трубу, отключить насос, присоединиться к сломанной части трубки с трубкой соединения и закрепить с молнией связей. Включите насос и продолжить фильтрацию.
- Проверьте трубки цепи на наличие утечек. Если утечки не обнаружено, устранить утечку, регулируя установку или повторно обеспечение с стяжку. Как только трубка системы герметичности, скорость насоса может быть увеличена до уровня не более 700 мл мин -1. Это значение скорости насоса должна быть оптимизирована в соответствии с размером трубы, чтобы избежать труб недостаточности. Продолжайте, пока фильтрации жидкости в резервуаре бутылка будет исчерпан почти ничего.
- После фильтрации является полным, сбор фильтрата, который содержит AgNPs из 50-нм в диаметре и маленькийЛер. Концентрат может быть сохранен для дальнейшего анализа в зависимости от конкретного приложения ССПС.
Шаг 2
- Промойте трубки с 2% HNO 3 и сверхчистой воды перед установкой 100-кДа MidiKros фильтрации с использованием тех же настройки, что и для 50-нм модулей.
- Повторите шаг 3,3 использовании 100-кДа MidiKros модуля.
- После фильтрации является полным, собирать содержимое трубки и фильтры (100-кДа ретентата). Объем должен быть примерно 50 мл.
Шаг 3
- Подключите размер 14 MasterFlex труб и 100-кДа MicroKros фильтр для перистальтического насоса в соответствии с рис 2B. Зафиксируйте все соединения с молнией связей. Выберите трубы размером 14 на насосе с помощью кнопки Размер и нижнего насоса скорость до 30 мл мин -1.
- Начало процесса фильтрации. Проверьте трубки цепи на наличие утечек. Если утечки не обнаружено, устранить утечку, регулируя нужнымTing или повторной обеспечения с стяжку.
- Как только трубка системы герметичности, скорость насоса может быть увеличена до уровня не более 90 мл мин -1. Продолжайте, пока фильтрации жидкости, оставшейся в резервуаре бутылка содержит минимальное количество концентрата.
- Остальное содержимое трубки и фильтры могут быть собраны в пласт бутылки, удалив трубка для кормления из бутылки, в то время как насос продолжает работать. Как только трубка и фильтр содержимого в резервуаре бутылки, насос может быть выключен.
4. Количественное Серебряный Сумма в коллоидной AgNPs с индуктивно связанной плазмой оптическая эмиссионная спектроскопия (ICP-OES)
Каждый коллоидных образец химически переваривается и количество серебра было количественно ICP-OES использованием спектрометра 710E (Varian Inc.) Линейной калибровочной кривой регрессии для серебра (рис. 4) была построена с использованием восемь серебряных стандартов (0, 3, 7, 10, 15, 25, 50 и 100 мкг L -1), которые были получены из 10000 мкг мл -1 серебряный стандарт для анализа следов металлов (Ultra Scientific).
- Химически переварить образцов с использованием HNO 3. Представитель образцы оригинальных коллоидной (шаг 1), 50-нм фильтрата (шаг 1), 100-кДа ретентата (шаг 2), и окончательная 100-кДа ретентата (шаг 3) (рис. 3).
- Образец должен быть разведен с 2%-ной HNO 3, используя следующие соотношения объема: 1:1000 для оригинального коллоид, 1:1000 для 50-нм фильтрата, 1:25,000 для первого 100-кДа ретентата, и 1:250000 для Окончательный 100-кДа ретентата. Для предотвращения выщелачивания серебра, все образцы должны храниться при низкой плотности полипропиленовых контейнеров.
- Установите ICP-OES инструмента следующие параметры: длина волны для Ag (328,068 нм), мощность (1,20 кВт), поток плазмы (15,0 л мин -1), вспомогательный поток (1,50 л мин -1), и распылитель давления (200 кПа ).
- Каждый SAmple должна измеряться в трех экземплярах с повторных время 10 с. Между измерения времени стабилизации 15 сек и 30 сек образца поглощение задержки должны быть использованы. Метод пустой должна быть введена между каждым образцом для снижения потенциального перекрестного загрязнения.
5. Размер распространения коллоидных AgNPs с помощью просвечивающей электронной микроскопии (ПЭМ)
Phillips EM 208S TEM был использован для визуализации коллоидных AgNPs. Электронные микрофотографии были получены с помощью высокого разрешения Gatan Bioscan камеру и проанализированы в программном обеспечении ImageJ 24.
- Развести 100-кДа ретентата образца с особо чистой воды (1:100 объему). Депозит 20 мкл исходной коллоидной и разбавленного 100-кДа ретентата (шаг 3) на 300-сетку формвар покрытые золотом сетей (Electron наук микроскопия). Разрешить сетей сушить в сушильном шкафу. Просмотр течение одного дня.
- Установить ускоряющий потенциал ТЕМ инструмента на 70 кВ для визуализации AgNPs. CApture электронной микроскопии (рис. 5), используя камеру с высоким разрешением и сохранить как помеченные файлы изображений формата (TIFF).
6. Представитель Результаты
Синтез и свойства коллоидных AgNPs
Четыре литра Крейтон коллоидных AgNPs были успешно синтезированы с использованием установки показан на рис 1А. Окончательный коллоидной имели характерный золотисто-желтый цвет (рис. 1б). 22, 23 UV-Vis спектр поглощения этой коллоидной был типичный острый, симметричный пик поверхностных плазмонов (SPR) при 394 нм (рис. 1С). Спектр комбинационного рассеяния оригинальный Крейтон коллоидной и окончательного 100-кДа ретентата представлены только три колебательных мод, а именно изгиб (1640 см -1) и симметричных и асимметричных валентных колебаний Н 2 О (3245 см -1 и 3390 см -1 , соответственно) (рис. 1D).
TFU коллоидных AgNPs
Установка TFU и схема 3-х ступенчатый процесс TFU изображены на рисунках 2 и 3, соответственно. На шаге 1, 50-нм фильтра (460 см 2) была использована для выбора размера и снять AgNPs и ССПС-агрегаты 50-нм в диаметре и более от первоначальной коллоидной (около 100 мл 50-нм ретентата). Этот шаг также сопровождалось небольшим снижением объема от 4 л оригинальных коллоидной вниз до 3,9 л 50-нм фильтрата. Нет шаг промывки или потока нарушения были использованы. Наибольший объем сокращения (например, удаление воды) был получен в шаге 2, когда 50-нм фильтрат затем проходит через 100-кДа фильтр (200 см 2). Полученную 100-кДа ретентата было общим объемом 50 мл. Большинство синтез побочных продуктов и избытка реагентов были устранены на данном этапе через воду растворитель (3,850 мл 100-кДа фильтрата). Кроме того, ССПС концентрация была достигнута Additиона третий шаг фильтрации сообщалось ранее процедуры. 19 В этом шаге 3, 100-кДа фильтр меньшую площадь поверхности (20 см 2) уменьшен на 100-кДа ретентата объем до 4,0 мл. TEM измерения покажут, что этот последний 100-кДа ретентата состоит в основном из скромного агрегированных AgNPs из 1-20 нм в диаметре.
ICP-OES и ТЕА коллоидных AgNPs
Линейной калибровочной кривой регрессии (рис. 4) для серебра была построена из восьми стандартов (0, 3, 7, 10, 15, 25, 50 и 100 мкг L -1). Количество серебра в каждом из четырех представителей коллоидных образцов определяли с ICP-OES калибровочной кривой путем экстраполяции: оригинальные коллоидной (15,2 промилле, 3А), 50-нм фильтрата (14,1 промилле, 3В), первые 100 - кД ретентата (683,1 частей на миллион, рис 3C) и окончательного 100-кДа ретентата (8,538.9 млн, рисунок 3D).Фактическая доходность в 15,2 промилле очень близко к типичной теоретический выход 15,4 промилле для реакции Крейтон. Высокая концентрация AgNPs (4 мл 8,538.9 млн) было отражено резкое изменение цвета от золотисто-желтого для оригинального коллоидной до темно-коричневого для окончательного 100-кДа ретентата (рис. 3, вставки из флакона фотографии). Качество фильтров было установлено, что решающее значение для процесса ФПУ, в частности к шагу 1. Окончательный ретентата концентрации варьировали от 3,390.1 млн до 9,333.3 млн в зависимости от состояния фильтров (активно используется против нового). Если поры мембраны стать угрозой, AgNPs, которые имеют диаметр меньше, чем 50-нм также будет сохранен и будет в дальнейшем уменьшить общую сумму AgNPs, собранные в фильтрате. Оптимизация процесса фильтрации, чтобы включить мониторинг давления и надлежащей очистки может увеличить срок службы фильтров.
Представитель Микрофотографии ПЭМ Оригинальный Крейтон коллоидной и окончательного 100-кДа ретентата (шаг 3) показаны на рис 5А и 5С, соответственно. В свою unaggregated государства, AgNPs отображаться в виде черных круглых области на светло серый фон. Около 800 AgNPs были определены в ПЭМ микрофотографии каждого из двух образцов и анализировали с помощью программы изображения J. Один частиц был определен полный и закрытый периметр. Значение область порог был установлен на уровне 1,0 нм 2 в соответствии с решением ПЭМ микрофотографии. ССПС графов и области данные были затем экспортированы в Microsoft Excel и ССПС диаметров были экстраполированы. Среднего диаметра ССПС в оригинальной коллоидной и окончательного 100-кДа ретентата были признаны 9,3 нм и 11,1 нм, соответственно. Диаметр измерений AgNPs затем были экспортированы в происхождении 8,0 программного обеспечения и TEM Гистограмма размеров был построен для каждого образца (рис. 5В и 5D).
1 "SRC =" / files/ftp_upload/4167/4167fig1.jpg "/>
Рисунок 1.) Синтез установки, б) Характерные цвета, C) UV-Vis спектра поглощения и D) спектр комбинационного рассеяния Крейтон коллоидных AgNPs.

Рисунок 2 TFU экспериментальной установки для) шаги 1 и 2. I) резервуар, содержащий коллоидное Крейтон AgNPs. II) Резервуар для сбора фильтрата. III) Y-образном перекрестке в трубку. IV) перистальтических насоса. . V) либо 50-нм или 100-кДа Midi Крос фильтр B) Шаг 3: I) резервуар, содержащий коллоидное Крейтон AgNPs. II) Резервуар для сбора фильтрата. III) 100-кДа Micro Крос фильтр.
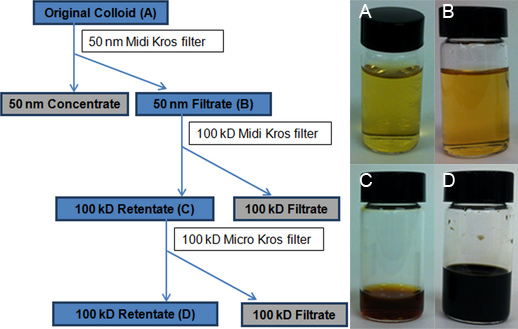
Рисунок 3. Блок-схемы, изображающие процесс ФПУ. Сине-серым цветом отметить коллоидных суспензий AgNPs собрали для дальнейшего анализа. Флакон рhotographs показать) Оригинальное коллоидной партии, B) 50-нм фильтрата, собранного после обработки исходного коллоидной по 50-нм фильтра (460 см 2), C) Начиная с 100-кДа ретентата, полученной после уменьшения объема использования 100-кДа Midi Крос фильтр (200 см 2), и D) окончательное 100-кДа ретентата в результате уменьшения объема использования 100-кДа Micro Крос фильтр (20 см 2). 100-кДа фильтрат выглядит как вода.
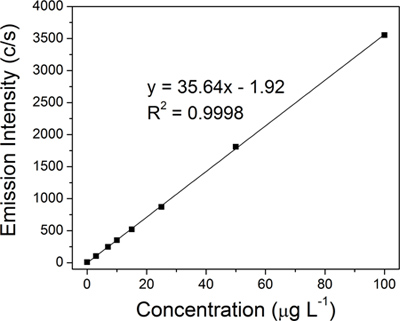
Рисунок 4 ICP-OES линейной калибровки построена с использованием восемь серебряных стандартов. 0, 3, 7, 10, 15, 25, 50 и 100 мкг L -1.
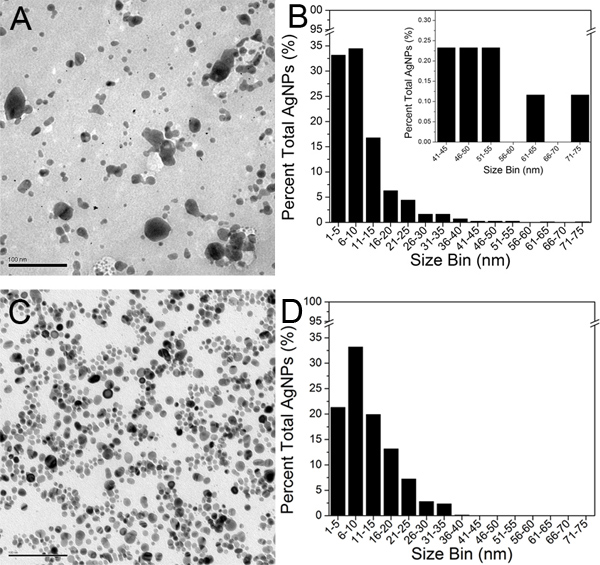
Рисунок 5. ПЭМ микрофотографии) оригинал Крейтон AgNPs и C) Окончательный 100-кДа ретентата (масштаб бар100 нм). Гистограммы TEM размер построены на основе анализа около 800 AgNPs для B) оригинальные AgNPs Крейтон и D) окончательное 100-кДа ретентата. Вставка на рисунке 5б показывает расширенную 41-75 нм диапазоне размеров для целей сравнения. Нажмите, чтобы увеличить показатель .
Обсуждение
UV-Vis абсорбционной спектрофотометрии и спектроскопии комбинационного рассеяния коллоидных AgNPs
Хорошо известно, что число поверхностных плазмонов резонансных пиков в спектре поглощения коллоидных уменьшается с симметрией AgNPs увеличивается. Кроме того, ССПС агрегации пр...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Финансирование от Национального научного фонда через Нюрнберг в технике и программы ЛИДЕР консорциума с благодарностью.
Материалы
| Нитрат серебра (AgNO 3) | Acros Organics Инк | CAS: 7761-88-8 | |
| Боргидрид натрия (NaBH 4) | Acros Organics Инк | CAS: 16940-66-2 | |
| Азотная кислота (HNO 3, Optima) | Fisher Scientific Инк | A467-1 | Трассировка металла класса для МСП анализа |
| 10000 мкг мл -1 серебряный стандарт, EnviroConcentrate | Ультра Научные | Американо-IAA-047 | |
| KrosFlo исследований II я Тангенциальная система фильтрации потока | Spectrum Laboratories, Inc | SYR2-U20-01N | |
| PS 0,05 мкм (0,5 мм) 460 см 2 | Spectrum Laboratories, Inc | X30S-900-02N | |
| Midi 100 кДа PS 200 см 2 | Spectrum Laboratories, Inc | X3-100S-901-02N | |
| Micro100 кДа PS 20 см 2 | Spectrum Laboratories, Inc | X1AB-300-10N | |
| MasterFlex C-Flex трубка L / S Размер 17 | Cole-Palmer машиностроительный завод | 06424-17 | |
| MasterFlex C-Flex трубка L / S Размер 14 | Cole-Palmer машиностроительный завод | 06424-14 | |
| Cary 50 UV-VIS-NIR спектрофотометр | Varian Инк | ||
| LabRam HR 800 системы | Horiba Jobin Yvon Инк | ||
| Varian 710ES ICP-OES | Varian Инк |
Таблица 1. Специфических реагентов и оборудования.
Ссылки
- Savage, N., Diallo, M. S. Nanomaterials and Water Purification: Opportunities and Challenges. Journal of Nanoparticle Research. 7, 331-342 (2005).
- Jain, J. Silver Nanoparticles in Therapeutics: Development of an Antimicrobial Gel Formulation for Topical Use. Mol. Pharmaceutics. 6, 1388-1401 (2009).
- Dal Lago, V., Franca, d. O., de, A. G., Kobarg, J., Borba Cardoso, M. Size-selective silver nanoparticles: future of biomedical devices with enhanced bactericidal properties. J. Mater. Chem. 21, 12267-12273 (2011).
- Panacek, A. Silver Colloid Nanoparticles: Synthesis, Characterization, and Their Antibacterial Activity. J. Phys. Chem. B. 110, 16248-16253 (2006).
- Elechiguerra, J. Interaction of silver nanoparticles with HIV-1. Journal of Nanobiotechnology. 3, 6 (2005).
- Jana, N. R., Sau, T. K., Pal, T. Growing Small Silver Particle as Redox Catalyst. J. Phys. Chem. B. 103, 115-121 (1999).
- Tolaymat, T. M. An evidence-based environmental perspective of manufactured silver nanoparticle in syntheses and applications: A systematic review and critical appraisal of peer-reviewed scientific papers. Sci. Total Environ. 408, 999-1006 (2010).
- Willets, K. Surface-enhanced Raman scattering (SERS) for probing internal cellular structure and dynamics. Analytical and Bioanalytical Chemistry. 394, 85-94 (2009).
- Novak, J. P., Nickerson, C., Franzen, S., Feldheim, D. L. Purification of Molecularly Bridged Metal Nanoparticle Arrays by Centrifugation and Size Exclusion Chromatography. Anal. Chem. 73, 5758-5761 (2001).
- Hossain, M. K., Kitahama, Y., Huang, G. G., Han, X., Ozaki, Y. Surface-enhanced Raman scattering: realization of localized surface plasmon resonance using unique substrates and methods. Analytical and Bioanalytical Chemistry. 394, 1747-1760 (2009).
- Henglein, A., Giersig, M. Formation of Colloidal Silver Nanoparticles: Capping Action of Citrate. J. Phys. Chem. B. 103, 9533-9539 (1999).
- Sapsford, K. E., Tyner, K. M., Dair, B. J., Deschamps, J. R., Medintz, I. L. Analyzing Nanomaterial Bioconjugates: A Review of Current and Emerging Purification and Characterization Techniques. Anal. Chem. 83, 4453-4488 (2011).
- Al-Somali, A., Krueger, K. M., Falkner, J. C., Colvin, V. L. Recycling Size Exclusion Chromatography for the Analysis and Separation of Nanocrystalline Gold. Anal. Chem. 76, 5903-5910 (2004).
- Hanauer, M., Pierrat, S., Zins, I., Lotz, A., Sonnichsen, C. Separation of Nanoparticles by Gel Electrophoresis According to Size and Shape. Nano Lett. 7, 2881-2885 (2007).
- Sweeney, S. F., Woehrle, G. H., Hutchison, J. E. Rapid Purification and Size Separation of Gold Nanoparticles via Diafiltration. J. Am. Chem. Soc. 128, 3190-3197 (2006).
- Clarke, N. Z., Waters, C., Johnson, K. A., Satherley, J., Schiffrin, D. J. Size-Dependent Solubility of Thiol-Derivatized Gold Nanoparticles in Supercritical Ethane. Langmuir. 17, 6048-6050 (2001).
- Schaaff, T. G. Isolation of Smaller Nanocrystal Au Molecules: Robust Quantum Effects in Optical Spectra. J Phys Chem B. 101, 7885-7891 (1997).
- Trefry, J. C. Size Selection and Concentration of Silver Nanoparticles by Tangential Flow Ultrafiltration for SERS-Based Biosensors. J. Am. Chem. Soc. 132, 10970-10972 (2010).
- Bhattacharjee, S., Bhattacharjee, C., Datta, S. Studies on the fractionation of & beta-lactoglobulin from casein whey using ultrafiltration and ion-exchange membrane chromatography. J. Membr. Sci. 275, 141-150 (2006).
- Eppler, A., Weigandt, M., Schulze, S., Hanefeld, A., Bunjes, H. Comparison of different protein concentration techniques within preformulation development. Int. J. Pharm. 421, 120-129 (2011).
- Creighton, J. A., Blatchford, C. G., Albrecht, M. G. Plasma resonance enhancement of Raman scattering by pyridine adsorbed on silver or gold sol particles of size comparable to the excitation wavelength. J. Chem. Soc. Faraday Trans. 2, 790-798 (1979).
- Pavel, I. E. Estimating the Analytical and Surface Enhancement Factors in Surface-Enhanced Raman Scattering (SERS): A Novel Physical Chemistry and Nanotechnology Laboratory Experiment. J. Chem. Educ. , (2011).
- Rasband, W. S. . ImageJ. , (1997).
- Kelly, K. L., Coronado, E., Zhao, L. L., Schatz, G. C. The Optical Properties of Metal Nanoparticles: The Influence of Size, Shape, and Dielectric Environment. J. Phys. Chem. B. 107, 668-677 (2003).
- Śileikaitċ, A., Prosyčevas, I., Puišo, J., Juraitis, A., Guobienċ, A. Analysis of Silver Nanoparticles Produced by Chemical Reduction of Silver Salt Solution. Mater. Sci. (Medziagotyra). 12, 287-291 (2006).
- Lewis, L. N. Chemical catalysis by colloids and clusters. Chem. Rev. 93, 2693-2730 (1993).
- Li, Y., Wu, Y., Ong, B. S. Facile Synthesis of Silver Nanoparticles Useful for Fabrication of High-Conductivity Elements for Printed Electronics. J. Am. Chem. Soc. 127, 3266-3267 (2005).
- Sun, Y., Xia, Y. Shape-Controlled Synthesis of Gold and Silver Nanoparticles. Science. 298, 2176-2179 (2002).
- Han, X., Zhao, B., Ozaki, Y. Surface-enhanced Raman scattering for protein detection. Analytical and Bioanalytical Chemistry. 394, 1719-1727 (2009).
- Pavel, I. Label-Free SERS Detection of Small Proteins Modified to Act as Bifunctional Linkers. J. Phys. Chem. C. 112, 4880-4883 (2008).
- Ladner, D. A., Steele, M., Weir, A., Hristovski, K., Westerhoff, P. Functionalized nanoparticle interactions with polymeric membranes. J. Hazard. Mater. , (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены