Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Tangential Flow-Ultrafiltration: Ein "Green"-Methode für die Größe Auswahl und Konzentration von kolloidalem Silber-Nanopartikel
In diesem Artikel
Zusammenfassung
Tangentialströmungs-Ultrafiltration (TFU) ist ein Verfahren zur Rückführung Gewicht basierenden Trennung Bioproben verwendet. TFU wurde einer select-(1-20 nm Durchmesser) ausgelegt und hoch konzentriert ein großes Volumen von polydispersen Silbernanopartikel (4 L von 15,2 ug ml -1 Bis 4 ml 8,539.9 pg ml -1) Mit minimaler Aggregation.
Zusammenfassung
Heutzutage werden AgNPs weitgehend in der Herstellung von Konsumgütern, 1 Wasser Desinfektionsmittel, 2 Therapeutika, 1, 3 und biomedizinische Geräte 4 aufgrund ihrer starken antimikrobiellen Eigenschaften verwendet. 3-6 Diese Nanopartikel Anwendungen stark von der AgNP Größe und Aggregatzustand beeinflusst . Viele Herausforderungen bestehen in der kontrollierten Fertigung 7 und Größe-basierte Isolierung von nichtfunktionalisierten 4,8, homogene AgNPs die frei von chemisch aggressiven Capping / Stabilisierungsmittel oder organische Lösungsmittel sind. 7-13 Einschränkungen ergeben sich aus der Toxizität von Reagenzien, hohe Kosten reduziert oder Effizienz der AgNP Synthese oder Isolierung Methoden (z. B. Zentrifugation, Größe-abhängige Löslichkeit, Größenausschlusschromatographie, etc.). 10,14-18 Um dies zu überwinden, haben wir vor kurzem gezeigt, dass TFU größere Kontrolle über die Größe, Konzentration und ermöglicht Aggregationszustand Creighton AgNPs (300ml von 15,3 pg ml -1 bis 10 ml 198,7 pg ml -1) als herkömmliche Methoden der Isolierung, wie Ultrazentrifugation. 19
TFU eine Umluft-Methode üblicherweise für die Gewichts-basierte Isolierung von Proteinen, Viren und Zellen verwendet. 20,21 Kürze, die flüssige Probe durch eine Reihe von Hohlfasermembranen mit Porengröße im Bereich von 1000 kD bis 10 kD übergeben wird. Kleinere suspendiert oder gelöst Bestandteile in der Probe wird durch die poröse Barriere zusammen vorbei mit dem Lösungsmittel (Filtrat), während die größeren Bestandteile zurückgehalten werden (Retentat). TFU kann als ein "grünes" Verfahren, da es weder Beschädigungen der Probe, noch erfordert zusätzliche Lösungsmittel giftig überschüssige Reagenzien und Nebenprodukte zu beseitigen. Ferner kann TFU gegenüber einer Vielzahl von Nanopartikeln eingesetzt werden, da beide hydrophobe und hydrophile Filter zur Verfügung stehen.
Die beiden wichtigsten Ziele dieser Studie waren: 1) zu veranschaulichen,die experimentellen Aspekte der TFU Ansatz durch einen eingeladenen Video-Erlebnis und 2) zum Nachweis der Machbarkeit des TFU-Methode für größere Mengen von kolloidalen Nanopartikeln und kleinere Mengen von Retentat. Erstens unfuctionalized AgNPs (4 l, 15.2 ug ml -1) wurden synthetisiert unter Verwendung des gut eingeführten Methode Creighton 22,23 durch Reduktion von AgNO 3 mit NaBH 4. AgNP Polydispersität wurde dann über ein 3-Stufen TFU Verwendung eines 50 nm-Filters (460 cm 2) bis AgNPs und AgNP-Aggregate größer als 50 nm, die von zwei 100-kD (200 cm 2 und 20 cm 2) zu entfernen, gefolgt Filter minimiert die AgNPs konzentrieren. Repräsentative Proben wurden mittels Transmissionselektronenmikroskopie, UV-Vis-Absorptions-Spektroskopie, Raman-Spektroskopie, und induktiv gekoppelte Plasma-Atom-Emissions-Spektroskopie. Die endgültige Retentat bestand aus hochkonzentrierten (4 ml, 8,539.9 ug ml-1) dennoch niedrigen aggregierten und homogenenAgNPs von 1-20 nm im Durchmesser. Dies entspricht einer Ausbeute von Silberkonzentration etwa 62%.
Protokoll
Ein. Synthese von kolloidalem AgNPs
Der Reaktionsmechanismus für die Creighton-Methode (leicht modifiziert, kostengünstig) 22 ist im Detail in den Hintergrundinformationen Bezugspunkt Pavel et.al zusammen mit dem unerwünschten Hydrolyse Nebenreaktion NaBH 4 bei Raumtemperatur oder höher beschrieben. 23
- Reinigen Sie alle Gläser für 12-24 h in einer 10% HNO 3 Bad, dann für 4-12 Stunden in einem 1,25 M NaOH in 40% Ethanol-Bad, und schließlich Autoklaven. Die Gläser sind gründlich gespült werden mindestens fünf Mal mit Reinstwasser (17 MOhm oder höher) nach der Säure und Base Bad Schritte.
- Planen 300 ml einer 2 mM NaBH 4-Lösung und 100 ml einer 1 mM AgNO 3-Lösung mit autoklaviertem Wasser bei 10 ° C abgekühlt Die niedrigeren Temperaturen verhindert die Nebenreaktion von NaBH 4.
- Dann werden 300 ml 2 mM NaBH 4-Lösung in einen 500 ml Erlenmeyer-Reaktionskolben containing einen Rührstab und wickeln Sie den Kolben mit Aluminiumfolie silber Oxidation zu verhindern. Den Kolben in einem Eisbad auf einer Rührplatte und rühren Sie die Lösung bei 325 rpm für 10 min.
- Prime ein 25 ml-Bürette durch Spülen mit einer vollen Spalte von Reinstwasser. Nach der Grundierung, füllen Sie die Bürette mit AgNO 3-Lösung und Wrap mit Aluminiumfolie.
- In einem dunklen Raum, mit 50 ml 1 mM AgNO 3-Lösung mit einer Geschwindigkeit von 1 Tropfen sec -1 zu dem NaBH 4-Lösung unter ständigem Rühren (1A). Bedecken Sie den mittleren Abschnitt der Vorrichtung mit einer "Folie Zelt" der Belichtung während der AgNO 3 Zugabe zu minimieren. Die AgNO 3 Zusätzlich benötigen 30-40 min. Füllen Sie den Eisbad regelmäßig.
- Nach der AgNO 3 Zugabe vollständig ist, füllt die Eisbad und weiter rühren die kolloidale Lösung für eine zusätzliche 45-50 min. Die Bildung von kolloidalen AgNPs wird durch eine Änderung in der Farbe von farblos signalisierteinem goldgelb, ist die Charakteristik der Oberflächenplasmonresonanz maximal AgNPs (1B).
- Sobald die Reaktion abgeschlossen ist, kühlen die Kolloid. Kolloidale AgNP Chargen nach einer Woche können kombiniert werden, wenn das Kolloid geblieben konsistente, dh hat die kolloidale Lösung nicht aggregiert und die Charge wurde dadurch über UV-Vis Absorptionsspektrophotometrie und Raman-Spektroskopie, um mögliche Aggregation oder Kontaminanten zu identifizieren.
2. Charakterisierung von kolloidalem AgNPs
A Cary 50 UV-VIS-NIR Spektralphotometer (Varian Inc.) und eine LabRamHR 800 Raman-System (Horiba Jobin Yvon, Inc.) ausgestattet eine Olympus BX41 konfokale Raman Mikroskop wurden AgNP Charakterisierung genutzt. Die Cary WinUV Software, LabSpec v.5 und Origin 8.0 Software wurden für die Datenerfassung und-analyse eingesetzt.
Hinweis: Die Aufnahme-Parameter werden optimiert fo werdenr andere Instrumente Modelle.
Bestimmung der Surface Plasmon Resonance of Kolloidales AgNPs via UV-VIS Spektralphotometrie
- Füllen Sie eine 1 cm 3 Einwegküvette mit Creighton Kolloid-und Reinstwasser in einer 1:10-Volumen-Verhältnis. Füllen Sie ein weiteres 1 cm 3 Küvette mit Reinstwasser für eine leere Basislinienkorrektur. Wischen Sie die Außenseite der beiden Küvetten mit einer Kimwipe.
- Stellen Sie die Spektralfotometer Absorption Modus aus einem Y Minimum von -0,5 bis einer Y maximal 1,0. Stellen Sie die X Scannen Fenster 200-800 nm und wählen Sie eine schnelle Abtastrate von 4.800 nm min -1 mit Basislinienkorrektur.
- Die Küvette mit Wasser in das Gerät gefüllt und führen Sie eine Baseline-Scan. Wiederholen, falls erforderlich, bis ein Nicht-Null Grundeinstellungssteuerungsskript erreicht.
- Ersetzen der leeren Küvette mit der Probenküvette und initiieren eine Absorbanz Abtastung für die Erfassung des UV-Vis-Absorptionsspektrum des kolloidalen Probe (Abbildung 1C).
Purity Test Kolloidales AgNPs über Raman-Spektroskopie
Aufgrund der zeitlichen Begrenzung der Video-Demonstration (10-15 min Video) und die räumliche Begrenzung des Protokolls Text (maximal 3 Seiten), wird diese experimentellen Abschnitt nicht gefilmt werden.
- Stellen Sie die Geräteeinstellungen wie folgt: Anregungsquelle (632,8 nm He-Ne), Filter (kein Filter, Laserleistung auf der Probe ~ 17 mW), konfokale Loch (300 um), Spektrometer (730 cm -1), holographische Gitter (600 Hainen / mm), Objektiv (50x langen Arbeitsabstand Luftobjektiv), Belichtungszeit (30 s) und die Akkumulation Zyklen (5).
- Verwenden Sie einen sauberen Pipette, um eine 2 ml Quarzküvette mit Kolloid füllen und schieben Sie den Stecker. Verwenden Sie einen Kimwipe zu reinigen Sie Fingerabdrücke, Flecken oder Kolloid von der Oberfläche der Küvette. Deutlich senken das Mikroskop Bühne. Wählen Sie das 50x Objektiv und legen Sie die Küvette auf die Bühne.
- Fokussieren Sie das laser Strahls auf der AgNP Kolloid direkt unterhalb der Innenwand der Küvette mit der Videomodus des Instruments und der Olympus Kamera. Schalten Sie Raumbeleuchtung und erwerben Raman-Spektrum (Abbildung 1D).
3. Size-Auswahl und Konzentration von kolloidalem AgNPs über Tangential-Ultrafiltration (TFU)
Ein KrosFlo II Forschung-Systems (Spectrum Laboratories, Rancho Dominguez, CA) wurde verwendet, um die Polydispersität AgNP begrenzen und diese (Abbildung 2) zu konzentrieren. Die drei Schritte der TFU Prozess waren: (1) Größe-Auswahl AgNPs und AgNP-Aggregate von 50-nm im Durchmesser und größer mit einem 50-nm MidiKros Polysulfon-Modul (460 cm 2), 2) Größe Auswahl und Konzentration AgNPs von 1-20 nm im Durchmesser unter Verwendung eines 100-kD MidiKros Filter (200 cm 2), und (3) weitere Volumenreduzierung unter Verwendung eines 100-kD MicroKros Polysulfon Filter (20 cm 2) (Abbildung 3).
Schritt 1
- Schließen Sie die Größe 17 Masterflex Fütterung Schlauch an der Schlauchpumpe nach 2A. Ein Y-Verzweigung und einem Schlauch-Übergang wird für die Set-up benötigt. Befestigen Sie Schlauch mit dem 50-nm MidiKros Modul. Achten Sie darauf, Schläuche sichern filtern mit Kabelbindern. Wählen Schlauch Größe 17 mit SIZE-Taste.
- Wählen Uhrzeigersinn Pumprichtung mit DIR-Taste. Stellen Sie sicher, MODE-Taste ist auf INT.
- Senken Sie die Pumpe auf unter 300 ml min -1, bevor die Pumpe starten. Die Pumpe sollte sich nach der Größe des verwendeten Schlauchs angepasst. Es sollte eine kleine Einstellung zu ermöglichen es dem Bediener, prompt auf potenzielle Leckagen aber groß genug, um noch eine Wirkung des Priming des Systems reagieren. Um das Vakuum erforderlich Kolloid aus dem Reservoir in den Schlauch und Filter zeichnen schaffen, schneiden die Schläuche, die aus dem unteren Teil des Filters führt zu dem oberen Abschnitt des Y-Verzweigung in der Mitte des Schlauchs.
- Legen Sie die Rohrstück, das aus dem Filter führt in der Vorratsflasche und klemmen Sie den unteren Abschnitt des Schlauchs in der Nähe der Y-Kreuzung mit einer Klammer oder von Hand. Schalten Sie die Pumpe. Die erzeugte Vakuum sollte beginnen Absaugen des Kolloids.
- Sobald die Flüssigkeit frei fließt durch die Röhre, die Pumpe auszuschalten, nehmen Sie den gebrochenen Rohrstück mit einem Schlauch Kreuzung und befestigen Sie sie mit Kabelbindern. Schalten Sie die Pumpe erneut und weiterhin Filtration.
- Überprüfen Sie die Schläuche Schaltung für Lecks. Wenn ein Leck gefunden haben, fixieren das Leck durch Anpassung der Armatur oder erneut die Sicherung mit einem Kabelbinder. Sobald das Schlauchsystem ist leckfreie, der Pumpendurchsatz zu nicht mehr als 700 ml min -1 erhöht werden kann. Diese Pumpe Rate-Wert sollte nach Schlauchgröße für Schläuche Ausfall zu vermeiden optimiert werden. Filtration fortzusetzen, bis die Flüssigkeit in der Vorratsflasche zu fast nichts verbraucht ist.
- Sobald die Filtration beendet ist, das Filtrat das enthält AgNPs von 50-nm Durchmesser und smaller. Das Retentat kann zur weiteren Analyse gemäß der spezifischen AgNP Anwendung gespeichert werden.
Schritt 2
- Spülen Sie den Schlauch mit 2% HNO 3 und Reinstwasser vor der Installation die 100-kD MidiKros filtern mit dem gleichen Setup wie bei der 50-nm-Modul.
- Wiederholen Sie Schritt 3,3 mit dem 100-kD MidiKros Modul.
- Sobald die Filtration abgeschlossen ist, erfassen den Inhalt der Verrohrung und dem Filter (100-kD Retentat). Das Volumen sollte ca. 50 ml betragen.
Schritt 3
- Schließen Sie die Größe 14 Masterflex Schläuche und die 100-kD MicroKros FILTER der Schlauchpumpe nach 2B Abbildung. Sichern Sie alle Verbindungsstellen mit Kabelbindern. Wählen Schlauch Größe 14 an der Pumpe mit der Taste SIZE und senken Sie die Pumpe auf 30 ml min -1.
- Beginnen Sie mit der Filtration. Überprüfen Sie die Schläuche Schaltung für Lecks. Wenn ein Leck gefunden haben, fixieren das Leck durch Anpassung der Passformting oder Re-Sicherung mit einem Kabelbinder.
- Sobald das Schlauchsystem ist leckfreie kann der Pumpendurchsatz zu nicht mehr als 90 ml min -1 erhöht werden. Filtration fortzusetzen, bis die Flüssigkeit, die in dem Reservoir Flasche enthält eine minimale Menge an Konzentrat.
- Die restlichen Inhalt der Schlauch und Filter können in die Vorratsflasche durch Entfernen der Magensonde von der Flasche, während die Pumpe noch läuft gesammelt werden. Sobald die Inhalte Schlauch und Filter in der Vorratsflasche sind, kann die Pumpe ausgeschaltet werden.
4. Quantifizierung von Silber Betrag in Kolloidales AgNPs durch induktiv gekoppelte Plasma Optical Emission Spectroscopy (ICP-OES)
Jede Probe wurde kolloidales chemisch aufgeschlossenen und die Menge an Silber wurde durch ICP-OES Verwendung eines A 710E-Spektrometer (Varian Inc.) quantifiziert. Eine lineare Regression Eichkurve für Silber (Abbildung 4) wurde unter Verwendung von acht Silber Standards (0, 3, 7, 10, 15, 25, 50 und 100 ug L -1), die von einer 10.000 pg ml -1 Silber Standard für die Spurenanalyse (Ultra Scientific) hergestellt wurden.
- Chemisch verdauen Proben mit HNO 3. Die repräsentativen Proben sind die ursprüngliche Kolloid (Schritt 1), 50-nm Filtrat (Schritt 1), 100-kD-Retentat (Schritt 2), und abschließenden 100-kD Retentat (Schritt 3) (Abbildung 3).
- 1:1000 für den ursprünglichen Kolloid, 1:1000 für den 50-nm Filtrat, 1:25,000 für das erste 100-kD Retentat und 1:250.000 für: Die Proben sollten mit 2% HNO 3 mit den folgenden Volumenverhältnisse verdünnt werden die letzte 100-kD Retentat. Um silber Auswaschung zu verhindern, sollten alle Proben in niedriger Dichte Polypropylen Behältern aufbewahrt werden.
- Stellen Sie die ICP-OES Geräteparameter wie folgt: Wellenlänge für Ag (328,068 nm), Macht (1,20 kW), Plasma-Flow (15,0 L min -1), Nebenstrom (1,50 L min -1) und Vernebler Druck (200 kPa ).
- Jeder sample sollten in dreifacher Ausfertigung mit einem Replikat von 10 s gemessen werden. Zwischen-Messung Stabilisierungszeit von 15 sec und 30 sec einer Probenaufnahme Verzögerung verwendet werden. Ein Verfahren leere sollte zwischen jeder Probe eingeführt werden, um mögliche Kreuzkontaminationen zu reduzieren.
5. Size Distribution von kolloidalem AgNPs via Transmission Electron Microscopy (TEM)
Der Phillips-EM 208S TEM wurde verwendet, um die kolloidalen AgNPs visualisieren. Elektronenmikroskopische Aufnahmen wurden gefangen mit einem hochauflösenden Gatan Bioscan Kamera und analysiert ImageJ Software. 24
- Verdünnen Sie die 100-kD Retentat Probe mit Reinstwasser (1:100 Volumenverhältnis). Ablagerung 20 ul der ursprünglichen Kolloid und dem verdünnten 100-kD Retentat (Schritt 3) auf 300-Mesh Formvar-beschichteten Gold-Gitter (Electron Microscopy Sciences). Lassen Sie die Gitter in einem Exsikkator trocknen. Zeige innerhalb eines Tages.
- Stellen Sie die Beschleunigungsspannung des TEM Instrument bei 70 kV bis AgNPs visualisieren. CApture elektronenmikroskopischen Aufnahmen (Abbildung 5) mit der hochauflösenden Kamera und speichern als getaggt Bilddateien (TIFF).
6. Repräsentative Ergebnisse
Synthese und Charakterisierung von kolloidalem AgNPs
Vier Liter Creighton kolloidalen AgNPs wurden erfolgreich synthetisiert mit dem Setup in 1A angezeigt. Die endgültige Kolloid hatte eine charakteristische goldgelbe Farbe (1B). 22, 23 Die UV-Vis-Absorptionsspektrum dieses Kolloids hatte eine typische scharfe, symmetrischen Peak Oberflächenplasmonresonanz (SPR) bei 394 nm (Abbildung 1C). Das Raman-Spektrum des ursprünglichen Creighton Kolloid und der abschließenden 100-kD Retentat vorgestellt nur drei Schwingungsmoden, nämlich die Biegung (1640 cm -1) und symmetrischen und asymmetrischen Streckschwingung von H 2 O (3245 cm -1 und 3390 cm -1 , jeweils) (Abbildung 1D).
TFU von kolloidalem AgNPs
Der Aufbau und die TFU schematische Darstellung des 3-Schritt TFU Verfahrens sind in den Abbildungen 2 und 3 dargestellt sind. In Schritt 1 wird ein 50-nm-Filter (460 cm 2) wurde auf Verwendete Größenklassen auszuwählen und AgNPs und AgNP-Aggregate von 50 nm Durchmesser und größere von der ursprünglichen Kolloid (etwa 100 ml 50-nm Retentat) zu entfernen. Dieser Schritt wurde auch durch eine geringe Volumenverminderung von 4 L des ursprünglichen Kolloids auf 3,9 l 50-nm Filtrat begleitet. Keine Rückspülung oder Flußunterbrechungseinrichtung Stufe eingesetzt wurde. Die größte Volumenreduktion (dh Wasserentfernung) wurde in Schritt 2, wenn die 50-nm Filtrat wurde anschließend durch ein 100-kD-Filter (200 cm 2) ausgeführt erhalten. Das resultierende 100-kD Retentat hatten ein Gesamtvolumen von 50 ml. Die meisten der Synthese Nebenprodukte und überschüssige Reagenzien wurden in diesem Schritt durch das Wasser Lösungsmittel (3,850 ml 100-kD Filtrat) eliminiert. Weiterhin wurde durch die Konzentration AgNP addit erreichtIonen eines dritten Filtrationsschritt zum zuvor berichteten Verfahren. 19 In diesem Schritt 3 wird ein 100-kD-Filter einer kleineren Fläche (20 cm 2) reduziert die 100-kD-Retentatvolumen bis 4,0 ml beträgt. Die TEM-Messungen werden zeigen, dass diese letzte 100-kD Retentat besteht hauptsächlich aus niederen aggregierten AgNPs von 1-20 nm im Durchmesser.
ICP-OES-und TEM von kolloidalem AgNPs
Eine lineare Regression Eichkurve (Figur 4) für Silber wurde aus acht Standards (0, 3, 7, 10, 15, 25, 50 und 100 ug L -1) konstruiert. Die Menge an Silber in jeder der vier repräsentativen kolloidalen Proben wurde dann von der ICP-OES Kalibrationskurve durch Extrapolation bestimmt: ursprüngliche Kolloid (15,2 ppm, 3A), 50-nm Filtrat (14,1 ppm, 3B), ersten 100 - kD Retentat (683,1 ppm, 3C) und die abschließende 100-kD Retentat (8,538.9 ppm, Abbildung 3D).Die tatsächliche Ausbeute von 15,2 ppm ist sehr nah an der typischen theoretischen Ausbeute von 15,4 ppm für die Creighton Reaktion. Die extreme Konzentration von AgNPs (4 ml 8,538.9 ppm) wurde durch eine dramatische Veränderung in der Farbe von Goldgelb für die ursprüngliche Kolloid-bis dunkelbraun für das Finale 100-kD Retentat (Abbildung 3, Einsätze aus vial Bilder) wider. Die Qualität der Filter erwies sich als entscheidend für die TFU Verfahren, insbesondere zum Schritt 1. Die endgültigen Konzentrationen lagen zwischen Retentat 3,390.1 ppm bis 9,333.3 ppm je nach Zustand der Filter (stark gegenüber brandneuen verwendet). Wenn die Membranporen gefährdet werden, wird AgNPs die Durchmesser weniger als 50-nm auch beibehalten werden und wird anschließend zu verringern den Gesamtbetrag der AgNPs, die im Filtrat gesammelt wird. Optimierung der Filtration zur Drucküberwachung und ordnungsgemäße Reinigung zählen erhöhen die Lebensdauer der Filter.
TEM-Aufnahmen von eine Creighton Kolloid und das endgültige 100-kD Retentat (Schritt 3) werden in 5A und 5C gezeigt. In ihrer aggregierten Zustand erscheinen AgNPs als schwarze runde Flächen auf einem helleren grauen Hintergrund. Etwa 800 AgNPs wurden in den TEM-Aufnahmen von jedem der beiden Proben identifiziert und wurden unter Verwendung des Image J Software. Eine Teilchen wurde durch eine vollständige und geschlossene Umfang definiert. Ein Bereich Schwellenwert wurde bei 1,0 nm 2 nach der Auflösung der TEM-Aufnahmen eingestellt. Die AgNP zählt und Umgebung Daten wurden dann in Microsoft Excel und die AgNP Durchmesser wurden extrapoliert exportiert. Die durchschnittliche AgNP Durchmesser im ursprünglichen Kolloids und der abschließenden 100-kD Retentat waren entschlossen, 9,3 nm und 11,1 nm, jeweils. Die Messungen der Durchmesser AgNPs wurden dann auf 8,0 Origin Software ausgeführten und eine TEM-Histogramms Größe wurde für jede Probe konstruiert (5B und 5D).
1 "src =" / files/ftp_upload/4167/4167fig1.jpg "/>
Abbildung 1. A) Synthese Setup, B) charakteristische Farbe, C) UV-Vis-Absorptionsspektrum, und D) Raman-Spektrum von Creighton kolloidalen AgNPs.

Abbildung 2 TFU Versuchsaufbau für A) die Schritte 1 und 2:. I) enthaltenden Reservoir Creighton kolloidalen AgNPs. II) Reservoir für Filtrat Sammlung. III) Y-Kreuzung in Schläuchen. IV) Schlauchpumpe Kopf. . V) Entweder 50-nm-oder 100-kD Midi Kros Filter B) Schritt 3: I) Reservoir mit Creighton kolloidalen AgNPs. II) Reservoir für Filtrat Sammlung. III) 100-kD Micro Kros Filter.
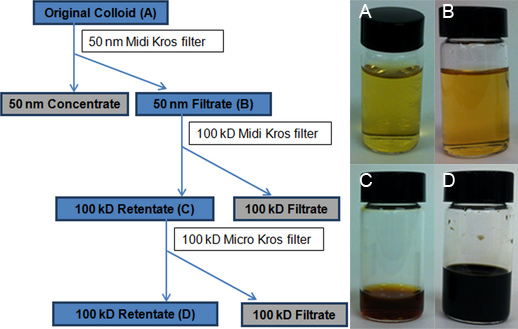
Abbildung 3. Flussdiagramm, das die TFU Prozess. Die blau-schattierten Kästen markieren die kolloidalen Suspensionen von AgNPs zur weiteren Analyse gesammelt. Vial photographs anzeigen A) Original Kolloid Charge, B) 50-nm Filtrat nach der Verarbeitung der ursprünglichen Kolloids durch die 50-nm-Filter (460 cm 2), C) erste 100-kD Retentat nach Volumenreduktion mit dem 100-kD Midi Kros erhaltenen gesammelten Filter (200 cm 2), und D) abschließenden 100-kD Retentat der Volumenverringerung mit dem 100-kD Micro Kros Filter (20 cm 2). Die 100-kD Filtrat sieht wie Wasser.
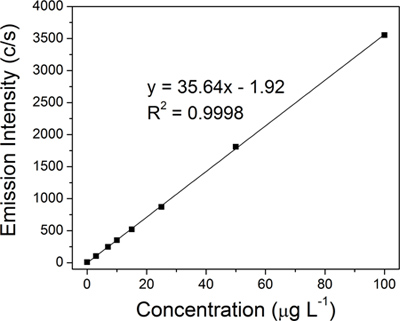
Abbildung 4 ICP-OES lineare Kalibration konstruiert unter Verwendung von acht Silber Normen:. 0, 3, 7, 10, 15, 25, 50 und 100 ug L -1.
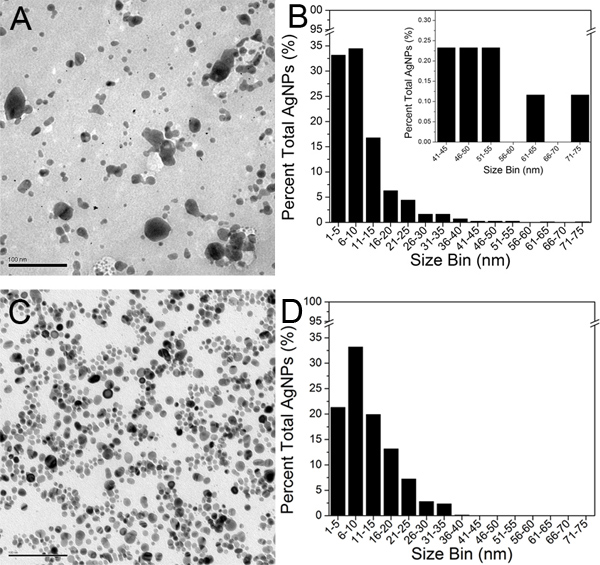
Abbildung 5. TEM-Aufnahmen von A) original Creighton AgNPs und C) final 100-kD Retentat (Maßstab ist100 nm). TEM Größe Histogramme durch Analysieren etwa 800 AgNPs für B) ursprünglichen Creighton AgNPs konstruiert, und D) abschließenden 100-kD Retentat. Der Einschub in Abbildung 5B zeigt den erweiterten 41-75 nm Größenbereich zu Vergleichszwecken. Klicken Sie hier für eine größere Abbildung zu sehen .
Diskussion
UV-Vis Absorptionsspektrophotometrie und Raman-Spektroskopie von kolloidalem AgNPs
Es ist bekannt, dass die Anzahl der Oberflächen-Plasmon-Resonanz-Spitzen im Absorptionsspektrum einer Kolloid als der Symmetrie der AgNPs abnimmt. Zusätzlich führt AgNP Aggregation zum Auftreten breiteren oder rot verschobenen Peaks. 25,26 Das Vorhandensein einer einzigen, scharfen und symmetrisch SPR Peak bei 394 nm angibt kleine, kugelförmige AgNPs mäßiger Aggregation und Größenverteilung ist...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Die Mittel aus dem National Science Foundation durch die NUE in Engineering und der LEADER Consortium Programs wird dankbar anerkannt.
Materialien
| Silbernitrat (AgNO 3) | Acros Organics Inc. | CAS: 7761-88-8 | |
| Natriumborhydrid (NaBH 4) | Acros Organics Inc. | CAS: 16940-66-2 | |
| Salpetersäure (HNO 3, Optima) | Fisher Scientific Inc. | A467-1 | Trace Metall grade für ICP-Analyse |
| 10.000 pg ml -1 silver standard, EnviroConcentrate | Ultra Scientific | US-IAA-047 | |
| KrosFlo Forschung II i Tangential Flow Filtration Systems | Spectrum Laboratories Inc. | SYR2-U20-01N | |
| 0,05 um PS (0,5 mm) 460 cm 2 | Spectrum Laboratories Inc. | X30S-900-02N | |
| Midi 100 kD PS 200 cm 2 | Spectrum Laboratories Inc. | X3-100S-901-02N | |
| Micro100 kD PS 20 cm 2 | Spectrum Laboratories Inc. | X1AB-300-10N | |
| Masterflex C-Flex-Schlauch L / S Größe 17 | Cole-Palmer Instrument Co. | 06424-17 | |
| Masterflex C-Flex-Schlauch L / S Größe 14 | Cole-Palmer Instrument Co. | 06424-14 | |
| Spektralphotometer Cary 50 UV-VIS-NIR | Varian Inc. | ||
| LabRam HR 800-System | Horiba Jobin Yvon Inc. | ||
| Varian 710ES ICP-OES | Varian Inc. |
Tabelle 1. Spezifisch Reagenzien und Ausrüstung.
Referenzen
- Savage, N., Diallo, M. S. Nanomaterials and Water Purification: Opportunities and Challenges. Journal of Nanoparticle Research. 7, 331-342 (2005).
- Jain, J. Silver Nanoparticles in Therapeutics: Development of an Antimicrobial Gel Formulation for Topical Use. Mol. Pharmaceutics. 6, 1388-1401 (2009).
- Dal Lago, V., Franca, d. O., de, A. G., Kobarg, J., Borba Cardoso, M. Size-selective silver nanoparticles: future of biomedical devices with enhanced bactericidal properties. J. Mater. Chem. 21, 12267-12273 (2011).
- Panacek, A. Silver Colloid Nanoparticles: Synthesis, Characterization, and Their Antibacterial Activity. J. Phys. Chem. B. 110, 16248-16253 (2006).
- Elechiguerra, J. Interaction of silver nanoparticles with HIV-1. Journal of Nanobiotechnology. 3, 6 (2005).
- Jana, N. R., Sau, T. K., Pal, T. Growing Small Silver Particle as Redox Catalyst. J. Phys. Chem. B. 103, 115-121 (1999).
- Tolaymat, T. M. An evidence-based environmental perspective of manufactured silver nanoparticle in syntheses and applications: A systematic review and critical appraisal of peer-reviewed scientific papers. Sci. Total Environ. 408, 999-1006 (2010).
- Willets, K. Surface-enhanced Raman scattering (SERS) for probing internal cellular structure and dynamics. Analytical and Bioanalytical Chemistry. 394, 85-94 (2009).
- Novak, J. P., Nickerson, C., Franzen, S., Feldheim, D. L. Purification of Molecularly Bridged Metal Nanoparticle Arrays by Centrifugation and Size Exclusion Chromatography. Anal. Chem. 73, 5758-5761 (2001).
- Hossain, M. K., Kitahama, Y., Huang, G. G., Han, X., Ozaki, Y. Surface-enhanced Raman scattering: realization of localized surface plasmon resonance using unique substrates and methods. Analytical and Bioanalytical Chemistry. 394, 1747-1760 (2009).
- Henglein, A., Giersig, M. Formation of Colloidal Silver Nanoparticles: Capping Action of Citrate. J. Phys. Chem. B. 103, 9533-9539 (1999).
- Sapsford, K. E., Tyner, K. M., Dair, B. J., Deschamps, J. R., Medintz, I. L. Analyzing Nanomaterial Bioconjugates: A Review of Current and Emerging Purification and Characterization Techniques. Anal. Chem. 83, 4453-4488 (2011).
- Al-Somali, A., Krueger, K. M., Falkner, J. C., Colvin, V. L. Recycling Size Exclusion Chromatography for the Analysis and Separation of Nanocrystalline Gold. Anal. Chem. 76, 5903-5910 (2004).
- Hanauer, M., Pierrat, S., Zins, I., Lotz, A., Sonnichsen, C. Separation of Nanoparticles by Gel Electrophoresis According to Size and Shape. Nano Lett. 7, 2881-2885 (2007).
- Sweeney, S. F., Woehrle, G. H., Hutchison, J. E. Rapid Purification and Size Separation of Gold Nanoparticles via Diafiltration. J. Am. Chem. Soc. 128, 3190-3197 (2006).
- Clarke, N. Z., Waters, C., Johnson, K. A., Satherley, J., Schiffrin, D. J. Size-Dependent Solubility of Thiol-Derivatized Gold Nanoparticles in Supercritical Ethane. Langmuir. 17, 6048-6050 (2001).
- Schaaff, T. G. Isolation of Smaller Nanocrystal Au Molecules: Robust Quantum Effects in Optical Spectra. J Phys Chem B. 101, 7885-7891 (1997).
- Trefry, J. C. Size Selection and Concentration of Silver Nanoparticles by Tangential Flow Ultrafiltration for SERS-Based Biosensors. J. Am. Chem. Soc. 132, 10970-10972 (2010).
- Bhattacharjee, S., Bhattacharjee, C., Datta, S. Studies on the fractionation of & beta-lactoglobulin from casein whey using ultrafiltration and ion-exchange membrane chromatography. J. Membr. Sci. 275, 141-150 (2006).
- Eppler, A., Weigandt, M., Schulze, S., Hanefeld, A., Bunjes, H. Comparison of different protein concentration techniques within preformulation development. Int. J. Pharm. 421, 120-129 (2011).
- Creighton, J. A., Blatchford, C. G., Albrecht, M. G. Plasma resonance enhancement of Raman scattering by pyridine adsorbed on silver or gold sol particles of size comparable to the excitation wavelength. J. Chem. Soc. Faraday Trans. 2, 790-798 (1979).
- Pavel, I. E. Estimating the Analytical and Surface Enhancement Factors in Surface-Enhanced Raman Scattering (SERS): A Novel Physical Chemistry and Nanotechnology Laboratory Experiment. J. Chem. Educ. , (2011).
- Rasband, W. S. . ImageJ. , (1997).
- Kelly, K. L., Coronado, E., Zhao, L. L., Schatz, G. C. The Optical Properties of Metal Nanoparticles: The Influence of Size, Shape, and Dielectric Environment. J. Phys. Chem. B. 107, 668-677 (2003).
- Śileikaitċ, A., Prosyčevas, I., Puišo, J., Juraitis, A., Guobienċ, A. Analysis of Silver Nanoparticles Produced by Chemical Reduction of Silver Salt Solution. Mater. Sci. (Medziagotyra). 12, 287-291 (2006).
- Lewis, L. N. Chemical catalysis by colloids and clusters. Chem. Rev. 93, 2693-2730 (1993).
- Li, Y., Wu, Y., Ong, B. S. Facile Synthesis of Silver Nanoparticles Useful for Fabrication of High-Conductivity Elements for Printed Electronics. J. Am. Chem. Soc. 127, 3266-3267 (2005).
- Sun, Y., Xia, Y. Shape-Controlled Synthesis of Gold and Silver Nanoparticles. Science. 298, 2176-2179 (2002).
- Han, X., Zhao, B., Ozaki, Y. Surface-enhanced Raman scattering for protein detection. Analytical and Bioanalytical Chemistry. 394, 1719-1727 (2009).
- Pavel, I. Label-Free SERS Detection of Small Proteins Modified to Act as Bifunctional Linkers. J. Phys. Chem. C. 112, 4880-4883 (2008).
- Ladner, D. A., Steele, M., Weir, A., Hristovski, K., Westerhoff, P. Functionalized nanoparticle interactions with polymeric membranes. J. Hazard. Mater. , (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten