Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
L'ultrafiltration à flux tangentiel: Un "Green" Méthode de sélection Taille et concentration des nanoparticules d'argent colloïdal
Dans cet article
Résumé
Ultrafiltration à flux tangentiel (AFT) est un procédé de recirculation utilisée pour la séparation en fonction du poids du échantillons biologiques. TFU a été adapté à la taille de sélection (1-20 nm de diamètre) et très concentrer une grande quantité de nanoparticules d'argent polydisperses (4 L de 15,2 mg ml -1 Jusqu'à 4 ml de 8,539.9 mg ml -1) Avec agrégation minimale.
Résumé
De nos jours, AGNPS sont largement utilisés dans la fabrication de produits de consommation, 1, 2 désinfectants de l'eau thérapeutique, 1, 3 et 4 dispositifs biomédicaux en raison de leurs puissantes propriétés antimicrobiennes. 6.3 Ces applications des nanoparticules sont fortement influencées par la taille et l'état d'agrégation AGNP . De nombreux défis existent dans la fabrication contrôlée 7 et basée sur la taille de l'isolement 4,8 non fonctionnalisées, AGNPS homogènes qui sont exempts de produits chimiques agressifs plafonnement / agents stabilisants ou des solvants organiques. 7-13 Limites sortir de la toxicité des réactifs, des coûts élevés ou réduits l'efficacité des méthodes de synthèse ou l'isolement AGNP (par exemple, la centrifugation, dépendant de la taille solubilité, chromatographie d'exclusion stérique, etc.) 10,14-18 Pour y remédier, nous avons récemment montré que TFU permet un meilleur contrôle sur la taille, la concentration et état d'agrégation de Creighton AGNPS (300ml de 15,3 pg ml -1 jusqu'à 10 ml de 198,7 pg -1 ml) que les méthodes classiques de séparation telles que l'ultracentrifugation. 19
AFT est un procédé de recyclage couramment utilisé pour l'isolement en fonction du poids de protéines, de virus et de cellules. 20,21 Brièvement, l'échantillon liquide est passé à travers une série de membranes à fibres creuses avec une taille de pores comprise entre 1.000 kD à 10 kD. Petits constituants en suspension ou dissous dans l'échantillon passe à travers la barrière poreuse avec le solvant (filtrat), tandis que les constituants plus grandes sont retenues (rétentat). TFU peut être considéré comme un "vert" méthode car elle ni dommages, ni de l'échantillon nécessite un supplément de solvant pour éliminer l'excès de réactifs toxiques et sous-produits. En outre, AFT peuvent être appliqués à une grande variété de nanoparticules que les deux filtres hydrophobes et hydrophiles sont disponibles.
Les deux principaux objectifs de cette étude étaient: 1) pour illustrerles aspects expérimentaux de l'approche TFU à travers une expérience vidéo invités et 2) de démontrer la faisabilité de la méthode TFU pour les grands volumes de nanoparticules colloïdales et les petits volumes de rétentat. Tout d'abord, AGNPS unfuctionalized (4 L, 15,2 mg -1 ml) ont été synthétisés selon la méthode bien établie Creighton 22,23 par la réduction de AgNO 3 avec NaBH4. AGNP polydispersité est ensuite réduit par l'intermédiaire d'un AFT 3-étape à l'aide d'un filtre 50-nm (460 cm 2) pour enlever et AGNPS AGNP-agrégats supérieure à 50 nm, suivi par deux 100-kD (200 cm 2 et 20 cm 2) filtres de concentrer les AGNPS. Des échantillons représentatifs ont été caractérisés par microscopie électronique à transmission, la spectrophotométrie d'absorption UV-Vis, spectroscopie Raman et plasma à couplage inductif spectroscopie d'émission optique. Le rétentat final comprenait très concentré (4 ml, 8,539.9 mg -1 ml) et pourtant humble agrégée et homogèneAGNPS de 1-20 nm de diamètre. Cela correspond à un rendement concentration d'argent de l'ordre de 62%.
Protocole
1. Synthèse des AGNPS colloïdal
Le mécanisme réactionnel de la méthode Creighton (légèrement modifié, peu coûteux) 22 est décrite en détail dans l'information de référence Soutenir Pavel et.al avec l'hydrolyse indésirable réaction secondaire de NaBH4 à la température ambiante ou plus 23.
- Nettoyez toute la verrerie pendant 12-24 h dans un 10% HNO 3 salles de bain, puis pour 4-12 heures dans une solution de NaOH 1,25 M dans un bain d'éthanol à 40%, et enfin autoclave. La verrerie doit être rincée à fond un minimum de cinq fois avec de l'eau ultrapure (17 MQ ou plus) après que l'acide et des mesures de bain de base.
- Préparer 300 ml d'une 2 mM solution de NaBH4 et 100 ml d'une 1 mM solution de AgNO 3 avec de l'eau autoclave refroidi à 10 ° C. Les températures inférieures empêche la réaction secondaire de NaBH 4.
- Ajouter 300 ml de 2 mM de solution de NaBH4 à une suite Erlenmeyer de 500 ml flacon de réactionAining un barreau d'agitation et envelopper le flacon dans une feuille d'aluminium pour empêcher l'oxydation d'argent. Placer la fiole dans un bain de glace sur une plaque d'agitation et on agite la solution à 325 rpm pendant 10 min.
- Premier burette de 25 ml en rinçant avec une colonne remplie d'eau ultra-pure. Après amorçage, remplir la burette avec la solution AgNO 3 et l'envelopper de papier d'aluminium.
- Dans une chambre noire, ajouter 50 ml de 1 mM solution de AgNO 3 à une vitesse de 1 s -1 à goutte la solution de NaBH 4 sous agitation continue (Figure 1A). Couvrir la partie médiane de l'appareil avec une "feuille de tente" pour minimiser l'exposition de lumière pendant l'addition AgNO 3. Le AgNO 3 plus, il faudra 30-40 minutes. Reconstituer le bain de glace périodiquement.
- Après la AgNO 3 addition est terminée, remplir le bain de glace et continuez de remuer la solution colloïdale pour une période additionnelle 45-50 min. La formation d'AGNPS colloïdales est signalée par un changement de couleur de l'incoloreà un jaune d'or, ce qui est caractéristique de la résonance plasmon de surface maximale de AGNPS (figure 1B).
- Une fois que la réaction est terminée, réfrigérer le colloïde. Lots AGNP colloïdales peuvent être combinées après une semaine si le colloïde est demeuré constant, c'est à dire, la solution colloïdale n'a pas agrégées et le lot a été caractérisé par spectrophotométrie d'absorption UV-Vis et spectroscopie Raman pour identifier l'agrégation possible ou contaminants.
2. Caractérisation des AGNPS colloïdal
Un spectrophotomètre Cary 50 UV-VIS-NIR (Varian Inc) et un LabRamHR 800 Système Raman (Horiba Jobin Yvon, Inc) équipé d'un Olympus BX41 microscope confocal Raman, ont été utilisées pour la caractérisation AGNP. La Cary WinUV logiciel, LabSpec v.5 et 8,0 Origine du logiciel ont été utilisées pour la collecte des données et l'analyse.
Remarque: Les paramètres d'acquisition devra être optimisé fomodèles R Instrumentation autres.
Détermination de résonance plasmonique de surface de AGNPS colloïdal par spectrophotométrie UV-VIS
- Remplir un 1 cm 3 avec cuvette jetable Creighton colloïde et de l'eau ultra pure dans un rapport volumique de 1:10. Remplir une autre cuvette 1 cm 3 avec de l'eau ultra-pure pour une correction de base vierge. Essuyez l'extérieur de deux cuvettes d'une Kimwipe.
- Régler le spectrophotomètre en mode absorbance d'un minimum de -0,5 Y à un maximum de 1,0 Y. Régler la fenêtre X à balayage à 200-800 nm et sélectionnez une vitesse de balayage rapide de 4800 nm -1 min avec correction de référence.
- Insérez la cuve remplie d'eau dans l'appareil et exécuter un scan de base. Répéter si nécessaire jusqu'à ce qu'une commande de référence de zéro est atteint.
- Remplacer la cuvette de blanc avec la cuve d'analyse et lancer une analyse d'absorption pour la collecte du spectre d'absorption UV-Vis de l'échantillon colloïdale (Figure 1C).
Test de pureté de AGNPS colloïdal par spectroscopie Raman
En raison de la limitation dans le temps de la vidéo de démonstration (10-15 min video) et la limitation de l'espace de texte du protocole (3 pages maximum), cette partie expérimentale ne sera pas filmé.
- Définissez les paramètres d'instrument comme suit: Source d'excitation (632,8 nm He-Ne), le filtre (pas de filtre, la puissance du laser sur l'échantillon ~ 17 mW), trou confocal (300 um), spectromètre (730 cm -1), réseau holographique (600 bosquets / mm), objectif (50x objectif à long air de travail à distance), le temps d'exposition (30 s), et des cycles d'accumulation (5).
- Utiliser une pipette propre pour remplir une cuvette en quartz de 2 ml avec un colloïde et insérez doucement le bouchon. Utiliser un Kimwipe pour nettoyer des taches ou des empreintes digitales, des colloïdes de la surface de la cuvette. Réduire de manière significative la platine du microscope. Sélectionnez l'objectif 50x et placer la cuvette sur la scène.
- La mise au point laser faisceau sur le colloïde AGNP directement sous la paroi intérieure de la cuve à l'aide du mode vidéo de l'appareil et l'appareil Olympus. Éteignez les lumières de chambre et acquérir du spectre Raman (figure 1D).
3. Taille-sélection et concentration des AGNPS colloïdal par ultrafiltration à flux tangentiel (TFU)
Un KrosFlo II recherche un système de filtration (Spectrum Laboratories, Rancho Dominguez, Californie) a été utilisé pour limiter la polydispersité AGNP et de se concentrer entre eux (figure 2). Les trois étapes du processus de TFU étaient les suivants: (1) Taille-sélection de AGNPS et AGNP-agrégats de 50 nm de diamètre et de plus en utilisant un 50-nm MidiKros polysulfone module (460 cm 2), 2) choix de la taille et de la concentration des AGNPS de 1-20 nm de diamètre à l'aide d'un 100-kD MidiKros filtre (200 cm 2), et (3) la réduction du volume utilisant en outre une MicroKros 100-kD polysulfone filtre (20 cm 2) (Figure 3).
Etape 1
- Raccorder le tuyau d'alimentation 17 taille MasterFlex de la pompe péristaltique selon la figure 2A. Une jonction Y et d'un tube de jonction sera nécessaire pour la mise en place. Fixer le tube au module 50-nm MidiKros. Assurez-vous de fixer la tuyauterie pour filtrer à l'aide des liens zip. Sélectionner taille de 17 tubes en utilisant le bouton TAILLE.
- Choisissez sens inverse des aiguilles pompe en utilisant le bouton DIR. Assurez-vous que le bouton MODE est sur INT.
- Abaissez le débit de la pompe à moins de 300 min -1 ml avant de démarrer la pompe. Le débit de la pompe doit être ajustée en fonction de la taille du tube utilisé. Il devrait y avoir un réglage faible pour permettre à l'opérateur de réagir rapidement à des fuites potentielles, mais assez grandes pour encore avoir un effet d'amorçage du système. Afin de créer le vide nécessaire à l'établissement de colloïde du réservoir dans le tube et le filtre, couper le tuyau qui relie la partie inférieure du filtre à la partie supérieure de la jonction en Y dans le milieu de la tubulure.
- Placer la section de tuyau qui conduit de filtre dans le flacon réservoir et clamper la partie inférieure du tube à proximité de la jonction en Y avec une pince ou à la main. Tournez sur la pompe. Le vide créé devrait commencer le siphonnage du colloïde.
- Une fois que le liquide circule librement à travers le tube, arrêter la pompe, joindre la section de tuyau cassé avec une jonction tube et fixez-le avec attaches. Mettre la pompe de nouveau et continuer la filtration.
- Vérifier le circuit de tuyaux pour les fuites. Si une fuite est détectée, réparer la fuite en ajustant le montage ou re-fixer avec une attache de câble. Une fois que le système de tuyauterie est exempte de fuites, le débit de la pompe peut être augmenté à pas plus de 700 min -1 ml. Cette valeur de débit de la pompe doit être optimisée en fonction de la taille de tuyau pour éviter l'échec tube. Poursuivre la filtration jusqu'à ce que le liquide dans la bouteille de réserve est épuisée à presque rien.
- Une fois la filtration terminée, recueillir le filtrat qui contient AGNPS de 50 nm de diamètre et smaller. Le rétentat peut être sauvegardé pour analyse ultérieure, conformément à la demande AGNP spécifique.
Étape 2
- Rincer la tubulure avec 2% de HNO 3 et de l'eau ultrapure avant d'installer les MidiKros 100-kD filtrer à l'aide de la même configuration que pour le module 50-nm.
- Répétez l'étape 3.3 en utilisant le module de 100 kD MidiKros.
- Une fois la filtration terminée, recueillir le contenu du tube et le filtre (100-kD rétentat). Le volume doit être d'environ 50 ml.
Étape 3
- Branchez le tuyau MasterFlex taille 14 et les MicroKros 100-kD filtre à la pompe péristaltique selon la figure 2B. Sécuriser toutes les jonctions avec les attaches. Sélectionnez taille 14 tubes sur la pompe en utilisant le bouton TAILLE et abaisser le débit de la pompe à 30 -1 ml min.
- Commencez le processus de filtration. Vérifier le circuit de tuyaux pour les fuites. Si une fuite est détectée, réparer la fuite en ajustant la formetion ou re-fixer avec une attache de câble.
- Une fois que le système de tuyauterie est exempte de fuites, le débit de la pompe peut être augmenté à pas plus de 90 -1 ml min. Poursuivre la filtration jusqu'à ce que le liquide restant dans la bouteille réservoir contient une quantité minimale de concentré.
- Le reste du contenu du tube et le filtre peuvent être recueillies dans le flacon réservoir en retirant le tube d'alimentation de la bouteille pendant que la pompe est toujours en marche. Une fois le contenu des tubes et des filtres sont dans la bouteille réservoir, la pompe peut être mis hors tension.
4. Quantification de la quantité d'argent colloïdal dans AGNPS par plasma à couplage inductif spectroscopie d'émission optique (ICP-OES)
Chaque échantillon a été chimiquement colloïdale digérée et la quantité d'argent a été quantifiée par ICP-OES utilisant un spectromètre Un 710E (Varian Inc.) Une courbe de régression linéaire d'étalonnage pour l'argent (figure 4) a été construit en utilisant huit normes d'argent (0, 3, 7, 10, 15, 25, 50 et 100 mg L -1), qui ont été préparés à partir d'un standard de 10.000 pg ml -1 pour l'argent analyse des métaux traces (Ultra scientifique).
- Chimiquement digérer les échantillons à l'aide HNO 3. Les échantillons représentatifs sont l'original colloïde (étape 1), 50-nm filtrat (étape 1), 100-kD rétentat (étape 2), et finale du 100 kD rétentat (étape 3) (figure 3).
- Les échantillons doivent être dilués avec 2% de HNO 3 en utilisant les ratios de volume suivants: 1:1000 pour l'original colloïde, 1:1000 pour le filtrat 50-nm, 1:25,000 pour le premier 100-kD rétentat et 1:250,000 pour la finale du 100 kD rétentat. Pour éviter le lessivage d'argent, tous les échantillons doivent être conservés dans des récipients en polypropylène de faible densité.
- Définissez les paramètres de l'instrument ICP-OES comme suit: longueur d'onde pour l'Ag (328,068 nm), la puissance (1,20 kW), débit plasmatique (15,0 L min -1), le flux auxiliaire (1,50 L min -1), et la pression du nébuliseur (200 kPa ).
- Chaque sample doit être mesurée en trois exemplaires, avec un temps de répétition de 10 s. Entre-temps de stabilisation de mesure de 15 secondes et un délai de 30 secondes absorption échantillon doit être utilisé. Un blanc de méthode devrait être introduit entre chaque échantillon pour réduire les risques de contamination croisée.
5. Répartition par taille des AGNPS colloïdal par microscopie électronique à transmission (MET)
A Phillips EM 208S TEM a été utilisé pour visualiser les AGNPS colloïdales. Les micrographies électroniques ont été capturées à l'aide d'une haute résolution Gatan Bioscan caméra et analysées dans le logiciel ImageJ 24.
- Diluer l'échantillon de 100 kD rétentat avec de l'eau ultrapure (1:100 rapport en volume). Dépôt de 20 ul de l'original colloïde et la dilution de 100 kD rétentat (étape 3) sur 300 mailles des grilles d'or formvar-enduits (Sciences microscopie électronique). Laissez les grilles sécher dans un dessiccateur. Voir dans la journée.
- Réglez le potentiel d'accélération de l'instrument TEM à 70 kV pour visualiser AGNPS. CApture microscope électronique (figure 5) à l'aide de la caméra à haute résolution et enregistrer en tant que fichiers image de format (TIFF) étiqueté.
6. Les résultats représentatifs
Synthèse et caractérisation de AGNPS colloïdal
Quatre litres de AGNPS Creighton colloïdales ont pu être synthétisés en utilisant la configuration présentée à la figure 1A. La finale colloïde a une couleur caractéristique jaune d'or (figure 1B). 22, 23 Le spectre d'absorption UV-Vis de ce colloïde eu une forte typique, symétrique pic de plasmon de surface (SPR) à 394 nm (figure 1C). Le spectre Raman de l'original colloïde Creighton et la finale du 100 kD rétentat présenté que trois modes de vibration, à savoir la flexion (1640 cm -1) et symétriques et asymétriques modes d'étirement de H 2 O (3245 cm -1 et 3390 cm -1 , respectivement) (figure 1D).
TFU de AGNPS colloïdal
La configuration TFU et le schéma du processus en 3 étapes TFU sont représentés aux figures 2 et 3, respectivement. À l'étape 1, un filtre de 50 nm (460 cm 2) a été utilisée pour sélectionner la taille et de supprimer AGNPS et AGNP-agrégats de 50 nm de diamètre et plus de l'original colloïde (environ 100 ml de 50-nm rétentat). Cette étape a également été accompagnée d'une réduction faible volume de 4 litres d'origine colloïde à 3,9 L de 50-nm filtrat. Aucune étape de lavage ou de perturbation d'écoulement a été utilisé. La réduction de volume le plus important (par exemple, l'élimination de l'eau) a été obtenu à l'étape 2, lorsque le filtrat 50-nm a été exécutée par la suite à travers un filtre 100-kD (200 cm 2). La résultante 100-kD rétentat a un volume total de 50 ml. La plupart des sous-produits de synthèse et des réactifs en excès ont été éliminés à cette étape à travers le solvant de l'eau (3.850 ml de 100 kD filtrat). En outre, la concentration AGNP a été réalisé par le addition d'un troisième étape de filtration à la procédure précédemment. 19 Dans cette étape 3, un filtre 100-kD d'une surface plus petite (20 cm 2) réduit le volume 100-kD rétentat à 4,0 ml. Les mesures TEM va démontrer que cette finale du 100 kD rétentat est principalement constitué de modestes AGNPS agrégées de 1-20 nm de diamètre.
ICP-OES et TEM de AGNPS colloïdal
Une courbe de régression linéaire d'étalonnage (Figure 4) pour de l'argent a été construit à partir de huit critères (0, 3, 7, 10, 15, 25, 50 et 100 mg L -1). La quantité d'argent dans chacune des quatre échantillons représentatifs colloïdales a été déterminée à partir de la courbe d'étalonnage par ICP-OES extrapolation: original colloïde (15,2 ppm, figure 3A), 50-nm filtrat (14,1 ppm, figure 3B), d'une part 100 - kD rétentat (683,1 ppm, figure 3C) et finale du 100 kD rétentat (8,538.9 ppm, figure 3D).Le rendement réel de 15,2 ppm est très proche du rendement théorique typique de 15,4 ppm pour la réaction Creighton. La concentration extrême de AGNPS (4 ml de 8,538.9 ppm) a été traduit par un changement dramatique dans la couleur du jaune d'or à l'original colloïde à brun foncé pour la finale du 100 kD rétentat (figure 3, encarts de photos flacon). La qualité des filtres a été jugée cruciale pour le processus de TFU, en particulier à l'étape 1. Les concentrations finales de rétentat variait entre 3,390.1 9,333.3 ppm ppm à fonction de l'état des filtres (largement utilisé contre neuf). Si les pores de la membrane est compromis, AGNPS qui ont un diamètre inférieur à 50 nm seront également retenues et seront par la suite diminuer le montant global des AGNPS qui sont recueillies dans le filtrat. Optimisation du processus de filtration d'inclure surveillance de la pression et un nettoyage correct peut augmenter la durée de vie des filtres.
Micrographies MET représentatifs de l'original Creighton colloïde et la finale du 100 kD rétentat (étape 3) sont présentés dans la figure 5A et 5C, respectivement. Dans leur état non agrégé, AGNPS apparaissent comme des zones noires rondes sur un fond gris pâle. Environ 800 AGNPS ont été identifiés dans les micrographies TEM de chacun des deux échantillons et analysées en utilisant le logiciel Image J. Une particule est définie par un périmètre complet et clos. Une valeur seuil de domaine a été fixé à 1,0 nm 2 selon la résolution des micrographies MET. Les chiffres et les données de la zone AGNP ont ensuite été exportées dans Microsoft Excel et les diamètres AGNP ont été extrapolés. Le diamètre moyen AGNP dans l'original colloïde et la finale du 100 kD rétentat ont été déterminées à 9,3 nm et 11,1 nm, respectivement. Les mesures du diamètre des AGNPS ont ensuite été exportés vers le logiciel Origin 8.0 et un histogramme de taille TEM a été construit pour chaque échantillon (figure 5B et 5D).
1 "src =" / files/ftp_upload/4167/4167fig1.jpg "/>
Figure 1. A) Synthèse de configuration, B) couleur caractéristique, C) Spectre d'absorption UV-Vis et D) spectre Raman du AGNPS Creighton colloïdales.

Figure 2 TFU montage expérimental pour A deux pas) 1 et 2:. I) Réservoir contenant AGNPS Creighton colloïdales. II) du réservoir de collecte de filtrat. III) Y-jonction en tuyau. IV) tête de pompe péristaltique. . V) Soit 50-nm ou 100-kD Midi Kros filtre B) étape 3: I) Réservoir contenant AGNPS Creighton colloïdales. II) du réservoir de collecte de filtrat. III) 100-kD Micro Kros filtre.
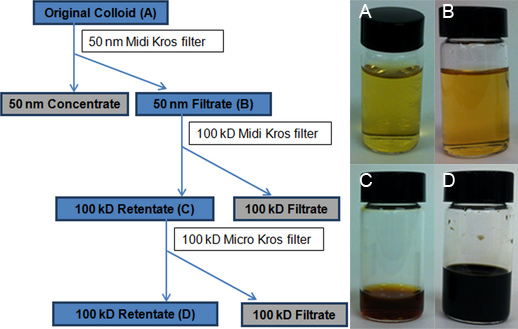
Organigramme Figure 3. Représentant le processus TFU. Les boîtes bleutées marquer les suspensions colloïdales de AGNPS collectées pour analyse ultérieure. P Vialhotographs voir A) d'origine colloïde lot, B) 50-nm filtrat recueilli après le traitement initial du colloïde à travers le filtre 50-nm (460 cm 2), C) 100-kD premier rétentat obtenu après réduction de volume à l'aide du 100-kD Midi Kros Filtre (200 cm 2), et D) rétentat final 100-kD résultant de la réduction de volume à l'aide du 100-kD Micro Kros filtre (20 cm 2). Le 100-kD filtrat ressemble à de l'eau.
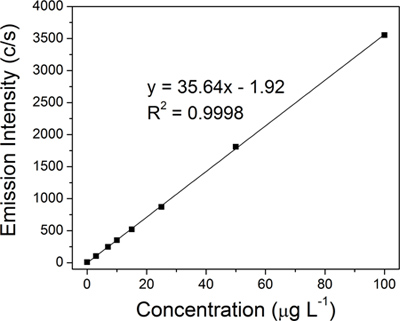
Figure 4 ICP-OES étalonnage linéaire construit en utilisant huit normes d'argent:. 0, 3, 7, 10, 15, 25, 50 et 100 pg L -1.
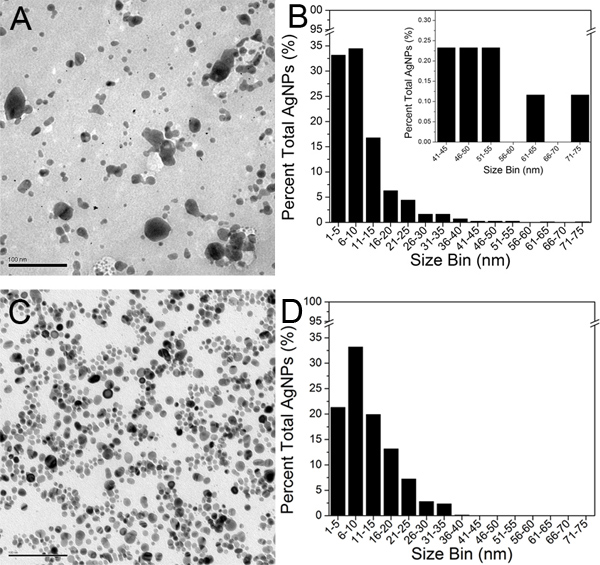
Micrographies MET Figure 5. AGNPS de A) original Creighton et C) finale du 100 kD rétentat (barre d'échelle est100 nm). Histogrammes de taille TEM construite en analysant environ 800 AGNPS pour B) d'origine AGNPS Creighton, et D) rétentat final de 100 kD. L'encart dans la figure 5B montre l'étendue 41-75 gamme de taille nm à des fins de comparaison. Cliquez ici pour agrandir la figure .
Discussion
Spectrophotométrie d'absorption UV-Vis et spectroscopie Raman de AGNPS colloïdal
Il est bien connu que le nombre de pics de résonance plasmonique de surface dans le spectre d'absorption d'un colloïde diminue à mesure que la symétrie des augmentations AGNPS. En outre, AGNP agrégation conduit à l'apparition de pics plus larges ou plus décalée vers le rouge. 25,26 La présence d'un seul pic pointu et symétrique à 394 nm SPR est révélateur de petits AGNP...
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Le financement de la National Science Foundation à travers le NUE dans l'ingénierie et les programmes LEADER Consortium est grandement appréciée.
matériels
| Le nitrate d'argent (AgNO3) | Acros Organics Inc | CAS: 7761-88-8 | |
| Le borohydrure de sodium (NaBH4) | Acros Organics Inc | CAS: 16940-66-2 | |
| L'acide nitrique (HNO 3, Optima) | Fisher Scientific Inc | A467-1 | Trace de qualité en métal pour analyse ICP |
| 10.000 mg ml -1 d'argent standard, EnviroConcentrate | Ultra scientifique | États-IAA-047 | |
| KrosFlo recherche II i tangentiel Système de filtration à flux | Spectrum Laboratories Inc | SYR2-U20-01N | |
| 0,05 um (0,5 mm) PS 460 cm 2 | Spectrum Laboratories Inc | X30S-900-02N | |
| Midi 100 kD PS 200 cm 2 | Spectrum Laboratories Inc | X3-100S-901-02N | |
| Micro100 kD PS 20 cm 2 | Spectrum Laboratories Inc | X1AB-300-10N | |
| Taille MasterFlex tubes C-Flex L / S 17 | Cole-Palmer Instrument Co. | 06424-17 | |
| Taille MasterFlex tubes C-Flex L / S 14 | Cole-Palmer Instrument Co. | 06424-14 | |
| Spectrophotomètre Cary 50 UV-VIS-NIR | Varian Inc | ||
| LabRam RH 800 Système | Horiba Jobin Yvon Inc | ||
| Varian 710ES ICP-OES | Varian Inc |
Tableau 1. Réactifs et équipements spécifiques.
Références
- Savage, N., Diallo, M. S. Nanomaterials and Water Purification: Opportunities and Challenges. Journal of Nanoparticle Research. 7, 331-342 (2005).
- Jain, J. Silver Nanoparticles in Therapeutics: Development of an Antimicrobial Gel Formulation for Topical Use. Mol. Pharmaceutics. 6, 1388-1401 (2009).
- Dal Lago, V., Franca, d. O., de, A. G., Kobarg, J., Borba Cardoso, M. Size-selective silver nanoparticles: future of biomedical devices with enhanced bactericidal properties. J. Mater. Chem. 21, 12267-12273 (2011).
- Panacek, A. Silver Colloid Nanoparticles: Synthesis, Characterization, and Their Antibacterial Activity. J. Phys. Chem. B. 110, 16248-16253 (2006).
- Elechiguerra, J. Interaction of silver nanoparticles with HIV-1. Journal of Nanobiotechnology. 3, 6 (2005).
- Jana, N. R., Sau, T. K., Pal, T. Growing Small Silver Particle as Redox Catalyst. J. Phys. Chem. B. 103, 115-121 (1999).
- Tolaymat, T. M. An evidence-based environmental perspective of manufactured silver nanoparticle in syntheses and applications: A systematic review and critical appraisal of peer-reviewed scientific papers. Sci. Total Environ. 408, 999-1006 (2010).
- Willets, K. Surface-enhanced Raman scattering (SERS) for probing internal cellular structure and dynamics. Analytical and Bioanalytical Chemistry. 394, 85-94 (2009).
- Novak, J. P., Nickerson, C., Franzen, S., Feldheim, D. L. Purification of Molecularly Bridged Metal Nanoparticle Arrays by Centrifugation and Size Exclusion Chromatography. Anal. Chem. 73, 5758-5761 (2001).
- Hossain, M. K., Kitahama, Y., Huang, G. G., Han, X., Ozaki, Y. Surface-enhanced Raman scattering: realization of localized surface plasmon resonance using unique substrates and methods. Analytical and Bioanalytical Chemistry. 394, 1747-1760 (2009).
- Henglein, A., Giersig, M. Formation of Colloidal Silver Nanoparticles: Capping Action of Citrate. J. Phys. Chem. B. 103, 9533-9539 (1999).
- Sapsford, K. E., Tyner, K. M., Dair, B. J., Deschamps, J. R., Medintz, I. L. Analyzing Nanomaterial Bioconjugates: A Review of Current and Emerging Purification and Characterization Techniques. Anal. Chem. 83, 4453-4488 (2011).
- Al-Somali, A., Krueger, K. M., Falkner, J. C., Colvin, V. L. Recycling Size Exclusion Chromatography for the Analysis and Separation of Nanocrystalline Gold. Anal. Chem. 76, 5903-5910 (2004).
- Hanauer, M., Pierrat, S., Zins, I., Lotz, A., Sonnichsen, C. Separation of Nanoparticles by Gel Electrophoresis According to Size and Shape. Nano Lett. 7, 2881-2885 (2007).
- Sweeney, S. F., Woehrle, G. H., Hutchison, J. E. Rapid Purification and Size Separation of Gold Nanoparticles via Diafiltration. J. Am. Chem. Soc. 128, 3190-3197 (2006).
- Clarke, N. Z., Waters, C., Johnson, K. A., Satherley, J., Schiffrin, D. J. Size-Dependent Solubility of Thiol-Derivatized Gold Nanoparticles in Supercritical Ethane. Langmuir. 17, 6048-6050 (2001).
- Schaaff, T. G. Isolation of Smaller Nanocrystal Au Molecules: Robust Quantum Effects in Optical Spectra. J Phys Chem B. 101, 7885-7891 (1997).
- Trefry, J. C. Size Selection and Concentration of Silver Nanoparticles by Tangential Flow Ultrafiltration for SERS-Based Biosensors. J. Am. Chem. Soc. 132, 10970-10972 (2010).
- Bhattacharjee, S., Bhattacharjee, C., Datta, S. Studies on the fractionation of & beta-lactoglobulin from casein whey using ultrafiltration and ion-exchange membrane chromatography. J. Membr. Sci. 275, 141-150 (2006).
- Eppler, A., Weigandt, M., Schulze, S., Hanefeld, A., Bunjes, H. Comparison of different protein concentration techniques within preformulation development. Int. J. Pharm. 421, 120-129 (2011).
- Creighton, J. A., Blatchford, C. G., Albrecht, M. G. Plasma resonance enhancement of Raman scattering by pyridine adsorbed on silver or gold sol particles of size comparable to the excitation wavelength. J. Chem. Soc. Faraday Trans. 2, 790-798 (1979).
- Pavel, I. E. Estimating the Analytical and Surface Enhancement Factors in Surface-Enhanced Raman Scattering (SERS): A Novel Physical Chemistry and Nanotechnology Laboratory Experiment. J. Chem. Educ. , (2011).
- Rasband, W. S. . ImageJ. , (1997).
- Kelly, K. L., Coronado, E., Zhao, L. L., Schatz, G. C. The Optical Properties of Metal Nanoparticles: The Influence of Size, Shape, and Dielectric Environment. J. Phys. Chem. B. 107, 668-677 (2003).
- Śileikaitċ, A., Prosyčevas, I., Puišo, J., Juraitis, A., Guobienċ, A. Analysis of Silver Nanoparticles Produced by Chemical Reduction of Silver Salt Solution. Mater. Sci. (Medziagotyra). 12, 287-291 (2006).
- Lewis, L. N. Chemical catalysis by colloids and clusters. Chem. Rev. 93, 2693-2730 (1993).
- Li, Y., Wu, Y., Ong, B. S. Facile Synthesis of Silver Nanoparticles Useful for Fabrication of High-Conductivity Elements for Printed Electronics. J. Am. Chem. Soc. 127, 3266-3267 (2005).
- Sun, Y., Xia, Y. Shape-Controlled Synthesis of Gold and Silver Nanoparticles. Science. 298, 2176-2179 (2002).
- Han, X., Zhao, B., Ozaki, Y. Surface-enhanced Raman scattering for protein detection. Analytical and Bioanalytical Chemistry. 394, 1719-1727 (2009).
- Pavel, I. Label-Free SERS Detection of Small Proteins Modified to Act as Bifunctional Linkers. J. Phys. Chem. C. 112, 4880-4883 (2008).
- Ladner, D. A., Steele, M., Weir, A., Hristovski, K., Westerhoff, P. Functionalized nanoparticle interactions with polymeric membranes. J. Hazard. Mater. , (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon