Method Article
急性移植片対宿主病のバイオマーカーの検証のためのハイスループットシーケンシャルELISA
要約
複数のバイオマーカー候補のハイスループットの検証は凍結/融解サイクルを最小限に抑え、貴重な血漿検体を使用するために、シーケンシャルELISA法により行うことができる。ここでは、連続して6つの異なる検証血漿バイオマーカーのELISAを実行する方法を示し 1月3日移植片対宿主病(GVHD)の 4同じ血漿試料に。
要約
公平ディスカバリープロテオミクス戦略は臨床現場での診断および予後のテストを改善することができ、治療的介入を導くのを助けることができる新たなバイオマーカーの大規模な番号を識別するために可能性を秘めている。候補タンパク質の大規模な番号が識別されると、それはそのような急性の発症として有限体積の、イベントドリブンとかけがえのない患者の血漿サンプルから、タイムリーかつ効率的な方法でバイオマーカー候補を検証することは困難である移植片対宿主病(GVHD)、同種造血幹細胞移植(HSCT)の潜在的に生命を脅かす合併症。
最小限にするために順番に、IL-2Rα5、TNFR1 6、HGF 7、IL-8の8、エラフィン2、REG3α3(またPAP1として知られている):ここでは、6つの検証済みの移植片対宿主病(GVHD)のタンパク質を市販のELISAを行う処理を記述凍結融解サイクル、プラズマ時間と血漿の使用量を解凍した。最適なシーケンシャルELISAの性能を容易にするためのマイナーな調整とメーカーのELISAキットとプロトコルを使用して我々の研究室で確立されたサンプルの希釈率によって決定されるように、この手順のために私達は順番にELISAを行う。得られた血漿バイオマーカーの濃度は、患者コホート内の重要な発見のためにコンパイルして解析することができます。これらのバイオマーカーは、研究目的のために現在であるが、臨床ケアへの取り込みは、現在臨床試験で検討されている。
この手法は、同じ試料上の関心のある複数のタンパク質/サイトカインのELISAを実行するために適用することができます(複数可)提供されたサンプルは、他の試薬と混合する必要はありません。 ELISAキットがプレコーティングされたプレート、96ウェルハーフウェルプレートまたは384ウェルプレートが付属していない場合は、さらにサンプル/試薬の使用を最小限に抑えるために使用することができます。
概要
急性移植片対宿主病(GVHD)、同種造血幹細胞移植(HSCT)後の非再発死亡率(NRM)の主要な原因は、3臓器系の機能不全によって測定される:皮膚、肝臓、消化管(GI)路4。急性GVHDは、通常2〜8週間、移植後に発生したが、後に発生する可能性があり、しばしばこのようなコンディショニングレジメンの毒性、感染症や薬の副作用などの他のポスト造血幹細胞移植の合併症から臨床的に区別することはできません。プロテオミクス戦略とシーケンシャルELISA法を用いた高スループット検証を使用することにより、我々はその濃度GVHDの臨床症状の発症時に上昇している6タンパク質を同定した。 IL-2Rα、TNFR1、4バイオマーカーパネルにまとめ、HGFおよびIL-8は、臨床症状の発症時GVHD診断できるとGVHDの重症度1の独立後の造血幹細胞の生存率を予測することができます。エラフィン、SKの移植片対宿主病(GVHD)のためのバイオマーカーには、このような薬疹など他の原因によるGVHDの発疹と発疹を区別することができ、移植の生存率2を予測することができます。我々は最近、下部消化管、最もNRMに関連付けられた標的臓器の移植片対宿主病(GVHD)のバイオマーカーとしてREG3α同定した。プラズマREG3α濃度は確実にポストHSCT下痢の原因として、GVHDを特定し、診断腸の生検に移植片対宿主病(GVHD)の組織学的重症度に相関させることができます。 GIの移植片対宿主病(GVHD)の発症時REG3α濃度もGVHDの治療とNRM 3への反応を予測することができます。臨床ケアにこれらの検証移植片対宿主病(GVHD)のバイオマーカーの取り込みは、現在臨床試験で検討されている。
これらの実験は、かけがえのないと数量限定となっており、GVHD発症時の2000年から2010年の間に造血幹細胞移植を受けた患者から採取した小さなプラズマアリコートで行った。これらのサンプルの貴重な自然のために、我々はMETを開発した過剰凍結融解サイクル、解凍時間と血漿の使用状況を解消するための効率的、再現可能な方法で、複数の血漿タンパク質濃度を測定hodで。この手法は、同じ試料上の関心のある複数のタンパク質/サイトカインのELISAを実行するために適用することができます(複数可)提供されたサンプルは、他の試薬と混合する必要はありません。 ELISAキットがプレコーティングされたプレート、96ウェルハーフウェルプレートまたは384ウェルプレートが付属していない場合は、さらにサンプル/試薬の使用を最小限に抑えるために使用することができます。本稿では、移植片対宿主病(GVHD)のバイオマーカーを測定することの技術的側面に焦点を当てています。
プロトコル
1。実験0日目:IL-2Rα、REG3αとHGFの捕捉抗体とサンプルの調製およびELISAテストプレートコーティング
- 分析される血漿アリコートサンプルを解凍し、プラズマからの上に底や脂質で血栓を分離するために10分間、12,000 rpmで遠心し、プルアップされます。未希釈血漿150μlをあらかじめ定義されたマップに従って手動ピペッティング(ソースプレート)を96ウェルV底プレートに各サンプルからメッキされます。アリコートをパラフィルムで包み、全体のプロセスの間に、4℃で湿潤チャンバー内に保持されます。もはやより72時間。
- IL-2RαおよびHGFの捕捉抗体が再構成し、メーカーの仕様および50μl当たり希釈後、密封し、4℃で一晩インキュベートして、それぞれ96ウェル高結合ハーフウェルプレートの各ウェル℃にメッキされされますまた、多くのプレートを37℃で乾燥し、℃、後で使用するために、依存して4℃で保存することができますタンパク質の安定性にる。
- REG3α捕捉抗体を密封し、4℃で一晩インキュベートし、384ウェルNuncマキシSORPプレートの各ウェル℃でめっきされるメーカーのコーティング緩衝液と25μlを用いて製造元のプロトコールに従って希釈化されることになります
2。実験1日目:IL-2RαELISA法(図1)
- IL-2Rαテストプレートを洗浄し、TBSでBLOTTOでブロックし、規格が再構成され、8点標準曲線は、メーカーのプロトコルごとに用意されています。
- ブロッキング工程の後にプレートを洗浄後、希釈していない血漿50μLをELISA試験板にソースプレートから複製でメッキされており、各標準液50μlを二重にメッキが施されている。プレートを300rpmに設定したプレート回転子に密封し、室温で2時間インキュベートする。
- プラズマは、IL-2RαELISA試験板から回収され、国連に戻されプラズマ源プレートを希釈した。 ELISAは、製造業者のプロトコルごとに完了した(ハーフウェルプレートに合わせて調整ボリューム付)と各ウェルの吸光度を450から570 nmに設定プレートリーダーを用いて読み取ると、データが保存され、分析されます。
3。実験1日目:REG3αELISA法(図1)
- 未希釈血漿10μlを別のVボトムソースプレートに転送されます。メーカー提供の希釈緩衝液90μlを1:10希釈ソースプレートを作成するために、各ウェルに添加する。
- REG3αELISAは、製造業者のプロトコルごとに実行されます(ボリュームで384ウェルプレート用に調整)、各ウェルの光学濃度を450から620 nmに設定プレートリーダーを使用して読み込まれ、データが保存され、分析されます。
4。実験1日目:捕獲抗体とエラフィンとTNFR1テストプレートコーティング
- エラフィンとTNFR1の捕捉抗体は、再構成およびDILになります製造元の仕様および50μl当たりutedを密封し、エラフィン室温で一晩インキュベートし、それぞれ96ウェル高結合ハーフウェルプレートの各ウェルに播種し、4°Cで一TNFR1のためでしょう。
5。実験日1-2:HGF ELISA法(図1)
- IL-2RαELISAを完了し、試験を確保した後に繰り返される必要はありません、無希釈血漿60μlのは、新しいソースプレートに転送し、その後、1×PBS中1%BSAの60μlを作るために各ウェルに添加し、 1:02希釈したプラズマ源プレート。
- HGFの試験板は、洗浄後にTBSでBLOTTOでブロックし、規格が再構成されると8ポイントの検量線は、製造業者のプロトコルごとに用意されています。
- ブロッキング工程の後にプレートを洗浄した後、1:2希釈した血漿50μLをELISA試験板上に二重にメッキが施されており、各標準液50μlを二重にメッキが施されている。プレートは密封され、300RPMでセットプレートローテーター上で室温で一晩インキュベートした。
- 1:02希釈した血漿は、HGF ELISA試験板から埋め立てと1:2希釈したプラズマ源プレートに戻される。 ELISAは、製造業者のプロトコルごとに完了した(ハーフウェルプレートに合わせて調整ボリューム付)と各ウェルの吸光度を450から570 nmに設定プレートリーダーを用いて読み取ると、データが保存され、分析されます。
6。実験2日目:エラフィンELISA
- 未希釈血漿10μlを新しいソースプレートに転送され、その後1×PBS中1%BSAを190μLのは、プラズマdluted 1:20の200μlを作るために各ウェルに追加されます。
- エラフィンELISAは、製造業者のプロトコル(ボリュームのハーフウェルプレート用に調整)に従って実施し、各ウェルの吸光度を450から570 nmに設定プレートリーダーを用いて読み取ると、データが保存され、分析されます。
7。実験ダY 2:TNFR1 ELISA
- PBS中1%BSAを含む25μlの1時25希釈した血漿125μlのを得るために、1:20のソースプレート(現在午前1時20分血漿100μlを含む)に追加されます。
- TNFR1 ELISAは、製造業者のプロトコルごとに完了した(ハーフウェルプレートに合わせて調整ボリューム付)と各ウェルの吸光度を450から570 nmに設定プレートリーダーを用いて読み取ると、データが保存され、分析されます。
8。実験2日目:IL-8 ELISA
- 1:02希釈した血漿60μlのは、新しいソースプレートに移しし、その後、IL-8希釈液180μlを、1:6希釈したプラズマ源プレートを作るために各ウェルに添加する。
- IL-8 ELISAはメーカーのプロトコルごとに完了した(ハーフウェルプレートに合わせて調整ボリューム付)と各ウェルの吸光度を450から570 nmに設定プレートリーダーを用いて読み取ると、データが保存され、分析されます。
すべてのELISAは、unuseを完了したあとDストック血漿を解凍アリコートに交換し、将来の使用のために凍結されます。
結果
バイオマーカーのワークフローとタイムラインを、それぞれ表1、表2に詳述されている。完了すると、6つの異なったタンパク質の濃度は現在、プラズマの150μLの合計を使用して、同じ血漿試料に定量化されている。重複あたりのテストのサンプルをめっきするCVの10%未満が最適であることと、内部質保証が可能になります。複数のプレートでシーケンシャルELISAを行っている場合は、高い水準の一貫した光学濃度が好まれており、測定値の改善されたプレート間の信頼性を考慮し、標準曲線ODSは、ELISAの性能( 図2)の矛盾のために査定探すためにプレートの間で比較することができます。 ODSは、我々の研究室で各バイオマーカーについて観察されたメチルベンジジン発色基質と高濃度を使用した開発時間を表3に記載されています。
tp_upload/4247/4247fig1.jpgの "alt ="図1 "/>
図1、IL-2Rα、REG3αとHGF ELISAのためのワークフロー。血漿サンプルは、IL-2RαELISA試験プレート上に播種された後、他のELISA用希釈ソースプレートを作るために再利用されます。 HGF ELISAのために、プラズマは、IL-8は1:6希釈プレートを準備するために再利用されます。 拡大図はこちらをクリックしてください 。
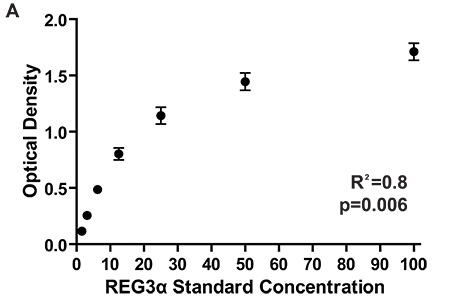
図2:初期REG3αGI GVHDのバイオマーカーのレポート3のためにテストされ1084人の患者に対応するREG3α濃度を測定する7種類のELISAプレートの標準曲線のための光学密度。プレート間の一貫したODSはプレート間の一貫性のタンパク濃度の測定を保証します。タンパク質の濃度血漿サンプル中の標準曲線光学濃度にサンプルの光学密度を比較することによって計算されます。
| 実験0日目 | 1。サンプルを準備します |
| 2。 IL-2Rα、HGFとREG3αキャプチャアブ | |
| 実験1日目 | 1。 IL-2RαELISA |
| 2。 REG3αELISA | |
| 3。 HGF ELISA(サンプルメッキを介して) | |
| 4。エラフィンおよびTNFRキャプチャアブ | |
| 実験2日目 | 1。 HGF ELISAの完了 |
| 2。エラフィンELISA | |
| 3。 TNFR1 ELISA | |
| 4。 IL-8 ELISA | |
| 5。未使用の再凍結プラズマ |
表1。GVHDバイオマーカーワークフローの概要
| 0日目 | 試料調製と一夜捕獲体のインキュベーション | ||||||
| ELISA | IL-2Rα | REG3α | HGF | エラフィン | TNFR1 | IL-8の | |
| 時間(hr) | 0.0 | ブロッキング | |||||
| 1.0 | メッキサンプル | ||||||
| 3.0 | 検出AB;血漿試料を取り戻す | ブロッキング;準備サンプル(1:10希釈) | |||||
| 4.0 | メッキされたサンプル(1:10) | ||||||
| 5.0 | ストレプトアビジン-HRP | 検出抗体 | |||||
| 5.5 | TMB | ストレプトアビジン-HRP | |||||
| 6.0 | プレート読み取り | TMB | ブロッキング;準備サンプル(1:2希釈) | ||||
| 6.5 | プレート読み取り | ||||||
| 7.0 | メッキされたサンプル(1:2) | アブ(一晩のインキュベーション)をキャプチャ | アブ(一晩のインキュベーション)をキャプチャ | ||||
| 2日目 | |||||||
| 時間(hr) | 0.0 | プラズマ、検出Abを取り戻す | ブロッキング;準備サンプル(1:20) | ||||
| 1.0 | サンプルめっき(1:2) | ブロッキング; 1:25希釈1:20〜サンプルのさらなる希薄化を | |||||
| 2.0 | HRP | サンプルめっき(1:25) | |||||
| 2.5 | TMB | ||||||
| 3.0 | プレート読み取り | 検出抗体 | |||||
| 3.5 | サンプル(1:6希釈)を準備 | ||||||
| 4.0 | 検出抗体 | サンプルめっき(1:6) | |||||
| 5.0 | HRP | ||||||
| 5.5 | TMB | ||||||
| 6.0 | プレート読み取り | HRP | 検出抗体 | ||||
| TMB | |||||||
| 7.0 | プレート読み取り | TMB | |||||
| 7.5 | プレート読み取り | ||||||
| 完成後 | アリコートに原料血漿を交換して、後で使用するために凍結 | ||||||
表2。ELISAを行うためのタイムライン。
| 血漿希釈率 | 高い標準濃度 | 基板開発時間(分) | 高いOD | 曲線 | |
| IL-2Rα | 午前1時01分 | 2000 pg / mlで | 5 | 1 | 線形 |
| HGF | 午前1時02分 | 4000 pg / mlで | 22 | 2.1 | 4パラメータ |
| IL-8の | 1時06分 | 200 pg / mlで | 12 | 2.7 | 4パラメータ |
| REG3α | 午前1時10分 | 100 ng / mlの | 12 | 1.7 | 4パラメータ |
| エラフィン | 1時20分 | 2000 pg / mlで | 20 | 1.9 | 4パラメータ |
| TNFR1 | 1時25 | 800 pg / mlで | 8 | 2.7 | 線形 |
6 GVHDのバイオマーカーについては、 表3。ELISA法の詳細。
ディスカッション
ここに提示され、順次、ELISA法を得ることが困難および/ またはそのような稀な疾患またはマウス9,10から得られた血漿サンプルでのヒト被験者から採取したサンプルのようにかけがえのないかもしれないプラズマの小さなボリュームに複数の血漿タンパク質の測定が可能になる。シーケンシャルELISAは、一般的に希釈した血漿を必要とするELISA法で、増加血漿希釈係数の順序で実行されます。≥必要に応じてこれを行うことができますが、1時10分は、典型的には、再利用することする必要はない。シーケンシャルELISAを実行する能力がプラズマは他の試薬、または異なる希釈バッファはプラズマのため必要とされるために混合されているELISAキット/プロトコルによって制限されますが、これは、その互換性の懸念のために再利用するサンプルにablilityを排除バッファ/試薬は、特定のテストのパフォーマンスを妨害する可能性があります。綿密な計画と、10以上のELISAは同じ血漿試料に対して行ってもよい。
ENT ">個々の研究室では、被験者から採取したサンプル中の目的のタンパク質の予想される血漿中濃度に基づいて解釈可能な結果を得るために、血漿希釈液を調整する必要があります。実験装置の違いは、インキュベーション及び比色開発を最適化するために必要になることがあり回、洗浄の回数および/または任意の与えられたELISA法を最適化するために時間を浸し洗浄する。高スループット能力と精度を向上させるために、費用対効果の高い方法で解析を実行するために、384ウェルプレート上で解析し、スタッキングユニットと自動プレート洗浄が可能なロボットのリキッドハンドリングプラットフォームの利用が推奨されています。この装置は、複数のユーザーによって実行された分析の正確さと精度を向上させ、間およびアッセイ内変動を低減するために分析の一貫性を提供するのに役立ちます。
我々は2つの理由のために利用できる多重プラットフォーム上でシーケンシャルELISAを使用した:1)のほとんどは、新規タンパク質に対する抗体のペアは、簡単にビーズまたは他の材料と同様にかかり、高価で時間通りにコンジュゲートすることができない、2)個々のELISAアッセイは、交差反応性11の不在に二次多重マイクロアレイまたはビーズよりも正確です。信頼性の高い方法が多重、ビーズベースのマイクロアレイを行うために設立されている場合は、シーケンシャルのELISAプロセスを置き換えることができるかもしれませんが、ビーズに抗体をコンジュゲートする能力によって、および/またはであることが所望のタンパク質の数が制限される場合があり分析した。
開示事項
特別な利害関係は宣言されません。
謝辞
NIHの助成金RC1-HL-101102、P01-CA039542、T32-HL007622、ハートウェル財団、ドリス·デューク慈善財団によってサポートされています。博士PaczesnyはエリックハートウェルファンドとエイミーStrelzer Manasevit研究プログラムの研究者でもある。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名称 | 会社 | カタログ番号 | 注釈 |
| ヒトIL-2、RアルファDuoset | R&Dシステムズ | DY223 | |
| ヒトHGF Duoset | R&Dシステムズ | DY294 | |
| ヒトIL-8 OptEIA·KITⅡ | ベクトン·ディッキンソン | 550999 | |
| AB-マッチASSEMBLY人間PAP1(REG3α)キット | MBLインターナショナル | 5323 | |
| AB-マッチユニバーサルキット | MBLインターナショナル | 5310 | |
| 人間sTNFRI/TNFRSF1A Duoset | R&Dシステムズ | DY225 | |
| 人間Trappin-2/Elafin Duoset | R&Dのサイ茎 | DY1747 | |
| 96ウェルのポリスチレン円錐形の底板 | サーモサイエンティフィック | 249570 | プラズマ源プレートに使用 |
| コスター半よく高結合96ウェルプレート | コーニング | 3690 | IL-2Rα、HGF、TNFR1とエラフィンELISAのための |
| ヌンク384ウェルMaxiSorpプレート | ヌンク | 464718 | REG3αELISA用 |
| Hyclone社リンは、1x、緩衝生理食塩水 | サーモサイエンティフィック | SH30256.02 | |
| ウシ血清アルブミン、フラクションV、熱処理ショック | フィッシャー·サイエンティフィック | BP1600-100 | |
| TBSでブロッカーBLOTTO | サーモサイエンティフィック | 37530 | IL-2RαHGFおよびTNFR1 ELISAのためのブロッキング剤 |
| ダルベッコリン酸緩衝生理食塩水 | ギブコ | 21600-069 | IL-2Rα、HGF、エラフィンとTNFR1 ELISAのためのバッファを洗う |
| TMB過酸化水素Susbtrate | Kirkegaardとペリーラボラトリーズ | 50-76-00 | |
| ツイーン20 | アクロスオーガニック | 233362500 | IL-2Rα、HGF、エラフィンとTNFR1 ELISAのためのバッファを洗う |
| 硫酸 | シグマアルドリッチ | 84720 | (2Nに希釈したもの)·ストップ·ソリューションのために |
参考文献
- Paczesny, S. A biomarker panel for acute graft-versus-host disease. Blood. 113, 273-278 (2009).
- Paczesny, S. Elafin is a biomarker of graft-versus-host disease of the skin. Science Translational Medicine. 2, 13ra12 (2010).
- Ferrara, J. L. Regenerating islet-derived 3 alpha is a biomarker of gastrointestinal graft-versus-host disease. Blood. , (2011).
- Ferrara, J. L., Levine, J. E., Reddy, P. Graft-versus-host disease. Lancet. 373, 1550-1561 (2009).
- Miyamoto, T. Serum concentration of the soluble interleukin-2 receptor for monitoring acute graft-versus-host disease. Bone Marrow Transpl. 17, 185-190 (1996).
- Holler, E. Role of tumor necrosis factor alpha in acute graft-versus-host disease and complications following allogeneic bone marrow transplantation. Transplant. Proc. 25, 1234-1236 (1993).
- Okamoto, T. Increased hepatocyte growth factor in serum in acute graft-versus-host disease. Bone Marrow Transpl. 28, 197-200 (2001).
- Uguccioni, M. Elevated interleukin-8 serum concentrations in beta-thalassemia and graft-versus-host disease. Blood. 81, 2252-2256 (1993).
- Osuchowski, M. F., Siddiqui, J., Copeland, S., Remick, D. G. Sequential ELISA to profile multiple cytokines from small volumes. J. Immunol. Methods. 302, 172-181 (2005).
- Osuchowski, M. F., Remick, D. G. The repetitive use of samples to measure multiple cytokines: the sequential ELISA. Methods. 38, 304-311 (2006).
- Schweitzer, B. Multiplexed protein profiling on microarrays by rolling-circle amplification. Nat. Biotechnol. 20, 359-365 (2002).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved