Method Article
High Throughput Sequential ELISA zur Validierung von Biomarkern des akuten Graft-Versus-Host Disease
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Hoher Durchsatz Validierung mehrerer Biomarker-Kandidaten können durch sequentielle ELISA durchgeführt werden, um Einfrieren / Auftauen zu minimieren und die Nutzung von wertvollen Plasmaproben. Hier zeigen wir, wie man nacheinander durchführen ELISAs für sechs verschiedene validierte Plasma-Biomarker 1-3 Of graft-versus-host disease (GVHD) 4 Auf dem gleichen Plasmaprobe.
Zusammenfassung
Unvoreingenommene Entdeckung Proteomics-Strategien haben das Potenzial, eine große Zahl von neuen Biomarkern, die diagnostische und prognostische Tests in einem klinischen Umfeld zu verbessern und kann möglicherweise Guide therapeutische Interventionen zu identifizieren. Wenn eine große Zahl von Kandidaten Proteine identifiziert werden, kann es schwierig sein, Biomarker-Kandidaten in einer zeitgerechten und effizienten Weise aus Patientenplasmaproben, die event-driven, der Finite-Volumen-und unersetzlich sind, wie zu Beginn der akuten validieren Graft-versus- host disease (GVHD), eine potenziell lebensbedrohliche Komplikation der allogenen hämatopoetischen Stammzelltransplantation (HSCT).
Hier beschreiben wir die Verfahren zur Durchführung der im Handel erhältlichen ELISA-Tests für sechs validiert GVHD Proteine: IL-2Rα 5, 6 TNFR1, HGF 7, IL-8 8, Elafin 2 und REG3α 3 (auch als PAP1 bekannt) in einer sequentiellen Weise zu minimieren Frost-Tau-Zyklen, Aufgetaut Plasma-Zeit und Plasma-Nutzung. Bei diesem Verfahren führen wir die ELISAs in Reihenfolge wie Probenverdünnungsfaktor bestimmt, wie in unserem Labor mit der Hersteller ELISA Kits und Protokolle mit geringfügigen Anpassungen, um eine optimale sequentielle ELISA Leistung erleichtert wird. Die resultierende Plasma-Biomarker-Konzentrationen können dann zusammengestellt und analysiert werden signifikante Ergebnisse innerhalb einer Patientengruppe. Während diese Biomarker derzeit nur für Forschungszwecke, wird ihre Einbeziehung in klinische Versorgung derzeit in klinischen Studien untersucht.
Diese Technik kann angewendet ELISAs für mehrere Proteine / Zytokine von Interesse an der gleichen Probe durchzuführen (e) sofern die Proben müssen nicht mit anderen Reagenzien gemischt werden. Wenn ELISA Kits nicht mit Pre-beschichtete Platten, 96-well half-well Platten oder 384-Well-Platten kommst können zur weiteren Reduzierung der Verwendung von Proben / Reagenzien werden.
Einleitung
Akute Graft-versus-Host-Krankheit (GVHD), eine führende Ursache von Nicht-Rückfall Mortalität (NRM) nach allogener Stammzelltransplantation (HSCT), wird durch eine Dysfunktion in drei Organsysteme gemessen: die Haut, Leber und Magen-Darm-(GI) Trakt 4. Akute GvHD tritt typischerweise zwischen zwei und acht Wochen nach der Transplantation kann aber später auftreten und ist oft klinisch nicht von anderen post-HSCT Komplikationen wie Konditionierung Toxizität, Infektionen oder Medikamente Nebenwirkungen. Durch den Einsatz von Proteom Strategien und Hochdurchsatz-Validierung mit sequentiellen ELISA haben wir 6 Proteine, deren Konzentrationen an dem Einsetzen der klinischen Manifestationen von GVHD erhöht identifiziert. IL-2Rα, TNFR1, HGF und IL-8, wenn sie in einem 4-Biomarker-Panel kombiniert werden zu Beginn der klinischen Symptome GVHD zu diagnostizieren und kann post-HSCT Überleben unabhängig von GVHD Schweregrad 1 vorherzusagen. Elafin, ein Biomarker für GVHD der skin, zwischen GVHD Ausschlag und Ausschlag von anderen Ursachen wie Arzneimittelexantheme diskriminieren und Transplantation das Überleben 2 vorherzusagen. Wir haben vor kurzem identifizierten REG3α als Biomarker von GVHD des unteren Gastrointestinaltrakt, das Zielorgan meisten mit NRM verbunden. Plasma REG3α Konzentration zuverlässig zu identifizieren GVHD als Ursache für post-HSCT Durchfall und korrelieren mit histologischen Schwere der GvHD auf diagnostische Darmbiopsien. REG3α Konzentrationen an GI GVHD Ausbruch kann auch vorhersagen, Reaktionsfähigkeit auf GVHD Therapie und NRM 3. Der Einbau dieser validierten GVHD Biomarker in der klinischen Versorgung wird derzeit in klinischen Studien untersucht.
Diese Experimente wurden auf kleinen Plasma-Aliquots von Patienten HSCT zwischen 2000 und 2010 bei der GVHD Auftreten, die unersetzlich und von begrenzter Menge sind gesammelt wurden. Aufgrund der wertvollen Natur dieser Proben haben wir eine met entwickelthod der Messung mehrere Plasma-Protein-Konzentrationen in einer effizienten, reproduzierbar, um überschüssige Gefrier-Auftau-Zyklen, Auftauzeit und Plasma Nutzung zu beseitigen. Diese Technik kann angewendet ELISAs für mehrere Proteine / Zytokine von Interesse an der gleichen Probe durchzuführen (e) sofern die Proben müssen nicht mit anderen Reagenzien gemischt werden. Wenn ELISA Kits nicht mit Pre-beschichtete Platten, 96-well half-well Platten oder 384-Well-Platten kommst können zur weiteren Reduzierung der Verwendung von Proben / Reagenzien werden. Dieses Manuskript konzentriert sich auf die technologischen Aspekte der Messung von GVHD Biomarkern.
Protokoll
Ein. Experiment Tag 0: Probenvorbereitung und ELISA-Test Platte Coating mit Capture Antikörper für IL-2Rα, REG3α und HGF
- Plasma Aliquot zu analysierenden Proben werden gezogen, werden aufgetaut und zentrifugiert bei 12.000 UpM für 10 min auf die Gerinnsel an der Unterseite und auf der Oberseite Lipide aus dem Plasma abzutrennen. 150 ul unverdünnten Plasma wird von jeder Probe auf eine 96-Well-V-Bodenplatte plattiert werden (Quelle Platte) durch manuelle Pipettiervorrichtung nach vordefinierten Karten. Die Aliquots werden in Parafilm eingewickelt werden und in einer feuchten Kammer bei 4 ° C während des gesamten Prozesses; nicht mehr als 72 Stunden.
- IL-2Rα und HGF Fängerantikörpern wird rekonstituiert und verdünnt werden pro Hersteller Spezifikation und 50 ul wird in jede Vertiefung der 96-Well jeweiligen High-bindende half-well Platten, die dann verschlossen und über Nacht bei 4 ° C inkubiert ausplattiert Alternativ können viele Platten bei 37 ° C getrocknet werden und bei 4 ° C für eine spätere Verwendung, hängenING auf die Stabilität des Proteins.
- REG3α Fängerantikörper wird nach Herstellerangaben Protokoll mit Hersteller-Beschichtungs-Puffer und 25 ul verdünnt werden in jede Vertiefung einer 384-well Nunc Maxi-Sorp Platte, die dann verschlossen und über Nacht bei 4 ° C inkubiert beschichtet werden
2. Experiment 1. Tag: IL-2Rα ELISA (Abbildung 1)
- Die IL-2Rα Testplatte gewaschen, mit BLOTTO in TBS, und die Standard-rekonstituiert wird und ein 8-Punkt-Standardkurve wird pro Hersteller-Protokoll vorbereitet.
- Nach Waschen der Platte nach der Sperrung Schritt wird 50 ul unverdünntem Plasma im Duplikat aus der Quellenplatte zu der ELISA-Test Platte ausplattiert und 50 ul jeder Standard ist in zweifacher Ausfertigung ausplattiert. Die Platte wird verschlossen und inkubiert 2 h bei Raumtemperatur auf einem Rotator Platte bei 300 Upm eingestellt.
- Das Plasma wird aus dem IL-2Rα ELISA Testplatte zurückgewonnen und wieder in die un platziertverdünnt Plasmaquelle Platte. Der ELISA ist je Hersteller-Protokoll (mit Volumina für half-well Platten eingestellt) und die optische Dichte eines jeden Wells liest unter Verwendung eines Plattenlesegeräts Satzes um 450 bis 570 nm nicht beendet werden, und die Daten gespeichert und analysiert.
3. Experiment Tag 1: REG3α ELISA (Abbildung 1)
- 10 ul unverdünnten Plasma wird mit einem separaten v-bottom Source-Platte übertragen werden. 90 ul Hersteller bereitgestellte Verdünnungspuffer in jede Vertiefung eine 1:10 Verdünnung Source-Platte erstellen hinzugefügt.
- Die REG3α ELISA wird pro Hersteller-Protokoll durchgeführt (mit einem Volumen eingestellt für 384-Well-Platten) und die optische Dichte jeder Vertiefung liest mit einer Platte-Reader bei 450-620 nm, und die Daten werden gespeichert und analysiert werden.
4. Experiment Tag 1: Elafin und TNFR1 Prüfplatte Coating mit Capture Antikörper
- Elafin und TNFR1 Fänger-Antikörper werden rekonstituierte und dilausgeschüttet pro Hersteller Spezifikation und 50 ul wird in jede Vertiefung der 96-Well jeweiligen High-bindende half-well Platten, die dann verschlossen und über Nacht bei Raumtemperatur inkubiert Elafin plattiert und bei 4 ° C für TNFR1.
5. Experiment Tag 1-2: HGF ELISA (Abbildung 1)
- Nach Abschluss der IL-2Rα ELISA und Sicherung der Test nicht wiederholt zu werden brauchen, werden mit 60 ul der unverdünnten Plasma zu einer neuen Quelle Platte übertragen und dann 60 ul 1% BSA in 1 x PBS zu jeder Vertiefung gegeben, um ein make 1:2 verdünnt Plasmaquelle Platte.
- Die HGF Testplatte gewaschen, mit BLOTTO in TBS, und die Standard-rekonstituiert wird und ein 8-Punkt-Standardkurve wird pro Hersteller-Protokoll vorbereitet.
- Nach Waschen der Platte nach der Sperrung Schritt wird 50 ul von 1:2 verdünntem Plasma in zweifacher Ausfertigung auf dem ELISA-Test Platte ausplattiert, und 50 ul jeden Standard wird in zweifacher Ausfertigung ausplattiert. Die Platte ist abgedichtet undüber Nacht bei Raumtemperatur auf einem Teller Rotator bei 300 RPM gesetzt inkubiert.
- Die 1:2 verdünntes Plasma aus dem HGF ELISA Testplatte zurückgewonnen und wieder in den platziert 1:2 verdünntes Plasmaquelle Platte. Der ELISA ist je Hersteller-Protokoll (mit Volumina für half-well Platten eingestellt) und die optische Dichte eines jeden Wells liest unter Verwendung eines Plattenlesegeräts Satzes um 450 bis 570 nm nicht beendet werden, und die Daten gespeichert und analysiert.
6. Experiment Tag 2: Elafin ELISA
- 10 ul unverdünnten Plasma wird zu einer neuen Quelle Platte übertragen werden und dann 190 ul 1% BSA in 1 x PBS wird zu jedem Well hinzugefügt werden, um 200 ul von Plasma dluted 01.20 machen.
- Die ELISA-Tests durchgeführt Elafin entsprechend Hersteller-Protokoll (mit Volumina eingestellt für Halb-Well-Platten), und die optische Dichte eines jeden Wells liest unter Verwendung eines Plattenlesegeräts auf 450-570 nm ist, und die Daten gespeichert und analysiert.
7. Experiment Day 2: TNFR1 ELISA
- 25 ul 1% BSA in PBS wird dem 01.20 Geberplattenteil (jetzt mit 100 ul Plasma 1.20) zu 125 ul verdünnte 1.25 Plasma zu erhalten zugesetzt werden.
- Der ELISA ist TNFR1 pro Hersteller-Protokoll abgeschlossen (mit Volumina für Halb-Well-Platten eingestellt) und die optische Dichte eines jeden Wells liest unter Verwendung eines Plattenlesegeräts auf 450-570 nm ist, und die Daten gespeichert und analysiert.
8. Experiment Tag 2: IL-8 ELISA
- 60 ul von 1:2 verdünnte Plasma wird zu einer neuen Quelle Platte überführt und anschließend 180 ul IL-8 Verdünnungsmittel zu jeder Vertiefung zugegeben, um eine verdünnte 1.06 Plasmaquelle Platte zu machen.
- Die IL-8 ELISA ist je Hersteller-Protokoll abgeschlossen (mit Volumina für Halb-Well-Platten eingestellt) und die optische Dichte eines jeden Wells liest unter Verwendung eines Plattenlesegeräts auf 450-570 nm ist, und die Daten gespeichert und analysiert.
Sobald alle ELISAs abgeschlossen sind, Nichtbenutzungd Lager Plasma werden in die Aliquots aufgetaut ersetzt werden und zur späteren Verwendung eingefroren.
Ergebnisse
Der Biomarker Workflow und Timeline sind in Tabelle 1 und Tabelle 2 aufgeführt sind. Einmal vollendet, Konzentrationen von 6 verschiedenen Proteinen sind jetzt auf dem gleichen Plasmaprobe quantifiziert worden mit insgesamt 150 ul des Plasmas. Ausplattieren der Proben im Doppelansatz pro Test ermöglicht für die interne Qualitätssicherung, mit CV weniger als 10% als optimal. Wenn die Durchführung der sequenziellen ELISA auf mehreren Platten, konsistente optische Dichten von dem hohen Standard bevorzugt und ermöglichen eine bessere inter-Platte Zuverlässigkeit der Messungen; Standardkurve ODs können zwischen den Platten verglichen werden, um zu sehen zu beurteilen für Inkonsistenz in ELISA Leistung (Abbildung 2). Entwicklungszeiten mit Tetramethylbenzidin kolorimetrischen Substrat und hohe Konzentration ODs beobachtet für jede Biomarker in unserem Labor sind in Tabelle 3 aufgeführt.
tp_upload/4247/4247fig1.jpg "alt =" Abbildung 1 "/>
Abbildung 1. Workflow für IL-2Rα, REG3α und HGF ELISAs. Nachdem die Plasmaproben auf die IL-2Rα ELISA Testplatten überzogen worden sind sie zurückgefordert zu einer Verwässerung Quelle Platten für andere ELISAs machen. Für die HGF ELISA wird das Plasma zurückgefordert, um die 1:6 Verdünnung Platte für IL-8 vorzubereiten. Klicken Sie hier für eine größere Abbildung .
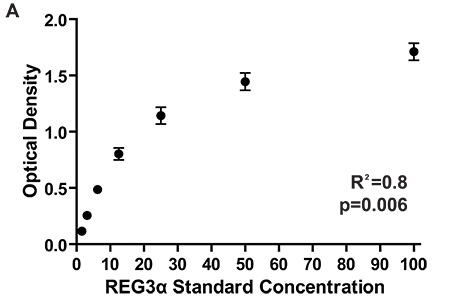
Abbildung 2. Optische Dichten für die Standardkurve von 7 verschiedenen ELISA-Platten messen REG3α Konzentrationen entsprechend den 1084 Patienten für die erste REG3α GI GVHD Biomarker Bericht 3 getestet. Konsequente ODs zwischen den Platten zu gewährleisten konsistente Proteinkonzentration Messungen zwischen den Platten. Konzentrationen von Proteinenin Plasmaproben Probe durch Vergleichen der optischen Dichten Standardkurve optischen Dichten berechnet.
| Experiment Tag 0 | Ein. Bereiten Sie die Proben |
| 2. IL-2Rα, HGF und REG3α capture Ab | |
| Experiment Tag 1 | Ein. IL-2RαELISA |
| 2. REG3αELISA | |
| 3. HGF ELISA (durch die Probe plating) | |
| 4. Elafin und TNFR capture Ab | |
| Experiment Tag 2 | Ein. HGF ELISA Abschluss |
| 2. Elafin ELISA | |
| 3. TNFR1 ELISA | |
| 4. IL-8 ELISA | |
| 5. Auffrieren ungenutztenPlasma |
Tabelle 1. GVHD Biomarker Workflow-Übersicht
| Tag 0 | Probenvorbereitung und Übernachtung capture Körper Inkubationszeit | ||||||
| ELISA | IL-2Rα | REG3α | HGF | Elafin | TNFR1 | IL-8 | |
| Zeit (hr) | 0,0 | Blockierung | |||||
| 1,0 | Proben Plated | ||||||
| 3,0 | Reclaim Plasmaproben; Erkennung Ab | Blocking; Prepare Samples (1:10 Verdünnung) | |||||
| 4,0 | Proben plated (1:10) | ||||||
| 5,0 | Streptavidin-HRP | Erkennung Ab | |||||
| 5,5 | TMB | Streptavidin-HRP | |||||
| 6,0 | Platte Lesen | TMB | Blocking; Prepare Proben (1:2 Verdünnung) | ||||
| 6,5 | Platte Lesen | ||||||
| 7,0 | Proben plated (1:2) | Erfassen Ab (Inkubation über Nacht) | Erfassen Ab (Inkubation über Nacht) | ||||
| Tag 2 | |||||||
| Zeit (hr) | 0,0 | Reclaim Plasma-Erkennung Ab | Blocking; Prepare Proben (1:20) | ||||
| 1,0 | Beispiel plating (1:2) | Blocking; weitere Verdünnung von 1:20 Proben bis 1:25 Verdünnung | |||||
| 2,0 | HRP | Beispiel plating (1:25) | |||||
| 2,5 | TMB | ||||||
| 3,0 | Platte Lesen | Erkennung Ab | |||||
| 3,5 | Bereiten Sie die Proben (1:6 Verdünnung) | ||||||
| 4,0 | Erkennung Ab | Beispiel plating (1:6) | |||||
| 5,0 | HRP | ||||||
| 5,5 | TMB | ||||||
| 6,0 | Platte Lesen | HRP | Erkennung Ab | ||||
| TMB | |||||||
| 7,0 | Platte Lesen | TMB | |||||
| 7,5 | Platte Lesen | ||||||
| Nach Beendigung | Ersetzen Source Plasma in Aliquots und einfrieren für eine spätere Verwendung | ||||||
Tabelle 2. Zeitplan für die Durchführung ELISAs.
| Plasma Verdünnungsfaktor | High Standard Concentration | Substrat Entwicklungszeit (min) | Hohe OD | Kurve | |
| IL-2Rα | 01.01 | 2000 pg / ml | 5 | 1 | Linear |
| HGF | 01.02 | 4.000 pg / ml | 22 | 2,1 | 4-Parameter |
| IL-8 | 01.06 | 200 pg / ml | 12 | 2,7 | 4-Parameter |
| REG3α | 01.10 | 100 ng / ml | 12 | 1,7 | 4-Parameter |
| Elafin | 01.20 | 2000 pg / ml | 20 | 1,9 | 4-Parameter |
| TNFR1 | 01.25 | 800 pg / ml | 8 | 2,7 | Linear |
Tabelle 3. ELISA Details für 6 GVHD Biomarker.
Diskussion
Die sequentielle ELISA hier vorgestellte Verfahren erlaubt eine Messung mehrerer Plasmaproteinen auf kleine Volumina von Plasma was schwierig sein kann zu erhalten, und / oder unersetzlichen wie Proben von Probanden mit der seltenen Erkrankungen oder Plasmaproben von Mäusen 9,10 erhalten. Die sequentiellen ELISAs werden typischerweise in der Reihenfolge der zunehmenden Plasmaverdünnung Faktor durchgeführt, mit ELISAs erfordern verdünnte Plasma ≥ 1:10 typischerweise nicht zu müssen aufgearbeitet werden, obwohl dies kann, falls gewünscht. Die Fähigkeit zur sequentiellen ELISA durchzuführen durch ELISA Kits / Protokolle in dem das Plasma mit anderen Reagenzien gemischt wird oder bei denen unterschiedliche Verdünnung Puffer für das Plasma benötigt begrenzt, dies schließt die ablility zur Wiederverwendung einer Probe aufgrund von Bedenken, dass eine inkompatible Puffer / Reagenz wird mit der Leistung eines bestimmten Tests stören. Bei sorgfältiger Planung kann 10 oder mehr ELISAs auf der gleichen Plasmaprobe durchgeführt werden.
ent "> Individuelle Labors müssen möglicherweise Plasmaverdünnungen anzupassen, um interpretierbare Ergebnisse auf erwartete Plasma-Konzentrationen des Proteins von Interesse in den Proben aus der Probanden basiert. Unterschiede in der Laborausrüstung kann in der Notwendigkeit führen, um die Inkubation und kolorimetrischen Entwicklung zu optimieren Zeiten, Anzahl der Wäschen und / oder waschen Haltezeiten um jede gegebene ELISA optimieren.Um hohe Durchsatzleistung und die Genauigkeit zu erhöhen und eine Untersuchung in kostengünstiger Weise durchzuführen, ist die Verwendung eines robotischen Liquid Handling Plattform fähig Analyse auf 384 Well Platten und einem automatisierten Tellerscheibe mit Stapeleinheit empfohlen. Dieses Gerät kann die Genauigkeit und Präzision der Analyse von mehreren Benutzern durchgeführt und helfen Konsistenz der Analyse inter-und intra-Assay-Variation zu reduzieren.
Wir verwendeten sequenziellen ELISA über verfügbare Multiplex-Plattformen für zwei Gründe: 1) Die meisten derAntikörper-Paare für neue Proteine können nicht leicht konjugiert werden auf Kügelchen oder einem anderen Material als auch zeitaufwendig und teuer, 2) einzelne ELISAs sind genauer als Multiplex-Mikroarray oder Kügelchen, sekundär zu einer Abwesenheit von Kreuzreaktivität 11. Wenn eine zuverlässige Methode hergestellt in gemultiplexte, wulst-basierten Microarrays durchzuführen, kann es in der Lage sein, um die sequentielle ELISA-Verfahren zu ersetzen, sondern kann durch die Möglichkeit, die Antikörper an Kügelchen und / oder konjugiert mit der Anzahl der gewünschten Proteine zu begrenzen analysiert.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Unterstützt durch NIH Zuschüsse RC1-HL-101102, P01-CA039542, T32-HL007622, der Hartwell-Stiftung, und der Doris Duke Charitable Foundation. Dr. Paczesny ist ein Ermittler der Eric Hartwell Fonds und Amy Strelzer Manasevit Research Program.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare |
| Menschliches IL-2 R alpha Duoset | R & D Systems | DY223 | |
| Menschliche HGF Duoset | R & D Systems | DY294 | |
| Human IL-8 OptEIA KIT II | Becton Dickinson | 550999 | |
| Ab-Match ASSEMBLY Menschliche PAP1 (REG3α) Kit | MBL International | 5323 | |
| Ab-Match UNIVERSAL Kit | MBL International | 5310 | |
| Menschliche sTNFRI/TNFRSF1A Duoset | R & D Systems | DY225 | |
| Menschliche Trappin-2/Elafin Duoset | R & D Systammt | DY1747 | |
| 96-well Polystyrol konischen Boden Platten | Thermo Scientific | 249570 | Wird für Plasmaquelle Platten |
| Costar half-well high-bindenden 96-Well-Platten | Corning | 3690 | Für IL-2Rα, HGF, TNFR1 und Elafin ELISAs |
| Nunc 384-well Platten MaxiSorp | Nunc | 464718 | Für REG3α Elisa |
| HyClone Phosphate Buffered Saline, 1x | Thermo Scientific | SH30256.02 | |
| Bovine Serum Albumin, Fraktion V, Heat Shock Behandelte | Fisher Scientific | BP1600-100 | |
| Blocker BLOTTO in TBS | Thermo Scientific | 37530 | Blockierungsmittel für IL-2Rα HGF und TNFR1 ELISAs |
| DulbeccosPhosphat-gepufferte Kochsalzlösung | Gibco | 21600-069 | Waschpuffer für IL-2Rα, HGF, Elafin und TNFR1 ELISAs |
| TMB Peroxide Susbtrate | Kirkegaard und Perry Laboratories | 50-76-00 | |
| Tween 20 | Acros Organics | 233362500 | Waschpuffer für IL-2Rα, HGF, Elafin und TNFR1 ELISAs |
| Schwefelsäure | Sigma-Aldrich | 84720 | (Verdünnt auf 2N) für Stop-Lösung |
Referenzen
- Paczesny, S. A biomarker panel for acute graft-versus-host disease. Blood. 113, 273-278 (2009).
- Paczesny, S. Elafin is a biomarker of graft-versus-host disease of the skin. Science Translational Medicine. 2, 13ra12 (2010).
- Ferrara, J. L. Regenerating islet-derived 3 alpha is a biomarker of gastrointestinal graft-versus-host disease. Blood. , (2011).
- Ferrara, J. L., Levine, J. E., Reddy, P. Graft-versus-host disease. Lancet. 373, 1550-1561 (2009).
- Miyamoto, T. Serum concentration of the soluble interleukin-2 receptor for monitoring acute graft-versus-host disease. Bone Marrow Transpl. 17, 185-190 (1996).
- Holler, E. Role of tumor necrosis factor alpha in acute graft-versus-host disease and complications following allogeneic bone marrow transplantation. Transplant. Proc. 25, 1234-1236 (1993).
- Okamoto, T. Increased hepatocyte growth factor in serum in acute graft-versus-host disease. Bone Marrow Transpl. 28, 197-200 (2001).
- Uguccioni, M. Elevated interleukin-8 serum concentrations in beta-thalassemia and graft-versus-host disease. Blood. 81, 2252-2256 (1993).
- Osuchowski, M. F., Siddiqui, J., Copeland, S., Remick, D. G. Sequential ELISA to profile multiple cytokines from small volumes. J. Immunol. Methods. 302, 172-181 (2005).
- Osuchowski, M. F., Remick, D. G. The repetitive use of samples to measure multiple cytokines: the sequential ELISA. Methods. 38, 304-311 (2006).
- Schweitzer, B. Multiplexed protein profiling on microarrays by rolling-circle amplification. Nat. Biotechnol. 20, 359-365 (2002).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten