Method Article
Высокая пропускная способность последовательного ELISA для проверки биомаркеров острого трансплантат против хозяина
В этой статье
Резюме
Высокая пропускная проверки нескольких биомаркеров кандидат может быть выполнена последовательная ELISA для того, чтобы свести к минимуму циклов замораживания / оттаивания и использования драгоценных образцов плазмы. Здесь мы покажем, как последовательно выполнять ИФА для шести различных подтверждено биомаркеров плазмы 1-3 Трансплантат против хозяина (РТПХ) 4 На том же образце плазмы.
Аннотация
Объективные открытие протеомики стратегии есть потенциал, чтобы идентифицировать большое количество новых биомаркеров, которые могут улучшить результаты диагностики и тестирования в клинических условиях и может помочь руководство терапевтических вмешательств. Когда большое число кандидатов белков определены, это может быть трудным для проверки кандидатов биомаркеров в своевременном и эффективном моды от пациента образцы плазмы, которые событию, конечный объем и незаменимы, например, в начале острой трансплантат-против- хозяина (РТПХ), потенциально опасное для жизни осложнение аллогенной трансплантации гемопоэтических стволовых клеток (ГСК).
Здесь мы опишем процесс выполнения коммерчески доступных ИФА в течение шести подтверждено GVHD белков: IL-2Rα 5, TNFR1 6, HGF 7, IL-8 8, elafin 2, и REG3α 3 (также известная как PAP1) в последовательном моды свести к минимуму циклов замораживания-оттаивания, Талые время плазмы и плазменные использования. Для этой процедуры мы проводим ИФА в последовательном порядке, как это определено образца коэффициент разбавления, установленный в нашей лаборатории с помощью ELISA производитель наборов и протоколов с незначительными изменениями для облегчения оптимального последовательного исполнения ELISA. В результате концентрация в плазме крови биомаркеров могут быть обобщены и проанализированы значительные результаты в когорте пациентов. Хотя эти биомаркеры в настоящее время только для исследовательских целей, их включение в медицинской помощи в настоящее время изучается в клинических испытаниях.
Этот метод может быть применен для выполнения ИФА для нескольких белков / цитокинов проценты по той же выборке (ы), при условии образцы не должны быть смешаны с другими реагентами. Если ИФА комплекты не поставляются с предварительно покрытых пластинами, 96-а полу-луночные планшеты или 384-луночных планшетов могут быть использованы для дальнейшей минимизации использования образцов / реагентов.
Введение
Острый трансплантат против хозяина (РТПХ), одной из ведущих причин, не рецидив смертности (NRM) после аллогенной трансплантации гемопоэтических стволовых клеток (ГСК), измеряется в трех дисфункции органов и систем: кожи, печени и желудочно-кишечного тракта (ЖКТ) тракта 4. Острая РТПХ обычно происходит от двух до восьми недель после пересадки, но может произойти позже, и часто клинически неотличимые от других пост-ТГСК осложнений, таких как режим кондиционирования токсичности, инфекции или побочные эффекты лечения. Благодаря использованию протеомных стратегии и высокой пропускной проверку с помощью последовательного ELISA, мы определили 6 белков, концентрация которых повышена в начале клинических проявлений РТПХ. IL-2Rα, TNFR1, HGF и IL-8, когда объединены в 4-биомаркеров панели могут диагностировать РТПХ в начале клинических симптомов и может предсказать, после ТГСК выживания независимо от тяжести GVHD 1. Elafin, биомаркеров для GVHD из SKВ, могут различать GVHD сыпь и высыпания от других причин, таких как наркотики извержений и не может предсказать выживания пересадки 2. Недавно мы определили REG3α в качестве биомаркеров РТПХ нижнего желудочно-кишечного тракта, органов-мишеней всего связаны с природными ресурсами. Плазменные REG3α концентрации может надежно идентифицировать РТПХ в качестве причины для пост-ТГСК диарея и коррелируют с гистологической тяжести GVHD по диагностике кишечной биопсии. REG3α концентрации на начало GI GVHD также может предсказать реакции на трансплантат против хозяина терапии и NRM 3. Включение этих подтверждено GVHD биомаркеров в клинической помощи в настоящее время изучается в клинических испытаниях.
Эти эксперименты проводились на небольшие аликвоты плазмы полученная от пациентов, получающих ГСК между 2000 и 2010 во время наступления GVHD, которые являются незаменимыми и ограниченном количестве. В связи с драгоценной природы этих образцов, мы разработали встретилисьХод измерения концентрации нескольких белков плазмы в эффективную, воспроизводимым способом ликвидации избыточных циклов замораживания-оттаивания, оттепель времени и плазменные использования. Этот метод может быть применен для выполнения ИФА для нескольких белков / цитокинов проценты по той же выборке (ы), при условии образцы не должны быть смешаны с другими реагентами. Если ИФА комплекты не поставляются с предварительно покрытых пластинами, 96-а полу-луночные планшеты или 384-луночных планшетов могут быть использованы для дальнейшей минимизации использования образцов / реагентов. Эта рукопись фокусируется на технологических аспектах измерения GVHD биомаркеров.
протокол
1. Эксперимент День 0: Подготовка проб и ИФА тест плиты покрытия с Capture антитела к IL-2Rα, REG3α и HGF
- Плазменные аликвоты образцов для анализа будут выведены, оттаивают и центрифугируют при 12000 оборотов в минуту в течение 10 мин для отделения сгустков на дне и липидов на верхнем из плазмы. 150 мкл неразбавленного плазмы будут покрыты из каждого образца на 96-и V-нижняя пластина (источник пластины) ручной пипетки в соответствии с предопределенными карты. Аликвоты будут завернуты в парафильмом и держали во влажной камере при температуре 4 ° C в течение всего процесса; не более 72 часов.
- IL-2Rα и антител HGF захвата будет преобразован и разбавляют согласно спецификации производителя, и 50 мкл будут покрыты в каждую лунку соответствующего 96-а высоких обязательного половину и пластин, которые затем закрывают и инкубируют в течение ночи при 4 ° C. Кроме того, многие плиты могут быть высушены при 37 ° С и хранят при 4 ° C для дальнейшего использования, зависитING на стабильность белка.
- REG3α антител захвата будет разбавлять в зависимости от производителя протокол, используя производитель буферном покрытии и 25 мкл будет помещают в каждую лунку 384-а Nunc Maxi-SORP пластину, которая затем закрывают и инкубируют в течение ночи при 4 ° C.
2. Эксперимент День 1: IL-2Rα ELISA (рис. 1)
- IL-2Rα испытательной пластины промывают, их с Blotto в TBS, и стандартный восстанавливается и 8-точки калибровочной кривой готовят на производителя протокол.
- После промывания планшета после блокирования шагом 50 мкл неразбавленного плазмы покрытием в двух экземплярах от источника пластины к пластине ИФА, и 50 мкл каждого стандарта покрытием в двух экземплярах. Пластина запечатаны и выдерживают в течение 2 ч при комнатной температуре на тарелку ротатор установлен на 300 оборотов в минуту.
- Плазма отвоеванной у Ил-2Rα пластины теста ELISA и помещен обратно в ООНразбавляют пластины источника плазмы. ELISA завершена на производителя протокол (с учетом объемов половины луночных) и оптическую плотность каждой лунки будет читать с помощью набора пластин читателя 450-570 нм, а данные сохранены и проанализированы.
3. Эксперимент День 1: REG3α ELISA (рис. 1)
- 10 мкл неразбавленного плазмы будут переведены в отдельный V-дно источника пластины. 90 мкл производителя при условии разбавления буфера в каждую лунку добавляют для создания 1:10 пластины источника разведения.
- REG3α ELISA осуществляется на производителя протокол (с поправкой на объемы 384-луночных) и оптическую плотность каждой лунки будет читать с помощью ридер установлен на 450-620 нм, и данные будут сохранены и проанализированы.
4. Эксперимент День 1: Elafin и TNFR1 Тест плиты покрытия с Capture антител
- Elafin и антител TNFR1 захвата будет воссоздана и разбавленнойраспределенными в соответствии со спецификацией производителя и 50 мкл будут покрыты в каждую лунку соответствующего 96-а высоких обязательного полу-луночные планшеты, которые затем закрывают и инкубируют в течение ночи при комнатной температуре Elafin, а при 4 ° С в течение TNFR1.
5. Эксперимент День 1-2: HGF ELISA (рис. 1)
- После завершения Ил-2Rα ELISA и обеспечения теста не нужно повторять по 60 мкл неразбавленного плазма будет передана в новую пластину источника, а затем 60 мкл 1% BSA в 1 х PBS добавляют в каждую лунку, чтобы 1:02 разбавленного пластины источника плазмы.
- Пластина HGF теста промывают, их с Blotto в TBS, и стандартный восстанавливается и 8-точки калибровочной кривой готовят на производителя протокол.
- После промывания планшета после блокировки шаг, 50 мкл разбавленного 1:2, плазма покрытием в двух экземплярах на тарелку ИФА, и 50 мкл каждого стандарта покрытием в двух экземплярах. Пластина запечатаны иинкубировали в течение ночи при комнатной температуре на тарелку ротатор установлен на 300 RPM.
- 1:02 разбавленной плазмы будет освобожден от испытательной пластины HGF ИФА и помещен обратно в 1:02 разбавленного пластины источника плазмы. ELISA завершена на производителя протокол (с учетом объемов половины луночных) и оптическую плотность каждой лунки будет читать с помощью набора пластин читателя 450-570 нм, а данные сохранены и проанализированы.
6. Эксперимент День 2: Elafin ELISA
- 10 мкл неразбавленного плазмы будут переведены на новую пластину источника, а затем 190 мкл 1% BSA в 1 х PBS будет добавлена в каждую лунку, чтобы сделать 200 мкл плазмы dluted 1:20.
- Elafin ELISA, как выполняется в соответствии с протоколом производителя (с учетом объемов полу-луночные планшеты), а оптическая плотность каждой лунки будет читать с помощью ридер установлен на 450-570 нм, а данные сохранены и проанализированы.
7. Эксперимент DaУ 2: TNFR1 ELISA
- 25 мкл 1% BSA в PBS будет добавлена к пластине 1:20 источников (в настоящее время, содержащей 100 мкл плазмы 1:20), чтобы получить 125 мкл разбавленной 1:25 плазмы.
- TNFR1 ELISA завершена на производителя протокол (с поправкой на объемы полу-луночных) и оптическую плотность каждой лунки будет читать с помощью ридер установлен на 450-570 нм, а данные сохранены и проанализированы.
8. Эксперимент День 2: IL-8 ELISA
- 60 мкл разбавленного 1:2, плазма будет передана в новую пластину источника, а затем 180 мкл IL-8 разбавителя в каждую лунку добавляют, чтобы сделать разбавленный 1:06 пластины источника плазмы.
- IL-8 ELISA завершена на производителя протокол (с поправкой на объемы полу-луночных) и оптическую плотность каждой лунки будет читать с помощью ридер установлен на 450-570 нм, а данные сохранены и проанализированы.
После того как все ИФА были завершены, unuseD складе плазмы будут заменены в талой аликвоты и замораживали для дальнейшего использования.
Результаты
Рабочий процесс биомаркеров и сроки, подробно изложены в таблицах 1 и 2, соответственно. После завершения концентрации 6 различных белков в настоящее время количественные на том же образце плазмы с помощью общей сложности 150 мкл плазмы. Покрывая образцов в двух экземплярах на тест позволяет для внутреннего контроля качества, с менее чем 10% CV в оптимальных. При выполнении последовательных ELISA на нескольких пластинах, в соответствии оптической плотности высокого уровня являются предпочтительными и обеспечить улучшение взаимодействия пластины надежность измерений; стандартной кривой ОР могут быть сопоставлены между пластинами, чтобы посмотреть оценки за непоследовательность в ИФА производительности (рис. 2). Развитие раз, используя тетраметилбензидина колориметрического субстрата и высокая концентрация наблюдается ОР для каждой биомаркеров в нашей лаборатории, приведены в таблице 3.
tp_upload/4247/4247fig1.jpg "ALT =" Рисунок 1 "/>
Рисунок 1. Workflow для Ил-2Rα, REG3α и HGF ELISA. После того, как образцы плазмы были покрыты на Ил-2Rα пластин ИФА он будет утилизирован, чтобы сделать разведение пластин источником для других ELISA. Для HGF ELISA, плазма будет утилизирован подготовить 1:06 разбавление пластины для IL-8. Нажмите для увеличения рисунка .
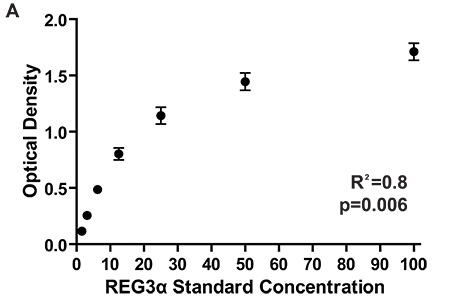
Рисунок 2. Оптических плотностей для стандартной кривой 7 различных пластины ELISA измерения REG3α концентрациях, соответствующих 1084 обследованных пациентов на начальном REG3α GI GVHD биомаркеров доклада 3. В соответствии ОРВ между пластинами обеспечения последовательного измерения концентрации белка между пластинами. Концентрации белкаВ образцах плазмы рассчитывается путем сравнения оптической плотности образца в стандартной кривой оптической плотности.
| Эксперимент день 0 | 1. Подготовка образцов |
| 2. IL-2Rα, HGF и REG3α захвата Ab | |
| Эксперимент День 1 | 1. IL-2RαELISA |
| 2. REG3αELISA | |
| 3. HGF ИФА (через образец покрытия) | |
| 4. Elafin и TNFR захвата Ab | |
| Эксперимент 2-й день | 1. HGF ELISA завершению |
| 2. Elafin ELISA | |
| 3. TNFR1 ELISA | |
| 4. IL-8 ELISA | |
| 5. Заморозить неиспользованнуюплазма |
Таблица 1. GVHD биомаркеров Workflow обзор
| День 0 | Подготовка проб и инкубации в течение ночи тело захвата | ||||||
| ELISA | IL-2Rα | REG3α | HGF | Elafin | TNFR1 | IL-8 | |
| Время (ч) | 0,0 | Блокирование | |||||
| 1,0 | Образцы Металлизированное | ||||||
| 3,0 | Возвращается образцы плазмы; обнаружения Ab | Блокировка; подготовки проб (1:10) | |||||
| 4,0 | Образцы покрытием (1:10) | ||||||
| 5,0 | Стрептавидин-HRP | Обнаружение Ab | |||||
| 5,5 | TMB | Стрептавидин-HRP | |||||
| 6,0 | Плита чтения | TMB | Блокировка, подготовка образцов (1:2 разбавление) | ||||
| 6,5 | Плита чтения | ||||||
| 7,0 | Образцы покрытием (1:2) | Захват Ab (инкубации в течение ночи) | Захват Ab (инкубации в течение ночи) | ||||
| День 2 | |||||||
| Время (ч) | 0,0 | Возвращается плазма, обнаружение Ab | Блокировка, подготовка образцов (1:20) | ||||
| 1,0 | Примеры покрытий (1:2) | Блокировка; Дальнейшее разбавление 1:20 до 1:25 образцы разбавления | |||||
| 2,0 | HRP | Примеры покрытий (1:25) | |||||
| 2,5 | TMB | ||||||
| 3,0 | Плита чтения | Обнаружение Ab | |||||
| 3,5 | Подготовка образцов (1:6 разбавление) | ||||||
| 4,0 | Обнаружение Ab | Примеры покрытий (1:6) | |||||
| 5,0 | HRP | ||||||
| 5,5 | TMB | ||||||
| 6,0 | Плита чтения | HRP | Обнаружение Ab | ||||
| TMB | |||||||
| 7,0 | Плита чтения | TMB | |||||
| 7,5 | Плита чтении | ||||||
| После завершения | Заменить источник плазмы на аликвоты и заморозить для дальнейшего использования | ||||||
Таблица 2. Сроки выполнения ИФА.
| Плазменные Коэффициент разведения | Высокий стандарт концентрации | Субстрат Развитие Время (мин) | Высокая OD | Кривая | |
| IL-2Rα | 1:01 | 2000 пг / мл | 5 | 1 | Линейный |
| HGF | 1:02 | 4000 пг / мл | 22 | 2,1 | 4-параметр |
| IL-8 | 1:06 | 200 пг / мл | 12 | 2,7 | 4-параметр |
| REG3α | 1:10 | 100 нг / мл | 12 | 1,7 | 4-параметр |
| Elafin | 1:20 | 2000 пг / мл | 20 | 1,9 | 4-параметр |
| TNFR1 | 1:25 | 800 пг / мл | 8 | 2,7 | Линейный |
Таблица 3. ELISA Подробности на 6 GVHD биомаркеров.
Обсуждение
Последовательный метод ИФА, представленные здесь позволяет производить измерения нескольких белков плазмы на малых объемах плазмы, которая может быть трудно получить и / или незаменимые, такие как образцы человеческих пациентов с редкими заболеваниями или плазму образцов, полученных от мышей 9,10. Последовательное ИФА, как правило, осуществляется в порядке возрастания фактора разбавления плазмы, с ИФА требует плазме разбавленной ≥ 1:10 правило, не нуждаются в утилизирован, хотя это можно сделать при желании. Способность выполнять последовательные ELISA ограничен ИФА / протоколы, в которых плазма смешивается с другими реагентами или для которых разведение различных буферов, необходимых для плазмы; это исключает ablility повторно использовать образец из-за опасений, что несовместима Буфер / реагента будет вмешиваться в выполнение конкретного теста. При тщательном планировании, 10 или более ИФА может быть выполнена на том же образце плазмы.
ENT "> Индивидуальные лаборатории может потребоваться настроить плазмы разведения, чтобы иметь интерпретируемые результаты, основанные на ожидаемых концентрациях в плазме крови белка в образцах из испытуемых. Различия в лабораторном оборудовании может привести к необходимости оптимизации инкубации и колориметрических развития раза, количество промываний и / или мытья замочить раз для того, чтобы оптимизировать любой ELISA.Для увеличения высокой пропускной способности и точности, и для выполнения анализов в экономически эффективным образом, использование роботов жидкость платформа обработки позволяет проводить анализ на 384-луночные планшеты и автоматизированная машина плита с укладки блока рекомендуется. Это оборудование может повысить достоверность и точность анализа, проведенного несколькими пользователями, и поможет обеспечить согласованность анализа для снижения меж-и внутри-анализ вариаций.
Мы использовали последовательное ELISA более доступные платформы мультиплексирования по двум причинам: 1) большинствоантитела пар для новых белков не может легко быть сопряжены с бисером или других материалов, а также трудоемким и дорогим, 2) отдельных ИФА являются более точными, чем микрочипов мультиплекс или бисером, вторичной по отношению к отсутствие перекрестной реактивности 11. Если надежный метод создан для выполнения мультиплексированных, шарик на основе микрочипов, это может быть в состоянии заменить последовательный процесс ELISA, но может быть ограничена возможность сопряженные антитела к бисера и / или по количеству белков желал быть проанализированы.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Поддерживается гранты NIH RC1-HL-101102, P01-CA039542, T32-HL007622, Хартвелл Фонда, и Дорис Дьюк благотворительный фонд. Доктор Paczesny является следователь Эрик Hartwell фонда и Эми Strelzer Manasevit исследовательской программы.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | Комментарии |
| Человека IL-2 R альфа DuoSet | R & D Systems | DY223 | |
| HGF человека DuoSet | R & D Systems | DY294 | |
| Человека IL-8 OptEIA KIT II | Becton Dickinson | 550999 | |
| Ab-Match АССАМБЛЕИ человека PAP1 (REG3α) Kit | MBL Международного | 5323 | |
| Ab-Match универсальный комплект | MBL Международного | 5310 | |
| Человека sTNFRI/TNFRSF1A DuoSet | R & D Systems | DY225 | |
| Человека Trappin-2/Elafin DuoSet | R & D Syстебли | DY1747 | |
| 96-луночные полистирола конической нижней пластины | Thermo Scientific | 249570 | Используется для пластин источника плазмы |
| Costar половину и высокой обязательной 96-луночные | Гранулирование | 3690 | Для Ил-2Rα, HGF, TNFR1 и elafin ИФА |
| Nunc 384-а MaxiSorp пластин | Nunc | 464718 | Для REG3α Elisa |
| HyClone фосфатным буферным раствором, 1x | Thermo Scientific | SH30256.02 | |
| Бычьего сывороточного альбумина, доля V, Heat Shock Обработанная | Fisher Scientific | BP1600-100 | |
| Blocker Blotto в TBS | Thermo Scientific | 37530 | Блокирующий агент для Ил-2Rα HGF и TNFR1 ИФА |
| ДульбеккоФосфатно-солевой буфер | Gibco | 21600-069 | Промывочный буфер для Ил-2Rα, HGF, Elafin и TNFR1 ИФА |
| TMB Susbtrate Перекись | Kirkegaard и Perry Laboratories | 50-76-00 | |
| Tween 20 | Acros Organics | 233362500 | Промывочный буфер для Ил-2Rα, HGF, Elafin и TNFR1 ИФА |
| Серная кислота | Sigma-Aldrich | 84720 | (Разбавленный до 2N) для остановки решения |
Ссылки
- Paczesny, S. A biomarker panel for acute graft-versus-host disease. Blood. 113, 273-278 (2009).
- Paczesny, S. Elafin is a biomarker of graft-versus-host disease of the skin. Science Translational Medicine. 2, 13ra12 (2010).
- Ferrara, J. L. Regenerating islet-derived 3 alpha is a biomarker of gastrointestinal graft-versus-host disease. Blood. , (2011).
- Ferrara, J. L., Levine, J. E., Reddy, P. Graft-versus-host disease. Lancet. 373, 1550-1561 (2009).
- Miyamoto, T. Serum concentration of the soluble interleukin-2 receptor for monitoring acute graft-versus-host disease. Bone Marrow Transpl. 17, 185-190 (1996).
- Holler, E. Role of tumor necrosis factor alpha in acute graft-versus-host disease and complications following allogeneic bone marrow transplantation. Transplant. Proc. 25, 1234-1236 (1993).
- Okamoto, T. Increased hepatocyte growth factor in serum in acute graft-versus-host disease. Bone Marrow Transpl. 28, 197-200 (2001).
- Uguccioni, M. Elevated interleukin-8 serum concentrations in beta-thalassemia and graft-versus-host disease. Blood. 81, 2252-2256 (1993).
- Osuchowski, M. F., Siddiqui, J., Copeland, S., Remick, D. G. Sequential ELISA to profile multiple cytokines from small volumes. J. Immunol. Methods. 302, 172-181 (2005).
- Osuchowski, M. F., Remick, D. G. The repetitive use of samples to measure multiple cytokines: the sequential ELISA. Methods. 38, 304-311 (2006).
- Schweitzer, B. Multiplexed protein profiling on microarrays by rolling-circle amplification. Nat. Biotechnol. 20, 359-365 (2002).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены