Method Article
Haut débit séquentiel ELISA pour la validation des biomarqueurs de réaction aiguë du greffon contre l'hôte
Dans cet article
Résumé
Validation à haut débit de biomarqueurs multiples peut être effectuée par ELISA séquentielle afin de minimiser les cycles gel / dégel et à utiliser des échantillons de plasma précieux. Ici, nous montrons comment réaliser de manière séquentielle ELISA pour six différents biomarqueurs plasmatiques validées 03.01 La réaction du greffon contre l'hôte (GVHD) 4 Sur le même échantillon de plasma.
Résumé
Impartiales protéomique de découverte stratégies ont le potentiel d'identifier un grand nombre de nouveaux biomarqueurs qui peuvent améliorer les tests de diagnostic et de pronostic dans un contexte clinique et peut aider à guider les interventions thérapeutiques. Lorsqu'un grand nombre de protéines candidates sont identifiées, il peut être difficile de valider des biomarqueurs candidats en temps opportun et efficace des échantillons plasmatiques de patients qui sont event-driven, de volume fini et irremplaçable, comme au début de la réaction aiguë du greffon contre l' greffon contre l'hôte (GVHD), une complication potentiellement mortelle de l'allogreffe de cellules souches hématopoïétiques (HSCT).
Ici, nous décrivons le processus d'exécution ELISA disponibles dans le commerce pour six protéines validées GVHD: IL-2Rα 5, TNFR1 6, HGF 7, IL-8 8, élafine 2 et REG3α 3 (également connu sous le nom PAP1) de manière séquentielle afin de minimiser cycles gel-dégel, Décongelés temps de plasma et de l'utilisation du plasma. Pour cette procédure nous effectuons les tests ELISA dans un ordre séquentiel tel que déterminé par le facteur de dilution de l'échantillon comme établi dans notre laboratoire en utilisant fabricant kits ELISA et protocoles avec des ajustements mineurs pour faciliter une performance optimale séquentielle ELISA. Les concentrations plasmatiques des marqueurs biologiques résultant peut ensuite être compilé et analysé des résultats significatifs au sein d'une cohorte de patients. Bien que ces biomarqueurs sont actuellement à des fins de recherche uniquement, leur intégration dans les soins cliniques est actuellement à l'étude dans des essais cliniques.
Cette technique peut être appliquée pour effectuer les tests ELISA pour de multiples protéines / cytokines d'intérêt sur le même échantillon (s) à condition que les échantillons n'ont pas besoin d'être mélangé avec d'autres réactifs. Si kits ELISA ne viennent pas avec des plaques pré-enduites, de 96 puits demi-puits des plaques ou des plaques de 384 puits peuvent être utilisés pour réduire davantage l'utilisation d'échantillons / réactifs.
Introduction
Aiguë du greffon contre l'hôte (GVHD), une des principales causes de la non-récidive de mortalité (NRM) après allogreffe de cellules souches hématopoïétiques (HSCT), est mesurée par un dysfonctionnement dans trois systèmes d'organes: la peau, le foie et gastro-intestinal (GI) voies 4. GVHD aiguë survient généralement entre deux et huit semaines après la greffe, mais peut survenir plus tard, et il est souvent impossible à distinguer cliniquement d'autres complications post-HSCT tels que la toxicité du conditionnement, une infection ou des effets secondaires des médicaments. Grâce à l'utilisation de stratégies protéomiques à haut débit et de validation en utilisant séquentielle ELISA, nous avons identifié 6 protéines dont les concentrations sont élevées au début des manifestations cliniques de GVHD. IL-2Rα, TNFR1, HGF et de l'IL-8, lorsqu'il est combiné à un panneau de 4-biomarqueur peut diagnostiquer GVHD à l'apparition des symptômes cliniques et peut prédire la survie post-greffe de CSH indépendamment de la gravité de la GVHD 1. Élafine, un biomarqueur de GVHD de la sken, peut faire la différence entre une éruption GVHD et une éruption cutanée à d'autres causes telles que les éruptions de drogue et peut prédire la survie de greffe 2. Nous avons récemment identifié REG3α en tant que biomarqueur de la GVHD du tractus gastro-intestinal, l'organe cible le plus associé à la GRN. Plasma REG3α concentration peut identifier de manière fiable GVHD comme la cause de la diarrhée post-greffe de CSH et en corrélation avec la sévérité de la GVHD histologique sur biopsies intestinales de diagnostic. Concentrations REG3α à GI GVH apparition peut également prédire la réponse au traitement et gestion des ressources naturelles GVHD 3. L'incorporation de ces biomarqueurs validés GVHD dans les soins cliniques est actuellement à l'étude dans des essais cliniques.
Ces expériences ont été réalisées sur des aliquotes de plasma petites recueillies auprès des patients recevant HSCT entre 2000 et 2010 au moment de l'apparition de GVHD qui sont irremplaçables et de quantité limitée. En raison de la nature précieuse de ces échantillons, nous avons développé un a rencontréhod de mesurer les concentrations de plusieurs protéines plasmatiques dans une manière efficace et reproductible pour éliminer l'excès de gel-dégel, le temps de décongélation et l'utilisation de plasma. Cette technique peut être appliquée pour effectuer les tests ELISA pour de multiples protéines / cytokines d'intérêt sur le même échantillon (s) à condition que les échantillons n'ont pas besoin d'être mélangé avec d'autres réactifs. Si kits ELISA ne viennent pas avec des plaques pré-enduites, de 96 puits demi-puits des plaques ou des plaques de 384 puits peuvent être utilisés pour réduire davantage l'utilisation d'échantillons / réactifs. Ce manuscrit se concentre sur les aspects technologiques de la mesure de biomarqueurs GVHD.
Protocole
1. 0 Jour Expérience: Préparation des échantillons et revêtement de plaque d'essai ELISA avec anticorps de capture pour l'IL-2Rα, REG3α et le HGF
- Échantillons aliquotes de plasma à analyser seront tirés, décongelé et centrifugé à 12000 rpm pendant 10 min pour séparer les caillots dans le bas et de lipides au-dessus du plasma. 150 ul de plasma non dilué sera plaquée de chaque échantillon sur un 96-V et plaque à fond (plaque de source) par pipetage manuel selon les cartes prédéfinies. Les aliquotes sera enveloppé dans du parafilm et conservée dans une chambre humide à 4 ° C pendant tout le processus, non plus que de 72 heures.
- IL-2Rα et anticorps de capture HGF sera reconstitué et dilué par les spécifications du fabricant et 50 pi seront étalées dans chaque puits d'respectives de 96 puits à haute reliure demi-puits qui sont ensuite scellées et incubées une nuit à 4 ° C. Sinon, de nombreuses plaques peuvent être séchés à 37 ° C et conservé à 4 ° C pour une utilisation ultérieure, dépendenttion sur la stabilité de la protéine.
- Anticorps de capture REG3α seront dilués selon le protocole du fabricant à l'aide du tampon de revêtement fabricant et 25 ul seront déposées dans chaque puits d'une de 384 puits Nunc Maxi-Sorp plaque qui est ensuite scellé et incubé pendant une nuit à 4 ° C.
2. 1 Jour Expérience: IL-2Rα ELISA (Figure 1)
- La plaque d'essai IL-2Rα est lavé, bloqué avec BLOTTO dans du TBS, et la norme est reconstitué et une courbe standard de 8 points est préparé par le protocole du fabricant.
- Après lavage de la plaque après l'étape de blocage, 50 ul de plasma non dilué est plaqué en double exemplaire de la plaque de source à la plaque ELISA, et 50 pi de chaque norme est plaqué en double exemplaire. La plaque est scellée et incubée pendant 2 heures à température ambiante sur un agitateur de microplaques à 300 rpm.
- Le plasma est récupéré à partir de la plaque d'IL-2Rα test ELISA et remis à l'ONUdilué plaque de source de plasma. Le test ELISA est complété par le protocole du fabricant (avec des volumes corrigés des demi-puits) et la densité optique de chaque puits est lue en utilisant un lecteur de plaque ensemble à 450-570 nm, et les données enregistrées et analysées.
3. 1 Jour Expérience: REG3α ELISA (Figure 1)
- 10 ul de plasma non dilué sera transféré à une plaque de source v-fond séparé. 90 ul du fabricant fourni par le tampon de dilution est ajouté à chaque puits pour créer une plaque dilution 1:10 source.
- Le test ELISA REG3α est effectuée par le protocole du fabricant (avec des volumes ajustés pour plaques de 384 puits) et la densité optique de chaque puits est lue en utilisant un lecteur de plaque réglé à 450-620 nm, et les données seront enregistrées et analysées.
4. 1 Jour Expérience: élafine et revêtement de TNFR1 plaque d'essai avec anticorps de capture
- Élafine et anticorps de capture TNFR1 sera reconstitué et diluétribué aux spécifications du fabricant et 50 pi seront étalées dans chaque puits d'respectives de 96 puits à haute reliure demi-puits qui sont ensuite scellées et incubées pendant une nuit à température ambiante pendant élafine, et à 4 ° C pour TNFR1.
5. Journée Expérience 1-2: HGF ELISA (Figure 1)
- Après avoir terminé le test ELISA d'IL-2Rα et en assurant le test n'a pas besoin d'être répété, 60 ul de plasma non dilué transféré sur une plaque nouvelle source, puis 60 pl de BSA à 1% dans 1 x PBS est ajouté dans chaque puits pour faire une 01h02 plaque de source de plasma dilué.
- La plaque d'essai HGF est lavé, bloqué avec BLOTTO dans du TBS, et la norme est reconstitué et une courbe standard de 8 points est préparé par le protocole du fabricant.
- Après lavage de la plaque après l'étape de blocage, 50 pi de 1:2 plasma dilué est plaqué en double sur la plaque de test ELISA, et 50 pi de chaque norme est plaqué en double exemplaire. La plaque etincubée pendant une nuit à température ambiante sur un agitateur de microplaques à 300 RPM.
- Le plasma dilué 01h02 est récupéré à partir de la plaque de HGF test ELISA et replacé dans le 1:2 plaque de source de plasma dilué. Le test ELISA est complété par le protocole du fabricant (avec des volumes corrigés des demi-puits) et la densité optique de chaque puits est lue en utilisant un lecteur de plaque ensemble à 450-570 nm, et les données enregistrées et analysées.
6. Jour 2 Expérience: élafine ELISA
- 10 ul de plasma non dilué sera transféré à une plaque nouvelle source, puis 190 ul de BSA à 1% dans 1 x PBS sera ajouté à chaque puits pour faire 200 ul de plasma 1:20 dluted.
- L'ELISA élafine interprété selon le protocole du fabricant (avec des volumes ajustés pour demi-puits), et la densité optique de chaque puits est lue en utilisant un lecteur de plaque fixé à 450-570 nm, et les données enregistrées et analysées.
7. Expérience Day 2: TNFR1 ELISA
- 25 pl de BSA à 1% dans du PBS sera ajouté à la plaque de source 1:20 (désormais contenant 100 pl de 1:20 plasma) pour obtenir 125 ul de 1:25 plasma dilué.
- L'ELISA TNFR1 est complété par le protocole du fabricant (avec des volumes corrigés des demi-puits) et la densité optique de chaque puits est lue en utilisant un lecteur de plaque fixé à 450-570 nm, et les données enregistrées et analysées.
8. Jour 2 Expérience: IL-8 ELISA
- 60 pl de 1:2 plasma dilué sera transféré sur une plaque nouvelle source, puis 180 ul d'IL-8 diluant est ajouté à chaque puits pour faire une plaque de 01h06 dilué source de plasma.
- L'IL-8 ELISA est complété par le protocole du fabricant (avec des volumes corrigés des demi-puits) et la densité optique de chaque puits est lue en utilisant un lecteur de plaque fixé à 450-570 nm, et les données enregistrées et analysées.
Une fois que tous les tests ELISA ont été réalisés, unused actions plasma sera remplacé dans les aliquotes décongelées et congelés pour une utilisation future.
Résultats
Le workflow des biomarqueurs et le calendrier sont détaillées dans le tableau 1 et le tableau 2, respectivement. Une fois terminé, les concentrations de 6 protéines différentes ont été quantifiées sur le même échantillon de plasma en utilisant un total de 150 ul de plasma. L'étalement des échantillons en double par test permet d'assurance qualité interne, avec CV inférieur à 10% est optimal. Si vous effectuez la séquence ELISA sur des plaques multiples, conformément densités optiques de la norme élevée sont préférés et permettre une meilleure inter-plaques fiabilité des mesures; courbe standard DO peuvent être comparés entre les plaques de regarder pour évaluer la performance des incohérences dans ELISA (Figure 2). Les temps de développement en utilisant tétraméthylbenzidine substrat colorimétrique et une forte concentration DO observée pour chaque biomarqueur dans notre laboratoire sont énumérés dans le tableau 3.
tp_upload/4247/4247fig1.jpg "alt =" Figure 1 "/>
Figure 1. Workflow pour l'IL-2Rα, REG3α et le HGF ELISA. Après les échantillons de plasma ont été étalées sur des plaques de IL-2Rα test ELISA qu'il ne soit récupéré pour fabriquer des plaques de source de dilution pour les tests ELISA autres. Pour le test ELISA HGF, le plasma est récupéré pour préparer la plaque de dilution 1:06 de l'IL-8. Cliquez ici pour agrandir la figure .
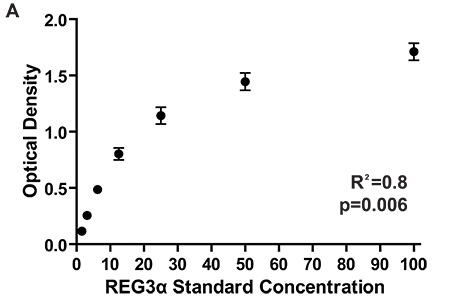
Figure 2. Densités optiques pour la courbe standard de 7 plaques ELISA différentes concentrations de mesure correspondant à REG3α les 1084 patients testés pour le rapport initial REG3α GI GVH biomarqueur 3. Conformément DO entre les plaques d'assurer cohérence des mesures de concentration de protéines entre les plaques. Les concentrations de protéinesdans des échantillons de plasma sont calculés en comparant les densités optiques d'échantillon pour les densités optiques courbe standard.
| 0 Jour expérience | 1. Préparer les échantillons |
| 2. IL-2Rα, HGF et REG3α capture Ab | |
| 1 Jour expérience | 1. IL-2RαELISA |
| 2. REG3αELISA | |
| 3. HGF ELISA (par plaquage de l'échantillon) | |
| 4. Élafine et TNFR capture Ab | |
| Jour 2 Expérience | 1. HGF ELISA achèvement |
| 2. Élafine ELISA | |
| 3. TNFR1 ELISA | |
| 4. IL-8 ELISA | |
| 5. Recongeler utiliséplasma |
Tableau 1. Aperçu GVHD workflow des biomarqueurs
| Jour 0 | La préparation des échantillons et nuit d'incubation corps capture | ||||||
| ELISA | IL-2Rα | REG3α | HGF | Élafine | TNFR1 | IL-8 | |
| Temps (h) | 0,0 | Blocage | |||||
| 1,0 | Les échantillons argentés, dorés | ||||||
| 3,0 | Reclaim échantillons de plasma; Détection Ab | Blocage des échantillons; préparer (dilution 1:10) | |||||
| 4.0 | Les échantillons plaqués (1:10) | ||||||
| 5.0 | Streptavidine-HRP | Détection Ab | |||||
| 5,5 | TMB | Streptavidine-HRP | |||||
| 6.0 | Plaque de lecture | TMB | Blocage des échantillons; Préparer la dilution (1:2) | ||||
| 6,5 | Plaque de lecture | ||||||
| 7.0 | Les échantillons plaqués (1:2) | Capturez Ab (une nuit d'incubation) | Capturez Ab (une nuit d'incubation) | ||||
| Jour 2 | |||||||
| Temps (h) | 0,0 | Reclaim plasma, Détection Ab | Blocage des échantillons; Préparer (1:20) | ||||
| 1,0 | Placage échantillon (1:2) | Blocage; dilution supplémentaire des échantillons à une dilution 1:20 1:25 | |||||
| 2,0 | HRP | Placage échantillon (1:25) | |||||
| 2,5 | TMB | ||||||
| 3,0 | Plaque de lecture | Détection Ab | |||||
| 3,5 | Préparer les échantillons de dilution (1:6) | ||||||
| 4.0 | Détection Ab | Placage échantillon (1:6) | |||||
| 5.0 | HRP | ||||||
| 5,5 | TMB | ||||||
| 6.0 | Plaque de lecture | HRP | Détection Ab | ||||
| TMB | |||||||
| 7.0 | Plaque de lecture | TMB | |||||
| 7,5 | Lecture de plaque | ||||||
| Après l'achèvement | Remplacer source de plasma en aliquotes et congeler pour une utilisation ultérieure | ||||||
Tableau 2. Chronologie pour effectuer les tests ELISA.
| Facteur de dilution du plasma | Haute Concentration du standard | Temps de développement substrat (min) | Haute OD | Courbe | |
| IL-2Rα | 01:01 | 2000 pg / ml | 5 | 1 | Linéaire |
| HGF | 01:02 | 4000 pg / ml | 22 | 2,1 | 4-paramètre |
| IL-8 | 01:06 | 200 pg / ml | 12 | 2,7 | 4-paramètre |
| REG3α | 01:10 | 100 ng / ml | 12 | 1,7 | 4-paramètre |
| Élafine | 01:20 | 2000 pg / ml | 20 | 1,9 | 4-paramètre |
| TNFR1 | 01:25 | 800 pg / ml | 8 | 2,7 | Linéaire |
Tableau 3. Détails ELISA pour 6 biomarqueurs GVHD.
Discussion
La méthode ELISA séquentielle présentée ici permet de mesurer des protéines plasmatiques multiples sur de petits volumes de plasma qui peuvent être difficiles à obtenir et / ou irremplaçables tels que des échantillons provenant de sujets humains atteints de maladies rares ou des échantillons de plasma provenant de souris 9,10. Les tests ELISA séquentiels sont généralement effectuées dans l'ordre d'un facteur de dilution de plasma augmente, avec les tests ELISA nécessitent plasma dilué ≥ 1:10 généralement pas besoin d'être remis en état, même si cela peut être fait si désiré. La possibilité d'effectuer séquentielle ELISA est limitée par des kits ELISA / protocoles dans lequel le plasma est mélangé avec d'autres réactifs ou pour lesquels tampons de dilution différentes sont nécessaires pour le plasma, ce qui exclut la ablility de réutiliser un échantillon en raison de préoccupations qu'un incompatibles tampon / réactif va interférer avec la performance d'un test particulier. Avec une planification soigneuse, plus de 10 tests ELISA peuvent être effectuées sur le même échantillon de plasma.
rents "> Les laboratoires peuvent avoir besoin d'ajuster dilutions de plasma afin d'avoir des résultats interprétables basés sur les concentrations plasmatiques attendues de la protéine d'intérêt dans les échantillons provenant de sujets testés. différences dans l'équipement de laboratoire peut entraîner la nécessité d'optimiser l'incubation et le développement colorimétrique fois, le nombre de lavages et / ou laver temps d'immersion afin d'optimiser toute donnée ELISA.Pour augmenter la capacité de haut débit et de précision et d'effectuer des analyses d'une manière rentable, l'utilisation d'une plate-forme de manipulation des liquides robotique capable d'analyse sur plaques de 384 puits et un laveur de plaque automatique avec unité d'empilage sont recommandés. Cet équipement peut augmenter l'exactitude et la précision des analyses effectuées par plusieurs utilisateurs, et aider à assurer la cohérence de l'analyse de réduire inter-et intra-laboratoires.
Nous avons utilisé séquentielle ELISA sur des plateformes multiplex disponibles pour deux raisons: 1) La plupart despaires d'anticorps pour de nouvelles protéines ne peuvent pas facilement être conjugués sur des billes ou tout autre matériel ainsi que le temps et coûteuse; 2) individuels tests ELISA sont plus précis que les puces à ADN multiplex ou perles, secondaire à une absence de réactivité croisée 11. Si une méthode fiable est établie pour effectuer multiplexés, perles à base de puces à ADN, il peut être en mesure de remplacer le processus séquentiel ELISA, mais peut être limité par la capacité de conjuguer les anticorps à des billes et / ou par le nombre de protéines, désireux de se analysés.
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Soutenu par des subventions du NIH RC1-HL-101102, P01-CA039542, T32-HL007622, la Fondation Hartwell, et la Doris Duke Charitable Foundation. Dr Paczesny est un enquêteur du fonds Eric Hartwell et le Programme de recherche Amy Strelzer Manasevit.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | Commentaires |
| L'IL-2 R alpha Duoset | R & D Systems | DY223 | |
| HGF humain Duoset | R & D Systems | DY294 | |
| IL-8 humaine OptEIA KIT II | Becton Dickinson | 550999 | |
| Ab-Match MONTAGE humaines PAP1 (REG3α) Kit | MBL International | 5323 | |
| Ab-Match UNIVERSEL Kit | MBL International | 5310 | |
| Human sTNFRI/TNFRSF1A Duoset | R & D Systems | DY225 | |
| Human Trappin-2/Elafin Duoset | R & D Sydécoule | DY1747 | |
| À 96 puits en polystyrène à fond conique | Thermo Scientific | 249570 | Utilisé pour les plaques de source de plasma |
| Costar demi-haute et de liaison des plaques 96 puits | Corning | 3690 | Pour l'IL-2Rα, HGF, TNFR1 et élafine ELISA |
| Nunc plaques de 384 puits MaxiSorp | Nunc | 464718 | Pour REG3α Elisa |
| HyClone Phosphate Buffered Saline, 1x | Thermo Scientific | SH30256.02 | |
| Sérum-albumine bovine Fraction V, choc subi un traitement thermique | Fisher Scientific | BP1600-100 | |
| Blocker BLOTTO dans du TBS | Thermo Scientific | 37530 | Agent de blocage de l'IL-2Rα HGF et TNFR1 ELISA |
| DulbeccoTampon phosphate salin | Gibco | 21600-069 | Le tampon de lavage pour l'IL-2Rα, HGF, élafine et TNFR1 ELISA |
| Susbtrate peroxyde TMB | Kirkegaard et Perry Laboratories | 50-76-00 | |
| Tween 20 | Acros Organics | 233362500 | Le tampon de lavage pour l'IL-2Rα, HGF, élafine et TNFR1 ELISA |
| Acide sulfurique | Sigma-Aldrich | 84720 | (Dilué à 2N) pour la solution d'arrêt |
Références
- Paczesny, S. A biomarker panel for acute graft-versus-host disease. Blood. 113, 273-278 (2009).
- Paczesny, S. Elafin is a biomarker of graft-versus-host disease of the skin. Science Translational Medicine. 2, 13ra12 (2010).
- Ferrara, J. L. Regenerating islet-derived 3 alpha is a biomarker of gastrointestinal graft-versus-host disease. Blood. , (2011).
- Ferrara, J. L., Levine, J. E., Reddy, P. Graft-versus-host disease. Lancet. 373, 1550-1561 (2009).
- Miyamoto, T. Serum concentration of the soluble interleukin-2 receptor for monitoring acute graft-versus-host disease. Bone Marrow Transpl. 17, 185-190 (1996).
- Holler, E. Role of tumor necrosis factor alpha in acute graft-versus-host disease and complications following allogeneic bone marrow transplantation. Transplant. Proc. 25, 1234-1236 (1993).
- Okamoto, T. Increased hepatocyte growth factor in serum in acute graft-versus-host disease. Bone Marrow Transpl. 28, 197-200 (2001).
- Uguccioni, M. Elevated interleukin-8 serum concentrations in beta-thalassemia and graft-versus-host disease. Blood. 81, 2252-2256 (1993).
- Osuchowski, M. F., Siddiqui, J., Copeland, S., Remick, D. G. Sequential ELISA to profile multiple cytokines from small volumes. J. Immunol. Methods. 302, 172-181 (2005).
- Osuchowski, M. F., Remick, D. G. The repetitive use of samples to measure multiple cytokines: the sequential ELISA. Methods. 38, 304-311 (2006).
- Schweitzer, B. Multiplexed protein profiling on microarrays by rolling-circle amplification. Nat. Biotechnol. 20, 359-365 (2002).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon