このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
DNA損傷応答タンパク質の2次元および3次元生細胞イメージング
要約
このプロトコルは、DNA損傷だけでなく、有糸分裂時にその局在化に応答して活性化されたDNA二重鎖切断シグナル伝達タンパク質を可視化するための方法を説明します。
要約
二本鎖切断(DSB)は、最も有害なDNAが細胞に発生する可能性病変である。未修復のままにしておくと、DSBは港の大きな可能性は、突然変異と染色体異常を生成するには1。 DSBを検出する細胞は、DNA損傷応答(DDR)を活性化し、DNAを修復するためにゲノム不安定性を触媒から外傷を防止するために、それは非常に重要です。刺激された時、DDRは修理が行われるか、細胞がアポトーシスを受けるように強制することを可能にするために、細胞周期の停止を誘発することによりゲノムの完全性を維持するために動作します。 DSB修復の主なメカニズムは、非相同末端結合(NHEJ)と相同組換え修復(HRR)(2件)を介して行われます。その活動が適切に機能するためにDDRのために正確に画策しなければならない多くのタンパク質があります。ここで、我々は2のための方法を記述する - そしてこれらのタンパク質の1の3次元(D)の可視化、53BP1。
p53結合タンパク質1(53BP1)は、の領域に局在する5-15分5内の病巣を形成し、修正されたヒストン3,4に結合することによりDSBは。 DSB部位に53BP1と他のDDRタンパク質のヒストン修飾とリクルートは、損傷の領域の周りクロマチンの構造的再編成を促進し、DNA修復6に寄与すると考えられている。修理の直接参加以外にも、追加の役割は、このようなイントラSチェックポイント、G2 / Mチェックポイント、および活性化下流のDDRタンパク質7-9規制として、DDRで53BP1のために記載されている。最近では、53BP1代わりにDSBが6の近傍に局在する前にG1を入力するセルを待って、有糸分裂時に誘発されるDNA損傷に応答して病巣を形成していないことが発見されました。そのような53BP1などのDDRタンパク質は細胞分裂から10までの進行の間に分裂構造(原体など)に関連付けることが見出されている。
視覚化すると3-Dライブセルイメージング - このプロトコルでは、我々は2の使用を記述するDNA損傷剤カンプトテシン(CPT)と同様に、有糸分裂時の53BP1の行動に応じて53BP1フォーカスの形成。カンプトテシンは主としてDNA複製の間にDSBを引き起こすトポイソメラーゼI阻害剤である。これを達成するために、我々は前述の53BP1-mCherry蛍光融合タンパク質はDSBは11に結合することができる53BP1タンパク質ドメインからなる構築に使用。また、ヒストンH2B-GFP蛍光融合タンパク質が有糸分裂中に12細胞周期全体が、特にクロマチンダイナミクスを監視することができる構築するために使用。複数のディメンションでライブセルイメージングは、真核細胞におけるDDRタンパク質の機能の理解を深めるための優れたツールです。
プロトコル
A.細胞の調製
- 正常ヒト初代線維芽細胞(GM02270)はコーリエル医学セルリポジトリ、カムデン、ニュージャージー州から得られた、およびhTERT 6により不死化された。細胞はCellStarで増殖し、増殖させた20%ウシ胎児血清(GIBCO)、non-essential/essentialアミノ酸、ビタミン、ピルビン酸ナトリウム、およびペニシリン/ストレプトマイシン(ハイクローンを補充したMEMから成るメディアの6 cmの皿(4ミリリットル) )。
- ヒト胎児腎臓293(HEK293)細胞は、アメリカンタイプカルチャーコレクションから入手しCellStar 6-10cm皿で増殖し、増殖させた。細胞を、10%ウシ胎児血清、非必須アミノ酸、L-グルタミンを添加したDMEM、およびペニシリン/ストレプトマイシンから成るメディア(4ml)に保たれた。
- 53BP1-mCherry(N-MYC 53BP1 WT PLPC-Puroの; 19836 Addgeneプラスミド)とH2B-GFP(pCLNR-H2BG; 17735 Addgeneプラスミド)融合遺伝子はまた、それぞれ、ピューロマイシンまたはG418耐性遺伝子を発現している(fibroblaを形質導入した構築STS)またはトランスフェクトされた(HEK293)が細胞内にスーパーフェクト(Qiagene)を使用し、薬剤選択の下で維持した。蛍光のメンテナンスは定期的にチェックした。
- 24〜48時間の画像取得の前に、細胞を単一細胞懸濁液にトリプシン処理し、3.5 cmのFluroDishガラスボトムプレート上に低密度で播種した。
B.顕微鏡のセットアップと画像収集
このプロトコルはAxioObserver Z1のスタンド、デュアルチャネルYokagawa CSU-X1A 5000スピニングディスクユニット、2 Photometrics QuantEM 512SC EMCCDカメラ、HXP 120Cファイバベース照明、4を装着したZeissセルオブザーバSDスピニングディスク共焦点顕微鏡を用いて開発されたレーザー(Lasos 100mWのマルチラインアルゴン[458、488、514 nm]で、50mWの405nmのダイオード、40 mWの561 nmのダイオードと、30mWの635nmのダイオード)、AOTF、Pecon XL multiS1ステージ培養システム、ツァイスインキュベーションモジュール(O 2モジュールS、CO 2のモジュールS、TempModule Sは、ヒーターユニットXL S)と前カ月NanoScanZピエゾZのインサート付きtorized XYステージ。ライブセルイメージングが水性媒体に、C-アポクロマート63x/1.20水/自動補正対物レンズとツァイスImmersol Wの浸液(屈折率n = 1.334を使用)でサポートされていながら、球面収差を最小限に抑えるために使用されていました。 2チャンネル共焦点イメージング、RQFT 405/488/568/647ダイクロイックミラーとBP525/50(緑)とBP629/62(赤)の蛍光フィルターを用いた。使用されるシステム·ソフトウェアは、AV4 Multi-channel/Z/T、高速イメージング、生理学、MosaiX、マーク&探す、デュアルカメラ、4Dの内部では、オートフォーカスおよび3次元デコンボリューションモジュールとツァイスAxioVisionのする(ver. 4.8.2.0)であった。
- CO 2ガスは、インキュベーションシステムのCO 2のモジュールに実行されていることを確認します。顕微鏡は防振エアテーブルでサポートされている場合は、エアテーブル用エア供給(またはN 2ガ ス)をオンにします。
- スピニングディスクユニット、カメラ、インキュベーションモジュール、HXP照明、電動ステージ、アルゴン、顕微鏡スタンドの電源を入れてくださいレーザー、コンピュータ。
- ウォームアップ時間の1分後、 "On"にアルゴンレーザーのためにイグニッションキーを回してください。
- ツァイスレーザーのコントロールパネルで、使用するレーザーライン用のスイッチをオンにします。
- "レーザーの実行"を"スタンバイ"からLasosアルゴンレーザーコントローラ用のトグルスイッチを切り替えて、最適なレベル(ちょうど下すなわち緑のインジケータが赤色に点灯ポイント)に光コントローラを調整します。
- AxioVisionのソフトウェアを起動します注 :AxioVisionのためのユーザインタフェースは、特定の顕微鏡とそれが制御するコンポーネントに対して特異的である窓とプルダウンメニューを使用してカスタマイズすることができる。このように、各システムは、潜在的にユニークなインターフェースを持っています。したがって、ソフトウェアの操作に関する一般的な説明ではなく、特定のソフトウェアのウィンドウ、タブ、および/またはプルダウンメニューの方向性ではなく、後続のステップで提供されています。
- イメージングの前に約1時間は、ソフトウェアで、インキュベーターのコントロールを見つけ、上部チャンバーとステージプレートの加熱をオンにします。 37℃に温度を設定しCO 2のコントロールをオンにして、5%のレベルを設定します。
- イメージングのための対物レンズを選択します。本研究では、63x/1.20 NAのC-アポクロマート水/自動補正対物レンズを使用した注 :このレンズは、水(ツァイスImmersol Wの液浸液)に似た屈折率液浸媒体が必要とされている。
- 複数の別々の位置が長期間にわたってサンプリングする場合、それが1つの位置から別のものに実施されることを確実にするために、液浸媒体の十分な量を適用することを忘れないでください。
- ステージに皿を置き、底に接触対物レンズを持ち出す。
- 顕微鏡コントロールまたはソフトウェアのいずれかを使用して、接眼レンズに出射された光を向けると、適切な広視野フィルタが目的の蛍光シグナル(この研究のために、 "赤"フィルタは53BP1と "GFP"フィルタ用に設定H2Bのために設定するために設定を選択)。
- 、接眼レンズを通して見る画像の焦点を、細胞の適切なフィールドを探します。
- ソフトウェアや顕微鏡コントロールのいずれかを使用して、回転するディスク共焦点ユニットとポートへの接眼レンズから出射された光を直射。
- ソフトウェアでは、適切なレーザー(この研究のために、53BP1とH2Bのためのアルゴンレーザーの488nmのラインのための561 nmのレーザー)の電源をオンにします。
- チャネルごとに、適切なレベルに音響光学波長可変フィルタ(AOTF)コントロールを調整することにより、レーザ光の強度を調整します。
- 適切なダイクロイックミラー(RQFT 405/488/568/647)と発光フィルター(H2B用53BP1とBP 50分の525のBP 62分の629)を選択します。回転するディスクユニットにシャッターを開きます。
- ビューの現在のフィールドを表示する "ライブ"のウィンドウを選択します。
- ソフトウェアでは、 "カメラ"コントロールを開くと、カメラが使用されるように選択する(デュアルカメラシステムの場合)、約100 msに露光時間を設定します。 %を調整し、EMはNECなどの獲得。essary 注:53BP1-mCherryコンストラクトはやや暗く表示されます。私たちは、EMゲインを大きくすることが役に立ったと評価しています
- ソフトウェアでは、共焦点回転するディスクユニットのコントロールを開き、適切な画像( 例えば 〜100ミリ秒)を取得するように設定されたカメラの露光時間を入力することによって、回転するディスクの速度を調整する。変化にロックする "設定"をクリックしてください。
- "多次元取得"を開きます。チャンネルタブを選択し、ロード/適切なチャンネルを選択します。この研究では、我々は、DsRedの(561 nmのレーザー励起とBP 629 /放出のためのフィルタ62)とGFP(励起と発光のためBP525/50フィルタの488nmレーザーライン)に対して定義されたチャネルを使用しています。
- 画像レジストレーションを確保するために、一般的なダイクロイックミラー(RQFT 405/488/568/647)は、両方のチャネルのために使用された。 "オート"にソフトウェアを設定してください :MDAの設定を調整するには、[ツール]→[設定エディタに移 動します。その適切なレーザパワーが設定されていることを確認します( "適切なレーザパワーが"あなたを有効にする設定を指します光退色)を最小限に抑えながら、適切な蛍光体を励起する。
- MDAのウィンドウで、zスタック]タブを選択します。 "現在のフォーカス位置でZ-スタック"を選択します。 zスタックの正確なサイズはセルの高さに依存します:〜10μmのZ-スタックおよびZ( 注)を通してナイキスト·サンプリングを確保するためのステップ数のために"最適"を選択するための範囲を設定します。それに応じて調整してください。
- 23。 "スタート"の設定を使用すると、( 例えば本研究では、それはイメージ核全体にとって重要だった)調査している何のために適切であることを確認するように、結果zスタック画像を解析]をクリックします。
- "T"は(時間)]タブを選択します。カンプトテシンとの我々の実験のために、私たちは5分と制御のための1時間(非処理細胞)ビデオのように、セッションの全体の期間に撮像時点間の間隔を設定注:光退色の細胞を最小限にするため、実験は撮像時間ポイント間のレーザーなどAOTFブランクに構成する必要があります。
- F又は皿の複数のセルのマルチポイントイメージングは、MDAのウィンドウで、[位置]タブを選択します。チェックされている "あたりの位置 'の時点の後/前に設定を'を適用する"ことを確認します。 "MARK_FIND"を選択します。 "ライブ"ビューを使用して、周りのお皿を移動し、ビューの適切なフィールドを選択します。
- 実験を開始し、(未処理細胞の)コントロールのビデオを記録するために、多次元·アクイジションメニューで "スタート"をクリックします。
- 制御ビデオの後、適切な治療(この場合は、10μMカンプトテシン)を追加します。我々は2-4時間5-10分間隔で実験(薬剤処理した細胞)のビデオを記録したノート:考慮すべき重要な問題は、与えられた効果は、治療後に発生する速度である。ビデオで見られるように、53BP1巣は、CPTの添加後約5分〜開始します。比較的簡単なプロセスだが、手動で皿に薬を追加して再校正顕微鏡は時間がかかります。実験を設計する際に考慮したが、これに与えられなければなりません。
- メートルを監視するためのitosis、我々は、7.5分の間隔を設定すると4-5時間(具体的な設定は、使用した細胞株とその細胞周期の長さに依存します)に記録されている。調整は長い録音中に光退色を防ぐために作られている必要があります。
Cの画像処理と解析
このプロトコルはVolocityソフトウェア(パーキンエルマー社)を用いて開発されました。このデータ(AxioVisionの)を取得するために使用するソフトウェアは、画像を処理し、分析する能力を持っています。ユーザーがそれらに利用できるソフトウェアを利用し、そのアプリケーションに関する適切な文献を参照することをお勧めします。
- Volocityソフトウェアを開きます。作成し、新しいライブラリに名前を付けて、あなたのビデオファイルをインポートします。
- ファイルを閲覧するために、我々は通常、 "拡張フォーカス"設定を使用することが最も役に立ちまし。これは、zスタックのスライスを重ね合わせると、このプロトコルのために、私たちは核のさまざまな分野で53BP1巣を視覚化することができます。
- 必要に応じてビデオを調整します。 Voはベロシティは、取得された画像の品質を向上させるためのさまざまなツールが装備されています。顕微鏡の設定が適切であった確実にすることによって、多くの時間は、後で編集で保存することができます。多くの場合、それはあなたのイメージをデコンボリューションし、明るさ/コントラストを調整しておくと便利です。あなたの具体的な編集のニーズは、実験に基づいて異なります。
- 相対的なタイムスタンプとスケールバーを追加します。
- 3-Dでのセルを表示するには、 "3-Dの不透明度"の設定に切り替えます。これは、このように細胞内で興味のある構造の複数の視点を提供し、空間内の3次元レンダリングセルの回転を可能注:これは、判断するために異なる平面内細胞を可視化するために有用である金利旅行の構造。例えば、 "拡張フォーカス"設定でそれは53BP1は、実際には、有糸分裂時にDNAから解離しないことを識別することは困難である。しかし、これは、3次元で容易に明らかである。
- ムービーや静止画はユーザーの設定に基づいて、さまざまな種類のファイルにエクスポートすることができる。 I>
D.描写結果
CPTに応答53BP1フォーカス形成の例を図1に示します。細胞は5〜10分以内に、CPTフォーム巣にさらされており、記録の期間にわたってこれらの病巣を維持します。としては、クロマチンから解離して凝縮する53BP1染色体の周りに薄いもやを形成し、有糸分裂の開始時に、 図2に示す。終期が発生し、有糸分裂が終わりになるように、明確な病巣に53BP1もう一度集約。 HEK293細胞を、CPTにさらされなかったが、彼らはそれにもかかわらず、内因性のDNA損傷によって生成された、豊富な、自発53BP1修理病巣を形成した。この観察は、私たちが53BP1は電離放射線と放射線類似薬5への細胞の曝露後に同様の効果を示す以前の報告に沿ったもので、初期の有糸分裂の間に巣を形成していないと結論付けることができました。
URE 1 "SRC =" / files/ftp_upload/4251/4251fig1.jpg "/>
図1:カンプトテシン(10μM)は、DSBは、培地への薬物を加えるの30分以内に線維芽細胞を循環における53BP1フォーカス形成を引き起こす。
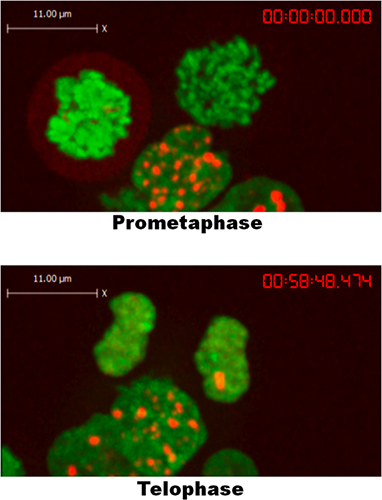
図2:53BP1はHEK293細胞におけるtelophase/G1まで、有糸分裂時に病巣を形成しない。
ディスカッション
ゲノムの完全性の維持は、細胞の生存にとって極めて重要である。早期老化、発癌、または死亡の8ゲノムの結果を保持するために失敗しました。目利きに強い関心がありますどのように基礎および臨床研究の両方に重要な役割を果たすから生じるDDR機能、。多くの技術は、細胞がDNA損傷を検出し、修復方法の研究を支援するために長年にわたって開発されてきた。最近の技術の進歩?...
開示事項
特別な利害関係は宣言されません。
謝辞
R01NS064593とR21ES016636(KV)によって部分的にサポートされています。顕微鏡はVCUで行われました - 神経生物学、解剖学顕微鏡ファシリティ省、NIH NINDSセンターコアグラント5P30NS047463の資金援助で、部分的には、サポートされています。回転するディスク共焦点顕微鏡は、NIH-NCRR賞(1S10RR027957)で購入されました。
資料
| Name | Company | Catalog Number | Comments |
| 製品 | 会社 | ||
| CellStar培養皿 | グライナーバイオ1 | ||
| FluroDishガラスボトムディッシュ | 世界の精密機器株式会社 | ||
| MEM培地 | GIBCO | ||
| 非必須アミノ酸 | GIBCO | ||
| アミノ酸 | GIBCO | ||
| ビタミン | GIBCO | ||
| ピルビン酸ナトリウム | インビトロジェン | ||
| ペニシリン/ストレプトマイシン | Hyclone社 | ||
| ウシ胎仔血清 | GIBCO | ||
| N-MYC 53BP1 WT PLPC-Puroの; プラスミド19836 | Addgene | ||
| pCLNR-H2BG;プラスミド17735 | Addgene | ||
| スーパーフェクト | キアゲン | ||
| ツァイスセルオブザーバーのSDイメージングシステム | ツァイス | ||
| AxioVisionの(リリース4.8.2) | ツァイス | ||
| ツァイスImmersol Wオイル | ツァイス | ||
| Volocityソフトウェア(バージョン6.0) | パーキンエルマー |
参考文献
- Botuyan, M. V., Lee, J., Ward, I. M., Kim, J. E., Thompson, J. R., Chen, J., Mer, G. Structural basis for the methylation state-specific recognition of histone H4-K20 by 53BP1 and Crb2 in DNA repair. Cell. 127, 1361-1373 (2006).
- Dimitrova, N., Chen, Y. C., Spector, D. L., de Lange, T. 53BP1 promotes non-homologous end joining of telomeres by increasing chromatin mobility. Nature. 456, 524-528 (2008).
- Feuerhahn, S., Egly, J. M. Tools to study DNA repair: what's in the box. Trends Genet. 24, 467-474 (2008).
- Giunta, S., Belotserkovskaya, R., Jackson, S. P. DNA damage signaling in response to double-strand breaks during mitosis. J. Cell Biol. 190, 197-207 (2010).
- Giunta, S., Jackson, S. P. Give me a break, but not in mitosis: the mitotic DNA damage response marks DNA double-strand breaks with early signaling events. Cell Cycle. 10, 1215-1221 (2011).
- Golding, S. E., Morgan, R. N., Adams, B. R., Hawkins, A. J., Povirk, L. F., Valerie, K. Pro-survival AKT and ERK signaling from EGFR and mutant EGFRvIII enhances DNA double-strand break repair in human glioma cells. Cancer Biol. Ther. 8, 730-738 (2009).
- Huyen, Y., Zgheib, O., Ditullio, R. A., Gorgoulis, V. G., Zacharatos, P., Petty, T. J., Sheston, E. A., Mellert, H. S., Stavridi, E. S., Halazonetis, T. D. Methylated lysine 79 of histone H3 targets 53BP1 to DNA double-strand breaks. Nature. 432, 406-411 (2004).
- Jackson, S. P., Bartek, J. The DNA-damage response in human biology and disease. Nature. 461, 1071-1078 (2009).
- Kanda, T., Sullivan, K. F., Wahl, G. M. Histone-GFP fusion protein enables sensitive analysis of chromosome dynamics in living mammalian cells. Curr. Biol. 8, 377-385 (1998).
- Massignani, M., Canton, I., Sun, T., Hearnden, V., Macneil, S., Blanazs, A., Armes, S. P., Lewis, A., Battaglia, G. Enhanced fluorescence imaging of live cells by effective cytosolic delivery of probes. PLoS One. 5, e10459 (2010).
- Nakamura, K., Sakai, W., Kawamoto, T., Bree, R. T., Lowndes, N. F., Takeda, S., Taniguchi, Y. Genetic dissection of vertebrate 53BP1: a major role in non-homologous end joining of DNA double strand breaks. DNA Repair (Amst). 5, 741-749 (2006).
- Schultz, L. B., Chehab, N. H., Malikzay, A., Halazonetis, T. D. p53 binding protein 1 (53BP1) is an early participant in the cellular response to DNA double-strand breaks. J. Cell. Biol. 151, 1381-1390 (2000).
- Valerie, K., Povirk, L. F. Regulation and mechanisms of mammalian double-strand break repair. Oncogene. 22, 5792-5812 (2003).
- Wang, B., Matsuoka, S., Carpenter, P. B., Elledge, S. J. 53BP1, a mediator of the DNA damage checkpoint. Science. 298, 1435-1438 (2002).
- Ward, I. M., Minn, K., Jorda, K. G., Chen, J. Accumulation of checkpoint protein 53BP1 at DNA breaks involves its binding to phosphorylated histone H2AX. J. Biol. Chem. 278, 19579-19582 (2003).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved