このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
SeqA-DNA複合体の結晶化のためのDNA二重鎖の反復最適化
要約
タンパク質-DNA複合体の結晶構造は、タンパク質の機能、機構、ならびに、特定の相互作用の性質についての洞察を提供することができます。ここでは、との共結晶の長さ、配列および二本鎖DNAの末端を最適化する方法を報告して大腸菌 SeqA、複製開始の負の調節因子。
要約
大腸菌 SeqAは複製1の原点内封鎖ヘミメチルGATCクラスターによる早期再開始イベントを防ぐDNA複製の負の調節因子である。原点を超えて、SeqAは複製フォーク、それがより高い秩序構造に新しく複製されたDNAを整理2で見出される。 SeqAシングルGATC配列と共に弱くしか仲間が、それは複数GATC部位を含むDNA二重鎖と親和性の高い複合体を形成している。 SeqAの最小限の機能と構造単位は、それによってヘミメチル化DNA 3と高親和性複合体を形成するために少なくとも2つのGATCシーケンスの要件を説明し、二量体である。さらに、SeqAアーキテクチャは、オリゴマー化と柔軟なリンカーによって分離されたDNA結合ドメインと、3つの螺旋回転までで区切らGATCリピートに結合することができます。したがって、分子レベルでSeqAの機能を理解することは構造的アナログを必要と複数GATC配列に結合SeqAの溶解。タンパク質-DNAの結晶化では、DNAはタンパク質とDNAの相対サイズとアーキテクチャに応じてパッキング相互作用に非常に優れた効果をnoneに持つことはできません。タンパク質はDNAまたはDNAの足跡のほとんどよりも大きい場合には、結晶充填は、主に、タンパク質 - タンパク質相互作用によって媒介される。逆に、タンパク質はDNAよりも同じサイズ以下であるか、またはそれが唯一のDNA、DNA-DNAとDNA-タンパク質相互作用の一部をカバーするとき、結晶パッキングを支配している。したがって、タンパク質-DNA複合体の結晶化は、DNAの長さ4、DNA末端(鈍またはオーバーハング)5-7の体系的スクリーニングを必要とします。本稿では、設計、最適化、精製および構造決定に適した結晶を得ることがSeqAの二量体変異体(SeqAΔ(41から59)-A25R)と複合したタンデムGATCリピートを含むヘミメチル化DNA二重鎖を結晶化する方法について説明します。
プロトコル
1。タンパク質精製
接続するフレキシブルリンカー、N-(オリゴマー)およびC末端(DNA結合)SeqAエイズ、DNA上の一から三ターンで区切らヘミメチルGATCリピートの認識のドメイン。この研究では、我々はさらに、オリゴマーとによって排他的に分離されたタンデムGATCへのDNA結合繰り返しを制限短縮しリンカを防ぎN末端ドメインに点突然変異とSeqAの二量体変異体(SeqAΔ(41から59)-A25R)を使用DNA上の1ターン( 図1)2,8。
- T7プロモーターの制御下にコードするプラスミドSeqAとBL21(DE3)細胞を形質転換し、
- 100μg/ mlのアンピシリンを含むLB寒天プレートにプレート変換反応、
- 小規模の一晩培養(100μg/ mlのアンピシリンを含むLB培地)に接種し混合コロニーをピックアップ、
- 翌朝overniの1:100希釈液を使用したメディアの1リットルに接種GHT文化、
- 〜0.7のOD 600に細胞を成長し、終濃度1mMにイソプロピルβ-D-1-チオガラクトピラノシド(IPTG)を添加することにより、タンパク質産生を誘導し、
- 、軌道に振とうしながら37℃で3時間インキュベーションを継続した後、遠心分離(3,300×gで10分)により細胞を収穫
- 精製バッファーで細胞ペレットを再懸濁し、超音波処理により溶解、
- 遠心分離(39,000×gで40分間)によって溶解物をクリアして、精製バッファーで平衡化したヘパリンカラムに上清をロードし、
- 1MのNaCl(〜0.7MのNaClで溶出SeqA)の直線勾配を用いて溶出SeqA、
- 一緒にプールSeqA含有画分を精製バッファーで平衡化した陽イオン交換クロマトグラフィーカラムに試料と負荷のイオン強度を下げるために希釈し、
- 線形塩勾配を用いて、純粋SeqAは、〜0.4 MのNaClで溶出
- 一緒にプールSeqA含有画分を、concentratE(3 mg / ml)とストレージ·バッファに保管してください。
2。 DNA精製
- あなたの好みの会社から順に相補非メチル化及びメチル化オリゴヌクレオチド、
- 、オートクレーブ滅菌ddH 2 Oを、渦の800μlの各凍結乾燥した一本鎖DNAの1マイクロモルを溶解し、それが10〜20分間放置
- 各オリゴヌクレオチドに予熱2Xローディングバッファー800μlを添加し、
- 20から30ヌクレオチド長のオリゴヌクレオチドは、大規模な10パーセント変性ゲル(160×250×1mm)を準備します。
*よく10%ページミックス、80μlのTEMEDとゲルあたり800μlの過硫酸アンモニウムの80ミリリットルを混合し、注ぐ、
一旦重合*、コームを取り外し、徹底的にddH 2 Oで井戸をすすぎ、
*、冷却板を含むゲルキャスト上でゲルを組み立て、その後バッファー(1×TBE)を実行して上部と下部貯水池を埋める
* 55℃にゲルを暖めるために700から750 Vでゲルを事前実行、
*実行を停止し、井戸ソロをすすぐughlyバッファが実行されています。 - 90にオリゴヌクレオチドを熱し℃で2分間、
- 渦とサンプルをスピンし、すぐにゲルをロードする前に、
- 〜700 Vでゲルを実行して、オリゴヌクレオチドが中途半端に移行した後、停止します。 (10%ポリアクリルアミドゲル上でブロモフェノールブルーのオリゴヌクレオチドとの共同移行していることに注意してください〜〜60塩基の長さを持つ20塩基長とキシレンシアノールFF)を、
- ゲルを停止し、ゲルボックスからそれを分解してスペーサーを取り外す
- 平らな面に、1枚のガラスプレートを取り外し、ラップでゲルを覆い、
- 、、ゲルを好転他のガラス板を取り外して、プラスチック製のラップでそれをカバー
- 、DNAの影を見てゲルの後ろに紫外光や蛍光プレートを用いてバンドをマーク
- 小さい部分にカミソリの刃でバンドを切り取り、無菌の15mlチューブにそれらを転送し、
- 溶出緩衝液9mlを追加し、攪拌しながら37℃で一晩溶出、
- 慎重に溶液を移す転送アクリルアミドの部分を避けて、pH7の3 M酢酸ナトリウム(1:10希釈)を1ml加えて冷やした100%エタノール(2.5巻)の25ミリリットルを追加するには、ゲルローディングピペットチップを用いてオートクレーブした遠心管に、
- 少なくとも3時間-20℃でインキュベートし、
- 、スピンダウンし、別のチューブに上清を移す
- 中火速度-VACでペレットを乾燥させ、
- オートクレーブ滅菌ddH 2 Oを400μlにペレットを再懸濁し、新しいチューブに移し、
- 100%エタノールのpHは7と1ミリリットルで3 M酢酸ナトリウム40μlを加え、よく混ぜる(渦)、-20℃で30分間、続いて室温で30分間℃で、インキュベート
- 、18,000 gで15分間スピンし、上清を捨てる
- 18000グラムで6分間ペレットとスピンから残留塩を除去するために70パーセントの冷エタノールを100μlでペレットを洗浄します。 、エタノールを捨て、スピード-VACでペレットを乾燥させ
- オートクレーブ滅菌蒸留H100μlの合計でペレットを再懸濁し 2 O 、オリゴヌクレオチドの濃度を測定
- ヘミメチル化DNA二重鎖をアニーリングするように、彼らが水浴内部ゆっくりと室温まで冷却させた後相補的な一本鎖のモル濃度をミックスし、℃で5分間水浴中で95に混合物を加熱して。
3。タンパク質-DNA複合体形成と分析
- 精製SeqAΔ等量の(41から59)-A25(81μM)およびヘミメチル化DNA(81μM)を、ミックス
- あなたはそれを使用する準備が整うまでは、4時15分、店舗℃の室温でインキュベート
- 商用スパースマトリックス画面を使用して結晶化条件の画面、
- 一度初期結晶化のリード線は回折品質結晶を成長させるための条件を最適化し、同定されており、
- どちらか25%の最終濃度(に結晶化溶液にPEG400の存在量を増加させることによって得られたSeqA-DNAの結晶をCryoprotectv / v)で、または、結晶化溶液に20%グリセロール(v / v)を追加
- ナイロンループを使って個々の結晶をすくい、液体窒素中でそれらをフラッシュフリーズ、
- 100 Kの各結晶の回折限界をテスト
4。代表的な結果
ヘミメチルGATC配列間の分離(i)は、二重の(ii)の長さ、および(iii):ヘミメチル化DNAに結合したSeqAΔ(41から59)-A25Rの結晶構造を得るために、我々は連続してDNA上の3つのパラメータを最適化5 'オーバーハングの不在/存在。
エレクトロモビリティシフトアッセイはSeqAΔ(41から59)-A25Rが優先的に9から10塩基対( 図1)で区切られたGATC繰り返しを結合することを示す。したがって、我々は最初に長い9または10 bpsのどちらかで区切られた二つのヘミメチルGATC配列を含む(bps)の二重鎖23から24塩基対をスクリーニングした。三二本鎖は、うまく形の結晶が( 図2)を得た。アル高分解能で回折結晶のしかしなし、9 bpsのGATC分離、結晶化のために好まれたことを示す他の部分よりもX線回折より良い9 bpsには、で区切られた二つのGATCサイトと23 bpsの長い二重。したがって、我々は後続のすべての画面に9 bpsに間GATC間隔を修正しました。
複数のDNA分子が結晶内で9連続B型DNAを形成するために、頭部と尾部を積み重ねることができるので、一般的には、DNAの結晶化は、正確なヘリカル巻数に対応する二重の長さについては好まれています。したがって、我々は21 bpsの( すなわち、2つのらせん状の回転)に二重鎖の全長を短縮した。平滑末端を有する21 bpsの全二重では回折品質結晶(データは示さず)、結晶を得たそれぞれの端に単一ヌクレオチドの5 'オーバーハングを有する21 bpsの半二重その私達の家のソース内の5Åの回折。を得ませんでしたが回折限界の改善は、エンドツーエンドのデュプレックス協会は確かに有利であることが示唆されたる結晶のパッキング。
SeqAがDNAの同一面上にあるGATC配列と相互作用するので、DNA二重鎖の反対側の面は、溶剤にさらされるべきである。さらに複合体の結晶性を向上するために、我々は、メソッド、二重の反対側の面を通って結晶に隣接したDNA分子を用いた溝バックボーン相互作用を促進するために2つのサイト間のGATC CGジヌクレオチドを含むように二重の順序を変更それは、過去10のDNAの結晶化を強化するために使用されています。しかし、CGを含有二重で成長した結晶の回折限界はCGジヌクレオチド( 図3)を含んでいなかった似たような二本鎖DNAとの相互成長したものと同一であった。この結果は、溝のバックボーン相互作用がこのケースでは重要ではないことが示された。我々は、その後それぞれに2付加的なヌクレオチドを持っていた二本鎖DNAと成長した結晶を比較することにより、オーバーハングの長さを最適化5 '末端。この変化は、結晶形態の抜本的な効果を持っていたと同様に、回折限界は、追加のヌクレオチドが劇的に強化された分子の連絡先や結晶組織( 図3)を変更したことを示す。
SeqAΔ(41から59)-A25Rの結晶構造は、DNA二重鎖の自由面が結晶接触に従事しないことを確認し、この最後の二本鎖DNAに結合した、など、CG-ジヌクレオチドを導入する効果は限定的と予想。タンパク質とDNAの相対的な大きさにもかかわらず、対称の仲間の間でほとんどの相互作用は、タンパク質-タンパク質とタンパク質-DNA相互作用( 図4)によって媒介される。興味深いことに、この特定のケースでは、5 'オーバーハングヌクレオチドの有益な効果は、擬似連続DNAの形成によるものではない。その代わりに、離れたDNA軸からのメチル化鎖プロジェクトの5 '末端とその理由2ヌクレオチドワット説明して、複合体の近位SeqA分子と相互作用する EREは厳密には8,11のパッキング結晶を変更する必要がありました。
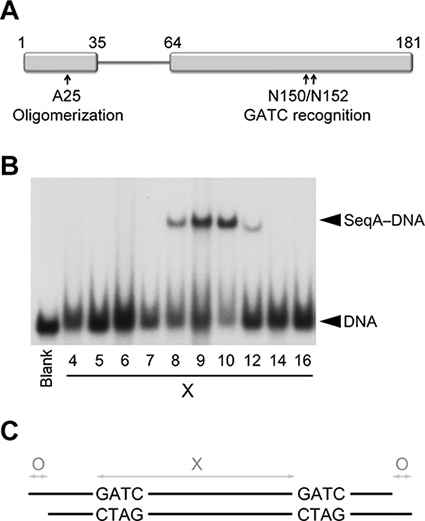
図1。ヘミメチル化DNAへSeqAΔ(41から59)-A25Rの結合。 (A)が媒介するタンパク質のオリゴマー化とDNA結合そのSeqAのドメインの概略図を。塩基対の増加によって分離された二つのヘミメチルGATC配列を含むDNAとSeqAΔ(41から59)-A25R(B)の電気泳動移動度シフトアッセイ( X)である。一番左のレーンは(空白のラベルが付いている)SeqAΔ(41から59)-A25Rの非存在下での2 GATC配列間の5,7を有するDNA、12、21、25〜34塩基対の等モル混合物を含んでいます(C)図は、回折品質結晶を得るためにDNA二本鎖に最適化された三つの変数を描いた。
upload/4266/4266fig2.jpg "のfo:コンテンツの幅=" 6インチ "のfo:SRC =" / files/ftp_upload/4266/4266fig2highres.jpg "/>
図2。 9または10塩基対で区切られた二つのヘミメチルGATC部位を含む23から24 bpの長さの二本鎖を用いて得られた使用したオリゴヌクレオチドと結晶の間GATC距離。概要を変化させる効果 。結晶のすべての画像が同じ倍率で撮影し、スケールバーは100μmを示した。各SeqAΔ(41から59) - A25R-DNAの結晶の分解能限界はリガクのRU-300のX線発生装置のシステムで収集された回折像に基づいています。 拡大図を表示するには、ここをクリックしてください 。

図3。トンのDNAを変化させる効果が終了します。まとめ21 bpsの長い二本鎖が9塩基対で区切られた二つのヘミメチルGATC部位を含む、0、1、または2ヌクレオチド5 '末端オーバーハングを含むと彼オリゴヌクレオチドが使用され、結晶が得られた。結晶のすべての画像が同じ倍率で撮影し、スケールバーは100μmを示した。各SeqAΔ(41から59) - A25R-DNAの結晶の分解能限界はX12CとX29(NSLS、BNL)のビームラインで収集された回折像に基づいています。 拡大図を表示するには、ここをクリックしてください 。
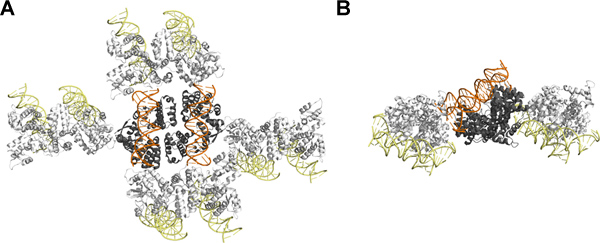
図4。ジヌクレオチドオーバーハングとDNAに結合SeqAΔ(41から59)-A25Rの結晶充填:()上面と側面(B)から見て。非対称単位は、DNAがオレンジ色で表示されている間タンパク質がグレーで表示されます2SeqAΔ(41から59) - A25R-DNA複合体を含んでいます。対称RY関連SeqAΔ(41から59) - A25R-DNA分子は、タンパク質とDNAのために黄色に白で表示されます。この数字はpymolの12を使用して調製した。この数字は、 ムービー1に関連しています。 拡大図を表示するには、ここをクリックしてください 。
映画は1。 ムービーを見るにはここをクリック 。
Access restricted. Please log in or start a trial to view this content.
ディスカッション
高分子のX線結晶学における最大の課題の1つは、回折品質の結晶を得ることである。タンパク質またはタンパク質-DNA複合体の場合には、このチャレンジが最適化されなければならない追加の変数が原因で悪化している。それは広く利用されているDNAの長さと粘り気のオーバーハングの存在は長く擬似二重に隣接するDNA分子の関連付けを強化すると考えられている最適化するための主要なパラ?...
Access restricted. Please log in or start a trial to view this content.
開示事項
特別な利害関係は宣言されません。
謝辞
著者らは、DNA精製のヘルプについては、データ収集とモニカPillon時の援助のためのNSLS(ブルックヘブン国立研究所)でPXRRのスタッフに感謝したいと思います。この作品は、カナダ衛生研究所(MOP 67189)によってサポートされていました。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名称 | 会社 | カタログ# | コメント(オプション) |
| トリス | Bioshop | TRS003.5 | |
| エチレンジアミン四酢酸(EDTA) | フィッシャー·サイエンティフィック | E478-500 | |
| Dithiotheitrolトール(DTT) | 基本バイオ株式会社 | DB0058 | |
| NaClを | Bioshop | SOD002.10 | |
| グリセロール | カレドン | 5350から1 | |
| スクロース | シグマアルドリッチ | S5016-500G | |
| ドデシル硫酸ナトリウム(SDS) | Bioshop | SDS001.500 | |
| 尿素 | Bioshop | URE001.5 | |
| 40パーセント29:1ビス/アクリルアミド | 基本バイオ株式会社 | A0007-500ML | 4℃で保存 |
| ホウ酸 | EMD | BX0865-1 | |
| キシレンシアノールFF | バイオ·ラッド | 161-0423 | |
| ブロモフェノールブルー | Bioshop | BR0222 | |
| デュアル可変垂直ゲルシステム | CBCのサイエンティフィック·カンパニー·インク | DASG-250 | |
| インデックス晶画面 | ハンプトンリサーチ | HR2-144 | 4℃で保存 |
| ウィザード私は結晶化画面 | エメラルドアプライドバイオシステムズ | EBS-WIZ-1 | 4℃で保存 |
| ウィザードIIの結晶化画面 | エメラルドアプライドバイオシステムズ | EBS-WIZ-2 | 4℃で保存 |
| クラシック結晶化画面 | キアゲン | 130701 | 4℃で保存 |
| Intelliplateトレー | アートロビンスインスツルメンツ | 102-0001-00 | |
ソリューション タンパク質精製バッファー:100 mMトリスpH 8、2mMのEDTA、2mMのDTT、5%グリセロール。 タンパク質貯蔵バッファー:20 mMトリスpH 8、150mMのNaCl、5mMのDTT、0.5mMのEDTA、5%グリセロール。 ゲルローディングミックス:オートクレーブ滅菌蒸留H 2 Oの70ミリリットルにショ糖の20グラム、ブロモフェノールブルーを25mg、キシレンシアノールFFの25mg、10%(w / v)のSDSおよび10X TBEの10ミリリットルの1ミリリットルを追加ショ糖が溶解するまで穏やかに加熱して攪拌し、最終的な調整オートクレーブ滅菌蒸留H 2 Oで100mlにボリューム4℃で保存する 2Xローディングバッファー:ゲルローディングミックス10mlに尿素の11グラムを追加します。尿素が溶けるまで、ホットプレート上でかき混ぜる。 4で2 mlチューブ内や店舗内にアリコート℃、 10Xホームページミックス:ミックス尿素の420.4グラム、10X TBEの100ミリリットル(オートクレーブ)、40%、250mlの29:1のddH 2 Oのビス/アクリルアミド完全に溶解するまで攪拌し、1リットルにボリュームを調整します。 4℃の暗所に保管してボトル 10X TBE:ディゾルブ 108グラム トリス、蒸留H 2 Oの1リットル中のホウ酸の55グラムとEDTAの9.3グラムの室温でオートクレーブや店舗。 溶出緩衝液:蒸留H 2 Oの200ミリリットルの5 M NaClを、1Mトリス(pH7.5)、0.5MのEDTA pHが8の0.4ミリリットルの2ミリリットルの希薄8ミリリットル室温でオートクレーブや店舗。 |
参考文献
- Campbell, J. L., Kleckner, N. E. coli oriC and the dnaA gene promoter are sequestered from dam methyltransferase following the passage of the chromosomal replication fork. Cell. 62, 967-979 (1990).
- Guarné, A. Crystal structure of a SeqA-N filament: implications for DNA replication and chromosome organization. Embo. J. 24, 1502-1511 (2005).
- Brendler, T., Austin, S. Binding of SeqA protein to DNA requires interaction between two or more complexes bound to separate hemimethylated GATC sequences. Embo. J. 18, 2304-2310 (1999).
- Jordan, S. R., Whitcombe, T. V., Berg, J. M., Pabo, C. O. Systematic variation in DNA length yields highly ordered repressor-operator cocrystals. Science. 230, 1383-1385 (1985).
- Tan, S., Hunziker, Y., Pellegrini, L., Richmond, T. J. Crystallization of the yeast MATalpha2/MCM1/DNA ternary complex: general methods and principles for protein/DNA cocrystallization. J. Mol. Biol. 297, 947-959 (2000).
- Rice, P. A., Yang, S., Mizuuchi, K., Nash, H. A. Crystal structure of an IHF-DNA complex: a protein-induced DNA U-turn. Cell. 87, 1295-1306 (1996).
- Yang, W., Steitz, T. A. Crystal structure of the site-specific recombinase gamma delta resolvase complexed with a 34 bp cleavage site. Cell. 82, 193-207 (1995).
- Chung, Y. S., Brendler, T., Austin, S., Guarne, A. Structural insights into the cooperative binding of SeqA to a tandem GATC repeat. Nucleic Acids Res. , (2009).
- Anderson, J., Ptashne, M., Harrison, S. C. Cocrystals of the DNA-binding domain of phage 434 repressor and a synthetic phage 434 operator. Proc. Natl. Acad. Sci. U.S.A. 81, 1307-1311 (1984).
- Timsit, Y., Moras, D. DNA self-fitting: the double helix directs the geometry of its supramolecular assembly. Embo J. 13, 2737-2746 (1994).
- Chung, Y. S., Guarne, A. Crystallization and preliminary X-ray diffraction analysis of SeqA bound to a pair of hemimethylated GATC sites. Acta Crystallogr Sect F Struct Biol Cryst Commun. 64, 567-571 (2008).
- DeLano, W. L. The PyMOL Molecular Graphic Systems. , DeLano Scientific. (2002).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved