JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
SeqA-DNA 단지의 결정에 대한 DNA의 Duplexes의 최적화를 반복
요약
단백질 DNA 단지의 결정 구조는 단백질 기능, 메커니즘뿐만 아니라, 특정 상호 작용의 성격에 대한 통찰력을 제공 할 수 있습니다. 여기, 우리는 함께 공동 결정의 길이, 순서 및 이중 DNA의 끝을 최적화하는 방법을보고 대장균 SeqA, 복제 개시의 네거티브 레귤레이터.
초록
에스 케리 키아 대장균 SeqA 복제 1의 기원에서 sequestering hemimethylated GATC 클러스터의 조기 reinitiation 이벤트를 방지 DNA 복제의 부정적인 레귤레이터입니다. 원산지 외에도 SeqA은 복제 포크, 그것이 높은 명령 구조로 새로 복제 된 DNA를 구성 2 발견됩니다. SeqA 동료는 약하게 하나의 GATC 시퀀스로하지만, 여러 GATC 사이트를 포함하는 DNA의 duplexes 높은 친화 단지를 형성한다. SeqA의 최소한의 기능 및 구조 단위는이를 hemimethylated DNA 3 고친 화성 단지를 형성하는 적어도 두 개의 GATC 시퀀스의 요구 사항을 설명하고, 이량 체입니다. 또한, oligomerization과 유연한 링커로 구분하여 DNA 결합 도메인 SeqA 아키텍처, 3 나선형 회전까지로 구분 GATC 반복에 바인딩 할 수 있습니다. 따라서, 분자 수준에서 SeqA의 기능을 이해하는 것은 구조적 아나가 필요합니다SeqA의 용해는 여러 GATC 시퀀스에 바인딩. 단백질 DNA의 결정에서 DNA는 단백질과 DNA의 상대적인 크기와 건축에 따라 포장의 상호 작용에 탁월한 효과 하나도 없다. 단백질은 DNA 나 발자국 DNA의 대부분을보다 큰 경우, 크리스탈 포장은 주로 단백질 단백질 상호 작용에 의해 중재됩니다. 반대로, 단백질이 DNA보다 같은 크기 또는 작은 또는 만 DNA, DNA-DNA 및 DNA-단백질 상호 작용의 일부를 포함 할 때 크리스탈 포장을 지배. 따라서, 단백질 DNA 단지의 결정은 DNA의 길이 4 DNA 종료 (둔기 나 오버행) 5-7의 체계적인 심사가 필요합니다. 이 보고서에서, 우리는 설계, 최적화, 정화 및 구조 결정에 적합한 결정을 얻을 수 SeqA의 dimeric 변형 (SeqAΔ (41-59) - A25R)으로 단지에 나란히 GATC 반복을 포함 hemimethylated의 DNA duplexes을 결정화하는 방법에 대해 설명합니다.
프로토콜
1. 단백질 정제
연결 유연 링커 N-(oligomerization)와 C-터미널 (DNA 바인딩) SeqA 에이즈 DNA에 1-3 회전으로 구분 hemimethylated GATC 반복의 인식 도메인입니다. 본 연구의 경우, 우리는 더 oligomerization과에 의해 독점적으로 구분 직렬 GATC에게 구속력 DNA 반복을 제한 단축 링커을 방지 N-터미널 도메인의 점 돌연변이로 SeqA의 dimeric 변종 (SeqAΔ (41-59) A25R)를 사용 DNA 하나 턴 (그림 1) 2,8.
- T7 프로모터의 제어 아래에있는 플라스미드 인코딩 SeqA와 BL21 (DE3) 세포를 변환,
- 판 100 μg / ML 암피실린 등의 LB-한천 플레이트의 변환 반응
- 소규모 밤 문화를 예방하기 위해 혼합 식민지를 선택 (LB 미디어를 100 μg / ML 암피실린과)
- 다음날 아침은 overni의 1:100 희석을 사용하여 미디어 1 L의 예방ght 문화,
- ~ 0.7의 OD 600 세포를 성장, 1 mm의 최종 농도에 이소 프로필 β-D-1-thiogalactopyranoside (IPTG)의 추가에 의해 단백질 생산을 유도,
- , 궤도는 떨고으로 37 ° C에서 3 시간에 부화를 계속하고 원심 분리 (3,300그램 10 분)하여 세포를 수확
- 정화 버퍼에있는 셀 펠렛을 Resuspend하고 sonication에 의해 lyse,
- 원심 분리 (39,000그램에서 40 분)에 의해 lysate를 지우고 정화 버퍼와 equilibrated 헤파린 열로 표면에 뜨는로드,
- Elute SeqA는 1 M NaCl (~ 0.7 M NaCl에서 SeqA elutes)에 선형 그라디언트를 사용하여
- 함께 수영장 SeqA 함유 분수를 정화 버퍼와 equilibrated 양이온 교환 크로마토 그래피 칼럼으로 이온 샘플의 강도와 하중을 낮출 희석,
- 선형 소금 그라디언트를 사용하여 순수한 SeqA은 ~ 0.4 M NaCl에서 elutes
- 함께 수영장 SeqA 함유 분수를 concentrat전자 (3 MG / ML) 및 스토리지 버퍼에 저장.
2. DNA의 정제
- 좋아하는 회사의 주문 보완 unmethylated과 methylated oligonucleotides,
- , autoclaved ddH 2 O, 소용돌이 800 μl의 각 동결 건조 된 단일 스트랜드 DNA의 1 μmol를 해산하고 10-20 분 동안 앉아 보자
- 각 oligonucleotide에 preheated 2X 로딩 버퍼 800 μl를 추가
- 20-30 세포핵 긴 oligonucleotides를 들어, 대형 10% denaturing 젤 (160 x 250 크기 × 1 ㎜) 준비 :
* 잘 10 % PAGE 믹스, 80 μl TEMED와 젤 당 800 μl 암모늄 persulfate의 80 ML을 섞어서 부어,
* 일단 polymerized, 빗을 제거하고 ddH 2 O 철저으로 우물을 헹굼
* 냉각 판 등의 겔 캐스트에 젤을 조립하고 (1X TBE) 버퍼를 실행으로 상단과 하단 저수지를 작성,
* 55 ° C에 젤을 따뜻하게 700-750 V에 젤을 미리 실행
* 실행을 중지하고 우물 thoro 씻어ughly 버퍼를 실행으로. - 90 oligonucleotides를 가열 ° C를 2 분 동안
- 소용돌이와 샘플을 스핀 즉시 젤을로드하기 전에,
- ~ 700 V에서 젤을 실행하여 oligonucleotide 중간 마이그레이션되면 그만 해요. (10 % polyacrylamide 젤에서 bromophenol 파란색 ~ 60 염기 길이와 ~ 20 염기 길이 크실렌 cyanol FF oligonucleotides와 공동 마이그레이션합니다)
- 젤 중지, 젤 상자에서 분해하고 스페이서를 제거
- 평평한 표면에 하나의 유리 플레이트를 제거하고 랩으로 젤을 커버
- , 젤을 돌려서 다른 유리 플레이트를 제거하고 랩으로 커버
- , DNA의 그림자를 볼 수 젤 뒤에 UV 빛과 형광 플레이트를 사용하여 밴드를 선택
- 작은 조각으로 면도날로 밴드를 잘라 멸균 15 ML 튜브에 넣어 전송
- 용출 버퍼 9 ML을 추가하고 교반으로 37 ° C에서 하룻밤 elute,
- 조심스럽게 솔루션을 전송전송 아크릴 아미드의 조각을 방지하고 pH를 7 3 M의 아세트산 나트륨 (1시 10분 희석) 1 ML 플러스 차가운 100 % 에탄올 (2.5 권)의 25 ML을 추가하려면 젤 로딩 피펫 팁을 사용하여 autoclaved 원심 분리기 튜브까지,
- 적어도 3 시간에 -20 ° C에서 알을 품다,
- , 스핀 다운, 별도의 튜브로 표면에 뜨는 전송
- 중간 불로 속도-VAC에서 펠렛을 건조,
- autoclaved ddH 2 O 400 μl의 펠렛을 Resuspend하고 신선한 튜브로 전송,
- 산도 7 3 M의 아세트산 나트륨 및 100 % 에탄올 1 ML의 40 μl 추가, 잘 혼합 (소용돌이)와 실온에서 30 분 배양는 -20에서 30 분 ° C, 다음
- 18,000그램 15 분 동안 회전하고 표면에 뜨는을 취소,
- 18,000그램의 6 분의 펠릿과 스핀에서 잔류 소금을 제거 70 % 감기에 에탄올 100 μl로 펠릿을 씻어. , 에탄올을 무시하고 속도 VAC에서 펠릿 건조
- autoclaved ddH 100 μl의 총 펠릿을 Resuspend 2 O. , oligonucleotide의 농도를 측정
- hemimethylated DNA의 duplexes을 단련하기 위해 그들에게 물을 욕조 안에 실내 온도로 서서히 냉각 해 다음 보완 한 가닥 몰 농도를 혼합 ° C 5 분을위한 물 목욕에 95 혼합물을 가열합니다.
3. 단백질 DNA 복합체 형성과 분석
- 정화 SeqAΔ의 동등한 볼륨 (41-59) - 대답 25 (81 μM)와 hemimethylated DNA (81 μM)을 혼합
- 4에 15 분 및 매장 동안 실온에서 배양 ° C 당신은을 사용 할 준비가 될 때까지,
- 상업 스파 스 매트릭스 스크린을 사용하여 결정화 조건 스크린,
- 초기 결정화 리드가 확인 된 후, 회절 품질 결정을 성장 조건을 최적화
- 중 25 % 최종 농도 (로 결정 솔루션에 PEG 400 현재의 양을 증가하여 발생하는 SeqA-DNA의 결정을 CryoprotectV / V) 또는 결정화 솔루션에 20 % 글리세롤 (V / V)를 추가
- 나일론 루프와 개인의 결정을 퍼 담아 액체 질소에서 그들을 플래시 동결,
- 100 K. 각 크리스탈의 회절 한계를 테스트
4. 대표 결과
hemimethylated GATC 서열 사이의 분리 (I), 이중의 (II) 길이하며, (iii) : hemimethylated DNA에 바인딩 SeqAΔ (41-59) A25R의 결정 구조를 얻으려면, 우리는 연속적으로 DNA에 세 매개 변수를 최적화 부재 / 5 'overhangs의 존재.
전기 이동성 교대 assays는 SeqAΔ (41-59) - A25R은 우선적으로 9-10 기본 쌍 (그림 1)로 구분 GATC 반복 바인딩을 나타냅니다. 따라서, 우리는 처음에 긴 9 또는 10 bps에 의해 두 개의 hemimethylated GATC 시퀀스를 포함하는 (bps) duplexes에게 23-24 기본 쌍 검사를 실시했습니다. 세 duplexes가 잘 모양의 크리스털을 (그림 2) 굴복. 알높은 해상도 diffracted 결정 중 어느 것도, 23 9 bps의 GATC 분리가 결정에 대한 선호 것을 나타내는 나머지보다 더 X-선 diffracted 9 bps로 구분하여 두 GATC 사이트와 긴 양면을 bps하지 찬사를 보냅니다. 따라서 이후의 모든 화면 9 bps로 간 GATC 간격을 고정.
여러 DNA 분자가 결정 구에서 B-DNA 연속을 형성하기 위해 머리 - 투 - 꼬리를 쌓을 수 있기 때문에 일반적으로 DNA의 결정은 정확한 나선형 회전에 대응하는 이중 길이에 대한 선호된다. 따라서, 우리는 21 bps (즉,이 나선형 회전)에 duplexes의 전체 길이를 단축. 무딘 끝으로 21 bps 복층 아파트 회절 품질 결정 (데이터가 게재되지 않음), 크리스털를 얻을 수 않았습니다 양쪽 끝에서 염기 하나 5 '오버행과 21 bps 이중 우리의 가정 원본에있는 5로 diffracted.를 얻을 수 없습니다 않았지만 회절 한계에 개선 엔드 - 투 - 엔드 이중 협회가 실제로 선호 것을 제안ING 크리스탈 포장.
SeqA는 DNA의 동일한 얼굴에있는 GATC 서열과 상호 작용 때문에, DNA의 이중의 반대 얼굴은 용매에 노출되어야합니다. 더 복잡한의 결정을 개선하기 위해, 우리는 다음 이중의 반대 얼굴을 통해 크리스탈에 인접한 DNA 분자와 그루브 - 백본 상호 작용을 촉진하는 두 GATC 사이트 간의 CG의 다이 뉴클레오타이드, 방법을 포함하도록 이중의 순서를 수정 그는 지난 10 DNA의 결정을 향상하는 데 사용되었습니다. 그러나, CG - 포함 이중으로 성장 결정의 회절 제한이 CG의 다이 뉴클레오타이드 (그림 3)을 포함하지 않은 비슷한 DNA의 이중과 함께 성장 동일했다. 이 결과는 그루브 - 백본 상호 작용이 경우에 중요하지이라고 지적했다. 우리는 이후 각에 두 개의 추가 세포핵을 가진 DNA의 이중과 재배 결정을 비교하여 overhangs의 길이를 최적화5 '끝. 이 변경 사항은 수정 형태에 큰 영향을 미쳤다뿐만 아니라, 회절 한계는 추가 염기가 극적으로 분자 연락처 및 강화 크리스탈 조직 (그림 3) 변경을 나타냅니다.
SeqAΔ (41-59) - A25R의 결정 구조는 DNA의 이중의 자유로운 얼굴 크리스탈 주소록에 관여하지 않는 것으로 확인이 마지막 DNA의 이중에 바인딩 같은 CG-다이 뉴클레오타이드를 도입의 제한된 효과 기대. 단백질과 DNA의 상대적인 크기에도 불구하고, 대칭 친구 사이의 대부분의 상호 작용은 단백질 단백질과 단백질 DNA 상호 작용 (그림 4)에 의해 중재됩니다. 흥미롭게도,이 특정 경우에, 5 '다이 뉴클레오타이드의 오버행의 유익한 효과는 의사 연속 DNA의 형성으로 인해하지 않습니다. 대신 5 '거리 DNA 축에서 methylated 스트랜드 프로젝트의 끝과 왜 두 세포핵에게 w를 설명, 단지의 근위 SeqA 분자와 상호 작용 오히려 엄격하게 8,11 포장 크리스탈을 변경해야합니다.
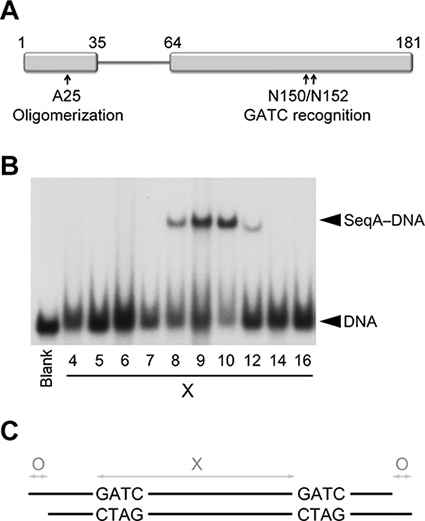
1 그림. hemimethylated DNA에 SeqAΔ (41-59) - A25R의 바인딩. SeqA의 도메인 (A) 개략도 중재 단백질 oligomerization과 DNA 바인딩이. 기본 쌍의 증가 (을 사이에두고 두 개의 hemimethylated GATC 서열을 포함하는 DNAs과 SeqAΔ (41-59) A25R의 (B) 전기 영동 이동 분석 X). 가장 왼쪽 차선은 (공백 표시) SeqAΔ의 부재 (41-59)의 두 GATC 시퀀스 사이의 몰 5 DNAs의 혼합물, 7, 12, 21, 25, 34 기본 쌍을 포함 - A25R. (C) 다이어그램 회절 품질 결정을 얻기 위해 DNA의 duplexes에 최적화 된 세 가지 변수를 묘사.
upload/4266/4266fig2.jpg "강한 : 콘텐츠 폭 ="6in "강한 : SRC ="/ files/ftp_upload/4266/4266fig2highres.jpg "/>
그림 2. 9 또는 10 기본 쌍을 사이에두고 두 개의 hemimethylated GATC 사이트를 포함하는 23-24 BP 긴 duplexes로 얻은 사용 oligonucleotides와 크리스탈의 상호 GATC 거리에 있습니다. 요약 다양한 효과. 결정의 모든 사진은 같은 배율로 촬영하고 규모 바는 100 μm을 나타냅니다되었습니다. 각 SeqAΔ의 해상도 제한 (41-59) A25R-DNA는 결정은 Rigaku RU-300 X-선 발생기 시스템에서 수집 된 회절 이미지를 기준으로합니다. 큰 그림을 보려면 여기를 클릭하십시오 .

그림 3. t의 DNA를 변화의 효과가 끝납니다. 요약21 bps 긴 duplexes 9 기본 쌍을 사이에두고 두 개의 hemimethylated GATC 사이트를 포함하고 0, 1 또는 2 염기 5 '최종 overhangs을 포함와 그 oligonucleotides는 사용 결정 냈다. 결정의 모든 사진은 같은 배율로 촬영하고 규모 바는 100 μm을 나타냅니다되었습니다. 각 SeqAΔ의 해상도 제한 (41-59)은-A25R-DNA 크리스탈은 (NSLS, BNL) X12C와 X29 beamlines에서 수집 회절 이미지를 기준으로합니다. 큰 그림을 보려면 여기를 클릭하십시오 .
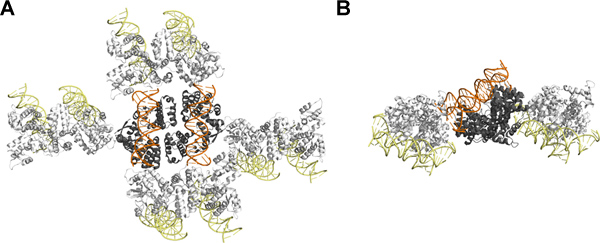
4 그림. SeqAΔ의 맑고 포장 (41-59) - A25R는 다이 뉴클레오타이드의 오버행과 DNA에 바인딩 : (A) 상단과 측면 (B)에서 본. 비대칭 단위는 두 SeqAΔ (41-59)를-A25R-DNA의 DNA가 주황색으로 표시되는 동안 단백질은 회색으로 표시됩니다 단지가 들어 있습니다. Symmet보시지 관련 SeqAΔ (41-59) A25R-DNA 분자는 단백질과 DNA에 노란색에 흰색으로 표시됩니다. 이 수치는 PyMOL 12를 사용하여 준비되었습니다. 이 수치는 영화 일에 관련된 것은. 큰 그림을 보려면 여기를 클릭하십시오 .
영화는 1. 동영상을 보려면 여기를 클릭하십시오 .
Access restricted. Please log in or start a trial to view this content.
토론
macromolecular X-선 결정학에서 가장 큰 도전 중 하나는 회절 품질 결정을 획득하고 있습니다. 단백질 또는 단백질 DNA 단지의 경우,이 도전은 최적화되어야합니다 추가 변수로 인해 악화됩니다. 그것은 널리 DNA의 길이와 끈적 overhangs의 존재가 더 이상 가상 이중의 주요 매개 변수를 최적화하는 것입니다에 인접한 DNA 분자의 연결을 강화하기 졌다고합니다. 그러나, 우리는 이러한 overhangs의 특성과 길?...
Access restricted. Please log in or start a trial to view this content.
공개
관심 없음 충돌이 선언 없습니다.
감사의 말
저자는 DNA 정화와 관련하여 도움이 데이터 수집 및 모니카 Pillon 동안 도움을 NSLS (브룩 헤이븐 국립 연구소)에서 PXRR 직원을 감사하고 싶습니다. 이 작품은 건강 연구의 캐나다 연구소 (걸레 67189)에 의해 지원되었다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 시약의 이름 | 회사 | 카탈로그 # | 코멘트 (선택 사항) |
| 트리스 | Bioshop | TRS003.5 | |
| Ethylenediaminetetraacetic 산 (EDTA (에틸렌 다이아 민 테트라 초산)) | 피셔 과학 | E478-500 | |
| Dithiotheitrol (DTT) | 바이오 기본 주식회사 | DB0058 | |
| NaCl | Bioshop | SOD002.10 | |
| 글리세린 | Caledon | 5350-1 | |
| 자당 | 시그마 - 알드리치 | S5016-500G | |
| 나트륨 dodecyl 황산 (SDS) | Bioshop | SDS001.500 | |
| 요소 | Bioshop | URE001.5 | |
| 40% 29:1 BIS / 아크릴 아미드 | 바이오 기본 주식회사 | A0007-500ml | 4에 저장 ° C |
| 붕산 | EMD | BX0865-1 | |
| 크실렌 cyanol FF | 바이오 RAD | 161-0423 | |
| Bromophenol 블루 | Bioshop | BR0222 | |
| 이중 조절 수직 젤 시스템 | CBC 과학 회사 주식회사 | DASG-250 | |
| 인덱스 결정화 화면 | 햄튼 연구 | HR2-144 | 4에 저장 ° C |
| 마법사 I의 결정 화면 | 에메랄드 BioSystems | EBS-마법사-1 | 4에 저장 ° C |
| 마법사 II의 결정 화면 | 에메랄드 BioSystems | EBS-마법사-2 | 4에 저장 ° C |
| 클래식 결정 화면 | Qiagen | 130701 | 4에 저장 ° C |
| Intelliplate 트레이 | 예술 로빈스 악기 | 102-0001-00 | |
솔루션 단백질 정화 버퍼 : 100 MM 트리스 산도 8, 2 MM EDTA (에틸렌 다이아 민 테트라 초산), 2 MM DTT와 5 % 글리세롤. 단백질 저장 버퍼 : 20 MM 트리스 산도 8, 150 MM NaCl, 5 MM DTT, 0.5 MM EDTA (에틸렌 다이아 민 테트라 초산) 및 5 % 글리세롤. 젤 로딩 믹스 : autoclaved ddH 2 O.의 70 ML에 자당의 20g, bromophenol 파란색의 25 밀리그램, 크실렌 cyanol FF의 25 밀리그램, 10 % w / V SDS의 1 ML과 10X TBE의 10 ML을 추가 자당이 용해 될 때까지 약한 난방 저어 및 최종을 조절볼륨 100 autoclaved ddH 2 O.있는 ML 4 ° C.에 저장 2X로드 버퍼 : 젤 로딩 믹스의 10 ML에 요소의 11g을 추가합니다. 요소가 해소 될 때까지 뜨거운 접시에 젓는다. 4 2 ML 튜브 및 매장에서 나누어지는 ° C. 10X PAGE 믹스 : 믹스 요소의 420.4 g, 10X TBE의 100 ML (autoclaved), 40 % 250 ML 29:1 ddH 2 O.에서 BIS / 아크릴 아미드 완전히 용해 될 때까지 저어 및 1리터에 볼륨을 조정할 수 있습니다. 4 ° C.에서 어두운 병에 저장 10X TBE : 디졸브 108g 트리스, ddH 2 O. 1 리터에 붕산의 55g과 EDTA (에틸렌 다이아 민 테트라 초산) 9.3 g의 상온에서 압력솥 및 매장. 용출 버퍼 : ddH 2 O. 200 ML 5 M NaCl, 1 M 트리스 산도 7.5, 0.5 M EDTA (에틸렌 다이아 민 테트라 초산) 산도 8 0.4 ML 2 ML의 희석 8 ML 상온에서 압력솥 및 매장. |
참고문헌
- Campbell, J. L., Kleckner, N. E. coli oriC and the dnaA gene promoter are sequestered from dam methyltransferase following the passage of the chromosomal replication fork. Cell. 62, 967-979 (1990).
- Guarné, A. Crystal structure of a SeqA-N filament: implications for DNA replication and chromosome organization. Embo. J. 24, 1502-1511 (2005).
- Brendler, T., Austin, S. Binding of SeqA protein to DNA requires interaction between two or more complexes bound to separate hemimethylated GATC sequences. Embo. J. 18, 2304-2310 (1999).
- Jordan, S. R., Whitcombe, T. V., Berg, J. M., Pabo, C. O. Systematic variation in DNA length yields highly ordered repressor-operator cocrystals. Science. 230, 1383-1385 (1985).
- Tan, S., Hunziker, Y., Pellegrini, L., Richmond, T. J. Crystallization of the yeast MATalpha2/MCM1/DNA ternary complex: general methods and principles for protein/DNA cocrystallization. J. Mol. Biol. 297, 947-959 (2000).
- Rice, P. A., Yang, S., Mizuuchi, K., Nash, H. A. Crystal structure of an IHF-DNA complex: a protein-induced DNA U-turn. Cell. 87, 1295-1306 (1996).
- Yang, W., Steitz, T. A. Crystal structure of the site-specific recombinase gamma delta resolvase complexed with a 34 bp cleavage site. Cell. 82, 193-207 (1995).
- Chung, Y. S., Brendler, T., Austin, S., Guarne, A. Structural insights into the cooperative binding of SeqA to a tandem GATC repeat. Nucleic Acids Res. , (2009).
- Anderson, J., Ptashne, M., Harrison, S. C. Cocrystals of the DNA-binding domain of phage 434 repressor and a synthetic phage 434 operator. Proc. Natl. Acad. Sci. U.S.A. 81, 1307-1311 (1984).
- Timsit, Y., Moras, D. DNA self-fitting: the double helix directs the geometry of its supramolecular assembly. Embo J. 13, 2737-2746 (1994).
- Chung, Y. S., Guarne, A. Crystallization and preliminary X-ray diffraction analysis of SeqA bound to a pair of hemimethylated GATC sites. Acta Crystallogr Sect F Struct Biol Cryst Commun. 64, 567-571 (2008).
- DeLano, W. L. The PyMOL Molecular Graphic Systems. , DeLano Scientific. (2002).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유