このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
遺伝子発現とE4orf4誘発細胞死にノックダウン効果の測定のための条件付きノックダウン細胞株の作製
要約
E4orf4誘導細胞死へのACFのクロマチンリモデリング因子の寄与を測定した。プロトコルはドキシサイクリン治療がACFユニットAcf1とSNF2hの条件付きノックダウンを誘導し、誘導細胞株でE4orf4誘導される細胞死を測定するためのDAPIアッセイを使用した細胞クローンの選択が含まれています。
要約
哺乳動物細胞における遺伝子発現の機能的不活性化は、様々な経路1,2に、目的のタンパク質の寄与の研究にとって極めて重要である。構成的なノックダウンが時間3月5日の長い期間のための細胞によって許容されていない場合しかし、遺伝子発現のノックダウン条件は場合に必要です。ここでは、ACFのクロマチンリモデリング因子のサブユニットの条件付きノックダウンを可能にする細胞株を調製するためのプロトコルを記述します。これらの細胞株は、アデノウイルスE4orf4タンパク質6による細胞死の誘導へのACFの寄与の決定を容易にする。 ACFのクロマチンリモデリング因子のAcf1とSNF2hサブユニットに対する短いヘアピンRNAをコードする配列はまた、ネオマイシン耐性遺伝子の遺伝子を含むプラスミドでドキシサイクリン誘導性プロモーターの隣にクローン化した。ネオマイシン耐性細胞クローンは、G418と孤立の存在下で選択した。得られた細胞ラインはによって誘発されたドキシサイクリン治療は、一度Acf1またはSNF2h発現レベルが低下した、細胞をコードするプラスミドE4orf4または空ベクターでトランスフェクトした。 shRNAコンストラクトの具体的な効果を確認するために、Acf1またはSNF2hタンパク質レベルはサイレント変異を導入することにより、shRNAのに耐性がレンダリングされた発現プラスミドAcf1またはSNF2hと共トランスフェクションすることにより、WTのレベルに復元されました。様々な試料に細胞死を誘導するE4orf4の能力は、トランスフェクトされた細胞集団におけるアポトーシスの形態を有する核の出現頻度が7-9を測定されたDAPIのアッセイによって決定した。
構成的なノックダウン細胞が致死であるかもしれない場合、ここで説明プロトコルは場合に限り、そのタンパク質パートナーによる細胞死の誘導に種々のタンパク質の機能的貢献の決定に利用することができる。
プロトコル
1。誘導性細胞株の作製
- 実験1の前に、目的の細胞株の調製のために使用されるすべての細胞を死滅させる薬剤G418の最小濃度を見つける必要があります。この目的のために、プレートの実験中に使用し、G418の濃度を増加させ(ml当たり0〜1,000μg)を追加する培地中でコンフルエント70%でいくつか重複してプレートで選択したセル。効率的に細胞を死滅させる最小限のG418濃度を決定するために、毎日細胞を監視します。細胞死は3-7日以内に観察される。
- それはshRNAを発現するプラスミドは研究対象の遺伝子のある程度式に減らすことができることを一過性トランスフェクションアッセイによって確認することが推奨された細胞株の世代の前に。これは、効率的にトランスフェクトすることができる任意のセルラインで行うことができる。
- プレート10パーセントテトSYを含むDMEM培地(8mlに10cmプレートあたり約5×10 6細胞の密度でT-REX-293細胞ステムが承認したFBS、2mM L-グルタミン、mlペニシリンおよびストレプトマイシンあたり0.1mg、ミリリットルブラストあたり5μg当たり100単位)。 37℃で一晩プレート℃、5%CO 2でインキュベートする 。
- 翌日、トランスフェクションの前に8ミリリットル新鮮な培地に変更します。
- テトラサイクリン誘導性H1プロモーター、ならびにGFPと融合および構成PGKプロモーターによって駆動されるネオマイシン耐性遺伝子によって駆動pSuperior.neo + GFPプラスミド( 図1)エンコーディングAcf1またはSNF2h shRNAの10μgを用いて細胞をトランスフェクトする。 150mMのNaClを500μlにDNAを追加。 μgのDNAあたり2μlの時150mM NaClを500μlの別のアリコートにjetPIE試薬を追加します。 DNAにjetPIE溶液を加え、ボルテックスでよく混和する。室温で15分間インキュベートする。穏やかに70から80パーセントコンフルエントの細胞を含む10cmプレート上にDNA複合体をピペット。インキュベーターにプレートを返す。
- 翌日は、選択培地(DMEM培地などでメディアを交換)mlのG418あたりの追加500μgを含有する上記。
- コロニーが現れると顕微鏡なしに可視化することができるようになるまで3〜4日ごとに次の2週間のために細胞を監視して、似たような新鮮な培地と選択培地を交換してください。
- コロニーの単離の前に、選択培地を用いて、24ウェルプレートを準備します。
- 目でコロニーを識別し、着色されたマーカーを用いて、プレートの下部にその位置をマークします。コロニーがよく分離されていることを顕微鏡で確認します。
- 無菌フードでは、優しく温かいPBSで洗い、よく、すべての残りの液体を吸引し、プレートから培地を吸引除去する。プレート上の1つのコロニーを0.25%トリプシン/ EDTAを3μlを追加します。細胞が剥離し、24ウェルプレート中のウェルの1つに追加するまで繰り返してトリプシンをピペット。皿の上に他のいくつかのコロニーのためにこれを繰り返します。
- 彼らは十分に埋めるまで、37℃、5%CO 2で細胞を成長させる。その後に由来する細胞を分割3つのウェルに、元植民地、独立した12ウェルプレートの各それぞれ、一晩インキュベートする。
- 翌日、ダブル蒸留水(ml当たり1から5ミリグラム)で調製した原液からドキシサイクリンミリリットル当たり1μgを含む培地で1プレートに培地を交換してください。ドキシサイクリンを含まない培地でコントロールプレート内の培地を交換してください。 37℃で72時間細胞をインキュベート℃、5%CO 2で 。
- Acf1またはSNF2hノックダウンの効率を決定するために処理したものとタンパク質抽出およびウエスタンブロット分析の準備のため、各細胞クローンの井戸未処理1から細胞を回収する。ローディングコントロールとして機能するだけでなく、α-チューブリンに対する抗体としてAcf1またはSNF2hに対する抗体を使用してください。よく第三中の細胞を使用し、ドキシサイクリンの添加は、研究対象のタンパク質のレベルで少なくとも50%の削減につながっている選択された細胞クローンの拡大のため、放置。さらなる使用のための90%のFBS、10%DMSO中でこれらの細胞のアリコートをフリーズします。
- 10cmプレートで選択培地中で細胞をプレート。 2分の1プレートにミリリットルあたり1μgにドキシサイクリンを追加し、37℃、48〜72時間( 図4を参照)を、5%CO 2。
- 48から72時間後、ドキシサイクリンの有無にかかわらず、同じ培地で数を数える、細胞の各グループから細胞をトリプシン処理し、プレート6cmのプレート当たり1.5×10 6個の細胞。 37℃、5%CO 2で一晩細胞をインキュベートします。セクション2.1からのプレートの各グループは、各ポイントのDAPIのアッセイのための2つの重複だけでなく、各サンプルのウェスタンブロット分析のために一枚の板を含む12 6cmのプレート( 図4参照)のために細胞を提供するように計画します。
- ベクトル4μgのと一緒に、空のプラスミド1μgのプラスミドまたはエンコーディングE4orf4の同一量:翌日のプラスミドは、以下の組み合わせで6cmのプレートで細胞をトランスフェクトAcf1-GFPまたはSNF2h-GFPを発現するサイレント突然変異、または対応する空のベクトルと1μgのプラスミドGFP発現( 図4)3μgの導入による細胞クローンにおけるshRNAのに耐性がレンダリングされます。トランスフェクション混合物を調製するために上記のようjetPIE試薬(5μgのDNAあたり10μl)を使用します。各サンプルについて、3つのプレートのためのトランスフェクション混合物を準備します。
- 室温でjetPIE試薬とDNAの15分間のインキュベーションの後、穏やかに3 6cmのプレートにそれぞれトランスフェクション混合物からDNA複合体の等量をピペットで、37℃、5%CO 2で一晩インキュベートする。
3。トランスフェクトされた細胞におけるDAPIアッセイ
- 翌日、Acf1またはSNF2hが効率的にノックダウンされていることとE4orf4が異なる試料でも同様に発現していることを決定するためにウェスタンブロット分析のためのサンプルあたり1つのプレートからタンパク質を抽出します。
- DAPIのために意図プレートから培地を吸引するアッセイ、PBSで穏やかにプレートを洗浄し、細胞をカバーするためにPBS中で調製し、4%パラホルムアルデヒドの1 mlを加える。この化学物質と細胞のパラホルムアルデヒド溶液と治療の調製化学フード内で行われるべきである。振とうせずに室温で15分間インキュベートする。
- パラホルムアルデヒドを吸引除去し、PBSで3回洗浄し、5分毎に時間室温でロッキング。少なくとも1時間、-20℃〜-20℃で、インキュベートに保ち、80%エタノールを加える。プレートは、彼らはエタノールの蒸発·乾燥を防ぐために十分に密封されている限り、数日間、-20℃でエタノール下に保つことができる。
- エタノールを吸引除去し、PBSで細胞を2回洗浄し、PBSで一度-BT(PBS中0.5%BSAおよび0.05%Tween-20を含む)と、5分毎に時間室温でロッキング。
- 室温で揺らしながら非特異的抗体の結合を防止するために、20分間、10%ヤギ血清を含む1mlのPBS-BTバッファに細胞をブロック。次にトンを洗うPBS-BTの二回、彼はセル、各5分間洗浄。
- 室温で揺らしながら1時間、1mlのPBS-BTの一次抗体(私たちの場合はE4orf4特異的抗体)で細胞をインキュベートする。次いでPBS-BTで二度洗浄し、PBSで一度に0.1%のBSA、各5分間洗浄を含む。
- 暗闇の中で、室温で揺らしながら適切な二次蛍光標識された抗体と40分間、DAPI mlの最終濃度あたり0.5μgを含有するPBS-0.1%BSAを1mlの細胞をインキュベートします。その後、5分間PBSで洗浄し、吸引によりよく乾燥させ、完全な乾燥を実現するために一晩にさらに1時間プレートを逆さまにしておく。その後Fluoromount™を-G溶液を用いて、細胞にカバースライドをマウントします。 4でプレートを保つ℃を暗闇の中でアポトーシス核をカウントする準備ができるまで。
- 公平な方法で行うことができますので、様々な試料にアポトーシス核を数えて、新しい番号で様々なプレートを識別するために、同僚に依頼してください。
- uの下の細胞を可視化する400X(空気中)または630×(浸油中)の倍率でpright蛍光顕微鏡。各サンプルで表現様々なタンパク質を染色し、トランスフェクトされた細胞集団内のDAPI染色により可視凝縮や断片化した核の数を数えるトランスフェクトされた細胞を識別します。いくつかのフィールドを監視し、少なくとも200トランスフェクトされた細胞の総数をカウントします。
- トランスフェクトされた細胞集団内のアポトーシス形態と核の割合を計算します。様々なサンプルの間の変化の統計的有意性を計算するために、重複して、2〜3回の実験を繰り返してください。
4。代表的な結果
遺伝子発現のノックダウン条件が成功されたコロニーを得る効率が関与する遺伝子に応じて、変数です。我々の手で、私たちはSNF2hためAcf1及び18のうち6のテスト12のうち7成功したコロニーを得た。 図2は、sh選択された細胞クローンの代表的なプレート( 図2A)と同様に、単一のコロニー( 図2B)を OWS。 図3は、72時間ドキシサイクリンの存在下または非存在下で増殖させた種々のクローンの細胞から抽出したタンパク質を用いて調製代表ブロットを示す。ブロットは、ローディングコントロールとして、SNF2hへとα-チューブリンに対する抗体で染色した。クローンのうちの2つ(番号4および5)ドキシサイクリン誘導時SNF2hレベルの大幅な減少を示した。それはpSuperior.neo + GFP細胞株の生成のために使用される( 図1)プラスミドはネオ-GFP融合タンパク質をコードしているものの、安定細胞株における緑色蛍光が非常に低く、他のGFP融合タンパク質の発現に留意すべきであるこれらの細胞に一過性に導入が簡単に背景の上に緑色蛍光を検出することができた。
実験の概略図は、MEAに細胞クローンで実施確かAcf1またはE4orf4誘導される細胞死に対するSNF2hノックダウンの影響をFig。 4。ドキシサイクリン治療によって遺伝子発現のノックダウンに要する時間はレベルが低減すべきタンパク質の安定性に応じて変えることができる。 Acf1とSNF2hについては、72時間処理は、タンパク質レベルでの効率的なノックダウンのために必要であった。
図5は、E4orf4とGFPを発現し、凝縮や断片化形態を有するDAPI染色核の出現によって明らかにされた細胞死を起こしている細胞の一例を、 図6は、ドキシサイクリン誘起Acf1ノックダウンにつながったことを示している代表的な実験の結果を示していますE4orf4刺激された細胞死の増加( 図6A)。この増加はE4orf4レベル( 図6B)の増加に起因していませんでした。さらに、ドキシサイクリン誘導細胞へAcf1の回復はレベルにE4orf4毒性の増加を減少非誘導細胞( 図6)で観察された。
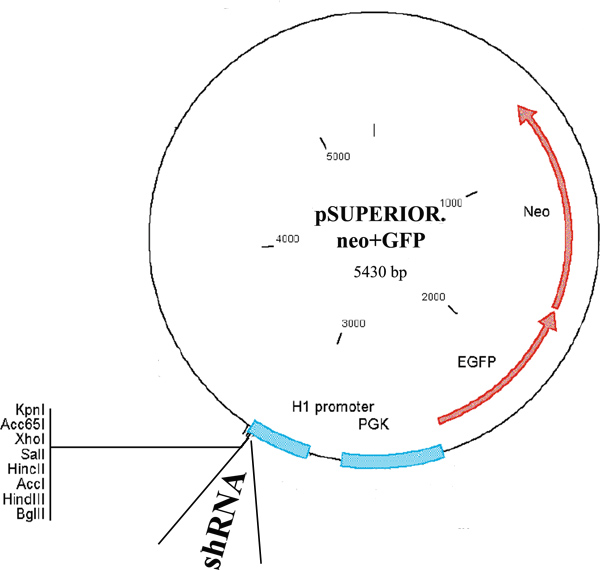
図1。プラスミドpSuperior.neo + GFPの地図。マップは、shRNA発現とneo-GFP融合タンパク質のPGKプロモーター駆動発現を駆動するテトラサイクリン誘導性H1プロモーターを示しています。マップはOligoEngine pSuperiorマニュアルから脚色したものです。
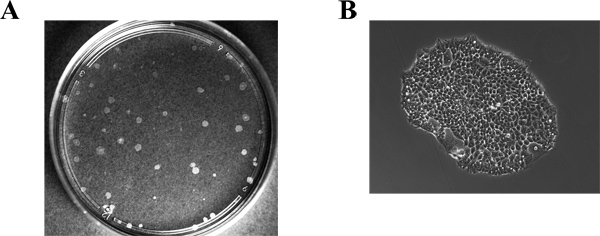
図2。ネオマイシン耐性コロニーの同定。コロニーを含むプレートの画像()および単一コロニーの(B)が表示されます。コロニーは、ネオマイシンを含む選択培地で培養することにより、14日間の細胞を得た。
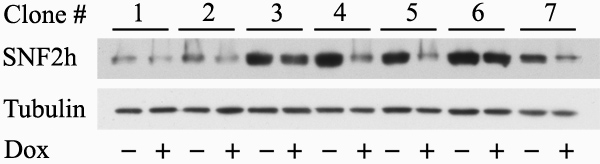
図3。選択したコロニーでのノックダウン効率の検討。ネオマイシンの存在下で選択されたいくつかのコロニーの細胞が重複したウェルで播種した。各試料の1つのウェルは、ドキシサイクリンによって誘導された(+)と1はよく未処理のまま放置されました( - )。タンパク質は、72時間後に誘導を抽出し、SDS-PAGE上でクロマトグラフィーした。ウエスタンブロット法を用いて、SNF2hへとα-チューブリン(ローディングコントロールとして機能する)に対する抗体で染色し、順次誘導およびコントロール細胞におけるSNF2hレベルを示した。
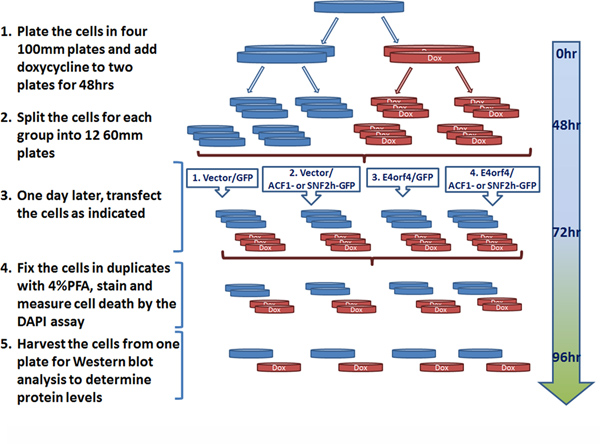
図4。典型的なノックダウン-DAPIアッセイ実験を計画している。実験の連続ステップがAcf1またはSNF2hノックダウン、Acf1またはSNF2h発現を回復したり、EMPを導入するトランスフェクションを達成するためのドキシサイクリン治療などが示されているtyはベクトルと細胞にE4orf4またはそれに対応する空のベクターを導入すること、および結果の分析。ドキシサイクリン処理プレートは赤で表示されます(DOX)とコントロールプレートが青色で記されています。 拡大図を表示するには、ここをクリックしてください 。

図5。 DAPIアッセイによるE4orf4誘導細胞死の検出図4で説明した様々な治療を受けた細胞は、トランスフェクトされた細胞の核を可視化するために固定されており、E4orf4特異的抗体およびDAPIで染色した。この具体的な絵はE4orf4と制御GFPタンパク質を含むサンプルから取られました。 ()GFP。 (B)はE4orf4。 (C)はDAPI。 (D)がマージされた画像。白い矢印マーク、GFPとアポトーシス形態と核を含むE4orf4-トランスフェクトされた細胞。赤い矢印アポトーシス核としてカウントされません不規則な形状の核をマーク。ただ分けているアスタリスクマーク分裂核または核。
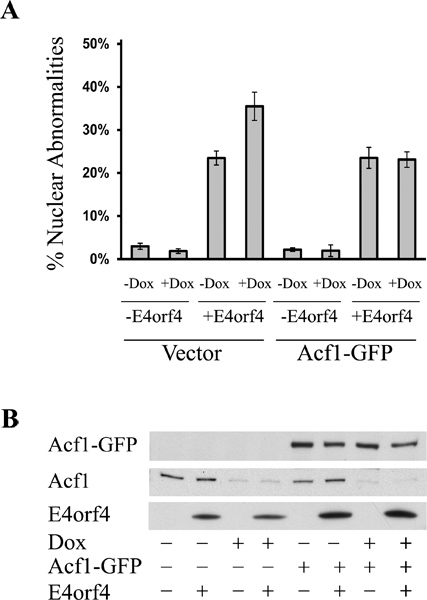
図6。 Acf1ノックダウンはE4orf4誘導される細胞死を増強する。(A)はテトラサイクリン誘導プロモーターからAcf1-shRNAを発現するT-REX-293由来細胞株由来の細胞をドキシサイクリン(+ DOX)または放置(-DOX)で誘導した。三日後、細胞を、空ベクトルまたはサイレントの導入によりshRNAのに耐性がレンダリングされた発現プラスミドGFPタグAcf1、一緒E4orf4(+ E4orf4)または空のベクトルを(-E4orf4)を発現するプラスミドでトランスフェクトした突然変異。細胞は二十四時間E4orf4に対する抗体を用いたトランスフェクションとステンド後、DAPIで修正されました。細胞死の誘導は、上記のDAPIアッセイおよびパーセンテージoによって測定された凝縮された、または断片化した核を持つFトランスフェクトした細胞を決定した。 3を持つ代表的な実験が示されている複製され、エラーバーは標準偏差を表す。 (B)は、平行板からの細胞は、ウェスタンブロット分析のために採取した。ブロットはE4orf4、GFPとAcf1に対する抗体で染色した。内因Acf1とAcf1-GFPは、2つの別々のパネルに示されている。
ディスカッション
特定の遺伝子発現のノックダウンは調節経路へのタンパク質の寄与の捜査に重要なアプローチである。必須遺伝子の発現の構成的なノックダウンが否定的に細胞増殖に影響を与えるので、それらの研究では、一時的なsiRNAの導入や安定した条件付きノックダウンシステムのアプリケーションのいずれかを必要とするかもしれません。ここで説明するshRNAの薬物誘発性の発現のための容量を持つ...
開示事項
特別な利害関係は宣言されません。
謝辞
この作品は、ドイツとイスラエルのプロジェクト協力(DIP)の枠組みの中で、ドイツ学術振興協会(DFG)によるイスラエル科学財団(グラント11分の399)によって、との研究のためのラパポートファミリー研究所(部分的に)サポートされていました医科学。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名称 | 会社 | カタログ番号 | コメント(オプション) |
| 高グルコースDMEM | ギブコ | 41965 | |
| TETシステムが承認したFBS | クロンテック | 631106 | |
| L-グルタミン酸 | ギブコ | 25030 | |
| ペンのStrep | ギブコ | 15140 | |
| 0.25%トリプシン-EDTA | ギブコ | 25200 | |
| T-REX-293細胞 | インビトロジェン | R710-07 | |
| G418 | シグマ | A1720 | |
| ブラストサイジン | Invitロゲン | R210-01 | |
| プラスミドpSuperior.neo + GFP | OligoEngine | VEC-PBS-0007/0008 | |
| jetPIE | Polyplusトランスフェクション | 101から40 | |
| ドキシサイクリン | シグマ | D9891 | |
| パラホルムアルデヒド | 電子顕微鏡学 | 15710 | |
| 4 '、6 - ジアミジノ-2 - フェニルインドール(DAPI) | シグマ | D9542 | |
| Fluoromount™を-G | SouthernBiotech | 0100から01 |
参考文献
- Brummelkamp, T. R., Bernards, R., Agami, R. A system for stable expression of short interfering RNAs in mammalian cells. Science (New York, N.Y). 296, 550-553 (2002).
- Brummelkamp, T. R., Bernards, R., Agami, R. Stable suppression of tumorigenicity by virus-mediated RNA interference. Cancer. 2, 243-247 (2002).
- Czauderna, F. Inducible shRNA expression for application in a prostate cancer mouse model. Nucleic acids research. 31, e127 (2003).
- Matsukura, S., Jones, P. A., Takai, D. Establishment of conditional vectors for hairpin siRNA knockdowns. Nucleic acids research. 31, e77 (2003).
- Wiznerowicz, M., Trono, D. Conditional suppression of cellular genes: lentivirus vector-mediated drug-inducible RNA interference. Journal of. 77, 8957-8961 (2003).
- Brestovitsky, A., Sharf, R., Mittelman, K., Kleinberger, T. The adenovirus E4orf4 protein targets PP2A to the ACF chromatin-remodeling factor and induces cell death through regulation of SNF2h-containing complexes. Nucleic acids research. 39, 6414-6427 (2011).
- Livne, A., Shtrichman, R., Kleinberger, T. Caspase activation by adenovirus E4orf4 protein is cell line-specific and is mediated by the death receptor pathway. J. Virol. 75, 789-798 (2001).
- Shtrichman, R., Kleinberger, T. Adenovirus type 5 E4 open reading frame 4 protein induces apoptosis in transformed cells. J. Virol. 72, 2975-2982 (1998).
- Shtrichman, R., Sharf, R., Kleinberger, T. Adenovirus E4orf4 protein interacts with both Ba and B' subunits of protein phosphatase 2A, but E4orf4-induced apoptosis is mediated only by the interaction with Ba. Oncogene. 19, 3757-3765 (2000).
- Galluzzi, L. Guidelines for the use and interpretation of assays for monitoring cell death in higher eukaryotes. Cell death and differentiation. 16, 1093-1107 (2009).
- Lavoie, J. N., Nguyen, M., Marcellus, R. C., Branton, P. E., Shore, G. C. E4orf4, a novel adenovirus death factor that induces p53-independent apoptosis by a pathway that is not inhibited by zVAD-fmk. J. Cell Biol. 140, 637-645 (1998).
- Li, S. The adenovirus E4orf4 protein induces growth arrest and mitotic catastrophe in H1299 human lung carcinoma cells. Oncogene. 28, 390-400 (2009).
- Lavoie, J. N., Champagne, C., Gingras, M. -. C., Robert, A. Adenovirus E4 open reading frame 4-induced apoptosis involves dysregulation of Src family kinases. J. Cell Biol. 150, 1037-1055 (2000).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved