Method Article
からの同時プリとポストシナプスの電気生理学的記録
要約
このビデオでは、胚の初代培養を成長させるために使用する手順を示していますアフリカツメガエル神経や筋肉細胞と同時プリおよびポストシナプスのパッチクランプ記録を作るための本製剤の有用性。
要約
神経伝達物質の放出を伴うシナプス前のイオン電流の結合に関する多くの情報が特に無脊椎動物の調製物、イカの巨大シナプス1から得られたものである。しかし、ここで説明する準備を除いて、いくつかの脊椎動物の調製品は、それが神経伝達物質の放出とシナプス前イオン電流の同時測定を行うことが可能であるが存在する。まで(数日間、彼らは一二から二四時間以内に機能シナプスを形成し、神経や筋肉の細胞の発達とシナプス相互作用を研究するために使用することができる;胚Xenopusの運動ニューロンと筋細胞は室温でシンプルな培地で一緒に成長させることができる異常増殖)が発生します。他の脊椎動物の調製品を介してこれらの共培養の利点をいくつか準備を簡単にするために、室温での文化や仕事を維持する能力、および2が形成されたシナプスの準備アクセシビリティを含める-4。準備がシナプス前のイオンチャネルと伝達物質放出5-8の規制の生物物理学的特性を研究するために広く用いられている。また、準備9-12神経突起伸長やシナプスの研究、神経伝達物質放出13-15、神経調節16,17の拡散性メッセンジャーの役割の分子機構、 および in vitroシナプス可塑性における 18を含む他の用途にそれ自身を貸している- 19。
プロトコル
1。予備実験の準備
- 1リットルのNFR(ノーマルカエルリンガー)、(b)は100ミリリットル10%食塩水、(c)は100ミリリットル、CMF(のCa 2 + / Mg 2 +を含まない溶液は、():次の解決策を(組成は表1を参照)を準備)、(d)は1ミリリットルのITS(インスリン - トランスフェリン - セレン、シグマI1884)、(e)は100ミリリットルのL-15培地、(f)は、10ミリリットルHCG(ヒト絨毛性ゴナドトロピンシグマ、CG-10)、(g)は100アムホテリシンBのミリリットルK +内部 溶液、(h)は100ミリリットルK +内部 溶液溶液1の浸透力は、それが蒸気圧浸透圧計( 例えば Wescorモデル#5100C)を用いて約260 mOsMであることを保証するためにチェックする必要があります。
- (b)のソリューションを殺菌フィルター処理、および(c)。ソリューションズ(a)と(b)と(c)は4℃で3ヶ月まで保存することができます25ゲージの注射針とシリンジフィルターを介して凍結乾燥粉末を含むバイアルに1 ml脱イオンH 2 Oを追加することにより、溶液(d)を準備します。この最終的な解決C30日間4℃で保存すること。
- ビーカーやフラスコ内のすべてのコンポーネントを組み合わせることにより、層流フード内の溶液(e)を準備します。最終的な解決策を滅菌し、滅菌遠心管に10ミリリットルのアリコートを転送フィルタします。 -20℃で保存する。
- 25ゲージの注射針とシリンジフィルターを介して凍結乾燥粉末を含むバイアルにH 2 Oを脱イオン10ミリリットルを添加することによりHCG(溶液(f))を準備します。この最終的な解決策は30日に4℃で保存することができます。
- Minutienピン(26002から10、ファイン科学ツール)は、シアノアクリレート接着剤でガラスパスツールピペットの最後に接着することによって、少なくとも2顕微解剖ツールを製作してください。ピペット約0.5cmの末尾を超えて拡張するためにピンの鋭い端を許可します。
- 二日間の文化を準備する前に、以下の手順で繁殖を誘発する。平面のsuに女性と暗い色素沈着に著名な、赤みを帯びた総排泄腔を観察することにより、 アフリカツメガエルの飼育対応のペアを識別雄の前足のrface。時間、正味各カエルに1つ、それは逃げることができないようにネットでシンクに腹側にそれを押したままにします。背側リンパ嚢の1に皮下ネットと通じ溶液1ml(f)を注入します。
- 水の覆われた10ガロンタンクで一緒に繁殖のペアを置きます。動物が新たにレイアウトされ、受精卵を踏みつけないようにするため、およそのメッシュサイズ½タンクの底部( 図1A)上記の"取り付けは約1〜2インチでスクリーニングされた床をインストールしてください。
- 動物が抱接にあり、受精卵が画面下の床( 図1B)に観察されるまで、12から48時間静置カエルのままにしておきます。
- タンクから動物を削除しますが、長く、少なくとも24時間、卵はそのままにする。カエルのこのペアは、6週間後に再飼育することができます。
- タンクの底部から胚を緩めて、4または5 60x15 mmのカルトに転送10%食塩水(溶液B)を含有するURE皿。 Niewkoopとフェーバー(文献20)のスキームに従って段階で胚をソートします。有用胚はステージ22から24でそれらになります。 図2A、図2B(約28段)に有用であることが開発に沿って遠すぎる胚を示しながら、約22段階の胚を示しています。それは健康である胚を選択することが重要です:明るい茶色と白のまだらのある外観が滑らかなものが理想的です。大きな黒または白のパッチが適用されている胚は一般的に不健康と使用できなくなります。
2。 アフリカツメガエル胚の顕微解剖
- 層流フード、ラベル内、10%食塩水で中途半端に約3 60x15ミリメートル無菌培養皿を満たし、およびCMFと1。
- 10%の食塩水を含んだ料理の一つに、滅菌したガラスパスツールピペット転送五から十段22から24胚を用いた。ステレオズームの助けを借りて解剖するフード内側る顕微鏡(10×接眼レンズ0.6-5X)は、無菌の#5鉗子(11251から30、ファイン科学ツール)の2ペアを使用して、それぞれの胚からゼリーコートと卵黄膜を除去します。 ( 図3Aおよび図3Bを参照してください。)
- CMFを含む皿にようやく生理食塩水と10%の残りの2つの料理を通じて、一つずつそれらを渡すことによって、裸の胚を洗浄します。各転送のための新しい、滅菌ピペットを使用し、皿から皿に移し、溶液の体積を最小限に抑えます。
- ターンでは、ステップ1.5で作ら顕微解剖ツールを使用して、ピンセットで優しく、しかし、しっかりとそれぞれの胚を保持し、神経管や動物の中で最も背側面に配置されている関連した筋節を削除します。 3スライス、神経管の場所と、それ( 図4A)にちょうど腹第三のいずれかの端に1つにすることによってこれを行います。離れて卵黄granulから皿のきれいな部分に各解剖神経管/筋節を移動ESおよび他の残骸( 図4B)。背腹軸、および神経管と筋節の位置は図4に示されている。
- この溶液中の約15分後(CMF)の解剖組織および廃棄の自由色素沈着した皮膚を持ち上げるためにピンセットを使用しています。彼らは互いに( 図4C)から解離になるその他の30〜60分後、細胞は"砂杭"を形成することになる。
3。神経筋共培養の準備
- 培地を10 mlチューブを解凍し、無菌的にITSの70μlを添加し、35 ng / mlのBDNF(シグマB3795)。
- ラベルおよび滅菌35mm培養皿(FD35-100世界の精密機器)のほぼ中間のL-15培地(溶液(e))は、解剖し、各胚のための1とを埋める。
- 炎の上にテーパ部を保持している間にガラスパスツールピペットの両端をつかんでメッキピペットを作製します。約1に端を引き離す次いで、0センチメートルと約0.2mmの先端を得るためにエンドを断つ。
- 描かれた溶液の量を最小限に抑える1つの胚から "砂杭"を吸い上げるメッキピペットを使用しています。培養皿の底に細胞を追い出す。いくつかの行に分割プレートの細胞を。メッキされた未分化細胞( 図5Aおよび5B)に従ってください。
- 細胞は時間が皿にアタッチできるように、少なくとも15分間静置播種した細胞の料理にしておきます。
4。パッチクランプ神経筋シナプス
- 筋細胞は紡錘形となり、脊髄神経細胞は長い突起( 図6)を拡張:培養液中で12から24時間後、播種した細胞は、異なる形態的特徴にかかる。神経突起varicositiesと筋細胞間の機能的なシナプスの接触が同時対に電気生理学的記録で確認することができます。 "M"、 "S"と "V"は神経、筋細胞にそれぞれ参照してください。ソーマとシナプス前静脈瘤。
- シナプス前静脈瘤のためのものと筋細胞のための1:録音のための2つのパッチ電極を準備します。
- シナプス前の電極については、次のようにアムホテリシン含有溶液を調製:5 mgのアムホテリシンB(シグマA4888)を含む1.5 mlマイクロチューブに100μlのDMSOを追加します。 10秒間ボルテックスこのソリューション。次に、アムホテリシンB(溶液(H))のために625μlのK +内部 溶液を含む第二のマイクロ遠心チューブにこの溶液10μlを添加する。上記のように渦。
- ステップ4.3で調製したアンホテリシン含有のK +内部 溶液とK +内部 液(溶液(グラム))とシナプス電極を使ったプレシナプス電極を埋める。
- NFRと培養皿の中でメディアを交換して、位相差光学系を搭載倒立顕微鏡に変える。
- ただ、それぞれの対象の上に両方の電極を配置します。細胞全体の協力を得る静脈瘤電極を備えた穿孔パッチ設定の前筋細胞電極とnfiguration。
- シナプスの機能を確認するには、ソフトウェア制御の下で( 例えば Axopatch 200B、Molecular Devices)をパッチクランプアンプで静脈瘤を脱分極(pCLAMP 9、Molecular Devices社など )と同時シナプス前とシナプス後電流を観察します。 図7を見電流を示し+40 mVへ-30 mVから10 mV刻みでシナプス前静脈瘤に与えられる電圧のステップを脱分極への返信です。シナプス前細胞に見られる内向き電流は、Na +とCa 2 +とK +による外向き電流によって運ばれる。シナプス後細胞に記録電流が静脈瘤から放出された神経伝達物質への応答であるとニコチン性アセチルコリン受容体チャネルを介したNa +が主に行われている。
結果
図4Bは、すぐにステージ22 アフリカツメガエル胚からの除去後に孤立した脊髄/筋節の背側のビューを示しています。 図4Cは 、そののCa 2の皮膚の除去およびインキュベーション後の+-Mg 2 +を含まない溶液(CMF、溶液(示していますc))は、細胞が "砂杭"に解離するとメッキの準備ができている。直ちに培地細胞へのめっき後の少しの形態学的変動を( 図5B)を示すが、文化の中で二十四時間後に異なる形状を取る。ニューロンは筋細胞( 図6)シナプスで精巧varicositesという神経突起を延長しながら、球形のまま筋細胞は紡錘形になる。シナプス前とシナプス後静脈瘤筋細胞( 図7)からの同時ペアリングパッチ記録は神経伝達物質の放出とresultaに関連付けられているシナプス前の内側と外向き電流を明らかにntのシナプス後電流を興奮。

図1:画面の上にバケツを交配することで、カエルの繁殖ペアB:受精卵と抱接中の蛙。
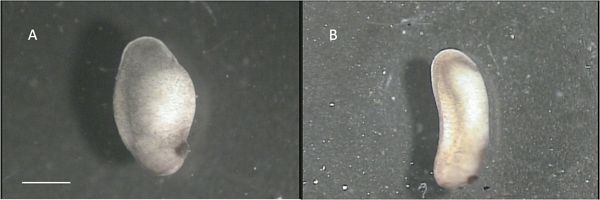
"適切な"ステージ22胚B:2図 。 "不向き"ステージ28胚。スケールバーは1ミリメートルを表しています。
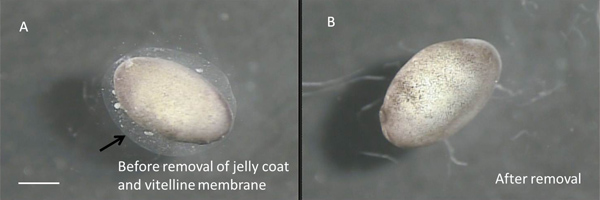
図3:ステージ22胚卵黄膜とゼリーコートの除去前。矢印はゼリーコートの外縁を指しています。卵黄膜はembrに密着。ヨーヨーと事実上見えませんB:ベア胚。スケールバーは1ミリメートルを表しています。
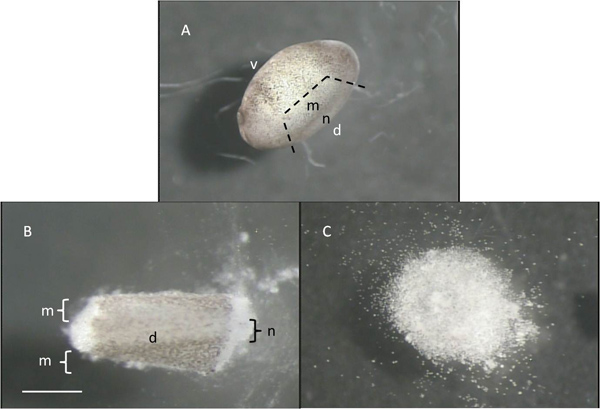
図4:解剖部分-であることを示す破線でステージ22胚B:胚の急性単離した背部分と、 "d"と"v"は胚の背側と腹側の側面を参照して、 "m"の間。 "n"はmytomesと神経管のおおよその位置を示し、Cは:CMFで60分後の細胞の"砂杭"。スケールバーは1ミリメートルのために、AとBとCの0.5ミリメートルを表しています。
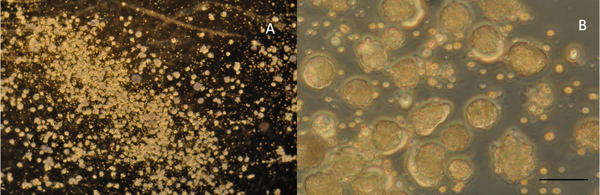
図5:直ちにめっき後の培養中の細胞の5倍の電力を表示します。 B:40倍速で同じ文化。スケールバーは40μmのため、AとBは5μmを表す
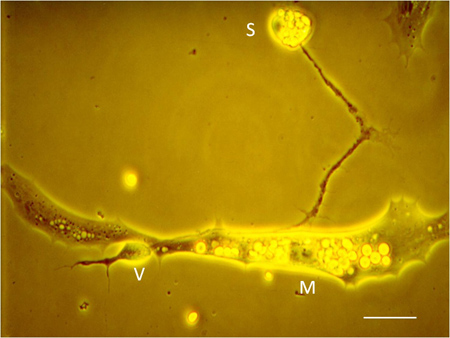
図6神経ソーマ(S)は、シナプス前静脈瘤(V)、およびシナプス後筋細胞(M)の同定と培養における神経筋接合部。スケールバー:5μmである。
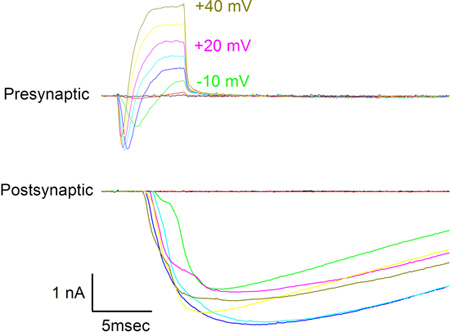
図7:シナプス前(上)と、-30 mVから+40 mVへのシナプス前静脈瘤に提示10mVの増分電圧ステップのアプリケーションに応じて、見(下)シナプス後電流。電圧ステップはシナプス前のトレースの一部の隣に表示されます。両方の細胞のための保持電位は-70 mVであった。
ディスカッション
運動ニューロンと筋細胞の共培養に成功における重要なステップは、適切にアフリカツメガエルカエルの誘発育種から生産胚を上演したの使用、および未分化脊髄ニューロンと筋芽細胞の注意深い無菌解剖されています。早く頻繁に彼らの開発、それらを停止して動くように、彼らは約10かそこらをステージに移動するまで、受精卵はそのままにすべきである。健康な胚は、滑らかな外観と茶色と白のまだらのカラーリングで識別されます。これは筋細胞が大幅に分化しただけで神経管が閉じた後と前に開発中のポイントであるため、ステージ22から24まで胚が最も有用である。また、古い胚から細胞がCMFによく解離することができない。それは、胚に強く付着したとして卵黄膜を除去するときは注意が必要です。胚はそのまま出てくるように、膜は鋭利なピンセットを用いてバラバラにされるべきである。もう一つの重要なprecautionは慎重に培養皿(むしろ彼らはそこに定住させるより)の底部にセルを配置することです。これは、細胞が培養皿に付着する可能性を高めるため、この方法をお勧めします。
神経と筋肉の間の機能的な神経伝達は、シナプス後の記録だけで決定することができると頻繁に神経支配の後に自発筋収縮の観察により確認することができる。非神経支配筋細胞は、培養中にけいれんはありません。単独でシナプス後録音が誘発放出のミニチュア終板電流または電位が、測定値を記録するために有用であるシナプス前の刺激を必要とし、前とシナプス後電流の相関がダブルパッチクランプが必要になります。
ペアになって、パッチの記録方法はここで説明する以外にも、この準備は、これが活動電位のthaの生成を可能にする神経細胞体5で3ピペットを紹介する機会を提供していますtは、シナプス前静脈瘤に伝播し、神経伝達物質の放出につながることができます。また、媒介すると考えられ、またはシナプス伝達を調節アール推定剤はシナプスのどちらかの側に導入することができる:筋細胞のピペットを介して、またはソーマに配置第三ピペットからの拡散による。
開示事項
特別な利害関係は宣言されません。
謝辞
NSF(0854551)から研究助成を受けた。
資料
| Name | Company | Catalog Number | Comments | ||||||||||||||
| 機器/用品 | ベンダー | カタログ/モデル番号 | |||||||||||||||
| インスリン - トランスフェリン - セレン | シグマ | I1884 | |||||||||||||||
| ヒト絨毛性ゴナドトロピン | シグマ | CG-10 | |||||||||||||||
| 蒸気圧浸透圧計 | Wescor | 5100C | |||||||||||||||
| Minutienピン | ファイン科学ツール | 26002から10 | |||||||||||||||
| アムホテリシンB | シグマ | A4888 | |||||||||||||||
| 鉗子 | ファイン科学ツール | 11251から30 | |||||||||||||||
|
TABLE 1。
参考文献
- Augustine, G. J., Eckert, R. Divalent cations differentially support transmitter release at the squid giant synapse. J. Physiol. 346, 257-271 (1984).
- Spitzer, N. C., Lamborghini, J. E. The development of the action potential mechanism of amphibian neurons isolated in culture. Proc. Natl. Acad. Sci. U.S.A. 73, 1641(1976).
- Weldon, P. R., Cohen, M. W. Development of synaptic ultrastructure at neuromuscular contacts in an amphibian cell culture system. J. Neurocytol. 8, 239-259 (1979).
- Tabti, N., Poo, M. -M. Culturing Nerve Cells. Banker, G., Goslin, K. , MIT Press. Cambridge, Massachusetts. 137-153 (1991).
- Yazejian, B., DiGregorio, D. A., Vergara, J. L., Poage, R. E., Meriney, S. D., Grinnell, A. D. Direct measurements of presynaptic calcium and calcium-activated potassium currents regulating neurotransmitter release at cultured Xenopus nerve-muscle synapses. J. Neurosci. 17, 2990(1997).
- DiGregorio, D. A., Peskoff, A., Vergara, J. L. Measurement of action potential-induced presynaptic calcium domains at a cultured neuromuscular junction. J. Neurosci. 19, 7846(1999).
- Yazejian, B., Sun, X. P., Grinnell, A. D. Tracking presynaptic Ca2+ dynamics during neurotransmitter release with Ca2+-activated K+ channels. Nat. Neurosci. 3, 566(2000).
- Sun, X. P., Chen, B. M., Sand, O., Kidokoro, Y., Grinnell, A. D. Depolarization-induced Ca2+ entry preferentially evokes release of large quanta in the developing Xenopus neuromuscular junction. J. Neurophysiol. 104 (5), 2730-2740 (2010).
- Xie, S. P., Poo, M. M. Initial events in the formation of neuromuscular synapse: rapid induction of acetylcholine release from embryonic neurons. Proc. Natl. Acad. Sci. U.S.A. 83, 7069(1986).
- Li, P. P., Chen, C., Lee, C. W., Madhavan, R., Peng, H. B. Axonal filopodial asymmetry induced by synaptic target. Mol. Biol Cell. 22 (14), 2480-2490 (2011).
- Feng, Z., Ko, C. P. Schwann cells promote synaptogenesis at the neuromuscular junction via transforming growth factor-beta1. J. Neurosci. 28 (39), 9599-9609 (2008).
- Song, H. J., Ming, G. L., Poo, M. M. cAMP-induced switching in turning direction of nerve growth cones. Nature. 17 (6639), 275-279 (1997).
- Morimoto, T., Wang, X. H., Poo, M. M. Overexpression of synaptotagmin modulates short-term synaptic plasticity at developing neuromuscular junctions. Neuroscience. 82 (4), 969-978 (1998).
- Lu, B., Czernik, A. J., Popov, S., Wang, T., Poo, M. M., Greengard, P. Expression of synapsin I correlates with maturation of the neuromuscular synapse. Neuroscience. 74 (4), 1087-1097 (1996).
- Schaeffer, E., Alder, J., Greengard, P., Poo, M. M. Synapsin IIa accelerates functional development of neuromuscular synapses. Proc. Natl. Acad. Sci. U.S.A. 26 (9), 3882-3886 (1994).
- Liou, J. C., Tsai, F. Z., Ho, S. Y. Potentiation of quantal secretion by insulin-like growth factor-1 at developing motoneurons in Xenopus cell culture. J. Physiol. 553 (Pt. 3), 719-7128 (2003).
- Peng, H. B., Yang, J. F., Dai, Z., Lee, C. W., Hung, H. W., Feng, Z. H., Ko, C. P. Differential effects of neurotrophins and schwann cell-derived signals on neuronal survival/growth and synaptogenesis. J. Neurosci. 23 (12), 5050-5060 (2003).
- Dan, Y., Poo, M. M. Hebbian depression of isolated neuromuscular synapses in vitro. Science. 12 (5063), 1570-1573 (1992).
- Xiao, Q., Xu, L., Spitzer, N. C. Target-dependent regulation of neurotransmitter specification and embryonic neuronal calcium spike activity. J. Neurosci. 30 (16), 5792-5801 (2010).
- Niewkoop, P. D., Faber, J. Normal table of Xenopus laevis (Daudin). , North-Holland, Amsterdam. (1967).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved