Method Article
Gleichzeitige Pre-und Post-synaptischen Elektrophysiologische Aufnahme von
In diesem Artikel
Zusammenfassung
Dieses Video zeigt die Maßnahmen zur primären Kulturen von embryonalen wachsen Xenopus Nerven-und Muskelzellen und die Nützlichkeit dieser Zubereitung für die Herstellung gleichzeitigen Pre-und Post-synaptischen Patch Clamp Messungen.
Zusammenfassung
Viele Informationen über die Kopplung von präsynaptischen Ionenströme mit der Freisetzung von Neurotransmitter hat sich von wirbellosen Präparate, vor allem die Tintenfische riesigen Synapse 1 erhalten worden. Jedoch mit Ausnahme der Herstellung hier beschriebenen existieren wenige Wirbeltier Zubereitungen, in denen es möglich ist, die gleichzeitige Messungen der Neurotransmitter-Ausschüttung und präsynaptischen Ionenströme machen. Embryonale Xenopus Motoneuronen und Muskelzellen können zusammen in einfachen Kulturmedium gezüchtet werden bei Raumtemperatur, sie werden innerhalb von zwölf funktionelle Synapsen to 24 Stunden zu bilden, und kann verwendet werden, um Nerven-und Muskel-Zell-Entwicklung und synaptische Interaktion über mehrere Tage zu untersuchen (bis Überwucherung auftritt). Einige Vorteile dieser Co-Kulturen gegenüber anderen Wirbeltieren Zubereitungen sind die Einfachheit der Zubereitung, die Fähigkeit, die Kulturen und die bei Raumtemperatur zu halten und die leichte Zugänglichkeit der Synapsen gebildet 2-4. Die Zubereitung wurde weithin um die biophysikalischen Eigenschaften der präsynaptischen Ionenkanälen und die Regulierung des Senders Release 8.5 Studie verwendet. Darüber hinaus hat die Zubereitung selbst zu anderen Verwendungen, einschließlich der Studie von Neuritauswuchs und Synaptogenese 9-12, molekularen Mechanismen der Neurotransmitterfreisetzung 13-15, die Rolle des diffundierbaren Botenstoffe im Neuromodulation 16,17, und in vitro die synaptische Plastizität verliehen 18 - 19.
Protokoll
Ein. Pre-experimentelle Vorbereitung
- Bereiten Sie die folgenden Lösungen (siehe Tabelle 1 für Kompositionen): (a) 1 Liter NFR (Normal Frog Ringer), (b) 100 ml 10% iger Kochsalzlösung, (c) 100 ml CMF (Ca 2 + / Mg 2 +-freien Lösung ), (d) 1 ml ITS (Insulin-Transferrin-Selen, Sigma I1884), (e) 100 ml L-15 Kulturmedium, (f) 10 ml HCG (humanes Choriongonadotropin Sigma CG-10), (g) 100 ml K +-interne Lösung, (h) 100 ml K +-interne Lösung für Amphotericin B. Der osmotische Stärke der Lösung 1, ist zu überprüfen, dass es ungefähr 260 mOsM Verwendung eines Dampfdruckosmometer (zB Wescor Modell # 5100C) ist werden .
- Filtern sterilisieren Lösungen (b) und (c). Lösungen (a) (b) und (c) können bis zu drei Monate gelagert werden bei 4 ° C. Planen Lösung (d) durch Zugabe von 1 ml deionisiertes H 2 O, um das Fläschchen mit dem lyophilisierten Pulver über eine 25-Gauge-Nadel und Spritze Spritzenfilter. Diese fertige Lösung cein bei 4 ° C für 30 Tage gelagert werden.
- Planen Lösung (e) in einer Sterilbank durch Kombination aller Komponenten in einem Becherglas oder Kolben. Filtern sterilisieren die endgültige Lösung und Transfer 10 ml Aliquots in sterile Zentrifugenröhrchen. Lagerung bei -20 ° C.
- Bereiten Sie die HCG (Lösung (f)) durch Zugabe von 10 ml deionisiertes H 2 0 bis das Fläschchen mit dem lyophilisierten Pulvers über eine 25-Gauge-Injektionsnadel und Spritze Filter. Diese fertige Lösung kann bei 4 ° C für 30 Tage gelagert werden.
- Fabrizieren mindestens zwei Mikrodissektion Werkzeuge durch Aufkleben eines Minutien Stift (26.002 bis 10, Fine Science Tools) mit dem Ende eines Glases Pasteurpipette mit Sekundenkleber. Lassen Sie das scharfe Ende des Stiftes über das Ende der Pipette ca. 0,5 cm verlängern.
- Zwei Tage vor der Zubereitung Kulturen, induzieren Zucht mit dem folgenden Verfahren. Identifizieren eines Zucht-ready Paar Xenopus durch Beobachtung einer prominenten, rötlich Kloake durch die weibliche und dunkle Pigmentierung auf der ebenen surface der Vorderpfoten des Männchens. Einer nach dem anderen, net jeder Frosch und halten Sie sie Bauchseite nach unten auf eine Spüle mit dem Netz, so dass es nicht entweichen kann. Jeweils 1 ml der Lösung (f) durch das Netz und subkutan in einen der dorsalen Lymphsäcke.
- Legen Sie die Zucht Paar zusammen in einem überdachten 10 Gallonen Wassertank. Um sicherzustellen, dass die Tiere nicht mit Füßen treten, die neu verlegt und befruchtete Eier, installieren Sie ein abgeschirmtes Boden mit einer Maschenweite von ca. ½ "ausgestattet ca. 1-2 cm über dem Boden des Tanks (Abbildung 1A).
- Lassen Frösche ungestört 12-48 h, bis die Tiere in amplexus sind und befruchteten Eier werden auf dem Boden unterhalb des Bildschirms (Abbildung 1B) beobachtet.
- Entfernen Sie die Tiere aus dem Tank, aber lassen Sie die Eier ungestört mindestens 24 Stunden länger. Dieses Paar Frösche können nach sechs Wochen wieder gezüchtet werden.
- Lösen Sie die Embryonen aus dem Boden des Tanks und übertragen Sie sie auf vier oder fünf 60x15 mm Kulture Schalen mit 10% iger Kochsalzlösung (Lösung b). Sortieren Sie die Embryonen von der Bühne nach dem Schema der Niewkoop und Faber (ref. 20). Nützliche Embryonen werden diejenigen im Stadium 22-24 sein. 2A zeigt einen Embryo in etwa Stufe 22, während 2B zeigt einen Embryo, der zu weit entlang in der Entwicklung nützlich zu sein (ca. Stufe 28). Es ist wichtig, Embryonen, die gesund sind wählen: solche, die ein glattes Aussehen mit hellbraunen und weißen Mottling sind ideal. Embryonen, die große schwarze oder weiße Flecken haben, sind in der Regel ungesunden und unbrauchbar.
2. Mikrodissektion von Xenopus Embryonen
- Innerhalb einer Sterilbank, Etikett und etwa in der Mitte zu füllen drei 60x15 mm sterile Kulturschalen mit 10% iger Kochsalzlösung und einer mit CMF.
- Verwendung einer sterilen, Glas Pasteurpipette Transfer fünf vor zehn Stadium 22-24 Embryonen in eine der Schalen mit 10% iger Kochsalzlösung. Mit der Hilfe eines Stereo-Zoom sezierenten Mikroskop innerhalb der Haube (0,6-5x mit 10 x Okulare), entfernen Sie das Gelee Mantel und Dotterhaut von jedem Embryo mit zwei Paar sterile Nr. 5 Zange (11251-30, Fine Science Tools). (Siehe 3A und 3B).
- Waschen Sie die nackten Embryonen, indem sie ein zu einer Zeit, durch die verbleibenden zwei Gerichte von 10% Kochsalzlösung und schließlich in die Schale mit CMF. Verwenden Sie eine neue, sterile Pipette für jede Übertragung und minimieren das Volumen der Lösung übertragen von Gericht zu Gericht.
- Im Gegenzug halten sich Embryo vorsichtig, aber fest mit einer Zange und mit Hilfe der Mikrodissektion Werkzeug in Schritt 1,5 gestaltet, entfernen Sie das Neuralrohr und die damit verbundenen Myotomen die am meisten Dorsalseite des Tieres befinden. Tun dies, indem sie drei Scheiben, eine an jedem Ende der Standort des Neuralrohr und eine dritte gerade ventralen dazu (4A). Bewegen jedes seziert Neuralrohr / Myotome zu einem sauberen Teil der Schale weg von dem Eigelb Granuln und andere Ablagerungen (4B). Die dorsal-ventralen Achse und die Orte der Neuralrohr und Myotome sind in Abbildung 4 dargestellt.
- Nach etwa 15 Minuten in dieser Lösung (CMF) Verwendung der Pinzette pigmentierte Haut frei von der sezierten Gewebes zu heben und zu verwerfen. Nach einer weiteren 30 bis 60 min werden die Zellen bilden einen "Sandhaufen", wie sie dissoziiert voneinander (4C) zu werden.
3. Vorbereitung der Nerv-Muskel-Co-Kulturen
- Auftauen eine 10 ml Tube Kulturmedium und aseptisch 70 ul ITS und 35 ng / ml BDNF (Sigma B3795).
- Etikett und füllen sterilen 35 mm Kulturschalen (FD35-100 World Precision Instruments) etwa zur Hälfte mit L-15 Kulturmedium (Lösung (E)), eine für jedes Embryo seziert.
- Fabrizieren Plattieren Pipette durch Ergreifen jedes Ende einer Pasteurpipette aus Glas während die sich verjüngenden Abschnitt über einer Flamme. Ziehen Sie die Enden auseinander zu 10 cm und dann brechen Sie das Ende ein Trinkgeld von etwa 0,2 mm zu erhalten.
- Verwenden der Plattierfläche Pipette zum Aufsaugen der "Sandhaufen" von einem Embryo Minimierung der Menge an Lösung gezogen. Auszutreiben der Zellen auf dem Boden der Kulturschale. Platte der Zellen in mehreren Zeilen. Beobachten plattierten undifferenzierten Zellen (5A und 5B).
- Lassen Sie die Gerichte der plattierten Zellen ungestört für mindestens 15 Minuten, damit die Zellen Zeit, um die Schale zu befestigen.
4. Patch-Clamp-Nerv-Muskel-Synapse
- Nach 12-24 h in Kultur nehmen plattierten Zellen auf verschiedenen morphologischen Merkmale: Muskelzellen werden spindelförmig und spinalen Neuronen verlängern lange Prozesse (Abbildung 6). Functional synaptischen Kontakte zwischen Neuriten Krampfadern und Muskelzellen können bei gleichzeitiger gepaart elektrophysiologischen Ableitungen bestätigt werden. "M", "S" und "V" beziehen sich jeweils auf die Muskelzelle, neuronaleSoma und präsynaptischen Krampfadern.
- Bereiten Sie zwei Patch-Elektroden für die Aufzeichnung: eine für den präsynaptischen Krampfadern und eine für die Muskelzelle.
- Für die präsynaptischen Elektrode, Vorbereitung einer Amphotericin-haltigen Lösung wie folgt: Fügen 100 ul DMSO zu einem 1,5 ml Mikrozentrifugenröhrchen mit 5 mg Amphotericin B (Sigma A4888). Vortex diese Lösung für 10 sek. Als Nächstes fügen Sie 10 ul dieser Lösung zu einem zweiten Mikrozentrifugenröhrchen, die 625 ul K +-interne Lösung für Amphotericin B (Lösung (h)) enthält. Wirbels wie oben.
- Füllen den präsynaptischen Elektrode mit der Amphotericin-haltigen K +-interne Lösung in Schritt 4.3 hergestellten und der postsynaptischen Elektrode mit K +-interne Lösung (Lösung (g)).
- Ersetzen Medien in der Kulturschale mit NFR und Verlagern dieses zu einem inversen Mikroskop mit Phasenkontrast-Optik ausgerüstet.
- Positionieren Sie beide Elektroden direkt über ihre jeweiligen Ziele. Besorgen Sie sich die whole-cell configuration mit der Muskelzelle Elektrode vor dem perforierten Patch-Konfiguration mit dem Krampfadern Elektrode.
- Um die Funktionalität der Synapse zu bestätigen, depolarisiert die Krampfadern mit einem Patch-Clamp-Verstärkers (z. B. Axopatch 200B, Molecular Devices) unter Software-Steuerung (zB durch pCLAMP 9, Molecular Devices) und beachten Sie die gleichzeitige präsynaptischen und postsynaptischen Ströme. Abbildung 7 zeigt die Ströme gesehen in Reaktion auf depolarisierende Schritte Spannung, die dem präsynaptischen Krampfadern in 10 mV-Schritten von -30 mV bis +40 mV. Die Einwärtsströme in der präsynaptischen Zelle aus gesehen werden durch Na + und Ca 2 + und den Auswärtsströme von K + durchgeführt wird. Ströme in der postsynaptischen Zelle aufgezeichnet sind Antworten auf Neurotransmitter aus der Krampfadern freigegeben und werden meist von Na + durch Nikotinsäure Acetylcholin-Rezeptor-Kanäle.
Ergebnisse
4B zeigt die Rückenansicht eines isolierten Rückenmark / Myotom unmittelbar nach ihrer Entnahme aus einer Stufe 22 Xenopus Embryo. 4C zeigt, dass nach Hautentfernung und Inkubation in Ca 2 +-Mg 2 +-freien Lösung (CMF, Lösung ( c)), Zellen in ein "Sandkasten" distanzieren und sind bereit zum Plattieren. Unmittelbar nach der Beschichtung in das Kulturmedium Zellen zeigen wenig morphologischen Variabilität (5B), sondern nehmen auf unterschiedlichen Formen nach 24 Stunden in Kultur. Muskelzellen geworden spindelförmigen während Neuronen während erstreckenden Neuriten bleiben kugelförmige daß aufwendige varicosites an Synapsen mit Muskelzellen (Abbildung 6). Gleichzeitige gepaart Patch Aufnahme aus dem präsynaptischen Krampfadern und postsynaptischen Muskelzelle (Abbildung 7) zeigt die präsynaptischen nach innen und außen Ströme mit der Freisetzung von Neurotransmittern und der resulta assoziiertnt exzitatorischen postsynaptischen Ströme.

Abbildung 1 A:.. Zuchtpaar von Fröschen bei der Paarung Eimer atop Bildschirm B: Frogs in amplexus mit befruchteten Eiern.
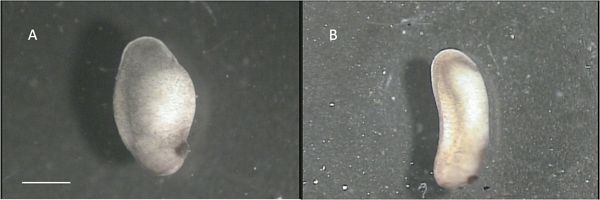
Abbildung 2 A:.. "Geeignet" Stufe 22 Embryos B: "ungeeignet" Stufe 28 Embryos. Maßstab entspricht 1 mm.
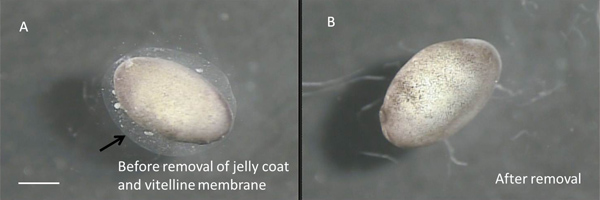
Abbildung 3 A:. Stage 22 Embryos vor dem Entfernen des Dotterhaut und Gelee Mantel. Der Pfeil zeigt auf den äußeren Rand des jelly Mantel. Die Dotterhaut hält sich eng an die embryo und praktisch unsichtbar B:. Bare Embryo. Maßstab entspricht 1 mm.
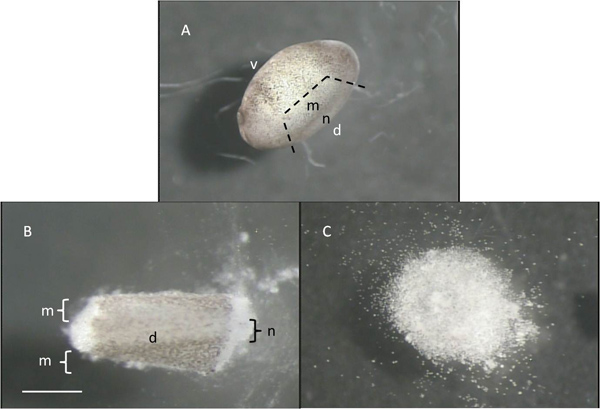
Abbildung 4 A: Stage 22 Embryos mit einer gestrichelten Linie, die zu werden seziert Teil B:.. Akut isoliert dorsalen Teil des Embryos, "d" und "v" beziehen sich auf die dorsalen und ventralen Aspekte der Embryonen, während "m" und "n" die ungefähre Lage der mytomes und Neuralrohr C:. "Sand Stapel" von Zellen nach 60 min in CMF. Maßstabsbalken entspricht 1 mm für A, und 0,5 mm für die B-und C.
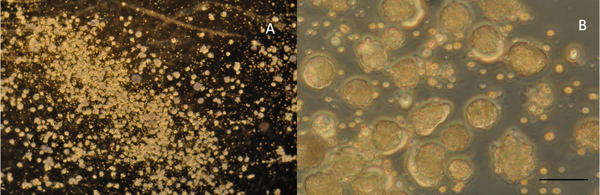
Figur 5 A:. 5x Leistung Ansicht von Zellen in Kultur unmittelbar nach dem Ausplattieren. B: Gleiche Kultur bei 40x. MaßstabBalken repräsentiert 40 um für A, und 5 um für B.
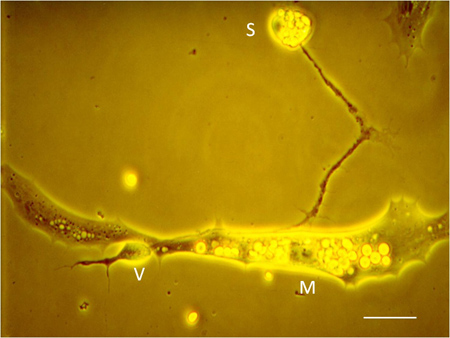
Abbildung 6. Neuromuskulären Synapse in Kultur mit Identifizierung der neuronalen Soma (S), präsynaptischen Krampfadern (V), und postsynaptischen Muskelzelle (M). Maßstab: 5 um.
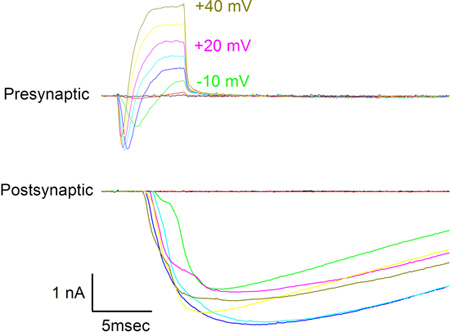
Abbildung 7. Präsynaptische (oben) und postsynaptischen (unten) Ströme in Reaktion auf die Anwendung von 10 mV inkrementelle Spannung sehen Schritte, um die präsynaptischen Krampfadern von -30 mV bis +40 mV vorgestellt. Spannungsstufen sind neben einigen der präsynaptischen Spuren angegeben. Die Holding Potenzial für beide Zellen betrug -70 mV.
Diskussion
Die wichtigsten Schritte zur erfolgreichen Cokultivieren von Motoneuronen und Muskelzellen sind die Verwendung geeigneter inszenierten Embryonen aus der induzierten Zucht von Xenopus Fröschen erzeugt und der sorgfältigen aseptischen Dissektion der undifferenzierten spinalen Neuronen und Myoblasten. Befruchtete Eier sollten in Ruhe gelassen werden, bis sie ungefähr Stufe erreichen 10 oder so bewegen sie früher oft hält ihre Entwicklung. Gesunde Embryonen werden durch eine glatte Optik und braun und weiß gefleckten Färbung identifiziert. Stufe 22-24 Embryonen sind die nützlichsten, denn dies ist der Punkt während der Entwicklung kurz nach der Neuralrohr geschlossen und vor den Myozyten deutlich differenziert. Darüber hinaus scheitern Zellen von älteren Embryonen gut dissoziieren in CMF. Vorsicht beim Entfernen der Dotterhaut da es stark haftet für den Embryo werden. Die Membran sollte auseinandergerissen werden mit scharfen Pinzette so dass der Embryo entsteht intakt. Ein weiterer wichtiger precaution ist, sorgfältig zu platzieren der Zellen auf dem Boden der Kulturschale (anstatt sie dort anzusiedeln). Dieses Verfahren ist bevorzugt, da dies die Wahrscheinlichkeit erhöht, dass die Zellen in die Kulturschale haften.
Funktionelle Neurotransmission zwischen Nerv und Muskel kann mit nur postsynaptischen Aufzeichnung bestimmt werden und oft festgestellt werden kann durch die Beobachtung der spontanen Muskelkontraktion nach Innervation. Un-innervierten Muskelzellen nicht in Kultur zucken. Postsynaptischen Aufnahme allein ist nützlich für die Aufnahme Miniatur-Endplatte Ströme oder Potenziale, aber Messungen evozierte Freisetzung erfordert präsynaptische Stimulation, und die Korrelation der prä-und postsynaptischen Ströme benötigt Doppel Patch-Clamp.
Neben dem gepaarten Patch Aufnahme hier beschriebene Methode bietet diese Vorbereitung die Möglichkeit, ein Drittel Pipette in der neuronalen Soma 5 einzuführen Dies ermöglicht die Erzeugung eines Aktionspotentials that können zur präsynaptischen Krampfadern ausbreiten und zu der Freisetzung von Neurotransmittern. Zusätzlich kann putativen Mittel, die gedacht sind, zu vermitteln oder zu modulieren synaptischen Übertragung zu jeder Seite der Synapse eingeführt werden: über die Muskelzelle Pipette oder durch Diffusion von einem dritten Pipette an dem Soma platziert.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Gefördert durch die NSF (0.854.551).
Materialien
| Name | Company | Catalog Number | Comments | ||||||||||||||
| Ausstattung / Zubehör | Verkäufer | Katalog / Modellnummer | |||||||||||||||
| Insulin-Transferrin-Selen | Sigma | I1884 | |||||||||||||||
| Humanes Choriongonadotropin | Sigma | CG-10 | |||||||||||||||
| Dampfdruckosmometers | Wescor | 5100C | |||||||||||||||
| Minutien Pins | Fine Science Tools | 26002-10 | |||||||||||||||
| Amphotericin B | Sigma | A4888 | |||||||||||||||
| Zange | Fine Science Tools | 11251-30 | |||||||||||||||
|
Table 1.
Referenzen
- Augustine, G. J., Eckert, R. Divalent cations differentially support transmitter release at the squid giant synapse. J. Physiol. 346, 257-271 (1984).
- Spitzer, N. C., Lamborghini, J. E. The development of the action potential mechanism of amphibian neurons isolated in culture. Proc. Natl. Acad. Sci. U.S.A. 73, 1641(1976).
- Weldon, P. R., Cohen, M. W. Development of synaptic ultrastructure at neuromuscular contacts in an amphibian cell culture system. J. Neurocytol. 8, 239-259 (1979).
- Tabti, N., Poo, M. -M. Culturing Nerve Cells. Banker, G., Goslin, K. , MIT Press. Cambridge, Massachusetts. 137-153 (1991).
- Yazejian, B., DiGregorio, D. A., Vergara, J. L., Poage, R. E., Meriney, S. D., Grinnell, A. D. Direct measurements of presynaptic calcium and calcium-activated potassium currents regulating neurotransmitter release at cultured Xenopus nerve-muscle synapses. J. Neurosci. 17, 2990(1997).
- DiGregorio, D. A., Peskoff, A., Vergara, J. L. Measurement of action potential-induced presynaptic calcium domains at a cultured neuromuscular junction. J. Neurosci. 19, 7846(1999).
- Yazejian, B., Sun, X. P., Grinnell, A. D. Tracking presynaptic Ca2+ dynamics during neurotransmitter release with Ca2+-activated K+ channels. Nat. Neurosci. 3, 566(2000).
- Sun, X. P., Chen, B. M., Sand, O., Kidokoro, Y., Grinnell, A. D. Depolarization-induced Ca2+ entry preferentially evokes release of large quanta in the developing Xenopus neuromuscular junction. J. Neurophysiol. 104 (5), 2730-2740 (2010).
- Xie, S. P., Poo, M. M. Initial events in the formation of neuromuscular synapse: rapid induction of acetylcholine release from embryonic neurons. Proc. Natl. Acad. Sci. U.S.A. 83, 7069(1986).
- Li, P. P., Chen, C., Lee, C. W., Madhavan, R., Peng, H. B. Axonal filopodial asymmetry induced by synaptic target. Mol. Biol Cell. 22 (14), 2480-2490 (2011).
- Feng, Z., Ko, C. P. Schwann cells promote synaptogenesis at the neuromuscular junction via transforming growth factor-beta1. J. Neurosci. 28 (39), 9599-9609 (2008).
- Song, H. J., Ming, G. L., Poo, M. M. cAMP-induced switching in turning direction of nerve growth cones. Nature. 17 (6639), 275-279 (1997).
- Morimoto, T., Wang, X. H., Poo, M. M. Overexpression of synaptotagmin modulates short-term synaptic plasticity at developing neuromuscular junctions. Neuroscience. 82 (4), 969-978 (1998).
- Lu, B., Czernik, A. J., Popov, S., Wang, T., Poo, M. M., Greengard, P. Expression of synapsin I correlates with maturation of the neuromuscular synapse. Neuroscience. 74 (4), 1087-1097 (1996).
- Schaeffer, E., Alder, J., Greengard, P., Poo, M. M. Synapsin IIa accelerates functional development of neuromuscular synapses. Proc. Natl. Acad. Sci. U.S.A. 26 (9), 3882-3886 (1994).
- Liou, J. C., Tsai, F. Z., Ho, S. Y. Potentiation of quantal secretion by insulin-like growth factor-1 at developing motoneurons in Xenopus cell culture. J. Physiol. 553 (Pt. 3), 719-7128 (2003).
- Peng, H. B., Yang, J. F., Dai, Z., Lee, C. W., Hung, H. W., Feng, Z. H., Ko, C. P. Differential effects of neurotrophins and schwann cell-derived signals on neuronal survival/growth and synaptogenesis. J. Neurosci. 23 (12), 5050-5060 (2003).
- Dan, Y., Poo, M. M. Hebbian depression of isolated neuromuscular synapses in vitro. Science. 12 (5063), 1570-1573 (1992).
- Xiao, Q., Xu, L., Spitzer, N. C. Target-dependent regulation of neurotransmitter specification and embryonic neuronal calcium spike activity. J. Neurosci. 30 (16), 5792-5801 (2010).
- Niewkoop, P. D., Faber, J. Normal table of Xenopus laevis (Daudin). , North-Holland, Amsterdam. (1967).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten