Method Article
シングル細胞におけるゼブラフィッシュセグメンテーション時計のイメージングのための分散前体節中胚葉細胞培養物の世代
要約
体節形成には、その空間的なパターン脊椎動物の胚の体軸リズミカルな発達過程である。以前、我々はこのプロセスを駆動する巡回遺伝子を観察する蛍光レポーターを使用したトランスジェニックゼブラフィッシュ系統を開発しました。ここでは、in vitroでの時間をかけて、これらの線とイメージ、その振動からの培養分散した細胞。
要約
セグメンテーションは、脊椎動物における周期とシーケンシャル形態形成のプロセスである。体軸に沿って体節と呼ばれる組織のブロックの形成は、このリズミカルな胚のパターニング遺伝発振器の証拠である。ゼブラフィッシュにおいて、細胞内のクロック駆動セグメンテーションは、負のフィードバックループに編成彼女/ hesの転写因子ファミリーのメンバーから構成されている。我々は最近、前体節中胚葉(PSM)における振動の時空間パターンを再現巡回遺伝子HER1のためのトランスジェニック蛍光レポーターラインを生成している。これらの行を使用して、我々は、単一の単離されたPSM細胞内セグメンテーションクロック発振のリアルタイム分析を可能にするインビトロ培養システムを開発した。トランスジェニック胚からPSMの組織を除去した後、ガラスボトムディッシュ上に領域を振動から細胞を分散させることによって、我々からの蛍光シグナルのタイムラプス撮影に適した培養物を生成し個々のクロック·セル。このアプローチは、その細胞自律的および組織レベルのプロパティを区別して解剖されることを可能に、これまでにない単一セルの分解能でセグメンテーションクロックを直接操作するための実験や概念的なフレームワークを提供します。
概要
脊椎動物の体軸や、体節形成に沿ってセグメントの定期的な形成は、発生中の胚における空間的および時間的な発振器の証拠である。体節形成を制御する有利なメカニズムは概念的になりました、細胞内サイクリックの遺伝子2のセットのリズミカルな表現によって駆動されると考えられ、セルラー発振器からなる「クロック」は、地層を切り刻み、ここで「時計と波面」モデル1で記述されている前体節中胚葉(PSM)からの体節の。胚が発展するにつれ、PSMでの成熟"波面は「減速して、3を通過する際に、携帯発振器を停止させることは、後方に向かって回帰する組織と協調して動く。一緒に、この時空間的に動的なシステムは、セグメンテーション·クロックと呼ばれる。地元のカップリング番目に単一細胞内の遺伝子発振器からセグメンテーションクロックスパンの組織の3増加レベルを研究する現在のアプローチATは、集団のPSM組織4の位置情報の世界的な規制の最後に、細胞との間で発生します。
以前の研究は、ゼブラフィッシュにおける細胞自律セグメンテーション発振器は転写抑制5-7を介して負のフィードバックループを形成すると考えられているfactorfamily 彼女/ HESの転写の遺伝子およびタンパク質産物、から構成されて示唆している。デルタ/ Notchシグナル伝達経路は、隣接するセル間の振動を同期させ、人口8月10日の集合時間を調節する。尾芽で生産FGFシグナル伝達分子は、ゼブラフィッシュ、PSMを横断勾配を構築するために表示され、それによって前部11で発振した細胞を遅くし、逮捕に貢献することを仮定している。今までは、体節形成におけるこれらの分子のそれぞれの機能的役割は、遺伝的変異、モルホリノ注入、熱ショック過剰発現、および拮抗薬のトリートメントルーム、によって研究されてきたクロックコンポーネントとセル5,7,10,12との間のシグナリングのtment。これらの摂動を使用して、セグメンテーション時計機能は、組織レベルでの体節欠陥の説明とHER1、her7、デルタ Cのような周期的な遺伝子の発現の均一な振動の損失から推測されていますしかし、ほぼすべてのこれらのデータのは、固定された胚からのものであり、正確にセグメンテーションクロックの動的な機能に固有の変更を取得することができない。より最近では、多胚タイムラプスイメージングは、変更された発振器周期の最初の変異体を明らかにしたが、これらの観察はまた、組織レベル7,13で行った。このように、体節形成中の仮説を立てた細胞自律振動子の挙動が観察されていない。
本質的に、プロセスは、振動系によって駆動され、体節形成のための静的スナップショットは、不完全な画像を得た。マウスやニワトリの細胞での以前の仕事は、転写産物のレベルを示したとタンパク質盛衰が、約2時間の振動をサンプリングごとに30または45分は、必ずしも、収集されたデータと14,15を描画することができ、したがって結論を制限します。他の生物学的発振器の研究では、最も顕著なのは、概日時計は、リアルタイムの蛍光および生物発光レポーターを16,17を使用して監視することに離れて、遺伝子およびタンパク質発現の段階的測定から移動しました。これらのツールは、単一細胞18のクロック特性を実証するために不可欠です。 たHes1巡回遺伝子の生物発光レポーターを開発し、簡単にマウスのシングルPSM細胞19で特徴づけられている。平均周期と分散は振動がインビトロで数サイクルの間持続することを示す、少数の細胞について計算した。しかしながら、これらの研究は、定量的に、細胞が自然に出入り振動ことができるかどうか、発振器周波数および振幅の安定性および堅牢性に対処していなかったとどのように細胞がそれらの位相関係を維持する。さらに、細胞自律的なクロックで胚に見られるシグナル伝達分子の影響を直接テストされていません。その結果、単一細胞発振器のこれらの基本的な性質は、完全に未知のままである。
我々は最近、HER1式 30のヴィーナス(YFP)の蛍光レポーターを駆動するのBACコンビニアリング20を使用したトランスジェニックフィッシュ系統を開発した。このような行は、それらが埋め込 まれた完全な染色体遺伝子座の規制手がかりを活用し、時間的ダイナミクスとHER1の空間パターンを再現。このブレークスルーは、 インビボで現像ゼブラフィッシュ胚における遺伝子発現のリアルタイムモニタリングを可能にする。細胞自律振動とどのような発現時間をかけて調節されているの基本的な特性を研究するために、我々は最近、in vitroでのPSM細胞から分離して記録するために信頼性の高い方法を開発した。このプロトタイプCOLは、我々は、単一の細胞内でのゼブラフィッシュセグメンテーションクロックの発振を特徴づけることができ、そこから分散した細胞培養を、生成するために、我々のトランスジェニックレポーターラインを利用している方法について説明します。私たちは、それによって、静的または組織レベルの解析ではアクセスできませんでした分野で顕著な問題に取り組むだけでなく、直接、シグナル伝達分子および阻害剤を用いた単一細胞レベルでのセグメンテーションクロックを操作することができます。
プロトコル
1。解剖の前に
- 解剖前日に、トランスジェニック対立遺伝子に関してヘテロゼブラフィッシュのペアのインクロスから胚を得る。
- シールド段階(6時間受精後)まで、28 O CでのメチレンブルーずにE3培地中で胚を上げる。
- 20 O、CO / NにメチレンブルーのないE3培地で移植胚彼らは尾芽段階に達すると20 度Cで、胚は、時間ごとに1体節を形成することになる。 20 O Cでの17〜20時間、O / N後、胚を解剖プロトコルの先頭に次の朝、ステージ5から8体節にあるべきである。
- 解剖のために必要なツールおよび試薬を組み立てます。
- 胚および組織の移転のためのファイアーポリッシュガラスピペット
- 胚から絨毛膜を除去するための細かいピンセット
- 解剖用SYLGARDでコーティングされた35-mmディッシュ - 35ミリメートル皿にシルガードポリマーを注ぎ、37℃でO / Nを治す使ってよく解剖をする硬化したポリマーの小さなボリュームを削除し、針の先端。皿を洗浄し、続いて再利用することができる。
- PSMの組織操作のための先鋭化、フラット化タングステン線ツール
- 文化にPSMの所望の部分を切断するためのマイクロ手術用メス
- トリプシンインキュベーションのための35mmのプラスチックシャーレ
- 10%ウシ胎児血清を含むL15培地
- 0.25%トリプシン/ EDTA溶液
- 分散のためのSigmacotedゲルローディングのヒント
- メチレンブルーずにE3培地を含むプラスチックペトリ皿。
- Fibronectin1基板(PBS中10μg/ mlの)とグラスボトムイメージング料理をカバーしています。解剖時にコーティングするためにベンチで料理をしておきます。
- 識別するために、適切な蛍光フィルターとソート正トランスジェニック胚(5から8体節期)とステレオスコープを使用してください。
- 蛍光チャンネル( 図1A)の下で、YFPの発現前体節中胚葉(PSM)を調べることによって、トランスジェニック胚を特定します。蛍光翔ULDは尾芽の最後に形成された体節の領域に見えるように。最も明るい信号に胚を選択します。子孫の25%が導入遺伝子の2コピーを有するホモ接合胚である必要があります。必要に応じて特定された胚の数は、実験に基づいて変化します。一解剖し尾芽胚ピースは、平均して、1,000個の細胞が得られます。一般的には、いくつかの追加の正の胚は、解剖中に行われた場合のエラーが発生するのに有用である。
- 信号から、特に卵黄細胞において、任意の自己蛍光を区別するために、位置基準として透過光を使用する。
- メチレンブルーずにE3培地を含む別々のプラスチックシャーレに正の胚を転送します。
2。PSM切開および散布
- 解剖のための胚を準備します。
- 解剖顕微鏡下で、細かい鉗子を使用して、慎重にE3培地に各胚から絨毛膜を除去します。胚に損傷を与えたり、卵黄細胞を破壊しないように注意してください。
- 血清を含むL15培地でのSylgardでコーティングされた解剖皿に入れます。鉗子または他の平らなツールを使用して、シルガードの表面から気泡を除去する。
- 解剖皿にファイアーポリッシュガラスピペットを使用して絨毛膜を除去した胚を転送します。
- ワイヤーツールを使用して、解剖皿の片側にすべての胚を移動します。
- シングル胚からPSMを解剖。
- オリエントよく解剖皿( 図1B)内のSylgard層で行われた小さなその横側に、単一の胚。
- マイクロメスを用いて、単に後脳に、胚の腹側の極( 図1B、赤い点線)を介して前方胚および卵黄細胞をスライス。
- 皿の側にそれを離れて移動し、井戸から胚の前方部分を削除してから、PSMなどの後方部分から離れて、残りの卵黄細胞の顆粒をこすり、ワイヤツールを使用しています。
- 卵黄が削り取られた後、平らにし、離れて、実験者から向いて前方端とのPSMおよび実験( 図1C)の方を向いて後方に向けます。
- 外胚葉の薄い層が、この時点ではオフに引っ張られていない場合は、離れてPSM組織の上からそれを剥離する線ツールを使用しています。
- マイクロメスを使用すると、離れた組織の他の部分( 図1C、赤い点線)から、脊索の終端を越えて尾芽胚、PSMの最も後方の先端を切った。注:PSMからの組織の他の部分は、最後に形成された体節に近い例前方PSMのために、また、実験的な質問に応じて、文化に撮影することができます。
- 離れて解剖エリアから皿の1コーナーに尾芽胚ピースを移動します。解剖フィールドからごみや不要な胚組織をクリアするために、ワイヤ·ツールを使用してください。
- 次の胚を繰り返します。
- プールは、複数の電子からの作品を尾芽胚mbryos、実験に必要とされるセルの数によって異なります。平均して、尾芽胚組織の一枚は、1,000個の細胞が得られます。
- トリプシン-EDTA少量の空の35 mmのプラスチック製の皿を埋める。
- ファイアーポリッシュガラスピペットを使用して、トリプシン/ EDTAを含む皿に料理を解剖から尾芽胚曲を転送します。 RTで20分間、トリプシン/ EDTAで尾芽片をインキュベートする。
- 組織は、トリプシン中でインキュベートされている間に、ガラス底のイメージング皿からFibronectin1溶液を除去。
- ミリQ水でガラスから3回のソリューションを洗浄します。各洗浄を削除し、料理は完全に乾燥していることを確認するために吸引を使用してください。
- イメージング用培地で尾芽胚片を分散させる。
- イメージング皿に血清をL15培地100μlをピペットで。
- コーティングされたゲルの先端を使用して、可能な限り少量のトリプシン/ EDTAから尾芽胚片を取り除く。
- 培地中に尾芽胚片をピペットイメージング一品。それらを分割し、培地中で細胞を懸濁するために上下に複数回の部分をピペット。気泡を導入しないように注意してください。顕微鏡下で細胞塊を確認し、必要に応じてより多くを分散させる。
- 懸濁液中の分散した細胞を、室温で20分間Fibronectin1コーティングガラス上に沈降させる。
- イメージングを開始する前に、細胞に血清を追加L15培地を少量を追加します。落ち着いた細胞を破壊しないように注意して使用してください。
- 実験の質問を考えると、文化に任意の補足的または薬物治療を追加します。
分散PSM細胞の3。イメージング
- タイムラプスイメージング顕微鏡で恒温槽内イメージングの皿を設定します。実験のために所望の温度にワーナー室を設定します。料理は、画像取得を開始する前に、少なくとも30分間平衡化することができます。必要であれば外部温度プローブとクロスチェック温度は、皿に入れた。注:ために温度や体節形成率21安定した温度制御との関係は、単一のPSM細胞における期間の正確な測定のために不可欠です。
- 露光時間と利得が雑音レベルに良好な信号を確保するために、飽和することなく、強度の大きなダイナミックレンジを提供することを確認するために蛍光チャンネルにおけるテスト画像を取得する。このプロトコルを使用して私たちのラインから生成され分散した細胞から得られた典型的な蛍光画像は、85のEMゲインで動作EMCCDカメラで透過光画像用の400ミリと40ミリ秒を必要としますから、また、プリアンプ·ゲインと読み出し速度カメラはノイズで信号を最大化するために不可欠である。
- 透過光チャネルを使用して、タイムラプス取得のための細胞のフィールドを選択します。
- 所望の時間のために、タイムラプス取得プロトコルを実行します。
- 1透過光と、フィールドごとに1つの蛍光画像を取得。注:取得ROの間隔を設定します。拡張された画像の上に、光退色や細胞内で毒性を誘発することなく、時間的なダイナミクスをキャプチャしますunds。このプロトコルは、2分間隔を使用しています。
- 細胞は、ソフトウェアやハードウェアのエラーなど焦点に残ることを保証するために、記録中に時折タイムラプスセットアップをチェックしてください
取得した時間経過の映画の4の画像処理
- 開いた動画像処理ソフトで取得したフィールドのファイル。 NOTE:フィジーは、このプロトコルの全ての処理のために使用した。
- 画像の2スタックを作成するために1フィールドからの透過光と蛍光のフレームを分割します。
- 透過光チャネル内の単一のセルを追跡します。
- 透過光チャネルの最初のフレームで選択したセルの周囲に円形のROI(関心領域)を配置します。注:1録画終了時に健康な細胞のみ、2は、フィールドの外に移動しない、および3は、他のCEと接触しない。LLSは、追跡される。
- ROIのROIマネージャーに数フレームごとに保存します。最後のフレームまでのセルを追跡します。
- 蛍光チャンネルに保存されたROIを使用して強度を測定する。
- 蛍光スタックを選択し、保存された関心領域を、時間をかけて追跡し、細胞の強度を測定するためのカスタム·サークル補間プラグインとマクロを使用します。
- マクロからの出力トレースを確認してください。トレースは定性的蛍光タイムラプスの特徴を捉えた場合、Excelのワークシートに値をエクスポートします。
- セルのためのROIリストを保存します。
- 送信されたチャネルで追跡し、フィールド内の他のセルの蛍光チャネルで測定を繰り返します。
- 実験からの追加フィールドのすべての手順を繰り返します。
結果
このプロトコルは、蛍光信号のタイムラプスイメージングのための実行可能な、分散された、単一のPSM細胞( 図2)の文化を生成します。私たちの導入遺伝子は、そのサイクルの生産と分解の時間半程度の胚における内因性遺伝子とタンパク質に類似ダイナミクスで発生リポーターを生成します。 、その速い回転率を、単一細胞におけるYFP信号は漂白を最小限に抑えるために迅速に検出し、各振動サイクルの特徴を捉えるために高時間分解能でなければならない。また、信号の相対的な薄暗与えられ、文化や買収条件は慎重に敏感かつ堅牢な結果を確保するために調整されてきた。我々は、次の要因は、撮像のための最適PSM細胞培養物を生成する際に重要であることが見出された:ガラス底培養皿をコーティングするために使用される1 ECM基板。 2。解剖と画像形成媒体への血清の添加。 HETEの交配後に撮影した識別された胚からのPSMの3。解剖その子孫、潜在的に導入遺伝子の2コピーを運ぶrozygousペア。蛍光シグナルの効率的な捕捉を確実にするために、より高いNAの対物レンズを使用して最適な倍率範囲内に4。画像取得、。 5。背景雑音に寄与し得る強度変動を最小化するために、固体光源を有する照明。信号読み出しを最大にする高感度EM-CCDカメラで6。シグナル検出。
次善の培養は、記録を通して、丸いと健康を維持しない細胞が含まれています。当社は、当社のECM基板は、ゼブラフィッシュfibronectin1の断片は、ポリ-リジンまたはラミニンのような他の一般的に使用される基板と比較して、未分化のPSMのような状態で細胞を維持するという仮説を立てた。我々は試験した他の基質は、細胞がガラスや記録の過程で蛍光信号を発振する損失に平らにしていました。我々はまた、発見した解剖時の培地への血清の添加、分散、記録が解離するために使用トリプシンをクエンチしないことだけが重要であったが、またによる改善された細胞生存率への可能性の背景上での蛍光強度を増加させた。単一細胞からの最適な信号の捕捉を確実にするために、我々は、高NAと特異的に蛍光イメージング(ツァイスプランNeoFluorシリーズ)用に設計された40倍の対物レンズを使用。我々はまた、固体光源は、ノイズの多い画像に貢献するバックグラウンドの変動を最小限にすることが重要である伝統的な水銀灯よりもより安定した照明をしていることが分かりました。これらの修飾は、ロバストな結果を確保するために重要である。
このプロトコルを使用して、我々は与えられたフィールド内の細胞の大部分は、記録中のある時点での蛍光されている文化を期待しています。蛍光細胞は、一般的に丸みを帯びたままで、録音時に時々非常に運動性であることを、私たちを見つける。蛍光細胞を含むいくつかの細胞は、記録時にアポトーシスになることがある。これらの細胞は、任意のAから除外されているnalysis。また、他の細胞と接触する細胞を排除または視野の外に移動する。透過光チャネル内の健康な細胞の数をカウントすることによって測定されるように、平均して、我々は、10時間記録の終わりまで視野あたりの細胞数の12%減少を参照。この損失は、フィールドの外に移動した細胞死および細胞の両方を含む。これらの警告に与えられた我々は、平均して、通常はトラック5蛍光生存可能で、表示されたままのフィールドあたりの細胞、及び、条件ごとに6つのフィールドを記録することができます。たとえば、4の条件を用いた実験は、取得された合計24のフィールドと条件あたり典型的には約30追跡された細胞を持つことになります。 10%ウシ胎児血清を含むL15培地で、標準の撮像条件の下で、我々は、PSMの細胞(n = 4つの実験の反復から101セル)が3±1のピーク(2の平均と標準偏差を有する、2〜7のピークの間に生成することができることが判明-3サイクル)。中央値ピーク数、ならびに25%パーセンタイル、2つのピークと75%パーセンタイルiは3つのピークをね。我々の半自動追跡および分析を用いて、我々はすぐに図2Cに示される代表的な細胞トレースと、個々のPSM細胞のための時間トレースの上に蛍光強度を生成することができる。これらの生トレースは、その後、周波数、振幅、サイクル数、およびピークのタイミングと、発振PSM細胞の特性の定量的な測定を行うために使用することができる。
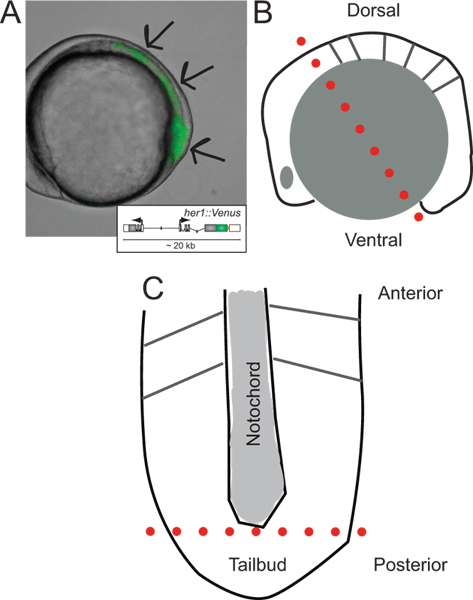
〜5体節期にYFP蛍光を発現するトランスジェニックゼブラフィッシュ胚の図1。その解剖のトランスジェニック胚および回路図の同定。(A)の側面図。画像は、透過光と蛍光チャンネルのオーバーレイである。矢印はLの方に、PSMを通じて、尾芽の先端に開始信号の領域を示している ASTは、体節が形成された。挿入図は、解剖時の最初のカットの前の胚の側面図(B)の模式図。30。その開発上やSoroldoni らを参照して、生体内挙動の詳細は、(レポーター導入遺伝子の模式図を示す。赤い点線最初のカットを示し、その前後軸に沿って配向卵黄顆粒及び表皮層を除去した後の平坦化されたPSM(C)の模式図で、。ただ尾芽胚の背後にある卵黄細胞ものの、後脳全体に作りました。赤い点線チップを削除するために第二のカットを示し、分散と文化のための尾芽の。 この図の拡大版を表示するには、こちらをクリックしてください。
07fig2.jpg "/>
図2。分散PSM培養における単一細胞から代表的な画像やトレース。6時間タイムラプス撮影の単一のPSMセルの透過光画像の(A)のモンタージュ。セルは記録の経過を通じて丸みを帯びた、健康的なままであることに注意してください。(B)は 、単一のPSM細胞から蛍光画像のモンタージュ対応。セルの強度のピークは、記録の過程で番号が付けられています。このセル上に置かれたROIから測定時間をかけて、(C)平均強度。値は、フィジーで書かれた円補間プラグインとカスタムマクロを使用して、2分ごとに1つのフレームレートでムービーのすべてのフレームから取られる。強度のピークが再びトレース全体に番号が付けられています。 この図の拡大版を表示するには、こちらをクリックしてください。
ディスカッション
胚発生の過程で起こる細胞プロセスを研究するために、生物学者は、典型的には、胚全体のコンテキスト内でのアプローチを利用する。しかし、完全に単一のセルが発達時間枠内でどのように動作するかを理解するために、分離して個々の細胞を調べ、混乱させる方法も非常に有益である。トランスジェニックゼブラフィッシュの胚を用いて分散PSM細胞培養物を生成することによって、我々は今、直接、定量的な方法でセグメンテーションクロックの遺伝的振動の細胞自律的な性質を研究するためのツールを持っている。これは、様々な条件下で細胞の数百のお蛍光レポーターの振動のダイナミクスを測定することが可能である。
培養中の単一細胞の観察期間が長く無傷の胚における体節形成の期間よりも長い。我々は、培養中のインタクトPSM外植片もまた股関節を示唆し、無傷の胚(データは示していない)よりも遅い振動を示すことを観察する単離された細胞で観察されたより長い周期T単に分散による損傷によるものではない。可変周期および振幅は、我々の単一細胞時系列のほとんどで観察される。この変動の原因は不明であるが、セグメンテーション·クロックのペース意思回路に関する重要な詳細を明らかにする必要があります。
この方法では、我々は、細胞レベルでのセグメンテーションの遺伝的要素を研究し、全胚で調べることに挑戦している問題に対処することができます。たとえば、私たちの文化に、発生中の胚で発見、既知のシグナル伝達分子の制御を加えることにより、我々は、堅牢で再現性のあるアッセイにおいて単一のPSM携帯発振器に与える影響を調べることができます。我々のPSM培養系は、単独で、どのような要因の厳格な評価への扉を開き、または組み合わせでこれらの振動を阻害し、そのような分子間の相互作用を試験するためにどのような要因は、これらの細胞における振動を促進する。手にこれらのツールにより、我々はすることを目指し胚全体で試験することができる予測を生成するために、単一細胞内に存在する公開された組織レベルのデータに基づいて体節形成のモデルならびに使用実績を評価する。
我々の知る限りでは、これは、単一細胞内の蛍光の急性タイムラプス撮影の最初のゼブラフィッシュの一次細胞培養プロトコルです。このプロトコルの更なる発展と改良が可能間違いないです。他のプロトコルは、しばしば、レポーターでトランスフェクトし、長期撮像27-29のために使用することができる安定な細胞株を生成するためにゼブラフィッシュ胚を使用する。安定株は、概日時計などの開発時期に結ばれていないプロセスを画像化するために有用であるが、細胞がその振動は、前駆状態にある間に、胚分割の問題は、すぐに画像を必要とする。細胞は、発振停止と、それらは分化した細胞の運命を想定し、そして組織において、体節中に組み込まれるとき。それはPOである右因子またはin vitroで存在する因子と我々はかなり長期的な観測、複数の連続摂動、またはハイスループットスクリーニングを可能にする、振動残るPSM様ゼブラフィッシュの細胞培養系を作製できることをssible。
我々は、タイムラプス撮影するための分散した細胞の初代培養物を調製するこの方法は、安定したゼブラフィッシュ細胞株を用いて親しみでない発達の時間枠内で起こる任意の細胞プロセスの研究のために適していることを期待する。切開によってまたはFACS経由のどちらか適切なトランスジェニックレポーター系統とは異なる発達段階の異なる細胞型の単離は、胚の解離後、出発細胞を提供することができます。細胞の胚起源によって案内培養条件、いくつかの最適化は、必要とされ得る。トランスジェニックゼブラフィッシュの急速に成長しているコレクションで、この柔軟で敏感なプロトコルを組み合わせることにより、行は、我々は古典的な遺伝的および発生学的方法と相補的であるin vitroの発生生物学のアプローチを容易にするために願っています。
開示事項
著者の貢献:
ABWが開発され、分散、培養、イメージング、細胞トラッキングプロトコルを洗練。 DSはトランスジェニック系統を生成し、このプロトコルで使用されるタイムラプス蛍光顕微鏡の設計を監督した。 AOは培養液中で解離し、画像PSM細胞に初期原理証明実験を開拓してきました。 JSフィジーの円補間プラグインツールは、タイムラプスムービーからの蛍光強度を測定するために使用さ書いた。 ABWとACOが原稿を書いている。
謝辞
この作品は、EMBO長期フェローシップ(ABW)、国立科学財団国際ポスドク研究フェローシップ(ABW)、マックスプランク研究機構(ABW、DS、JS、ACO)、DIGS-BBのフェローシップ(AO)によってサポートされていましたおよび欧州共同体セブンス枠組み計画STG-207634(DS、ACO)の下で、欧州研究会議。私たちは、原稿上の有益なコメントをラヴィデサイに感謝します。また、ゼブラフィッシュFibronectin1フラグメント、ケア、私たちの魚のラインと画像化をサポートするためのMPI-CBG光学顕微鏡設備の維持管理のためのMPI-CBG魚施設のスタッフの生産のために、MPI-CBGタンパク質発現機構に感謝したいと思います。
資料
| Name | Company | Catalog Number | Comments |
| Epifluorescence microscope | Olympus | Model: SZX16 | |
| Epifluorescence microscope | X-cite Illumination | Series: 120Q | |
| Dissection microscope | Olympus | Model: SZX12 | |
| Fine forceps no. 55 | Fine Science Tools | 11295-51 | |
| Glass transfer pipettes | Assistent | 567/2 | |
| 35 mm plastic petri dishes | Greiner | 627102 | |
| 60 mm plastic petri dishes | Greiner | 628102 | |
| Sylgard polymer | SASCO | 266727 | |
| Manipulation tools | Made in-house | For description of manipulation tools Ref. 22 | |
| Microsurgical knife | World Precision Instruments | 500249 | |
| L15 medium | Invitrogen | 57322 | |
| Penicillin/streptomyocin | PAA | P11-010 | |
| Fetal bovine serum | Invitrogen | 257322 | |
| 0.05% trypsin / 0.02% EDTA | PAA | L11-004 | |
| Gel loading tips | Fisher Scientific | 253188 | |
| Sigmacote | Sigma Aldrich | 254589 | |
| Micropipette set | Gilson International | F167300 | |
| Zebrafish Fibronectin1 70 kD fragment | MPI-CBG protein facility | Generated in-house from construct based on previously published work Ref. 23-25 | |
| Glass bottom imaging dishes | Mattek (single well) | P35G-1.5-14-C | |
| Glass bottom imaging dishes | Greiner (CellView -multi-well) | 262502 | |
| E3 medium without methylene blue | Made in-house | From The Zebrafish Book, 5th Ed. Ref. 26 | |
| Plastic transfer pipettes | Ratiolab | 260011 | |
| Warner heating/cooling chamber | Warner Instruments | TC-324B/344B | |
| EM-CCD camera | Andor | Model: iXOn 888 | |
| Wide-field fluorescence microscope with Venus filter set | Zeiss | Model: Axiovert 200M | |
| Wide-field fluorescence microscope with Venus filter set | NeoFluor 40x, NA 0.75 | ||
| Wide-field fluorescence microscope with Venus filter set | Lumencor Light Engine | Model: Spectra X | |
| Wide-field fluorescence microscope with Venus filter set | BrightLine HC 575/15 | F39-575 |
参考文献
- Cooke, J., Zeeman, E. C. A clock and wavefront model for control of the number of repeated structures during animal morphogenesis. J Theor Biol. 58, 455-476 (1976).
- Oates, A. C., Morelli, L. G., Ares, S. Patterning embryos with oscillations: structure, function and dynamics of the vertebrate segmentation clock. Development. 139, 625-639 (2012).
- Dequeant, M. L., Pourquie, O. Segmental patterning of the vertebrate embryonic axis. Nat Rev Genet. 9, 370-382 (2008).
- Oates, A. C., Gorfinkiel, N., Gonzalez-Gaitan, M., Heisenberg, C. P. Quantitative approaches in developmental biology. Nat Rev Genet. 10, 517-530 (2009).
- Oates, A. C., Ho, R. K. Hairy/E(spl)-related (Her) genes are central components of the segmentation oscillator and display redundancy with the Delta/Notch signaling pathway in the formation of anterior segmental boundaries in the zebrafish. Development. 129, 2929-2946 (2002).
- Lewis, J. Autoinhibition with transcriptional delay: a simple mechanism for the zebrafish somitogenesis oscillator. Curr Biol. 13, 1398-1408 (2003).
- Schroter, C., Oates, A. C. Segment Number and Axial Identity in a Segmentation Clock Period Mutant. Curr Biol. 20, 1254-1258 (2010).
- Riedel-Kruse, I. H., Muller, C., Oates, A. C. Synchrony dynamics during initiation, failure, and rescue of the segmentation clock. Science. 317, 1911-1915 (2007).
- Ozbudak, E. M., Lewis, J. Notch signalling synchronizes the zebrafish segmentation clock but is not needed to create somite boundaries. PLoS Genet. 4, e15 (2008).
- Herrgen, L., et al. Intercellular Coupling Regulates the Period of the Segmentation Clock. Curr Biol. 20, 1244-1253 (2010).
- Sawada, A., et al. Fgf/MAPK signalling is a crucial positional cue in somite boundary formation. Development. 128, 4873-4880 (2001).
- Giudicelli, F., Ozbudak, E. M., Wright, G. J., Lewis, J. Setting the tempo in development: an investigation of the zebrafish somite clock mechanism. PLoS Biol. 5, e150 (2007).
- Herrgen, L., Schroter, C., Bajard, L., Oates, A. C. Multiple embryo time-lapse imaging of zebrafish development. Methods Mol Biol. 546, 243-254 (2009).
- Hirata, H., et al. Oscillatory expression of the bHLH factor Hes1 regulated by a negative feedback loop. Science. 298, 840-843 (2002).
- Maroto, M., Dale, J. K., Dequeant, M. L., Petit, A. C., Pourquie, O. Synchronised cycling gene oscillations in presomitic mesoderm cells require cell-cell contact. Int J Dev Biol. 49, 309-315 (2005).
- Reppert, S. M., Weaver, D. R. Coordination of circadian timing in mammals. Nature. 418, 935-941 (2002).
- Welsh, D. K., Imaizumi, T., Kay, S. A. Real-time reporting of circadian-regulated gene expression by luciferase imaging in plants and mammalian cells. Methods Enzymol. 393, 269-288 (2005).
- Soroldoni, D., Oates, A. C. Live transgenic reporters of the vertebrate embryo's Segmentation Clock. Curr Opin Genet Dev. 21, 600-605 (2011).
- Masamizu, Y., et al. Real-time imaging of the somite segmentation clock: revelation of unstable oscillators in the individual presomitic mesoderm cells. Proc Natl Acad Sci USA. 103, 1313-1318 (2006).
- Soroldoni, D., Hogan, B. M., Oates, A. C. Simple and efficient transgenesis with meganuclease constructs in zebrafish. Methods in molecular biology. 546, 117-130 (2009).
- Schroter, C., et al. Dynamics of zebrafish somitogenesis. Dev Dyn. 237, 545-553 (2008).
- Picker, A., Roellig, D., Pourquie, O., Oates, A. C., Brand, M. Tissue micromanipulation in zebrafish embryos. Methods in molecular biology. 546, 153-172 (2009).
- Mould, A. P., et al. Identification of multiple integrin beta1 homologs in zebrafish (Danio rerio). BMC Cell Biol. 7, 24 (2006).
- Mould, A. P., Koper, E. J., Byron, A., Zahn, G., Humphries, M. J. Mapping the ligand-binding pocket of integrin alpha5beta1 using a gain-of-function approach. Biochem J. 424, 179-189 (2009).
- Zhao, Q., Liu, X., Collodi, P. Identification and characterization of a novel fibronectin in zebrafish. Exp Cell Res. 268, 211-219 (2001).
- Westerfield, M. In The zebrafish book : a guide for the laboratory use of zebrafish (Brachydanio rerio). , (1993).
- Vallone, D., Santoriello, C., Gondi, S. B., Foulkes, N. S. Basic protocols for zebrafish cell lines: maintenance and transfection. Methods Mol Biol. 362, 429-441 (2007).
- Carr, A. J., Whitmore, D. Imaging of single light-responsive clock cells reveals fluctuating free-running periods. Nat Cell Biol. 7, 319-321 (2005).
- Whitmore, D., Foulkes, N. S., Sassone-Corsi, P. Light acts directly on organs and cells in culture to set the vertebrate circadian clock. Nature. 404, 87-91 (2000).
- Soroldoni, D., et al. A Doppler effect in embryonic pattern formation. Science. 345, 222-225 (1126).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved