Method Article
Генерация распределенные пресомитной мезодермы клеточных культур для работы с изображениями данио рерио Сегментация часы в одиночных камерах
В этой статье
Резюме
Сомитогенеза является ритмичный процесс развития, что пространственно модели оси тела эмбрионов позвоночных. Ранее мы разработали трансгенных данио линии, которые используют флуоресцентные журналистам соблюдать циклические гены, которые управляют этим процессом. Здесь мы культура рассеяны клетки от этих линий и изображение их колебаний с течением времени в пробирке.
Аннотация
Сегментация является периодической и последовательной морфогенетический процесс у позвоночных. Это ритмическая формирование блоков ткани называемых сомиты вдоль оси тела свидетельствует о генетической генератора паттерна развивающийся эмбрион. У рыбок данио, внутриклеточный часы вождения сегментации состоит из членов Ее / Hes фактора транскрипции семьи организованной в отрицательные петель обратной связи. Недавно мы генерируется трансгенных флуоресцентных репортер линии для циклического гена HER1 что резюмировать пространственно-временную структуру колебаний в пресомитной мезодермы (PSM). Используя эти линии, мы разработали систему культуры в пробирке, который позволяет в режиме реального времени анализ сегментации тактовых колебаний в отдельных, изолированных клеток PSM. Удаляя PSM ткани из трансгенных эмбрионов, а затем диспергирования клетки от колеблющихся регионы на стеклянным дном блюда, мы получили культур, пригодных для покадровой визуализации сигнала флуоресценции ототдельные часы клетки. Такой подход обеспечивает экспериментальную и концептуальную основу для прямого манипулирования сегментации часы с беспрецедентным разрешением одноклеточных, что позволяет его свойства клеток-автономной и ткани на уровне следует отличать и расчленены.
Введение
Периодическое формирование сегментов вдоль позвоночных оси тела, или сомитогенеза, свидетельствует о пространственной и временной осциллятора в развивающемся эмбрионе. Благоприятствования механизм управления сомитогенеза концептуально описывается "часами и волнового фронта" модели 1, в котором "часы", состоящий из сотовых осцилляторов, сейчас считается, что внутри клетки обусловлен ритмической экспрессии набора циклических генов 2, клещей от образования из сомиты от пресомитной мезодермы (PSM). По мере развития эмбриона, созревание "волнового фронта" в PSM движется согласованно с регресс ткани по направлению к задней, замедляя и арестовывать сотовые осцилляторы, как она проходит 3. Все вместе это пространственно-временной динамическая система называется сегментации часы. Современные подходы для изучения сегментации SPAN тактовой три повышение уровня организации от генетического осциллятора в одиночных камерах в местные го связина происходит между клетками и, наконец, к глобальному регулированию позиционной информации в коллективном PSM ткани 4.
Предыдущие исследования показали, клетка-автономная сегментация генератор у рыбок данио состоит из генов и белковых продуктов из ее / HES транскрипции factorfamily, который, как считается, образуют отрицательной обратной связи через репрессии транскрипции 5-7. Сигнальный путь Delta / Notch синхронизирует колебания между соседними клетками и регулирует коллективный период населения 8-10. Fgf сигнальные молекулы, производимые в хвостовой почки появляются построить градиент через данио PSM, и тем самым предположили, внести свой вклад в замедление и арестовывать колеблющиеся клеток в передней 11. До сих пор функциональная роль каждого из этих молекул в сомитогенеза не были исследованы генетической мутации, инъекции морфолиногруппой, теплового шока избыточная экспрессия, и антагонистом наркотиков TREAtment тактовых компонентов и сигнализации между клетками 5,7,10,12. Используя эти возмущения, сегментация функция часы были выведены из описания ткани уровня сомитных дефектов и потери однородных колебаний в выражении циклических генов как HER1, her7 и дельты С. Тем не менее, почти все из этих данных со стационарных эмбрионов и не в состоянии точно фиксировать изменения, которые присущи динамической функции сегментации часы. Совсем недавно, с несколькими эмбрион покадровой визуализации показал первые мутанты с периода измененного осциллятора, но эти наблюдения были также сделаны на уровне ткани 7,13. Таким образом, поведение предполагаемого клеточно-автономным генератором во время сомитогенеза не наблюдалось.
Статические снимки сомитогенеза дать неполную картину, поскольку, по сути, процесс приводится в движение колебательной системы. Ранее работа в мыши и куриных клеток показали, что уровни стенограммыи повышение белка и осенью, но выборки примерно 2 часов колебаний каждые 30 или 45 минут обязательно ограничивает данные, собранные и, следовательно, выводы, которые можно сделать 14,15. Изучение других биологических осцилляторов, в первую очередь, циркадные часы, отошла от постановочных измерений гена и экспрессии белка в режиме реального времени мониторинг с помощью флуоресцентной и биолюминесцентных журналистам 16,17. Эти средства необходимы для демонстрации часы свойства отдельных клеток 18. Биолюминесцентное корреспондент Hes1 циклического гена была разработана и кратко характеризуется в единичных мыши PSM клеток 19. Средний период и отклонение были рассчитаны для небольшого числа клеток, показывающий, что колебания сохраняться в течение нескольких циклов в пробирке. Однако эти исследования не количественном отношении стабильности и надежности частоты генератора и амплитудой, будь клетки могут спонтанно входа или выхода колебания,и как клетки сохраняют свои фазовые соотношения. Кроме того, эффекты сигнальных молекул, обнаруженных в эмбрионе на часах клеточно-автономными не были протестированы непосредственно. Следовательно, эти фундаментальные свойства одиночного осциллятора клеток остаются совершенно неизвестно.
Недавно мы разработали трансгенных рыб линий с использованием ВАС recombineering 20 ездить Венера (YFP) флуоресценции журналистам из HER1 выражения 30. Такие линии использовать регуляторные сигналы от интактной хромосомного локуса в которую они встроены и воспроизводят временную динамику и пространственное распределение HER1. Этот прорыв позволяет для мониторинга в режиме реального времени экспрессии генов в развивающихся эмбрионов рыбок данио в естественных условиях. Для изучения фундаментальных свойств клеточных автономных колебаний и, как такое выражение регулируется с течением времени, мы недавно разработали надежный метод, чтобы изолировать и записи из PSM клеток в пробирке. Это протоцв описывает, как мы использовали наши трансгенных репортер линии для создания распределенных клеточных культур, из которых мы можем охарактеризовать колебания данио сегментации часы в одиночных камерах. Мы можем, таким образом, решить нерешенные вопросы в области, которые не были доступны со статическим или ткань уровня анализа, а также напрямую управлять сегментации часы на одном уровне клетки с сигнальных молекул и ингибиторов.
протокол
1. Прежде Рассечение
- За день до вскрытия, получить эмбрионы из Incross из рыбок данио пар, гетерозиготных по трансгенной аллеля.
- Поднимите эмбрионов в E3 среде без метиленового синего на 28 ° С до щита этапе (6 ч после оплодотворения).
- Эмбрионы переноса в E3 среде без метиленового синего в 20 O CO / Н. В 20 ° С, эмбрионы будут формировать 1 сомита за час, как только они достигают хвостовой почки этап. После 17-20 часов O / N при 20 ° С, эмбрионы должны быть от 5 до 8 сомитов на следующее утро в начале протокола вскрытия.
- Соберите инструменты и реагенты, необходимые для вскрытия.
- Противопожарные полированного стекла пипетки для передачи эмбрионов и ткани
- Пара тонких щипцов для удаления хорионов из эмбрионов
- Sylgard покрытием 35-мм блюдо для вскрытия - Налейте Sylgard полимера в 35 мм блюдо и вылечить O / N в 37 ° С Сделать вскрытие скважины с использованиемкончик иглы для удаления небольшой объем отвержденного полимера. Блюдо может быть очищен, а затем повторно.
- Уточненные, сплющенные вольфрамовой проволоки инструменты для PSM ткани манипуляции
- Микро-скальпель для резки желаемых куски PSM к культуре
- 35-мм пластиковая тарелка для трипсина инкубации
- L15, содержащей 10% фетальной бычьей сыворотки
- 0,25% раствор трипсина / EDTA
- Sigmacoted гелевые загрузкой для разгона
- Пластиковые чашки Петри, содержащие E3 среду без метиленового синего.
- Обложка со стеклянным дном изображений блюдо с Fibronectin1 подложки (10 мкг / мл в PBS). Оставьте блюдо на скамейке, чтобы покрыть во время вскрытия.
- Используйте стереоскоп с соответствующими флуоресцентных фильтров для выявления и рода положительных трансгенных эмбрионов (стадия 5 до 8 сомит).
- Определить трансгенных эмбрионов путем изучения пресомитной мезодерму (PSM) для выражения YFP под флуоресценции канала (рис. 1А). Флуоресценции шоULD будет видно в регионе с последнего сформированного сомита к хвостовой почки. Выберите эмбрионов с яркой сигнала; 25% потомства должно быть гомозиготные эмбрионы, несущие 2 копии трансгена. Количество идентифицированных эмбрионов, необходимых изменяется в зависимости от эксперимента. Один расчлененный хвостовой почки кусок даст 1000 клеток, в среднем. Как правило, несколько дополнительных положительных эмбрионы могут быть использованы в случае ошибки сделаны во время вскрытия.
- С помощью пропускаемого света в качестве позиционной ссылкой отличить любой аутофлюоресценция, особенно в желтка клетки, из сигнала.
- Передача положительные эмбрионов в отдельный пластиковый чашку Петри, содержащую E3 среду без метиленовым синим.
2. PSM Вскрытие и Разгон
- Подготовка эмбрионов для вскрытия.
- Под микроскопом рассечение, используя тонкий пинцет, осторожно снимите хориона от каждого эмбриона в среде E3. Будьте уверены, чтобы не повредить эмбрион или нарушить желтка ячейку.
- Заполните Sylgard покрытием рассекает блюдо с L15 среды с сывороткой. Использование щипцов или другой плоский инструмент, удалите все пузырьки воздуха из поверхности Sylgard.
- Трансфер dechorionated эмбрионов с помощью огневой полировкой стеклянную пипетку, чтобы рассечение блюдо.
- Использование проволочных инструментов, переместите все эмбрионов одной стороне рассекает блюдо.
- Проанализируйте PSM из одного эмбриона.
- Ориент один эмбрион на его боковой стороне в малом хорошо сделал в слое Sylgard внутри рассекает блюдо (рис. 1В).
- Использование микро-скальпель, ломтик через эмбриона и желточного клетки просто впереди в заднем мозге и через брюшной полюсе эмбриона (рис. 1В, усеянной красная линия).
- Снимите переднюю часть эмбриона из колодца, перемещение его, в сторону тарелки, а затем использовать проводные инструменты для соскрести оставшиеся гранулы желтка клеток из раздела задней включая PSM.
- После того, как желток был разгреб, сгладить и ориентировать PSM с переднего конца указывая прочь от экспериментатора и кзади указывая на экспериментатора (рис. 1в).
- Если тонкий слой эктодермы не снял на данный момент, использовать проводные средства, чтобы очистить его от верхней части PSM ткани.
- Использование микро-скальпель сократить хвостовой почки, самый задний кончик PSM мимо конце хорды, далеко от остальной ткани (рис. 1в, пунктирная красная линия). Примечание: Остальные кусочки ткани от PSM, например передней части PSM ближе к последней, образованной сомитов, также могут быть приняты в культуру, в зависимости от экспериментальной вопрос.
- Перемещение хвостовой почки кусок в один из углов блюдо от области вскрытии. Используйте проводные средства, чтобы очистить весь мусор и ненужный эмбриона ткань от области вскрытии.
- Повторите со следующей эмбриона.
- Бассейн хвостовой почки пьесы из многократного еmbryos, в зависимости от того, сколько клеток будут необходимы для эксперимента. В среднем, один кусок хвостовой почки ткани дает 1000 клеток.
- Заполните пустой 35-мм пластиковую чашку с небольшим объемом трипсин-ЭДТА.
- Использование огня-полированного стекла пипетки хвостовой почки части от рассечения блюдо в блюдо с трипсина / ЭДТА. Инкубировать хвостовой почки штук в трипсин / ЭДТА в течение 20 мин при комнатной температуре.
- В то время как ткань инкубируют в трипсина, удаления раствора Fibronectin1 от изображений блюдо со стеклянным дном.
- Вымойте решение из стекла 3 раза MilliQ воды. Используйте всасывания для удаления каждого мытья и обеспечить блюдо должна быть абсолютно сухой.
- Дисперсные хвостовой почки штук в среде для работы с изображениями.
- Внесите 100 мкл среде L15 с сывороткой в визуализации блюдо.
- Использование чаевые гель покрытием, удалите хвостовой почки куски от трипсина / ЭДТА в качестве небольшого объема, как это возможно.
- Внесите в хвостовой почки штук в среду втомография блюдо. Пипетки части вверх и вниз несколько раз, чтобы разорвать их на части и приостановить клеток в среде. Будьте осторожны, чтобы не вводить пузырьков воздуха. Проверка на клеточных комочков под микроскопом и дисперсных более по мере необходимости.
- Разрешить рассеянные клетки в суспензии оседать на стекле Fibronectin1 покрытием в течение 20 мин при комнатной температуре.
- Добавить небольшой объем дополнительной L15 среде с сывороткой к клеткам перед началом визуализации. Будьте осторожны, чтобы не нарушать устоявшиеся клетки.
- Учитывая экспериментальный вопрос, добавить любую дополнительную или медикаментозного лечения к культуре.
3. Визуализация распределенные PSM клеток
- Настройка изображений блюдо в холодильной камеры на изображения микроскопа покадровой. Установка Warner камеру к желаемой температуре в течение эксперимента. Разрешить блюдо для уравновешивания в течение не менее 30 мин до начала захвата изображений. Crosscheck температуры с датчика внешней температуры помещается в блюдо, если требуется. ПРИМЕЧАНИЕ: В связи сотношения между температуры и скорости сомитогенеза 21 стабильной контроля температуры имеет важное значение для точных измерений периода в отдельных клеток PSM.
- Приобретать тестовых фотографий в флуоресценции канала, чтобы проверить, что время экспозиции и усиления обеспечивают большой динамический диапазон интенсивностей без насыщения для обеспечения хорошего сигнал уровнем шума. Типичный флуоресценции изображение, полученное от рассеянных клеток, полученных от наших линий с использованием этого протокола требуется 400 мс и 40 мс для передаваемого светового изображения с EMCCD камеры, работающей при ЭМ Gain 85 лет. Кроме того, усиление предварительного сигнала и скорость считывания от Камера также имеют важное значение для максимального сигнала над помехой.
- Использование проходящем свете канал, выберите поля клеток для приобретения покадровой.
- Запустите протокол сбора покадровой для желаемого промежутка времени.
- Приобретать один проходящий свет и один флуоресценции изображение на поле. ПРИМЕЧАНИЕ: Установите интервал между ро приобретенияunds, который захватит временную динамику без фото-отбеливание более длительного изображений или индуцирующего токсичности в клетках. Этот протокол использует интервал 2 мин.
- Проверьте покадровой настройку иногда во время записи, чтобы убедиться, что клетки остаются в фокусе, не программные или аппаратные ошибки и т.д.
4. Обработка изображений приобретенных покадровой Фильмы
- Открыть файл фильма для приобретенного поля в программное обеспечение для обработки изображений. ПРИМЕЧАНИЕ: Фиджи был использован для обработки всех в этом протоколе.
- Сплит проходящем свете и флуоресценции кадры из одного поля, чтобы создать 2 стопки изображений.
- Трек одну ячейку в проходящем свете канала.
- Поместите круглую ROI (область интереса) вокруг выбранной ячейки в первом кадре в проходящем свете канала. Примечание:.. Только клетки, которые являются здоровыми 1 в конце записи, два не выходить за пределы области, и 3 не вступают в контакт с другой CE.LLS отслеживаются.
- Сохранить ROI каждые несколько кадров с менеджером ROI. не отслеживать Сотовый до последнего кадра.
- Измерьте интенсивность, используя сохраненные трансформирования на флуоресценции канала.
- Выберите стек флуоресценции и с сохраненной трансформирования, используйте пользовательский круг интерполяция плагин и макрос для измерения интенсивности гусеничного клетки с течением времени.
- Проверьте выходной след от макроса. Если след качественно захватывает особенности флуоресценции покадровой, экспортировать значения на лист Excel.
- Сохранить список ROI для ячейки.
- Повторите отслеживания в проходящем канала и измерения в флуоресценции канала для других клеток в этой области.
- Повторите все шаги для дополнительных полей из эксперимента.
Результаты
Этот протокол производит культур жизнеспособных, рассеянных, отдельных клеток PSM для покадровой визуализации сигнала флуоресценции (рис. 2). Наша трансген генерирует репортером, цикл производства и деградации происходит с подобными динамики к эндогенным геном и белком в зародыше, порядка получаса. Благодаря быстрому обороту, сигнал YFP в отдельные клетки должны быть обнаружены быстро, чтобы минимизировать отбеливание и с высоким временным разрешением, чтобы захватить особенности каждого колебательного цикла. Кроме того, учитывая относительную помутнение сигнала, культуры и приобретение условия были тщательно настроены для обеспечения чувствительных и надежных результатов. Мы нашли следующие факторы, чтобы иметь важное значение в создании оптимальных клеточных культур PSM для визуализации:. 1 ECM подложки используется для покрытия прозрачным дном чашки для культивирования. 2. Добавление сыворотки вскрытия и обработки изображений среды. 3. Рассечение PSM из выявленных эмбрионов, взятых после спаривания нетеrozygous пар, чьи потомки потенциально нести 2 копии трансгена. 4. Получение изображений в оптимальном диапазоне увеличения, используя цели более высокого NA для обеспечения эффективного захвата сигнала флуоресценции. 5. Освещение с твердотельного источника света, чтобы минимизировать колебания интенсивности, которые могут способствовать фонового шума. 6. Обнаружение сигнала с высокочувствительным EM-CCD камеры для максимального сигнала считывания.
Неоптимальной культуры будет содержать клетки, которые не остаются округлые и здоровым в течение записи. Мы предположили, что наша ECM подложка, фрагмент данио fibronectin1 удерживает клетки в недифференцированном PSM-подобное состояние, в сравнении с другими широко используемых субстратов, таких как поли-лизин или ламинин. Другие субстраты протестированных вызвано клетки, чтобы сгладить на стекле и потери колебательного сигнала флуоресценции на протяжении записи. Мы также обнаружили, что добавление сыворотки в среду во время вскрытия, разгон,и запись была не только важным, чтобы утолить трипсина используется для диссоциации, но и увеличение интенсивности флуоресценции над фоне, вероятно, связано с улучшением жизнеспособности клеток. Для обеспечения оптимального захвата сигнала от одной клетки мы использовали 40x цели, специально предназначенные для визуализации флуоресценции (Zeiss плана серии NeoFluor) с высокой NA. Мы также обнаружили, что твердотельный источник света при условии более стабильной освещение, чем традиционные ртутных ламп, что является критическим для минимизации фоновых колебаний, которые способствуют шумных изображений. Эти модификации играют важную роль, чтобы обеспечить надежные результаты.
Используя этот протокол мы ожидаем культуры, в которых большинство клеток в данной области флуоресцентные в какой-то момент во время записи. Мы считаем, что флуоресцентные клетки обычно остаются округлые и иногда довольно подвижны во записей. Несколько клетки, в том числе люминесцентных клеток, может стать апоптоза во время записи. Эти клетки исключены из любого анализ. Мы также исключить клетки, которые вступают в контакт с другими клетками или переместить вне поля зрения. В среднем, мы видим снижение на 12% количества клеток в области к концу записи 10 ч, как измерено путем подсчета количества здоровых клеток в проходящем свете канала. Эта потеря включает в себя как гибель клеток и клетки, которые перемещаются из области. С учетом этих предостережений можно, в среднем, трек 5 флуоресцентные клетки в области, которые остаются жизнеспособными и видно, и, как правило записывать 6 полей в состоянии. Например, эксперимент с 4 условиях будет иметь 24 всего поля приобрела и обычно около 30 отслеживаемые клеток на состоянии. При стандартных условиях визуализации с L15 среде, содержащей 10% эмбриональной бычьей сыворотки, мы находим, что PSM клетки (п = 101 клеток из 4 экспериментальных повторах) может производить от 2 до 7 пиков, со средним и стандартным отклонением 3 ± 1 пиков (2 -3 циклов). Средний пик количество, а также 25% процентиль, составляет 2 пики и 75% процентиль яы 3 пика. Используя наш полу-автоматического отслеживания и анализа, мы можем быстро создать интенсивность флуоресценции с течением времени следов для отдельных клеток PSM, с представительной следа клеток показано на рисунке 2C. Эти сырые следы затем могут быть использованы, чтобы сделать количественные измерения свойств колебательных PSM клеток, таких как частота, амплитуда, числа циклов, и времени пиков.
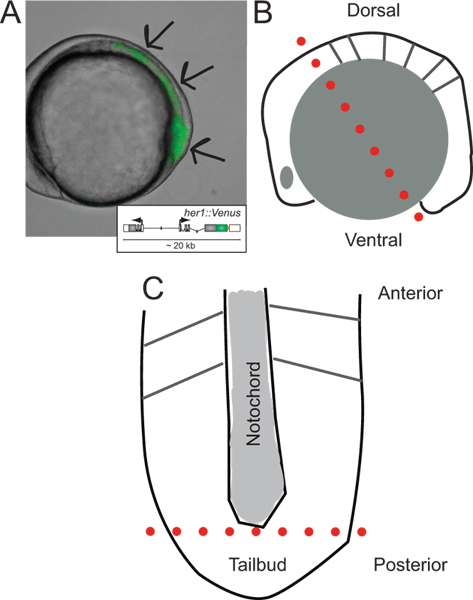
Рисунок 1. Идентификация трансгенных эмбрионов и схемы их вскрытия. (A) Боковой вид трансгенного эмбриона данио, экспрессирующих флуоресценции YFP при ~ 5 сомитов. Изображение наложение проходящем свете и флуоресценции канала. Стрелки указывают направления сигнала, начиная с кончика хвостовой почки, на протяжении PSM, к л аст формируется сомита. Вставка показана схема репортера трансгена (для получения дополнительной информации о своем развитии и в естественных условиях поведения относятся к Soroldoni др.. 30. (В) Схема бокового зрения эмбриона до первого сократить во время вскрытия. Пунктирная красная линия обозначает первое сокращение сделал через задний мозг, хотя желток клеток сразу за хвостовой почки. (С) схематический вид уплощенной PSM после удаления гранул желтка и эпидермального слоя, ориентированного вдоль его передне-задней оси. Пунктирная красная линия указывает на второй разрез, чтобы удалить кончик из хвостовой почки для разгона и культуры. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
07fig2.jpg "/>
Рисунок 2. Типичные изображения и следы от одной клетки в диспергированном PSM культуры. (A) Монтаж проходящем свете изображения одной клетки PSM в 6-часовой записи покадровой. Следует отметить, что клетка остается округлый и здоровым на протяжении всей записи. (B)-корреспондент монтаж флуоресценции изображений из одной клетки PSM. Пики интенсивности клетки пронумерованы в течение записи. (C) Средняя интенсивность с течением времени измеряется от ROI, размещенной на этой камере. Величины взяты из каждого кадра из фильма с частотой кадров одного за 2 мин, используя круг интерполяция плагин и пользовательский макрос, написанный на Фиджи. Пики интенсивности снова пронумерованы следа. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
Обсуждение
Для изучения клеточный процесс, который происходит в течение эмбрионального развития, биологи обычно используют подход в контексте всей эмбриона. Однако, чтобы полностью понять, как одна клетка ведет себя в развития сроки, способ изучить и возмущают отдельные клетки в изоляции также весьма полезным. Создавая дисперсные клеточных культур PSM с использованием трансгенных эмбрионов рыбок данио у нас теперь есть инструмент непосредственного изучения клеток автономный характер генетических колебаний в сегментации часов в количественном виде. Это можно измерить динамику колебаний в нашей флуоресцентного репортера в сотни клеток при различных условиях.
Наблюдаемое период одиночных клеток в культуре длиннее, чем период сомитогенеза в интактном эмбриона. Заметим, что нетронутыми ПСМ эксплант в культуре также проявляет более медленные колебания, чем интактной эмбриона (данные не представлены), предполагая, тхат длительный период наблюдается в изолированных клетках не просто из-за ущерба от разгона. Переменная период и амплитуда наблюдается в большинстве наших одноклеточных временных рядов. Источником этой изменчивости, неизвестно, но должны выявить важные детали о темпе решений схем сегментации часов камеры.
С помощью этого метода можно изучать генетические компоненты сегментации на клеточном уровне, и решения вопросов, которые являются достаточно сложными для изучения во всем эмбриона. Например, контролируемым добавлением известных сигнальных молекул, обнаруженных в развивающегося эмбриона до наших культур, мы можем рассмотреть их воздействие на одной сотовой PSM осциллятора в надежной и воспроизводимой анализа. Наша система культуры ПСМ открывает дверь к точной оценки, какие факторы, по отдельности или в комбинации способствовать колебания в этих клетках, какие факторы тормозят эти колебания, и, чтобы проверить взаимодействие между таких молекул. С помощью этих инструментов в руках, мы стремимсяоценить существующие модели сомитогенеза, которые основаны на опубликованных данных тканей уровня, а также использование приводит одиночных клеток для создания предсказания, которые могут быть проверены в целом эмбриона.
Насколько нам известно, это первый данио протокол первичной культуры клеток при остром покадровой записи флуоресценции в одиночных камерах; дальнейшее развитие и совершенствование этого протокола нет сомнений возможно. Другие протоколы часто используют эмбрионы рыбок данио для генерации стабильных клеточных линий, которые могут быть трансфицированных с журналистами и используемые для долгосрочного изображений 27-29. В то время как стабильные линии полезны для визуализации процесса, которая не привязана к срокам разработки, такие как циркадных часов, вопрос о эмбрионального сегментации требует немедленного картину звучания и клетки все еще находятся в колебательной, государства-предшественника. После того, как клетки прекращают колеблющаяся, они предполагают дифференцированный судьбу клетки, а когда в ткани, будут включены в сомита. Это роssible, что при правильном фактора или факторов, присутствующих в пробирке мы могли генерировать ПСМ-как данио клеточных культур линии, которые остались бы колебательная, значительно позволяет долгосрочных наблюдений, несколько последовательных возмущения или высокопроизводительного скрининга.
Мы ожидаем, что этот способ получения первичных культур рассеянных клеток для покадровой обработки изображений хорошо подходит для изучения любого сотового процесс, который происходит в течение развития временных рамок, которые не доступным с использованием стабильных данио клеточных линий. Выделение различных типов клеток в различных стадиях развития из соответствующих трансгенных репортеров линий, либо через рассечение или через FACS после эмбрионального диссоциации, может обеспечить начальные клетки. Некоторые оптимизация условий культивирования, руководствуясь эмбрионального происхождения клеток, которые могут потребоваться. Комбинируя этот гибкий и чувствительный протокол с быстро растущей коллекции трансгенных даниолинии, мы надеемся способствовать пробирке биологии развития подхода в том, что является дополнением к классической генетических и эмбриологических методов.
Раскрытие информации
Вклад авторов:
ABW разработал и усовершенствовал разгона, культуру, изображений и протоколы отслеживания клеток. DS сгенерировали трансгенных линий и курировал дизайн покадровой флуоресцентного микроскопа, используемого в данном протоколе. АО впервые начальные доказывающих принципе эксперименты, чтобы отделить и изображение PSM клетки в культуре. JS написал инструмент плагин круг интерполяция на Фиджи используется для измерения интенсивности флуоресценции от покадровой фильмов. ABW и АКН написал рукопись.
Благодарности
Эта работа была поддержана EMBO длительных стажировок (ABW), Национальный научный фонд Международный Докторантура исследовательский грант (ABW), Макс Планк Gesellschaft (ABW, DS, JS, АКН), роет-ВВ стипендий (АО), и Европейский исследовательский совет под Европейских сообществ Седьмая Рамочная программа STG-207634 (DS, АКН). Мы благодарим Рави Десаи за полезные замечания по рукописи. Мы также хотели бы поблагодарить экспрессии белка-центр MPI-ЦБС для производства данио Fibronectin1 фрагмента, персонала рыба объекта MPI-ЦБС для ухода и обслуживания наших рыбных линий и MPI-ЦБС световой микроскопии объекта для поддержки визуализации.
Материалы
| Name | Company | Catalog Number | Comments |
| Epifluorescence microscope | Olympus | Model: SZX16 | |
| Epifluorescence microscope | X-cite Illumination | Series: 120Q | |
| Dissection microscope | Olympus | Model: SZX12 | |
| Fine forceps no. 55 | Fine Science Tools | 11295-51 | |
| Glass transfer pipettes | Assistent | 567/2 | |
| 35 mm plastic petri dishes | Greiner | 627102 | |
| 60 mm plastic petri dishes | Greiner | 628102 | |
| Sylgard polymer | SASCO | 266727 | |
| Manipulation tools | Made in-house | For description of manipulation tools Ref. 22 | |
| Microsurgical knife | World Precision Instruments | 500249 | |
| L15 medium | Invitrogen | 57322 | |
| Penicillin/streptomyocin | PAA | P11-010 | |
| Fetal bovine serum | Invitrogen | 257322 | |
| 0.05% trypsin / 0.02% EDTA | PAA | L11-004 | |
| Gel loading tips | Fisher Scientific | 253188 | |
| Sigmacote | Sigma Aldrich | 254589 | |
| Micropipette set | Gilson International | F167300 | |
| Zebrafish Fibronectin1 70 kD fragment | MPI-CBG protein facility | Generated in-house from construct based on previously published work Ref. 23-25 | |
| Glass bottom imaging dishes | Mattek (single well) | P35G-1.5-14-C | |
| Glass bottom imaging dishes | Greiner (CellView -multi-well) | 262502 | |
| E3 medium without methylene blue | Made in-house | From The Zebrafish Book, 5th Ed. Ref. 26 | |
| Plastic transfer pipettes | Ratiolab | 260011 | |
| Warner heating/cooling chamber | Warner Instruments | TC-324B/344B | |
| EM-CCD camera | Andor | Model: iXOn 888 | |
| Wide-field fluorescence microscope with Venus filter set | Zeiss | Model: Axiovert 200M | |
| Wide-field fluorescence microscope with Venus filter set | NeoFluor 40x, NA 0.75 | ||
| Wide-field fluorescence microscope with Venus filter set | Lumencor Light Engine | Model: Spectra X | |
| Wide-field fluorescence microscope with Venus filter set | BrightLine HC 575/15 | F39-575 |
Ссылки
- Cooke, J., Zeeman, E. C. A clock and wavefront model for control of the number of repeated structures during animal morphogenesis. J Theor Biol. 58, 455-476 (1976).
- Oates, A. C., Morelli, L. G., Ares, S. Patterning embryos with oscillations: structure, function and dynamics of the vertebrate segmentation clock. Development. 139, 625-639 (2012).
- Dequeant, M. L., Pourquie, O. Segmental patterning of the vertebrate embryonic axis. Nat Rev Genet. 9, 370-382 (2008).
- Oates, A. C., Gorfinkiel, N., Gonzalez-Gaitan, M., Heisenberg, C. P. Quantitative approaches in developmental biology. Nat Rev Genet. 10, 517-530 (2009).
- Oates, A. C., Ho, R. K. Hairy/E(spl)-related (Her) genes are central components of the segmentation oscillator and display redundancy with the Delta/Notch signaling pathway in the formation of anterior segmental boundaries in the zebrafish. Development. 129, 2929-2946 (2002).
- Lewis, J. Autoinhibition with transcriptional delay: a simple mechanism for the zebrafish somitogenesis oscillator. Curr Biol. 13, 1398-1408 (2003).
- Schroter, C., Oates, A. C. Segment Number and Axial Identity in a Segmentation Clock Period Mutant. Curr Biol. 20, 1254-1258 (2010).
- Riedel-Kruse, I. H., Muller, C., Oates, A. C. Synchrony dynamics during initiation, failure, and rescue of the segmentation clock. Science. 317, 1911-1915 (2007).
- Ozbudak, E. M., Lewis, J. Notch signalling synchronizes the zebrafish segmentation clock but is not needed to create somite boundaries. PLoS Genet. 4, e15 (2008).
- Herrgen, L., et al. Intercellular Coupling Regulates the Period of the Segmentation Clock. Curr Biol. 20, 1244-1253 (2010).
- Sawada, A., et al. Fgf/MAPK signalling is a crucial positional cue in somite boundary formation. Development. 128, 4873-4880 (2001).
- Giudicelli, F., Ozbudak, E. M., Wright, G. J., Lewis, J. Setting the tempo in development: an investigation of the zebrafish somite clock mechanism. PLoS Biol. 5, e150 (2007).
- Herrgen, L., Schroter, C., Bajard, L., Oates, A. C. Multiple embryo time-lapse imaging of zebrafish development. Methods Mol Biol. 546, 243-254 (2009).
- Hirata, H., et al. Oscillatory expression of the bHLH factor Hes1 regulated by a negative feedback loop. Science. 298, 840-843 (2002).
- Maroto, M., Dale, J. K., Dequeant, M. L., Petit, A. C., Pourquie, O. Synchronised cycling gene oscillations in presomitic mesoderm cells require cell-cell contact. Int J Dev Biol. 49, 309-315 (2005).
- Reppert, S. M., Weaver, D. R. Coordination of circadian timing in mammals. Nature. 418, 935-941 (2002).
- Welsh, D. K., Imaizumi, T., Kay, S. A. Real-time reporting of circadian-regulated gene expression by luciferase imaging in plants and mammalian cells. Methods Enzymol. 393, 269-288 (2005).
- Soroldoni, D., Oates, A. C. Live transgenic reporters of the vertebrate embryo's Segmentation Clock. Curr Opin Genet Dev. 21, 600-605 (2011).
- Masamizu, Y., et al. Real-time imaging of the somite segmentation clock: revelation of unstable oscillators in the individual presomitic mesoderm cells. Proc Natl Acad Sci USA. 103, 1313-1318 (2006).
- Soroldoni, D., Hogan, B. M., Oates, A. C. Simple and efficient transgenesis with meganuclease constructs in zebrafish. Methods in molecular biology. 546, 117-130 (2009).
- Schroter, C., et al. Dynamics of zebrafish somitogenesis. Dev Dyn. 237, 545-553 (2008).
- Picker, A., Roellig, D., Pourquie, O., Oates, A. C., Brand, M. Tissue micromanipulation in zebrafish embryos. Methods in molecular biology. 546, 153-172 (2009).
- Mould, A. P., et al. Identification of multiple integrin beta1 homologs in zebrafish (Danio rerio). BMC Cell Biol. 7, 24 (2006).
- Mould, A. P., Koper, E. J., Byron, A., Zahn, G., Humphries, M. J. Mapping the ligand-binding pocket of integrin alpha5beta1 using a gain-of-function approach. Biochem J. 424, 179-189 (2009).
- Zhao, Q., Liu, X., Collodi, P. Identification and characterization of a novel fibronectin in zebrafish. Exp Cell Res. 268, 211-219 (2001).
- Westerfield, M. In The zebrafish book : a guide for the laboratory use of zebrafish (Brachydanio rerio). , (1993).
- Vallone, D., Santoriello, C., Gondi, S. B., Foulkes, N. S. Basic protocols for zebrafish cell lines: maintenance and transfection. Methods Mol Biol. 362, 429-441 (2007).
- Carr, A. J., Whitmore, D. Imaging of single light-responsive clock cells reveals fluctuating free-running periods. Nat Cell Biol. 7, 319-321 (2005).
- Whitmore, D., Foulkes, N. S., Sassone-Corsi, P. Light acts directly on organs and cells in culture to set the vertebrate circadian clock. Nature. 404, 87-91 (2000).
- Soroldoni, D., et al. A Doppler effect in embryonic pattern formation. Science. 345, 222-225 (1126).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены