Method Article
Tek Hücrelerde Zebra balığı Segmentasyon Clock Görüntüleme Dağınık Presomitic Mesoderm Hücre Kültürleri Üretimi
Bu Makalede
Özet
Somitogenesis ritmik bir gelişimsel süreç olduğu mekansal desenler, embriyonun vücut ekseni. Daha önce, biz bu süreci götürmek döngüsel genleri gözlemlemek için floresan gazetecilere kullanmak transgenik zebra balığı hatları geliştirdik. Burada, kültür in vitro zamanla bu satırları ve görüntü onların salınımların hücreleri dağınık.
Özet
Segmentasyon omurgalılarda bir periyodik ve ardışık morfojenetik süreçtir. Vücut ekseni boyunca Somitlerin denilen doku blokları bu ritmik oluşumu gelişen embriyo desenlendirme genetik osilatör kanıtıdır. Zebra balığı, hücre içi saat sürüş segmentasyon negatif geri besleme döngüleri halinde organize Onun / Hes transkripsiyon faktörü ailesinin üyelerinden oluşur. Biz son zamanlarda presomitic mezoderm (PSM) içinde salınımlarının uzay-zamansal desen özetlemek döngüsel gen Her1 için transgenik floresan muhabiri hatları yarattı. Bu satırları kullanarak, tek, izole PSM hücrelerin içinde segmentasyon saat salınımlarının gerçek zamanlı analiz sağlayan in vitro kültür sistemi geliştirdi. Transgenik embriyolar PSM dokusunun çıkartılması ve daha sonra cam alt yemekler üzerine bölgelerini salınan hücreleri dağıtılarak, biz floresan sinyalinin zaman atlamalı görüntüleme gelen uygun kültürleri oluşturulanBireysel saat hücreleri. Bu yaklaşım kendi hücre-özerk ve doku düzeyi özellikleri ayırt ve disseke izin vererek, görülmemiş tek hücreli çözünürlükte segmentasyon saatin doğrudan manipülasyon için bir deneysel ve kavramsal bir çerçeve sunmaktadır.
Giriş
Omurgalı vücut ekseni, ya da somitogenesis boyunca bölümlerinin periyodik oluşumu, gelişmekte olan embriyonun bir mekansal ve zamansal osilatör kanıtıdır. Somitogenesis kontrol tercih mekanizması kavramsal şimdi hücre siklik genlerin 2 bir dizi ritmik ifadesi tarafından tahrik edilmesi düşünülen hücresel osilatörler oluşan "saat", oluşumunu kapalı keneler buradaki bir "saat ve Wavefront" modeli 1, tarafından açıklanan bir Somitlerin presomitic mezoderm (PSM) dan. Embriyo geliştikçe, PSM bir olgunlaşma "Wavefront" yavaşlatma ve 3 geçer gibi hücresel osilatörler tutuklanması, posterior doğru gerileyen dokusu ile uyum içinde hareket eder. Birlikte, bu spatiotemporally dinamik sistem bölümleme saati denir. Segmentasyon saat SPAN yerel bağlama inci tek hücrelerde genetik osilatör gelen üç organizasyon artan düzeyde çalışma Güncel yaklaşımlar, hücreler ve son olarak toplu doku PSM 4 konum bilgileri ve küresel düzenlemeye arasında ortaya çıkar.
Önceki çalışmalar zebrabalıkları hücre özerk segmentasyon osilatör transkripsiyon baskının 5-7 ile bir negatif geri besleme döngüsü oluşturmak için düşünülen factorfamily onun / hes transkripsiyon, genlerin ve protein ürünlerden oluşmaktadır öneririz. Delta / Çentik sinyal yolu komşu hücreler arasındaki salınımlar eşitler ve nüfusun 8-10 toplu süre düzenler. Tailbud üretilen fgf sinyal molekülleri Zebrafish PSM degrade oluşturmak için görünür ve böylece anterior 11 salınan hücreleri yavaşlama ve tutuklamaya katkıda varsayılır. Şimdiye kadar, somitogenesis bu moleküllerin her birinin fonksiyonel rolleri genetik mutasyon, morfolino enjeksiyon, ısı-şok aşırı ifadesi ve antagonist ilaç trea tarafından incelenmiştirsaat bileşenleri ve hücreler arası sinyal 5,7,10,12 tment. Bu tedirginlikler kullanarak, segmentasyon saat fonksiyonu doku düzeyinde somite kusurları açıklamaları ve Her1, her7 ve delta gibi döngüsel genlerin ifadesinde üniforma salınımlarının kaybı olayla olmuştur C. Ancak, neredeyse tüm bu verilerin sabit embriyolar ve doğru bir segmentasyon saatin dinamik işlevi doğasında olan değişiklikleri yakalamak için başarısız. Daha yakın zamanlarda, birden fazla embriyo time-lapse görüntüleme değişmiş osilatör dönemi ile ilk mutantlar ortaya koymuştur, ancak bu gözlemler, aynı zamanda doku seviyesi 7,13 yapılmıştır. Bu nedenle, somitogenesis sırasında varsayılmış hücreye otonom osilatör davranışı gözlenmemiştir.
Doğal olarak, işlem, bir titreşimli sistem tarafından tahrik edilir, çünkü somitogenesis statik anlık eksik bir görüntü verir. Fare ve civciv hücrelerinde önceki çalışmaları gösterdi transkript düzeylerive protein yükselişi ve düşüşü, ancak yaklaşık 2 saat salınım her 30 veya 45 dakika örnekleme mutlaka toplanan veri ve 14,15 çizilebilir nedenle sonuçlar kısıtlar. Diğer biyolojik osilatörler çalışma, en önemlisi, sirkadiyen saatler, gerçek-zamanlı floresan ve biyolüminesens gazetecilere 16,17 kullanarak izleme uzak gen ve protein ifade sahnelenen ölçümlerinden taşındı. Bu araçlar tek hücreler 18 saat özelliklerini göstermek için gereklidir. Hes1 siklik geninin bir bio-ışıldar haberci geliştirilmiş ve kısa bir süre için tek bir fare PSM hücre 19 ile karakterize edilmiştir. Ortalama süresi ve varyans salınımlar in vitro çok döngü boyunca devam olduğunu gösteren küçük bir hücre sayısı hesaplandı. Ancak bu çalışmalar kantitatif hücreleri kendiliğinden girmek veya çıkmak salınımlar olup olmadığını, osilatör frekans ve genlik kararlılık ve sağlamlık ele vermedi,ve nasıl hücreler faz ilişkileri sürdürmek. Buna ek olarak, hücre-özerk saati embriyo bulunan sinyal molekülleri etkiler, test edilmemiştir. Sonuç olarak, tek bir hücre osilatör bu temel özellikleri tamamen bilinmemektedir.
Biz son zamanlarda Her1 ifade 30 Venüs (YFP) floresan gazetecilere sürücü BAC Recombineering 20 kullanılarak transgenik balık hatları geliştirdik. Bu çizgiler gömülü ve temporal dinamikleri ve Her1 uzamsal desen özetlemek edildiği dokunulmamış kromozomal düzenleyici ipuçları yararlanılmaktadır. Bu buluş, in vivo, gelişmekte olan embriyonun zebrafish gen ifadesinin gerçek zamanlı olarak izlenmesini sağlar. Temel hücre özerk salınım özellikleri ve ne tür ifade zaman içinde düzenlenir incelemek için, son zamanlarda in vitro PSM hücrelerinden izole etmek ve kaydetmek için güvenilir bir yöntem geliştirdi. Bu protocol biz tek hücrelere Zebra balığı segmentasyon saatin salınımlarını karakterize hangi dağınık hücre kültürleri, üretmek bizim transgenik muhabiri hatları kullanmıştır anlatıyor. Biz böylece üstün statik veya doku düzeyinde analiz ile erişilebilir değil alanındaki soruları, hem de doğrudan sinyal molekülleri ve inhibitörleri ile tek hücre düzeyinde segmentasyon saatini manipüle üstesinden gelebilirsiniz.
Protokol
1.. Diseksiyon önce
- Diseksiyon bir gün önce, transgenik allel için heterozigos zebra balığı çiftleri incross embriyolar elde edilir.
- 28 o C de metilen mavisi olmadan E3 ortamda embriyolar kaldırın kalkan aşamasında (6 saat sonrası fertilizasyon) kadar.
- 20 o CO / N. metilen mavisi olmadan E3 ortamda embriyolar transfer Onlar tailbud aşamaya ulaştığında, 20 o C, embriyolar saat başına 1 hücre gruplarının oluşturacaktır. O 20 ° C'de 17-20 saat O / N sonra, embriyolar diseksiyon protokol başında ertesi sabah sahne 5-8 hücre gruplarının olmalıdır.
- Araçları ve diseksiyon için gerekli reaktifleri birleştirin.
- Embriyo ve doku transferi için yangın parlatılmış cam pipet
- Embriyolardan chorions çıkarılması için ince forseps çifti
- Diseksiyon için Sylgard kaplı 35 mm çanak - 35 mm çanak içine Slygard polimer dökün ve 37 ° C O / N tedavi Iyi kullanarak diseksiyon yapmaktedavi polimerin küçük bir hacmini çıkarmak için bir iğne ucu. Çanak temizlenmiş ve daha sonra tekrar edilebilir.
- PSM doku manipülasyon için bilenmiş, basık tungsten tel araçları
- Kültüre PSM istenilen parçalar kesmek için mikro-neşter
- Tripsin inkübasyon için 35 mm plastik tabak
- % 10 fetal inek serumu ihtiva eden ortam L15
- % 0.25 tripsin / EDTA solüsyonu
- Dağıtmaya sigmacoted jel yükleme ipuçları
- Metilen mavisi olmadan E3 ortamı içeren plastik petri.
- Fibronectin1 alt-tabaka (PBS içerisinde 10 ug / ml) ile cam-alt görüntüleme çanak örtün. Diseksiyon sırasında kat bankta çanak bırakın.
- Tanımlamak için uygun floresan filtre ve sıralama pozitif transgenik embriyolar (5-8 somite evre) ile Stereoskop kullanın.
- Floresan kanal altında YFP ekspresyon için presomitic mezoderm (PSM) (Şekil 1A) incelenerek transgenik embriyolar belirlenmesi. Floresan shoULD tailbud son oluşturulan hücre gruplarının arasındaki bölgede görünür. Parlak sinyal embriyo seçin; Yavruların% 25 Transgenin 2 kopyalarını taşıyan homozigot embriyolar olmalıdır. Gerekli tespit embriyo sayısı deney göre değişir. Bir disseke tailbud parça ortalama 1.000 hücreleri verecektir. Tipik olarak, birkaç ek olumlu embriyolar durumda hatalar diseksiyonu sırasında yapılan yararlıdır.
- Sinyal, özellikle yumurta sarısı hücrede, bir otoflüoresanı ayırt etmek için bir konum referansı olarak iletilen ışık kullanın.
- Metilen mavisi olmadan E3 ortamı içeren ayrı bir plastik petri olumlu embriyolar transfer.
2.. PSM Diseksiyon ve Dağılma
- Diseksiyon için embriyolar hazırlayın.
- Diseksiyon mikroskobu altında, ince forseps kullanarak, dikkatli bir şekilde E3 ortamda her embriyo koryon çıkarın. Embriyo zarar veya sarısı hücreyi bozmak için değil emin olun.
- Dolgu serum ile L15 orta ile diseksiyon çanak Sylgard kaplı. Forseps ya da başka düz aracını kullanarak, Sylgard yüzeyinden hava kabarcıkları.
- Diseksiyon çanak yangın parlatılmış cam pipet kullanarak dechorionated embriyolar transfer.
- Tel araçlarını kullanma, diseksiyon çanak bir tarafında tüm embriyoları taşımak.
- Tek embriyo PSM ayır.
- Orient de kesme çanak (Şekil 1 B) içindeki Sylgard katmanda yapılan küçük yan yüzeyi üzerinde tek bir embriyo.
- Embriyo ve yumurta sarısı hücresi boyunca mikro-neşter, dilim kullanarak sadece arka beyin ve (kırmızı çizgi noktalı Şekil 1B) embriyonun ventral kutbu üzerinden anterior.
- Yemeğin tarafına onu hareket, kuyudan embriyo ön parçasını çıkarın ve sonra da PSM da dahil olmak üzere arka bölümünden uzakta kalan yumurta sarısı hücre granüller kazımak için tel araçları.
- Sarısı kazınarak edildikten sonra, düzleştirmek ve uzak deneyci işaret eden ön ucu ile PSM ve deneyci (Şekil 1C) doğru işaret posterior yönlendirin.
- Ektoderm ince tabaka bu noktada çıkardı değilse, uzak PSM dokusunun üst onu soymak için tel araçlarını kullanın.
- Mikro neşteri kullanarak uzak doku (kırmızı noktalı çizgi Şekil 1C) geri kalanından tailbud, Notokordun sonunun PSM'sinin en arka ucu, kesti. Not: PSM gelen doku diğer parçaları, örneğin, ön PSM için yakın son hücre gruplarının oluşturduğu için, aynı deneysel soruna bağlı olarak, kültüre alınabilir.
- Uzakta Diseksiyon alanından yemeğin bir köşesine tailbud taşı. Diseksiyon alanında herhangi bir enkaz ve istenmeyen embriyo doku temizlemek için tel araçlarını kullanın.
- Sonraki embriyo ile tekrarlayın.
- Birden fazla e Havuz tailbud parçalarmbryos, deney için gerekli olacak kaç hücre bağlı olarak değişir. Ortalama olarak, tailbud doku tek bir parça 1000 hücreleri elde edilir.
- Tripsin-EDTA küçük bir hacim ile boş 35-mm plastik çanak doldurun.
- Yangın parlatılmış cam pipet kullanarak, tripsin / EDTA içeren çanak içine diseksiyon çanak dan tailbud parçaları aktarmak. Oda sıcaklığında 20 dakika boyunca tripsin / EDTA içinde tailbud parçaları inkübe edin.
- Doku tripsin inkübe edilirken, cam tabanlı bir görüntüleme çanağından Fibronectin1 uzaklaştırın.
- MilliQ su ile cam 3 kez çözeltisi yıkayın. Her yıkama kaldırmak ve çanak tamamen kuru olduğundan emin olmak için emme kullanın.
- Görüntüleme için bir ortam içinde tailbud parçaları dağıtılır.
- Görüntüleme çanak içine serum ile L15 orta 100 ul pipet.
- Kaplanmış bir jel ucunu kullanarak, mümkün olduğu kadar küçük bir hacim içinde tripsin / EDTA tailbud parçaları çıkarın.
- Içindeki ortam içine tailbud parçaları Pipetgörüntüleme çanak. Birbirinden kırmak ve orta hücreleri askıya yukarı ve aşağı birden çok kez adet Pipet. Hava kabarcıkları tanıtmak için dikkatli olun. Mikroskop altında hücre kümeleri için kontrol edin ve gerekiyorsa daha fazla dağılırlar.
- Süspansiyon içinde dağılmış hücreler oda sıcaklığında 20 dakika boyunca Fibronectin1 kaplı cam üzerine yerleşmek için izin verin.
- Görüntüleme başlamadan önce, hücrelere serum ilave L15 ortamı küçük bir hacim. Yerleşik hücreleri bozmak için değil dikkatli olun.
- Deney sorun dikkate alındığında, kültüre bir tamamlayıcı ya da ilaç tedavisi ekleyin.
Dağınık PSM hücrelerinin 3. Görüntüleme
- Time-lapse görüntüleme mikroskobu sıcaklık odasında görüntüleme çanak kurmak. Deney için istenen sıcaklığa Warner odası ayarlayın. Çanak görüntü elde etme başlamadan önce en az 30 dakika boyunca dengelenmeye bırakın. Gerekirse, dış sıcaklık probu ile Crosscheck sıcaklık, çanak içine yerleştirilmiştir. NOT: Nedeniylesıcaklık ve somitogenesis oranı 21 stabil sıcaklık kontrolü arasındaki ilişki tek PSM hücrelerinde dönemin hassas ölçümler için gereklidir.
- Maruz kalma süresi ve kazanç gürültü düzeyleri için iyi bir sinyal sağlamak için doygunluk olmadan şiddetlerinin geniş bir dinamik aralığı sağlamak olduğunu kontrol etmek için floresan kanal test görüntü kazanır. Bu protokolü kullanarak bizim hatları oluşturulan dağılmış hücrelerden alınan tipik bir floresan görüntü 85 EM Kazancı çalışan bir EMCCD kamera ile iletilen ışık görüntü için 400 msn ve 40 msn gerektirir. Gelen ek olarak, pre-amp kazancı ve okuma hızı Kamera aynı zamanda gürültü üzerinden sinyal üst düzeye çıkarmak için gereklidir.
- Iletilen ışık kanalını kullanarak, time-lapse edinimi için hücrelerin alanları seçin.
- Zaman istenilen uzunlukta için time-lapse edinimi protokolü çalıştırın.
- Bir iletilen ışık ve alan başına bir floresan görüntü kazanır. NOT: iktisap ro arasındaki aralığı ayarlayınhücrelerde genişletilmiş görüntüleme veya uyaran toksisite üzerinde fotoğraf çizmeden zamansal dinamiklerini yakalamak olacaktır unds. Bu protokol 2 dk aralığını kullanır.
- Hücreler, herhangi bir yazılım veya donanım hataları, vb odak içinde kalmasını sağlamak için kayıt sırasında zaman zaman atlamalı set Check-up
Edinsel Time-lapse Filmler 4. Görüntü İşleme
- Açık film bir görüntü işleme yazılımı kazanılmış bir alan için dosya. NOT: Bu protokol Fiji tüm işlem için kullanılmıştır.
- Bölünmüş görüntülerin 2 yığınlar oluşturmak için tek bir alandan ışık ve floresan çerçeveleri iletilir.
- Iletilen ışık kanalda bir tek hücre izlemek.
- Iletilen ışık kanalında ilk çerçevede seçilen hücrenin etrafında dairesel bir ROI (region of interest) yerleştirin. . NOT:. 1. kaydın sonunda sağlıklı Yalnızca hücreler, 2 alanın dışında hareket etmiyor ve 3 diğer ce ile temas yoktur.lls izlenir.
- Bir ROI ROI yöneticisi her birkaç kare kaydedin. Son kareye kadar hücre izlemek.
- Floresan kanalda kayıtlı İB'leri kullanarak yoğunluğunu ölçün.
- Floresan yığını seçin ve kaydedilen ROI'ler ile zamanla izlenen hücre yoğunluğunu ölçmek için özel daire interpolator plug-in ve makro kullanabilirsiniz.
- Makro çıkış izi kontrol edin. Iz niteliksel floresan time-lapse özelliklerini yakalar, bir Excel çalışma sayfasına değerleri ihracat.
- Hücre için ROI listesini kaydedin.
- Iletilen kanal izleme ve alandaki diğer hücreler için floresan kanal ölçme tekrarlayın.
- Deneyden ek alanlar için tüm adımları tekrarlayın.
Sonuçlar
Bu protokol floresan sinyalinin zaman atlamalı görüntüleme (Şekil 2) için uygun, dağınık, tek PSM hücre kültürleri üretir. Bizim transgen olan döngüsü üretimi ve yıkımı yarım saat emriyle embriyo endojen gen ve protein, benzer dinamikleri ile oluşan bir muhabir oluşturur. Nedeniyle, hızlı devir için, tek hücreler içinde YFP sinyal ağartma en aza indirmek için hızlı bir şekilde tespit edilir ve her bir salınım döngüsü özelliklerini yakalamak için yüksek zamansal çözünürlüğe sahip olmalıdır. Ayrıca, sinyalin göreli dimness verilen, kültür ve satın alma koşulları dikkatle hassas ve sağlam sonuçlar sağlamak için ayarlanmış edilmiştir. . Cam alt kültür kaplarına kaplanması için kullanılan bir ECM 1 alt-tabaka: Bu görüntüleme için en iyi PSM hücre kültürleri elde edilmesinde önemli olduğu şu faktörler bulduk. 2.. Diseksiyon ve görüntüleme ortamına serum eklenmesi. HETE çiftleşme sonrası alınan tespit embriyolardan PSM'nin 3. Diseksiyonolan yavrular potansiyel Transgenin 2 kopyasını taşıyan rozygous çiftleri. Floresan sinyalin etkin yakalama sağlamak için daha yüksek bir NA objektif kullanarak optimal bir büyütme aralığında 4. Görüntü elde edilmesi,. 5.. Arka plan gürültü katkıda bulunabileceğini yoğunluk dalgalanmaları en aza indirmek için bir katı-hal ışık kaynağı ile aydınlatılması. 6.. Son derece hassas EM-CCD kamera ile Sinyal algılama sinyali okuma üst düzeye çıkarmak.
Alt-optimal kültürleri kayıt boyunca yuvarlak ve sağlıklı kalması gerekmez hücreleri içerir. Biz ECM alt-tabaka, zebra balığı fibronectin1 bir fragmanı ya da poli-lisin, laminin gibi diğer yaygın olarak kullanılan alt-tabakalar ile karşılaştırıldığında, farklılaşmamış bir PSM-benzeri halde hücreleri tutan varsayıldı. Test Diğer alt-tabakalar hücreler kaydın boyunca cam ve salınan fluoresan sinyalinin kaybı düzleştirmek neden oldu. Ayrıca bulundu Diseksiyon sırasında ortama serumunun eklenmesi, dağılma,ve kayıt sadece ayrışması için kullanılan tripsin söndürmek için önemli değil, aynı zamanda geliştirilmiş nedeniyle hücre canlılığı muhtemel arka plan üzerinde floresan yoğunluğu, artmıştır. Tek hücre optimal sinyal yakalama sağlamak için bir yüksek NA ile spesifik floresan görüntüleme (Zeiss Planı NeoFluor serisi) için tasarlanmış bir 40x objektif kullanılır. Ayrıca, bir katı-hal ışık kaynağı gürültülü görüntüleri katkı plan dalgalanmaları en aza indirmek için kritik geleneksel cıva lambaları, daha stabil bir aydınlatma sağlanmaktadır bulundu. Bu değişiklikler sonucu sağlamak için önemlidir.
Bu protokol kullanılarak beklenen belirli bir alanda hücrelerin çoğunluğu kayıt sırasında bir noktada floresan edildiği kültürler. Biz floresan hücreler tipik kayıtları sırasında bazen oldukça hareketli yuvarlak kalır ve olduğunu bulmak. Floresan hücreler de dahil olmak üzere bir kaç hücreleri, kayıt sırasında apoptotik olabilir. Bu hücreler, herhangi bir a hariç tutulmuşturnalysis. Ayrıca, diğer hücrelerle temas hücreleri hariç veya görüş alanının dışında hareket eder. Iletilen ışık kanalda sağlıklı hücrelerin sayısının sayılmasıyla ölçüldü Ortalama olarak, biz 10 saat kaydının sonuna kadar alan başına hücre sayısında% 12 azalma bkz. Bu kayıp, hücre ölümü ve alanının dışına taşındı hücreleri içerir. Bu uyarılar göz önüne alındığında biz, ortalama, tipik parça 5 florasan canlı ve görünür alan başına hücreleri ve durumuna başına 6 alanlarını kaydedebilirsiniz. Örneğin, 4 koşullara sahip bir deney 24 toplam alanları tipik durum başına yaklaşık 30 paletli hücreleri edinilen ve olacaktır. % 10 fetal inek serumu ihtiva eden L15 ortam maddesi ile standart görüntüleme koşullarında, PSM hücrelerinin (4 deney tekrarlanmış olan n = 101 hücreleri) 3 ± 1 tepe (2 ortalama ve standart sapma ile birlikte, 2 ve 7 tepe arasında üretebilir bulmak -3 siklus). Medyan peak sayısı, hem de% 25 yüzde, 2 tepe noktası ve% 75 yüzde i3. zirveleri var. Bizim yarı otomatik bir izleme ve analiz kullanarak, hızlı bir şekilde Şekil 2C'de gösterilen temsili bir hücre iz, tek tek hücreler için PSM zaman izleri üzerinde floresan yoğunluğu oluşturabilir. Bu ham izleri daha sonra, frekans, genlik, döngü sayısı ve tepe zamanlaması olarak salınımlı PSM hücrelerinin özelliklerinin sayısal ölçümler yapmak için kullanılabilir.
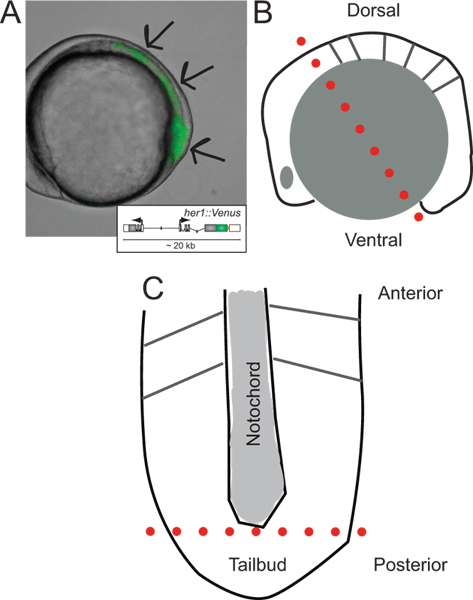
~ 5-somite aşamada YFP floresan ifade eden bir transgenik zebrafish embriyo kendi diseksiyonu transgenik embriyolar ve şemaları Şekil 1.. Kimlik. (A) Yanal görünümü. Görüntü iletilen ışık ve floresan kanal bir bindirme olduğunu. Oklar l doğru, PSM boyunca tailbud ucundaki başlangıç sinyalinin alanlarını gösterir ast hücre gruplarının kurdu. Ankastre gelişimi ve in vivo davranışlarında daha fazla bilgi için Soroldoni vd. 30'a bakın. Ilk diseksiyonu sırasında kesmek için önce embriyonun lateral görüntüsü (B) şematik. Noktalı kırmızı çizgi ilk kesim gösterir (raportör transgen bir şematik sadece tailbud sarısı granüller ve anterior-posterior ekseni boyunca yönlendirilmiş epidermal tabakasının ayrılmasından sonra yassı PSM'nin. (C) şematik görünümü arkasında sarısı hücre. noktalı kırmızı çizgi ucu kaldırmak için ikinci kesimini göstermektedir da, arka beyin boyunca yapılan dağılma ve kültür için tailbud ait. , bu rakamın daha büyük bir versiyonunu görmek için buraya tıklayınız.
07fig2.jpg "/>
Şekil 2. Dağınık bir PSM kültüründe bir tek hücreden Temsilcisi görüntüler ve izler. (A) Kurulma bir 6-saat time-lapse kayıt tek PSM hücrenin ışık görüntülerini iletilir. Hücre kaydın kurs boyunca yuvarlak ve sağlıklı kaldığına dikkat edin. (B) tek bir hücreden PSM floresan görüntülerin karşılık gelen montaj. Hücre yoğunluğundaki pikleri kaydın boyunca numaralandırılır. Bu hücreye yerleştirilmiş bir ROI ölçüldüğü zaman (C) ortalama yoğunluğu. Değerler Fiji yazılı daire interpolator plug-in ve özel makro kullanarak 2 dakika başına birinin bir kare hızı ile bir film her karede alınır. Yoğunluk zirveleri tekrar iz boyunca numaralandırılır. , bu rakamın daha büyük bir versiyonunu görmek için buraya tıklayınız.
Tartışmalar
Embriyonik gelişim boyunca yer alan bir hücresel süreç çalışma için, biyologlar tipik olarak tüm embriyo bağlamında bir yaklaşımı kullanır. Ancak, tam bir tek hücre gelişimsel bir zaman çerçevesinde nasıl davrandığını anlamak, incelemek ve izolasyon bireysel hücrelerin perturb bir yöntem de son derece faydalıdır. Transgenik zebra balığı embriyoları kullanılarak dağıtıldı PSM hücre kültürleri üreterek artık doğrudan bir nicel şekilde segmentasyon saat genetik salınımlarının hücre özerk doğasını incelemek için bir araç var. Bu, çeşitli koşullar altında hücre yüzlerce bizim floresan haberci olarak salınım dinamiği ölçmek mümkündür.
Kültür içinde tek hücre gözlenen süre sağlam embriyo somitogenesis süresinden daha uzundur. Bu kültürde, bozulmamış bir PSM eksplant da tha düşündüren, dokunulmamış embriyo (veriler gösterilmemiştir) daha yavaş salınımların sergiler gözlemlemekt izole edilmiş hücrelerde gözlemlenen daha uzun bir süre dağılımı gelen hasara karşı sadece bağlı değildir. Bir değişken periyodu ve genliği bizim tek hücreli zaman serilerinin çoğunda görülmektedir. Bu değişkenlik kaynağı bilinmiyor, ancak segmentasyon saatin hızı verme devreleri hakkında önemli ayrıntılar ortaya koymalıdır.
Bu yöntem ile biz bütün embriyo incelemek için zorlu genetik hücresel düzeyde segmentasyon bileşenleri ve adres çalışma soruları olabilir. Örneğin, kültürlere gelişen embriyonun bulunan bilinen sinyal molekülleri kontrollü eklenmesiyle, bir sağlam ve tekrarlanabilir bir deneyde bir PSM hücre osilatör üzerindeki etkilerini incelemek. Bizim PSM kültür sistemi bu titreşimleri engelleyen faktörler neler, yalnız, faktörleri, veya birlikte, bu hücrelerde salınımı teşvik ne bir titiz değerlendirme için kapıyı açar, ve bu tür moleküller arasındaki etkileşimi test etmek. Elinde Bu araçları ile, biz hedefliyoruzBütün embriyo test edilebilir tahminler üretmek için tek bir hücre içinde yayınlanan doku düzey veri yanı sıra, kullanım sonuçlarına dayalı somitogenesis mevcut modellerini değerlendirir.
Bildiğimiz kadarıyla, bu tek hücre floresan akut time-lapse kayıt için ilk Zebrafish birincil hücre kültürü protokolü; Bu protokolün daha da geliştirilmesi ve arıtma mümkün kuşkusuz. Diğer protokoller genellikle muhabir ile transfekte edilmiş ve uzun süreli görüntüleme 27-29 için kullanılabilecek kararlı hücre kuşaklarının üretilmesi için zebra balığı embriyolar kullanın. Kararlı çizgiler gibi sirkadiyen saati geliştirme zamanlaması, bağlı olmayan bir süreç görüntüleme için yararlı olmakla birlikte, hücreler salınımlı, öncül devlet hala iken, embriyonik segmentasyon soru acil görüntüleme gerektirir. Hücreler salınan durdurmak sonra, onlar dokuda, bir hücre gruplarının dahil olacağını zaman bir farklılaşmış hücre kaderi varsayalım, ve. Bu poDoğru faktörü veya in vitro olarak mevcut faktörler ile önemli ölçüde daha uzun vadeli gözlemler, birden çok ardışık bozulmaları, ya da yüksek verimli tarama sağlayan titreşimli kalacağını PSM-benzeri zebra balığı hücre kültür hatları oluşturmak olabilir ssible.
Biz zaman atlamalı görüntüleme için dağılmış hücrelerden primer kültürü hazırlama, bu yöntem kararlı Zebrafish hücre hatları kullanılarak ulaşılabilir değildir gelişimsel bir zaman dilimi içinde meydana gelen herhangi bir hücresel sürecin çalışması için çok uygun olduğunu düşünüyoruz. Diseksiyon ile veya FACS ile ya da uygun bir transgenik raportör hatlardan farklı gelişim aşamalarında farklı hücre tiplerinin izolasyonu embriyonik ayrıldıktan sonra, başlangıç hücreleri sağlayabilir. Hücrelerin embriyo tarafından yönlendirilen kültür koşulları, bazı optimizasyonu, gerekli olabilir. Transgenik zebrafish hızla büyüyen koleksiyonu ile bu esnek ve hassas protokol birleştirerekçizgiler, biz klasik genetik ve embriyolojik yöntemlere tamamlayıcı olan bir in vitro gelişim biyoloji yaklaşımı kolaylaştırmak istedik.
Açıklamalar
Yazar Katılımlar:
ABW geliştirilen ve dağılma, kültür, görüntüleme ve hücre izleme protokolleri rafine. DS transgenik hatları oluşturulur ve bu protokolde kullanılan time-lapse floresan mikroskop tasarımını yönetti. AO ayırmak için ilk kanıt-prensibi deney öncülük ve kültür görüntü PSM hücreler. JS time-lapse film floresan yoğunluğunu ölçmek için kullanılan Fiji daire interpolator eklenti aracı yazdı. ABW ve ACO el yazması yazdı.
Teşekkürler
Bu çalışma, bir EMBO Uzun süreli araştırma bursu (ABW) tarafından desteklenen, Ulusal Bilim Vakfı Uluslararası Doktora Sonrası Araştırma Bursu (ABW), Max Planck Gesellschaft (ABW, DS, JS, ACO), bir kazılar-BB bursu (AO), ve (ACO DS) Avrupa Toplulukları Yedinci Çerçeve Programı STG-207634 altında Avrupa Araştırma Konseyi. Biz yazının yararlı yorumlar için Ravi Desai teşekkür ederim. Biz de Zebra balığı Fibronectin1 fragmanı, bakım ve bizim balık hatları ve görüntüleme desteği için MPI-CBG ışık mikroskobu tesisin bakımı için MPI-CBG balık tesisi personelinin üretimi için MPI-CBG protein ekspresyon tesis teşekkür etmek istiyorum.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Name of Reagent/Material | Company | Catalog Number | Comments |
| Epifluorescence microscope | Olympus | Model: SZX16 | |
| Epifluorescence microscope | X-cite Illumination | Series: 120Q | |
| Dissection microscope | Olympus | Model: SZX12 | |
| Fine forceps no. 55 | Fine Science Tools | 11295-51 | |
| Glass transfer pipettes | Assistent | 567/2 | |
| 35 mm plastic petri dishes | Greiner | 627102 | |
| 60 mm plastic petri dishes | Greiner | 628102 | |
| Sylgard polymer | SASCO | 266727 | |
| Manipulation tools | Made in-house | For description of manipulation tools Ref. 22 | |
| Microsurgical knife | World Precision Instruments | 500249 | |
| L15 medium | Invitrogen | 57322 | |
| Penicillin/streptomyocin | PAA | P11-010 | |
| Fetal bovine serum | Invitrogen | 257322 | |
| 0.05% trypsin / 0.02% EDTA | PAA | L11-004 | |
| Gel loading tips | Fisher Scientific | 253188 | |
| Sigmacote | Sigma Aldrich | 254589 | |
| Micropipette set | Gilson International | F167300 | |
| Zebrafish Fibronectin1 70 kD fragment | MPI-CBG protein facility | Generated in-house from construct based on previously published work Ref. 23-25 | |
| Glass bottom imaging dishes | Mattek (single well) | P35G-1.5-14-C | |
| Glass bottom imaging dishes | Greiner (CellView -multi-well) | 262502 | |
| E3 medium without methylene blue | Made in-house | From The Zebrafish Book, 5th Ed. Ref. 26 | |
| Plastic transfer pipettes | Ratiolab | 260011 | |
| Warner heating/cooling chamber | Warner Instruments | TC-324B/344B | |
| EM-CCD camera | Andor | Model: iXOn 888 | |
| Wide-field fluorescence microscope with Venus filter set | Zeiss | Model: Axiovert 200M | |
| Wide-field fluorescence microscope with Venus filter set | NeoFluor 40x, NA 0.75 | ||
| Wide-field fluorescence microscope with Venus filter set | Lumencor Light Engine | Model: Spectra X | |
| Wide-field fluorescence microscope with Venus filter set | |||
| Wide-field fluorescence microscope with Venus filter set | BrightLine HC 575/15 | F39-575 |
Referanslar
- Cooke, J., Zeeman, E. C. A clock and wavefront model for control of the number of repeated structures during animal morphogenesis. J Theor Biol. 58, 455-476 (1976).
- Oates, A. C., Morelli, L. G., Ares, S. Patterning embryos with oscillations: structure, function and dynamics of the vertebrate segmentation clock. Development. 139, 625-639 (2012).
- Dequeant, M. L., Pourquie, O. Segmental patterning of the vertebrate embryonic axis. Nat Rev Genet. 9, 370-382 (2008).
- Oates, A. C., Gorfinkiel, N., Gonzalez-Gaitan, M., Heisenberg, C. P. Quantitative approaches in developmental biology. Nat Rev Genet. 10, 517-530 (2009).
- Oates, A. C., Ho, R. K. Hairy/E(spl)-related (Her) genes are central components of the segmentation oscillator and display redundancy with the Delta/Notch signaling pathway in the formation of anterior segmental boundaries in the zebrafish. Development. 129, 2929-2946 (2002).
- Lewis, J. Autoinhibition with transcriptional delay: a simple mechanism for the zebrafish somitogenesis oscillator. Curr Biol. 13, 1398-1408 (2003).
- Schroter, C., Oates, A. C. Segment Number and Axial Identity in a Segmentation Clock Period Mutant. Curr Biol. 20, 1254-1258 (2010).
- Riedel-Kruse, I. H., Muller, C., Oates, A. C. Synchrony dynamics during initiation, failure, and rescue of the segmentation clock. Science. 317, 1911-1915 (2007).
- Ozbudak, E. M., Lewis, J. Notch signalling synchronizes the zebrafish segmentation clock but is not needed to create somite boundaries. PLoS Genet. 4, e15 (2008).
- Herrgen, L., et al. Intercellular Coupling Regulates the Period of the Segmentation Clock. Curr Biol. 20, 1244-1253 (2010).
- Sawada, A., et al. Fgf/MAPK signalling is a crucial positional cue in somite boundary formation. Development. 128, 4873-4880 (2001).
- Giudicelli, F., Ozbudak, E. M., Wright, G. J., Lewis, J. Setting the tempo in development: an investigation of the zebrafish somite clock mechanism. PLoS Biol. 5, e150 (2007).
- Herrgen, L., Schroter, C., Bajard, L., Oates, A. C. Multiple embryo time-lapse imaging of zebrafish development. Methods Mol Biol. 546, 243-254 (2009).
- Hirata, H., et al. Oscillatory expression of the bHLH factor Hes1 regulated by a negative feedback loop. Science. 298, 840-843 (2002).
- Maroto, M., Dale, J. K., Dequeant, M. L., Petit, A. C., Pourquie, O. Synchronised cycling gene oscillations in presomitic mesoderm cells require cell-cell contact. Int J Dev Biol. 49, 309-315 (2005).
- Reppert, S. M., Weaver, D. R. Coordination of circadian timing in mammals. Nature. 418, 935-941 (2002).
- Welsh, D. K., Imaizumi, T., Kay, S. A. Real-time reporting of circadian-regulated gene expression by luciferase imaging in plants and mammalian cells. Methods Enzymol. 393, 269-288 (2005).
- Soroldoni, D., Oates, A. C. Live transgenic reporters of the vertebrate embryo's Segmentation Clock. Curr Opin Genet Dev. 21, 600-605 (2011).
- Masamizu, Y., et al. Real-time imaging of the somite segmentation clock: revelation of unstable oscillators in the individual presomitic mesoderm cells. Proc Natl Acad Sci USA. 103, 1313-1318 (2006).
- Soroldoni, D., Hogan, B. M., Oates, A. C. Simple and efficient transgenesis with meganuclease constructs in zebrafish. Methods in molecular biology. 546, 117-130 (2009).
- Schroter, C., et al. Dynamics of zebrafish somitogenesis. Dev Dyn. 237, 545-553 (2008).
- Picker, A., Roellig, D., Pourquie, O., Oates, A. C., Brand, M. Tissue micromanipulation in zebrafish embryos. Methods in molecular biology. 546, 153-172 (2009).
- Mould, A. P., et al. Identification of multiple integrin beta1 homologs in zebrafish (Danio rerio). BMC Cell Biol. 7, 24 (2006).
- Mould, A. P., Koper, E. J., Byron, A., Zahn, G., Humphries, M. J. Mapping the ligand-binding pocket of integrin alpha5beta1 using a gain-of-function approach. Biochem J. 424, 179-189 (2009).
- Zhao, Q., Liu, X., Collodi, P. Identification and characterization of a novel fibronectin in zebrafish. Exp Cell Res. 268, 211-219 (2001).
- Westerfield, M. In The zebrafish book : a guide for the laboratory use of zebrafish (Brachydanio rerio). , (1993).
- Vallone, D., Santoriello, C., Gondi, S. B., Foulkes, N. S. Basic protocols for zebrafish cell lines: maintenance and transfection. Methods Mol Biol. 362, 429-441 (2007).
- Carr, A. J., Whitmore, D. Imaging of single light-responsive clock cells reveals fluctuating free-running periods. Nat Cell Biol. 7, 319-321 (2005).
- Whitmore, D., Foulkes, N. S., Sassone-Corsi, P. Light acts directly on organs and cells in culture to set the vertebrate circadian clock. Nature. 404, 87-91 (2000).
- Soroldoni, D., et al. A Doppler effect in embryonic pattern formation. Science. 345, 222-225 (1126).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır