Method Article
共通液ハンドリングロボットでTruTipテクノロジーを使用して臨床検体からのDNAやRNAのハイスループット、自動抽出
要約
TruTipは、多孔質モノリシック結合マトリックスがピペットチップ内に挿入される単純な核酸抽出技術である。これにより、試料調製フォーマットは、ほとんどの液体ハンドリング機器と互換性があり、高スループットの臨床応用およびサンプルタイプに多くの媒体を用いることができる。
要約
TruTipは、多孔質モノリシック結合マトリックスがピペットチップ内に挿入される単純な核酸抽出技術である。モノリスの形状は、1.0から5.0ミリリットルにボリュームの範囲の特定のピペットチップに適合させることができる。モノリスの大気孔率は容易に最小限の流体の背圧でそれを通過する粘性または複雑なサンプルを有効にします。双方向フローは、モノリスと試料との間の滞留時間を最大化し、単一TruTip内で処理すべき大量の試料を可能にする。かかわらず、サンプルボリュームまたはTruTipジオメトリの基本的な手順は、細胞溶解、TruTipモノリスの内側の孔に結合核酸、結合していない試料成分と溶解緩衝液を洗い流し、適切な緩衝液中に精製し、濃縮した核酸を溶出するが含まれています。 TruTipの属性と適応はエッペンドルフepMotion 5070を使用して、3つの自動化された臨床サンプル処理プロトコルで実証されている鼻咽頭吸引液からRNAの単離、全血からのゲノムDNAの分離、及び母体血漿(それぞれ)の大ボリュームから胎児のDNA抽出と濃縮を含め、ハミルトンSTARとSTARplus液体ハンドリングロボット、。
概要
核酸精製は、のみを使用し、ほとんどの研究分子診断のために必要であり、ライフサイエンスアプリケーション。様々なアプローチが、その多くは、カオトロピック塩1の存在下でシリカに結合する核酸の基本的な原理に基づいており、フェノール/クロロホルム抽出の時から浮上している。抽出プロセスは、(2-13に例を参照)、スピンフィルタ、磁気ビーズおよびライフサイエンス業界を支配して関連するアプローチで、様々なビーズとメンブレンベースの形式を使用することにより合理化および自動化されています。効果的で挑戦的な臨床行列に直面したとき、粒子と膜は限界を知っていた。例えば、膜およびビーズベースの列が対応し、小孔サイズを(従って、高い背圧)があり、遠心分離または真空システムによって処理されるために、支持体のいくつかのタイプを必要とする。膜やビーズ列結果のの物理的特性効率的な消耗、及び/又は一方向流路を加工することができる合計(入力)サンプル量を詰まらせることなく処理することができる試料の種類を制限する重要な流体抵抗。逆に、磁性粒子は攪拌により試料全体に分散されている必要があります。均一溶液中に磁性粒子を分散させる必要が最も磁気ビーズ消耗品を使用して処理することができる総入力サンプル量を制限する。臨床サンプルの属性(例えば、粘度や複雑さなど)がチューブまたはロッドの側面に非効率的な磁気粒子濃度につながることができます。また、シリカ微粒子は、その磁化を失い、最終サンプルを汚染する、抽出プロセス中にビーズのオフに破ることができる。
TruTip技術は、これらの核酸試料処理の制約および制限14のいくつかを克服するために開発された。多孔質モノリス内に埋め込むことによりピペットチップは、流体の背圧が低下し、真空下( すなわち、ピペット吸引)による流量制御を可能にする。この機能は、大幅に簡素化することが困難な試料タイプ( 図1)から核酸を精製するために必要な抽出処理および計装を可能にする。モノリスのジオメトリと気孔率はモノリスの厚さは1.0から5.0ミリリットルまでのサンプル量に十分な核酸結合容量を提供しながら、目詰まりを最小限にするために調整されています。検体吸引分注時の双方向の流れがサンプル抽出かつ効率的な核酸の回収および溶出に対する結合モノリスとの間の延長された滞留時間を可能にし、ピペットチップ自体の体積容量を超えること処理される比較的大きな試料体積を可能にする。我々は以前に、シングルまたはマルチチャネルライを使用して、鼻咽頭サンプルからインフルエンザRNAを精製するための手動TruTip手順の開発と応用が報告され忍ピペッター15。同等の抽出効率が10 6遺伝子コピーで自動QIAcubeと手動TruTipメソッド間インフルエンザ当たりミリリットル鼻咽頭吸引液を得た。本研究の目的は、一般的に基準臨床検査で見つかった液体ハンドリングロボットを用いた鼻咽頭吸引(NPA)および他の臨床的に関連するサンプルタイプの中·高スループット自動化TruTip核酸の精製手順を実証することであった。
プロトコル
三自動TruTip抽出プロトコルが記述され、ここで実証されています:エッペンドルフepMotion 5070でNPAから1)培地スループットRNA抽出、2)ハミルトンSTAR上の全血の低ボリュームから高スループットのゲノムDNAの抽出、3)選択分離とハミルトンSTARplusで母体血漿の大ボリュームから断片化された胎児DNAの濃縮。自動化されたスクリプトはAkonniから入手可能であり、唯一の高レベルのプログラム記述は、ここで提供されています。臨床検体を処理する前に、抽出および溶出試薬は自動的に自動化スクリプト(複数可)によってバルク試薬トラフから96ウェルプレートに分配される。
1。鼻咽頭吸引から自動化されたRNA抽出
前述のマニュアルTruTip法15は、現在1.0ミリリットルエッペンドルフ管に埋め込 ま大孔TruTip行列を用いて、エッペンドルフepMotion 5070液体ハンドリングロボットで実行するように構成されているってヒント、2ミリリットルディープウェルプレート(米国サイエンティフィック)、Akonni TruTip抽出試薬およびNPAサンプルタイプとして。 epMotion 5070液体ハンドリングロボットは、同時に、そのベースライン自動化プロトコルは8並列抽出に記載されている8つのヒントまで保持しています。しかし、最大24サンプルが1ディープウェル、96ウェルサンプルプレート内の単一のプログラムの間に処理することができます。別epMotionプログラムが16または24のサンプルを処理するために(そして必須)可能です。以下に概説するプロトコルは、8サンプルの自動化されたスクリプトです。
セットアップ
- 抽出を開始する前に、RTに咽頭のサンプルを持参してください。
- サンプルプレートのカラム1( 図2A)に100μlの鼻咽頭吸引プラス150μlのヌクレアーゼフリー水を分配する。
- epMotionワークテーブル( 図2B)上の位置B1にサンプルプレートを置きます。
- 場所ピペットチップ、TruTipsとそれぞれepMotionのWorktabへ30ミリリットル試薬トラフル位置( 図2B)。
- エッペンドルフepBlueソフトウェアを開き、8サンプルのためAkonniが提供する実行ファイルを選択し、[RUN]タブの[RUN]ボタンをクリックしてメソッドをロードします。
- レベルセンサーの設定]で、レベルとヒントを選択し、[実行]ボタンをクリックします。
- 入力ソフトウェアにサンプル量と実行]をクリックします。
- epMotionスクリプトは、ユーザーがワークテーブル上の位置B2に位置する試薬リザーバーに抽出し、溶出試薬を追加するには、プロンプトが表示されます。それぞれの谷に各試薬の推奨ボリュームを追加します。 8サンプルについては、最低限の試薬容量は以下のとおりです。
| 試薬 | 容量(ml) | トラフポジション |
| 95%エタノール | 3.5 | 2 |
| 緩衝液Dを洗う | 9.0 | 3 |
| バッファEを洗う | 9.0 | 4 |
| 溶出バッファーA2 | 1.3 | 5 |
| 溶解および結合バッファーD | 11.0 | 6 |
- 上記の手順8からのプロンプト時にepMotionソフトウェアによって提示された表に入力試薬ボリュームを。入力値は、それぞれの試薬リザーバーにユーザによって分配バッファの実際の量を反映するべきであり、以上の上記のように最低限のボリュームでなければなりません。間違ったボリュームエントリは、96ウェルプレート(S)の各チューブまたはウェルにepMotionハードウェアで配信間違ったボリュームにつながる可能性があります。
自動プログラム
- 自動化された方法を開始するために実行する]を選択します。自動化されたスクリプトは、ユーザーの介入なしに、次のステップを移動します:
サンプル溶解および試薬の配布:- 10の列1とミックスに375μlの溶解緩衝液Dディスペンスサイクル(+ = 1サイクルを分配apirate)。残りの試薬が小分けされている間、このステップは溶解インキュベーションプロセスを開始します。
- コラム2に1.6ミリリットル洗浄緩衝液Dを分注する。
- 3列目に1.6ミリリットルの洗浄バッファーEを分注する。
- 列4に50μlの溶出バッファーを分配。
- 溶解緩衝液中で10分間サンプルのインキュベーションを完了するために6分間休止D.
- 10ペッティングサイクルをエタノールで各サンプルを混合し、1列目の各ウェルに375μlのエタノールを追加します。
- ワークテーブル上の位置A2から8 TruTipsをロードし、 図1で説明した抽出プロセスを開始します。
- TruTipモノリスに核酸に結合することが7サイクル用サンプルプレートのカラム1からサンプル/溶解バッファー/エタノール混合物を吸引して分注する。 (臨床試料の粘度の違いに起因する)TruTip介して試料流が変わる場合があるが、これらのサンプル用核酸の収量はありませんでしたtは流変動の影響を受ける。試料流を改善するためのオプションは、ディスカッションに記載されている。
- 残留溶解緩衝液およびサンプルマトリックスを除去するために試料プレートのカラム2、およびモノリスの上に5倍の周期洗浄緩衝液DにTruTipsを移動する。
- サンプルプレート塔3、および結合核酸からタンパク質および他の汚染物質を除去するためにモノリス以上5倍サイクル洗浄バッファーEへTruTipsを移動します。
- モノリスを乾燥させるために空の試薬リザーバ位置1(ワークテーブルの場所B2)とサイクル80X(速い流速で)にTruTipsを移動します。溶出された核酸調製物中の残留溶媒が負に、逆転写酵素およびTaq DNA ポリメラーゼのような酵素に影響を与えるように、それは、完全にTruTipを乾燥することが重要である。
- 抽出され、精製された核酸は、サンプルプレート塔4ウェルの溶出バッファーに今ある溶出緩衝液Aで5倍のサンプルプレート列4とサイクルTruTipsを移動します。
- epMotion廃ビンにTruTipsを取り出します。
- 番組が終了すると、手動で機器からのサンプルプレートを除去し、長期保存またはさらなる使用のための新しいチューブに精製された核酸を転送する。必要に応じて高度なepMotionユーザーは、別のストレージチューブまたはPCRプレートに溶出したサンプルを転送するためにファイル名を指定して実行ファイルに命令を追加することができます。
合計16サンプルのためのプログラムは、サンプルプレートカラム5-8を使用して10.13〜ステップ10.1を繰り返します。 24サンプルプログラムについては、10.13を通じて10.1手順2倍使用してサンプルプレート列をそれぞれ5-8と9-12を、繰り返されます。
2。全血からの96ウェルのゲノムDNA抽出
ハミルトンSTAR液体ハンドリングロボットは、全血から同時に96サンプルの自動抽出を実証するために使用される。ハミルトンSTARは、特定の臨床の酵素消化のために重要である、オプションのヒーター/シェーカーユニットはデッキ上で利用可能であるという点でepMotionシステムとは異なりますこのような全血などのCAL行列。システムは96チャンネルピペットヘッドを装着することができるので、TruTipステップおよび試薬のそれぞれについて専用の96ウェルプレートがある。
セットアップ
- STAR機器とコンピューターの電源をオンにします。
- ハミルトン実行制御ソフトウェアを開きます。
- 96サンプルのためAkonniが提供するファイル名を指定して実行ファイルを開きます。
- 図3に示すようSTARデッキの上に場所が実験器具。
- それらの対応するトラフ(ボリュームは96サンプルを処理するために必要な最小値を示す)内に試薬を分注する。
| 試薬 | 容量(ml) | トラフポジション |
| 溶解および結合バッファーのF | 75 | 5 |
| 95%エタノール | 100 | 6 |
| バッファJを洗う | 175 | 7 |
| 洗うバッファK | 175 | 8 |
| 溶出バッファーA2 | 12 | 9 |
| プロテイナーゼK(20mgを加え-1) | 8 | 15 |
6。サンプルはRTに平衡化することができます。
7。サンプルキャリアラック( 図3のデッキ位置4)のサンプルチューブを置きます。場所は左端キャリア背面のサンプル1とフロント右の位置にサンプル96エンディングで各キャリア下に順次移動します。
自動プログラム
- 実行ファイルのウィンドウと入力処理されているサンプル数の左上にあるPLAYボタンを選択します。自動化されたスクリプトは、ユーザの介入なしに、次のステップを移動します:
サンプル溶解および試薬の配布- 彼の位置14でインキュベーションプレートに各サンプルチューブから200μlをアテル/シェーカーモジュール( 図3)。
- 培養プレートの各サンプルウェルに80μlのProteinase Kを分注する。
- 培養プレートの各ウェルに600μlの溶解緩衝液Fを分配する。
- 10サイクルのためのソリューションを混ぜた後、℃、500 rpmで70℃で20分間インキュベートする。プロテイナーゼK活性の範囲内であるディープウェルプレート内〜60°C、試料温度が70°C設定温度をもたらす。サンプルをインキュベートしている間、液体ハンドリングシステムは、対応するプレートとウェルに試薬を分配することにより動作を継続:
- 位置13にディープウェルプレートの各ウェルに100μlの溶出バッファー。
- 位置10にディープウェルプレートの各ウェルに800μlのエタノール。
- 位置12にディープウェルプレートの各ウェルに1.6ミリリットルの洗浄バッファK。
- 位置11にディープウェルプレートの各ウェルに1.6ミリリットルの洗浄バッファーJ。
- 20分のインキュベーション後、試料混合物をインキュベーションプレートから離れた位置10でのディープウェルプレートに移し、そして12ピペッティングサイクルを混合する。
- 廃棄物のビンに試薬のヒントを取り出します。
抽出
gDNAの血手順のこの部分は、洗浄試薬およびサイクル数の組成を除いて、epMotionインフルエンザプロトコルに非常に類似している。ハミルトンTruTipsチップは黒なので、TruTipを通して液体の流れが表示されません。
- デッキ位置3から96 TruTipsをロードします。
- TruTipモノリスに核酸をバインドするために10サイクルの位置10のサンプル/溶解バッファー/エタノール混合物を吸引して分注する。
- 残留溶解バッファーとサンプルマトリックスを削除するには、モノリスの上に11と5倍サイクル洗浄バッファーJを配置するTruTipsを移動します。
- バインドされた核酸からタンパク質および他の汚染物質を除去するために5倍の12とサイクル洗浄バッファーKを配置するTruTipsを移動します。
- サイクル空気乾燥に高速で40倍TruTip。
- 位置13および溶出バッファーA2の5倍サイクルTruTipsを移動します。抽出され、精製された核酸は、深いウェルプレートに溶出バッファーになりました。
- 廃棄物のビンにTruTipsを取り出します。
プログラムが終了すると、器具から溶出プレートを取り外し、保管又は下流のアプリケーションに適しチューブに採取したサンプルを移す。
3。大容量ボリュームの血漿サンプルからのDNA抽出
ハミルトンSTARplus器具は母体血漿を5mlから自由に循環する胎児DNAを抽出するための自動化されたプロトコルを示すために使用される。 STARplusシステムは、2つの自動ピペットチャンネルアーム、8×5ミリリットルのチャンネル1と8×1ミリリットルのチャンネル1をサポートすることができます。これらのアームは8サンプルそれぞれのバッチで千鳥処理用並列に動作することができます。を5ml TruTipは、初期リットルのために使用されARGE容量の抽出、および、1mlのTruTipは、サイズ分離、抽出した核酸のさらなる濃縮のために使用される。
セットアップ
- STARplus楽器とコンピュータの電源を入れます。
- ハミルトン実行制御ソフトウェアを開きます。
- 8大容量の血漿サンプルのためAkonniが提供するファイル名を指定して実行ファイルを開きます。
- 図4に示すようSTARplusデッキに実験器具を置きます。
- それらに対応する貯水池に試薬を分注する。
| 試薬 | 容量(ml) | トラフポジション |
| CN-W1 | 17 | 5A |
| CN-W2 | 17 | 5B |
| CN-W4 | 21 | 5C |
| プロテイナーゼK(20mgを加え-1) | 5 | 6A |
| EBB | 17 | 6B |
| EBA2 | 5 | 6C |
| CN-W3 | 5 | 6D |
| CN-B2 | 5 | 6E |
| CN-B3 | 5 | 6F |
| CN-L1 | 52 | 7 |
| CN-B1 | 175 | 8 |
- サンプルはRTに平衡化することができます。
- サンプルキャリアラック( 図4のデッキ位置3)のサンプルチューブを置きます。リアにサンプル1を置き、デッキの正面に向かって順番に移動します。
自動プログラム
なぜなら大きな入力サンプルボリュームの、溶解および均質化の手順は、水浴中でハミルトンSTARplusの器具から実行する必要があります。自動化されたプロトコルの中で、ユーザーの介入を必要とする手順はbeginninにアスタリスク(*)で示されてい文章のgおよび太字 。
試料の溶解および試薬分配:試料が試料を均質化してDNAを放出するプロテイナーゼKと溶解緩衝液でインキュベートする。
- 実行ファイルウィンドウの左上にあるPLAYボタンを選択します。入力処理されているサンプルの数、甲板上のピペットチップの場所、甲板上TruTipsの場所を。
- 自動化されたスクリプトは、各50ミリリットルコニカルチューブに615μlのProteinase K、5ミリリットルプラズマ、および6.2ミリリットルの溶解バッファーCN-L1を追加し、PAUSEその後意志。
- *高速で30秒間のサンプルデッキ、渦から50ミリリットルコニカルチューブを外し、60℃のウォーターバスまたはヒートブロック中で30分間オフラインでインキュベートする。コニカルチューブがハミルトンデッキから削除された後、それぞれのプレートのウェル( 図4Bおよび4C)に試薬を分注を継続する自動化されたスクリプトを略歴:
- 2ミリリットルCN-W1位置9列1の他のすべてのウェルに。
- 2 mlのCN-W2位置9列2の他のすべてのウェルに。
- 2 mlのCN-W4位置9列3の他のすべてのウェルに。
- 位置の他のすべてのウェルに250μlのEBA2 9列4と5。
- 位置10カラム1内の他のすべてのウェルに495μlのCN-B2。
- 位置10 2列内の他のすべてのウェルに、1mlのEBB。
- 位置10 3列内の他のすべてのウェルに500μlのCN-W3。
- 位置10カラム4内の他のすべてのウェルに500μlのCN-W4。
- 位置10 5列内の他のすべてのウェルに50μlのEBA2。
5ミリリットルチャネルはデッキ位置9の深いウェルプレートの他のすべてのウェルに各サンプルの隣接する井戸、プログラム自動分配試薬を使用することが広すぎるので。 、1mlのチャンネルに使用される機械式アームは、また排除と第濃度試薬プレート内の他のすべてのウェルの使用を必要とするプロトコルのEPS。
試薬を分配した後、プログラムが一時停止します。
- * 30分後、60℃のインキュベーション、5分間氷上で50ミリリットルコニカルチューブを配置します。
- *デッキ位置4サンプルキャリアラック内の元の位置に50ミリリットルコニカルチューブを戻し、自動化されたスクリプトを再開します。
- 各サンプルチューブに12ミリリットル結合バッファーのCN-B1を追加し、10倍混ぜる。
大容量ボリュームの抽出:5ミリリットルのTruTipsを溶解血漿サンプルから全DNAを抽出するために使用されます。
- 大容量の核酸抽出に位置2から5ミリリットルTruTipsを拾う。
- サイクルサンプル50ミリリットルコニカルチューブにmixture15回、チューブの底から開始し、各ピサイクル後に高い3ミリメートルを移動。このステップはTruTipモノリスへ全核酸をバインドします。
- 位置でディープウェルプレートに6列1、とcyをTruTipsを移動洗浄バッファーCN-W1でCLE 1X。
- ウォッシュCN-W2で9列2とサイクル1Xを配置するTruTipsを移動します。
- 9列3とウォッシュCN-W4でサイクル2倍を配置するTruTipsを移動します。
- 結合マトリックスを乾燥させるために、高速で40倍9列4とサイクルを配置するTruTipsを移動します。
- 9カラム5,5ミリリットルTruTipsから結合した核酸を溶出するために10倍のサイクルを配置するTruTipsを移動します。これは、大容量の溶出#1です。
- 6列にTruTipsを移動し、溶出緩衝液の第2のアリコートとの手順を繰り返します。これにより、大容量の溶出#2である。
- 9列5は溶出1位とそれを組み合わせると、TruTipsを破棄する位置に溶出#2を転送します。
排除及び濃度:高分子量DNAを抽出サンプルから除去され、残りのDNAを単離し、濃縮した。
- 10カラム1を置き、徹底的に10倍に混合するステップ22から組み合わせ溶離液を追加します。
- 1ミリリットルTruTiをピックアップモノリスに高分子量のDNAを結合するための位置13とサイクル20XからPS。
- 10カラム2、チップを洗浄および高分子量DNAを除去するために5倍の周期を位置決めするTruTipsを移動する。 TruTipsは保持と位置13における先端ラックに戻って配置されます。
- 位置12から試薬のヒントと、位置10列1にサンプルに結合バッファーのCN-B3の575μLを加え、10倍混ぜる。
- ステップ25からTruTipsをピックアップし、サンプルから、1mlのTruTipに残りのDNAを結合する10カラム1、サイクル20倍の位置に戻す。
- 残りの阻害剤を除去するために洗浄CN-W3で10列4とサイクル1Xを配置するTruTipsを移動します。
- CN-W3から残留塩を洗浄する洗浄CN-W4で10列5とサイクル1Xを配置するTruTipsを移動します。
- 位置10列5とモノリスを乾燥させる35Xヒントを循環空気にわたってTruTipsを上げる。
- 精製された、サイズ選択範囲を溶出するEBA2 10倍10列6とサイクルを配置するTruTipsを移動テッドと濃核酸。
- TruTipsを破棄。
- ポジション11の列6〜1.5ミリリットル管から溶出サンプルを転送します。抽出されたサンプルは、ストレージや下流の処理のための準備が整いました。
結果
NPAからインフルエンザRNA抽出のためのリアルタイムPCRデータは、 図5Aに示されている。推定された核酸抽出効率は、プロトコル15の手動バージョンで得られた結果と同様である。平均C T値の線形応答は、平均C Tの標準偏差が1未満の値を持つ6 4 10〜10遺伝子コピーミリリットル-1は 、(AとBインフルエンザ= 0.99と0.98、それぞれR 2)インフルエンザを改正した観察されサイクル。 epMotionシステムとの交差汚染の有無を10 6遺伝子コピーミリリットル-1 NPAを含む12正NPAサンプルは12バッファブランクが散在された図5Bに示されている。陽性対照の平均C tが ±0.14 30.16だった、とすべてのバッファー·ブランクが陰性であった。全試料の処理時間は、それぞれ8,16及び24の試料について16、28及び40分である。典型的な臨床鼻咽頭吸引または綿棒が10 7遺伝子コピーミリリットル-1(1,000 TCID 50あたりビリオン16と> 10 4 TCID 50ミリリットル-1インフルエンザ17と仮定して)が含まれますので、自動epMotionプロトコルは過半数に有効であると期待されている臨床NPA標本の。
ヒトゲノムDNAに対して行わ分子試験の範囲を考えると、全血から核酸抽出の主な目的は、汚染物質を含まない、高分子量のゲノムDNAを製造することである。 96サンプルのための自動化されたプロトコル( 例えばプロメガMagneSil = 90分とキアゲンQIAamp調製DNA血液バイオロボットMDxのシステム= 2.5時間)。 図6Aは、UV /可視吸光度プロファイルを示し、他の自動化されたシステムに比べて改善されて1時間内に完了する平均で、ハミルトンSTARプロトコル上の45試薬ブランクで同時に処理45陽性の血液サンプル 280分の260 1.96の比率と1.93の平均230分の260比。 吸光度比260/280 1.7から2.0と230分の260比と> 1.7は、一般的に残留塩、タンパク質や溶剤、最下流分子のアプリケーションのための許容の自由、非常に純粋なDNAを示すものである。 図6B中の1%アガロースゲルで得られたgDNAは、最小限の剪断を有する高分子量(> 24キロバイト)であることを示している。 45陽性サンプルのフルセットからの平均核酸収率は5.26である±ライフテクノロジーズQuantifilerヒトDNA定量キットに基づいて、200μlの全血あたり0.46μgのヒトDNA、。 図5Bに示したものと同様交差汚染試験は陰性対照バッファブランク陽性サンプルが点在し、並行して抽出を行った。すべてのブランクが再びPCR(図示せず)による陰性であった。精製されたgDNAはまた、多数の他のPCRベースの解析(図示せず)に適している。
大容量TruTip手順で処理プールされた母体の血漿サンプルの8複製サンプルからリアルタイム結果を図7に示す。完全なプロトコル(オフラインプロテイナーゼKのインキュベーションを含む)は、核酸キット(全く同等の自動抽出キットはまだ利用できません)循環キアゲンマニュアルに似て約2.5時間、に仕上がっています。すべての複製の平均C T値は34.58±0.66及び29.76±胎児の男性(CHY)と合計(CH1)DNAのための0.50、それぞれ、自動化された抽出方法の優れた再現性を示しています。全DNAプール内の胎児DNAの濃度は(ゲノム換算)であり、2.8%の全サンプルにわたる結果平均%胎児DNAと、規格に適合ポイント分析の比較に基づいて計算されます。このサンプル抽出を実行する前にプールしたため、このサンプルの実際の%ウシ胎児DNAは不明である。胎児のDNA合成、非プール血漿サンプルはTruTip法を用いて抽出キアゲン循環核酸キット(図示せず)を用いた結果と比較して、典型的には1.5倍高い。
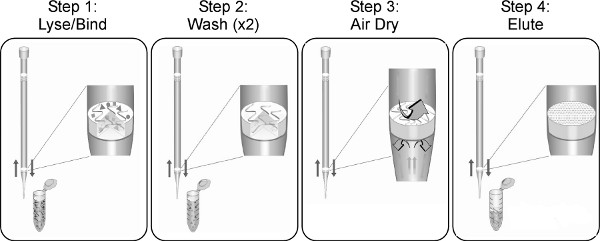
図1。 TruTip抽出処理と、液体ハンドリングシステムの作業の流れにかかわらず、その他の試料調製又は液体処理工程は、特定の液体処理装置およびソフトウェアの機能に応じて自動化されたルーチンに組み込むことができる。
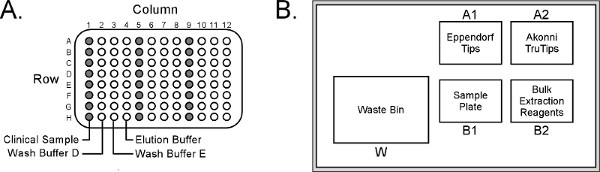
図2。 (A)エッペンドルフepMotion 5070サンプルプレートレイアウト。試薬/ consuma(B)のアレンジメントワークテーブル上BLES。epMotionしか同時に8サンプルの最大値を処理しますが、サンプルプレートは、24サンプル(それぞれの列1、5および9)にするように構成できは大きい数字を表示するには、ここをクリックしてください 。
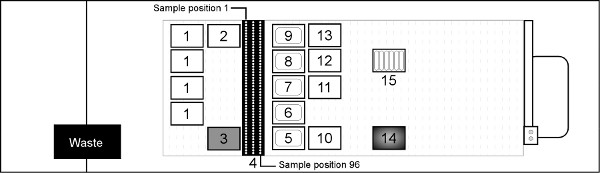
図3。全血からゲノムDNAを精製するためのハミルトンSTARデッキレイアウト(ノンスケール)デッキポジション1 =ハミルトン1ミリリットルフィルタリングヒント; 2 =ハミルトン1ミリリットル非フィルタ処理のヒント; 3 = Akonni /ハミルトン1ミリリットルLPT 2ミリメートルのTruTips; 4 =入力血液サンプルキャリア(採血管やマイクロチューブ)、溶解緩衝液Fの5-9 = 290ミリリットル試薬トラフ、エタノールは、バッファJ、洗浄バッファーKと溶出バッファーA2を洗って、それぞれ、10 = 96 DEEPうまく結合板、11 = 96深井戸Jを洗って、12 = 96深井戸Kを洗う、13 = 96深井戸溶出板;ヌンク96ディープウェル培養プレートを14 =ハミルトンHHS2ヒーター/シェーカー; 15 = 50ミリリットル試薬トラフプロテイナーゼKを含むより大きな数字を表示するには、ここをクリックしてください 。
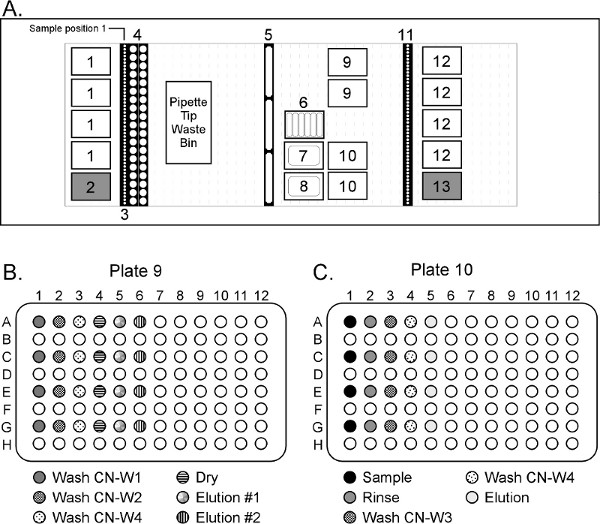
図4。大容量の血漿試料(正確な縮尺ではない)からDNAを精製するためのハミルトンSTARplusデッキレイアウトシステムは、8×5ミリリットルのチャンネルと8×1ミリリットルのチャネル(デッキレイアウトに図示せず)を備えている。デッキポジション1 =ハミルトン4ミリリットルフィルタリングヒント; 2 = Akonni /ハミルトンを5ml TruTips; 3 =ソース血漿サンプル、4 = 50 mlコニカルチューブ、CN-W1、CN-W2とCN-W4を含む5 = 120ミリリットル試薬トラフreageNTS; CN-L1試薬を含む7 = 290ミリリットル試薬トラフ;; 8 = 290ミリリットル試薬トラフ含むCNプロテイナーゼK、CN-B2、CN-B3、EBA2、EBBとCN-W3試薬を含む6 =低容量試薬トラフ-B1試薬; 9ステップ1 = 96ディープウェルプレート、10ステップ2 = 96ディープウェルプレート、精製、最終製品のために11 =サンプルのキャリア、12 =ハミルトン1ミリリットルフィルタリングされていないヒント; 13 = Akonni /ハミルトン1ミリリットルLPT 4ミリメートルTruTipsは大きい数字を表示するには、ここをクリックしてください 。
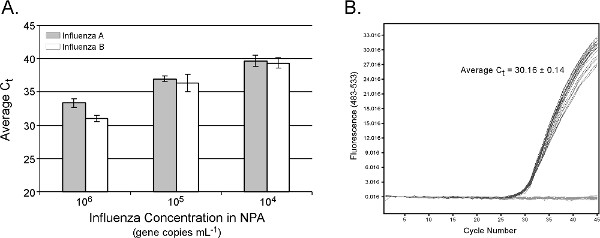
図5。 ()。インフルエンザウイルスの自動TruTip抽出からのリアルタイムPCRの結果は、鼻咽頭吸引(NPA)に添加。入力NPA体積=100μlを、溶出体積=50μlの。結果が3の複製、電子の平均である希釈レベルとインフルエンザターゲットごとに異なる5つのNPAの背景(N = 15)からxtractions。定量PCRは、以前15に記載のアッセイ条件にライトサイクラー480システム上で行われた。12正NPAサンプルテンプレートなしのコントロールおよび自動抽出手順の対象と散在しているとき(B)いいえ交差汚染が検出されない。 より大きい数字を表示するには、ここをクリックしてください 。
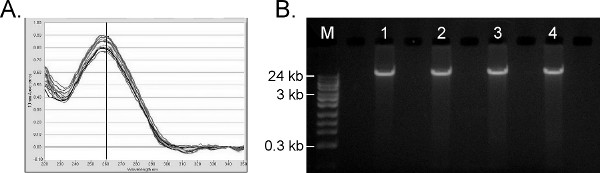
図6。ランダムに選択された10〜光度1000(ThermoFisher)から全血からのヒトゲノムDNA抽出の結果。)UV-可視トレースが複製されます。B)1%TruTip精製したgDNAのアガロースゲル。 M =フィッシャー24キロバイトマックスDNAラダー。レーン1から4 =〜100ngの精製gDNAを4からランダムに選択された複製。 より大きい数字を表示するには、ここをクリックしてください 。
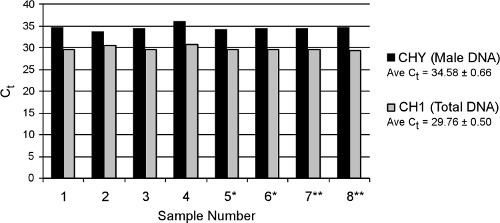
図7。自由に血漿からDNAを循環させる8つの反復TruTip抽出からのリアルタイムPCRの結果。アスタリスク(*または**)で表されるサンプルは、別の日に抽出した。 CHYは男性胎児DNAを定量化し、CH1合計存在するDNA(胎児と母体の)を定量化します。定量PCRはCHYとCH1 18を標的と以前に発表されたアッセイとライトサイクラー480システム(Roche社)を行った。
ディスカッション
TruTipの概念およびワークフローの簡略化( 図1)、それは容易に適合させる、自動化された効率的および臨床サンプルマトリックス、入力サンプルボリューム、および液体ハンドリングシステムの数のために有効である。これは、すべての臨床試料が一意であることが認識されるべきであり、粘度、粒子状物質、粘液、表面汚染物質、微生物、および/またはヒトの遺伝的背景の次に1つを変化するであろう。臨床試料組成物および自動TruTipサンプル調製プロトコルの利用目的の予想ばらつきを考えると、それは、したがって、特定のサンプルの種類の所望の結果を達成するために、TruTip手順における特定のステップを修正する必要があるかもしれない。かかわらず、サンプルタイプの、しかし、典型的に核酸の純度及び/又は回収に最も大きな影響を及ぼすTruTipパラメータがあります。
- 溶解バッファー(とアルコール)との混合と均質化のサンプル。TruTips再を持っているがlatively大きな細孔の大きさ、サンプルの均質化と液化は、効率的な細胞溶解のために非常に重要である、とTruTipモノリス以降の結合手順。均質かつ十分に液化溶解物、サンプルがサンプル全体の処理時間を短縮し、より高い流量を有するTruTipを介して移動することができる。大容量プラズマプロトコルは、大きな入力サンプル量にもかかわらず、完全に均質と難しいサンプル(オンラインまたはオフライン)液化するためのユーザーのための可能性を示しています。
- 流速。遅い流速核酸結合又は溶出中には、通常、全体の処理時間を犠牲にもかかわらず、より高い核酸収量をもたらす。遅い流量はまた、DNAのせん断の程度を減らすことができます。
- サイクル数。吸引の最適な数とサイクルを分配するには、サンプルの種類、総サンプル量、および流速に依存する。 図1のステップ1は、典型的には、サイクルnumbeポイントですRS(と流量)などの異なる患者からNPA粘度の範囲のために最適化するために、より挑戦的な溶解物のいずれかを表す咽頭吸引( 図5)のようなサンプルを用いて、いくつかの実証的な最適化が必要になる場合があります。
- 乾燥。TruTipモノリスの完全な乾燥が精製された核酸試料を抑制下流のプロセスまたはテストを共溶出するから残留有機溶剤を防止することが不可欠である。 TruTipを遠心分離又は吸引濾過によって乾燥されていないので、乾燥工程中に流量およびサイクル数の両方を最大化することが重要である。たまに乾燥サイクルが完了した後TruTipの末端に洗浄液の残液滴が存在する。ハミルトンロボットは、それによって無溶媒溶出を確実に、液滴を解放するために井戸の側の "先端タッチ"を実行する能力を持っています。 epMotionシステムがこの機能を持っているが、エルでTruTip末端のプレすすぎませんutionバッファは、同じ効果を達成するようにプログラムすることができる。
ロボットアームチャネルに幾何学、ピペットチップ材料、及び取り付け方法は、各機器メーカー一意であるため、異なるTruTip構築物は、それぞれの液体ハンドリングシステムのために必要とされる。 TruTipモノリス寸法(直径、厚さ、孔径)は、核酸結合能(および溶出効率)と相関しない、などの任意の固相抽出技術が期待される。厚い(> 4 mm)の行列は、大容量のサンプルのための核酸結合容量を増加および/または特定のTruTip形式を横切る結合容量が等しくなるように、1mlのTruTipに埋め込まれてもよいが、TruTipの厚さとの間の流量との間にトレードオフが存在する初期結合工程(粗溶解の存在下で)。従って、それは( 例えば<、自動化されたプロトコルの最初のステップのための大ボリュームピペットチップに大径のモノリスを埋め込 むことが時として有利で ある/ em>の大容量抽出のために5ミリリットルハミルトン/ Akonni TruTips)。リキッドハンドリングロボットの製造業者によって規定特定TruTip構成を考えると、しかし、我々は、必ずしもTruTip核酸利回りは異なるメーカーの、または異なるTruTipサイズ渡るリキッドハンドリングプラットフォーム間で同一であることを期待しないでください。
彼らは通常は無菌の部位( 例えば脳脊髄液)から取得していない限り、臨床検体は(定義により)ヒトゲノムDNAのかなりの量が含まれます。他のアプリケーションで不要なヒトDNAゲノムの背景( 図5のような)を表す一方、時にはヒトゲノムDNAは、( 図6のように)が望まれている。バックグラウンドDNAの存在は、通常モノリスの結合容量を超えない試料中の核酸の総量限り、問題とならない、背景DNAは、キャリアとして機能することができ、所望の標的核酸場合酸は微量で存在する。ことを除いて感染症検査の試料調製対物レンズに類似している大容量の血漿抽出プロトコール( 図7)母系DNAの10〜20倍過剰の存在下で(断片化)胎児DNAを単離すること、を目的配列は高度に合同であるとのみ特異性の高い分子検査および/またはサイズの差別によって区別することができます。この場合には、総循環DNAを5mlのTruTipを用いて単離し、高分子続くと低分子量の胎児DNAを、結合バッファー条件を変えることによって、1mlのTruTipに後続の結合および溶出を介して分離される。シリカモノリスへの結合および溶出特性に基づいて標的核酸の選択的なサイズ分離と濃縮は、膜またはサイズ排除スピンカラムによって達成さよりも有意に異なる作用機モードである。ヒトゲノムDNAからサイズ分離と微生物のDNAの濃縮は、かもしれないカスタマイズTruTip結合および溶出バッファーを経由して、将来のアプリケーションでccomplished。
自動化されたプロトコルは、多様な臨床サンプル、そしてそれがどのように大規模なボリュームと特定の液体ハンドリングロボットに適合させることができるを処理するためTruTipモノリス自体の有用性を強調してここに示しました。合理化された方法は、典型的には他の自動化システムと比較してより高速な抽出プロトコールをもたらす。 TruTip手続きを自動化するために必要な主要なハードウェアはピペットチャンネルアーム自体ではなく、磁気棒、真空システムであるため、TruTip技術のシンプルさは、しかし、また、新しい、自動化された核酸精製システムを購入に興味のある人のためのいくつかのコスト優位性を与える、または遠心分離機オンボード。予め充填された試薬プレートを利用することも領域と必要な消耗を低減し、走行あたりのスループットを倍増できる。 TruTipプロトコルでデッキスペースを最小限に抑えることも、上流またはdを統合する上級ユーザーを可能にするTruTipとownstream自動化されたプロセス。例えば分別全血にハミルトンのeasyBloodソリューションが大幅にバイオバンキングプロセスを合理化したい自動TruTip抽出方法で組み込むことができます。このような核酸定量、正規化、PCRをセットアップ、またはDNA配列としてポスト抽出プロセスも容易に大きくリキッドハンドリングプラットフォーム上TruTipに統合されています。
開示事項
著者は、この記事で使用する材料を製造Akonniバイオシステムズ社の従業員です。
この記事の無料アクセスと生産はAkonniバイオシステムズ社が主催しています
謝辞
この作業の一部は助成R 44 AI072784下国立衛生研究所(NIH)によってサポートされていました。我々は博士キルスティンセントジョージ、サラB. Griesemer、ダリルラムソンとウイルス病研究室のエイミー·ディーン、定量インフルエンザビリオンと臨床的に検証されインフルエンザへのアクセスをリアルタイム用ズワースセンター、ニューヨーク州保健部に感謝PCRアッセイ。
資料
| Name | Company | Catalog Number | Comments |
| Reagent/Material | |||
| TruTip Influenza Extraction Kit (EPM TruTips) |  Akonni Biosystems, Inc. Akonni Biosystems, Inc. | 300-11120 | |
| 95% Ethanol | Acros Organics/ThermoFisher Scientific | AC615110040 | |
| 99% Acetone | Sigma-Aldrich | 270725-4L | |
| DEPC-treated water | Life Technologies | AM9906 | |
| Reagent Reservoir, 30 ml | Eppendorf | 960050100 | |
| Deep well plate 96/2,000 μl | USA Scientific | 30502302 | |
| epT.I.P.S. Motion Filtertips, 1,000 μl | Eppendorf | 960050100 | |
| Equipment | |||
| epMotion 5070 System | Eppendorf | 5070 000.000 | |
| Dispensing tool TM1000-8 | 960001061 | ||
| Reservoir rack | 960002148 | ||
| Table 1. Reagents and equipment for automated RNA extraction from NPA. | |||
| Reagent/Material | |||
| TruTip gDNA Blood Extraction Kit (Hamilton TruTips) |  Akonni Biosystems, Inc. Akonni Biosystems, Inc. | 300-20341 | |
| 95% ethanol | Acros Organics/ThermoFisher Scientific | AC615110040 | |
| Proteinase K | AMRESCO LLC | E195 | |
| 1 ml Hamilton filtered CO-RE 96 tip rack | Hamilton Robotics, Inc. | 235905 | |
| 1 ml Hamilton non-filtered CO-RE 96 tip rack | Hamilton Robotics, Inc. | 235904 | |
| 50 ml Reagent Trough | Hamilton Robotics, Inc. | 187297 | |
| Deep Well 2 ml plate | USA Scientific | 1896-2800 | |
| Nunc 96 DWP-2 ml | Thermofisher | 27874 | |
| Reagent Trough | Fisher | 14-222-412 | |
| Equipment | |||
| Hamilton STAR System | Hamilton Robotics, Inc. | 173027 | |
| 1 ml Independent Pipette Channels / Modular Arm | Hamilton Robotics, Inc. | 173081/173050 | |
| 1 ml 96-channel head | Hamilton Robotics, Inc. | 199090 | |
| Tip Carriers | Hamilton Robotics, Inc. | 182085 | |
| Sample Carriers/Inserts | Hamilton Robotics, Inc. | 173400/182238 | |
| Plate Carriers | Hamilton Robotics, Inc. | 182090 | |
| Multiflex Carrier | Hamilton Robotics, Inc. | 188039 | |
| HHS2 Heater Shaker Unit | Hamilton Robotics, Inc. | 199033 | |
| Rack Carrier | Hamilton Robotics, Inc. | 188047 | |
| Table 2. Regents and equipment for 96-well genomic DNA extraction from whole blood. | |||
| Reagent/Material | |||
| TruTip R+D Circulating DNA Extraction Kit (Hamilton TruTips) |  Akonni Biosystems, Inc. Akonni Biosystems, Inc. | Call to inquire | |
| 100% ethanol | Sigma-Aldrich | 459828-1L | |
| Isopropanol | Acros Organics/ThermoFisher Scientific | AC327270010 | |
| Proteinase K | AMRESCO LLC | E195 | |
| Filtered 4 ml Tips | Hamilton Robotics, Inc. | 184022 | |
| Unfiltered 1 ml Tips | Hamilton Robotics, Inc. | 235939 | |
| 96-Deep Well Plates | USA Scientific | 1896-2800 | |
| 50 ml Conical Tubes | Corning/ThermoFisher Scientific | 05-526B | |
| 50 ml Reagent Troughs | Hamilton Robotics, Inc. | 187297 | |
| 120 ml Reagent Troughs | Hamilton Robotics, Inc. | 182703 | |
| Large Volume 96-Pos Reagent Troughs | ThermoFisher Scientific | 14-222-412 | |
| Equipment | |||
| STARplus Autoload Workstation Base / Deck Module | Hamilton Robotics, Inc. | 173025/190012 | |
| 1 ml Independent Pipette Channels / Arm | Hamilton Robotics, Inc. | 173081/173052 | |
| 5 ml Independent Channel / Modular Arm | Hamilton Robotics, Inc. | 184090/173050 | |
| Plate Carriers | Hamilton Robotics, Inc. | 182090 | |
| Multiflex Carrier | Hamilton Robotics, Inc. | 188039 | |
| Rack Carrier for 50 ml Reagent Troughs | Hamilton Robotics, Inc. | 188047 | |
| 120 ml Reagent trough carrier | Hamilton Robotics, Inc. | 185290 | |
| Tip Carriers | Hamilton Robotics, Inc. | 182085 | |
| 50 ml Tube Carriers | Hamilton Robotics, Inc. | 182245 | |
| 24 Position Sample Carriers | Hamilton Robotics, Inc. | 173400 | |
| 32 Position Sample Carrier | Hamilton Robotics, Inc. | 173410 | |
| Table 3. Reagents and equipment for large volume DNA extraction from plasma. | |||
参考文献
- Boom, R., Sol, C. J. A., et al. Rapid and simple method for purification of nucleic acids. J. Clin. Microbiol. 28, 495-503 (1990).
- Baker, M. P., Mitchell, A., et al. Isolation of genomic DNA from blood using a novel filter-based DNA purification technology. BioTechniques. 31, 142-145 (2001).
- Sinclair, B. To bead or not to bead: applications of magnetic bead technology. The Scientist. 12, 17-24 (1998).
- Dederich, D. A., Okwuonu, G., et al. Glass bead purification of plasmid template DNA for high throughput sequencing of mammalian genomes. Nucl. Acids Res. 30, e32 (2002).
- Levison, P. R., Badger, S. E., et al. Recent developments of magnetic beads for use in nucleic acid purification. J. Chromatogr. A. 816, 107-111 (1998).
- Hourfar, M. K., Schmidt, M., Seifried, E., Roth, W. K. Evaluation of an automated high-volume extraction method for viral nucleic acids in comparison to a manual procedure with preceding enrichment. Vox Sang. 89, 71-76 (2005).
- Perelle, S., Cavellini, L., et al. Use of a robotic RNA purification protocol based on the NucliSens easyMAG for real-time RT-PCR detection of hepatitis A virus in bottled water. J. Virol. Methods. 157, 80-83 (2009).
- Riemann, K., Adamzik, M., et al. Comparison of manual and automated nucleic acid extraction from whole-blood samples. J. Clin. Lab. Anal. 21, 244-248 (2007).
- Hukari, K. W., Shultz, M., Isely, N., Milson, R., West, J. A. A completely automated sample preparation instrument and consumable device for isolation and purification of nucleic acids. J. Lab. Autom. 16, 355-365 (2011).
- Kessler, H., Mühlbauer, G. Fully automated nucleic acid extraction. MagNA Pure LC. Clin. Chem. 47, 1124-1126 (2001).
- Miller, S., Seet, H., Khan, Y., Wright, C., Nadarajah, R. Comparison of QIAGEN automated nucleic acid extraction methods for CMV quantitative PCR testing. Am. J. Clin. Pathol. 133, 558-563 (2010).
- Dundas, N., Leos, N. K., Mitui, M., Revell, P., Rogers, B. B. Comparison of automated nucleic acid extraction methods with manual extraction. J. Mol. Diagn. 10, 311-316 (2008).
- Kruhøffer, M., Voss, T., et al. Evaluation of the QIAsymphony SP workstation for magnetic particle-based nucleic acid purification from different sample types for demanding downstream applications. J. Lab. Autom. 15, 41-51 (2010).
- Belgrader, P. Apparatus, system, and method for purifying nucleic acids. United States Patent. , (2010).
- Chandler, D. P., Griesemer, S. B., et al. Rapid, simple influenza RNA extraction from nasopharyngeal samples. J. Virol. Methods. 183, 8-13 (2012).
- Chan, K. H., Lai, S. T., et al. Analytical sensitivity of rapid influenza antigen detection tests for swine-origin influenza virus (H1N1). J. Clin. Virol. 45, 205-207 (2009).
- Chan, K. H., Lama, S. Y., et al. Comparative analytical sensitivities of six rapid influenza A antigen detection test kits for detection of influenza A. subtypes H1N1, H3N2 and. 38, 169-171 (2007).
- Fan, H. C., Blumenfeld, Y. J., Chitkara, U., Hudgins, L., Quake, S. R. Noninvasive diagnosis of fetal aneuploidy by shotgun sequencing DNA from maternal blood. Proc. Natl. Acad. Sci. USA. 105, 16266-16271 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved