このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
単離されたミトコンドリアのフローサイトメトリーによる外膜タンパク質の免疫検出
要約
ここで説明するフローサイトメトリーによりげっ歯類組織分析から単離されたミトコンドリアの免疫標識によってミトコンドリア外膜タンパク質を検出および定量するための方法である。この方法は、ミトコンドリア亜集団の機能的側面を評価するために拡張することができる。
要約
動物組織内のミトコンドリア外膜タンパク質成分を検出し、監視するための方法は、ミトコンドリアの生理学および病態生理学を研究するために不可欠である。このプロトコルは、齧歯類の組織から単離されたミトコンドリアは、免疫標識およびフローサイトメトリーによって分析する技術が記載されている。ミトコンドリアは、齧歯類脊髄から単離され、ミエリン、神経組織から調製されたミトコンドリア画分の主要な汚染物質を除去するために急速な濃縮工程に供される。単離されたミトコンドリアは、その後、選択した抗体と、蛍光結合二次抗体で標識する。フローサイトメトリーによる分析は、免疫標識タンパク質の検出および定量に続いて、ミトコンドリア特異的色素で染色することにより、ミトコンドリア調製物の相対的な純度を検証します。この技術は、サンプルあたりのミトコンドリアの数十万の分析を可能にする、迅速な定量化及びハイスループットである。それは、新規なpを評価するために適用され正常な生理的条件下で、ミトコンドリアの表面でroteinsだけでなく、病理中にこの細胞小器官にmislocalizedなる可能性がタンパク質。重要なことに、この方法は、ミトコンドリア亜集団の特定の活動を報告する蛍光指示薬色素に結合され、中枢神経系(脳および脊髄)、ならびに肝臓からミトコンドリアに対して実行可能であることができる。
概要
ミトコンドリアは、高エネルギー需要部位に輸送され、生理的刺激1に迅速に対応している、核分裂と核融合の複数のラウンドを受ける非常にダイナミックな細胞小器官である。それはますます異なる組織内のミトコンドリア、さらには異なる細胞区画には、異なる機能プロファイルを有することが認識されているので、新しい方法は、これらの異なるミトコンドリアのサブセットを識別するために必要とされる。
顕微鏡検査は、個別のミトコンドリアを視覚化することができ、ミトコンドリアでのまたは中のタンパク質の存在が免疫蛍光2によって決定することができる手段を提供する。しかしながら、この方法による定量分析は、労働集約的であり、不死化または初代細胞株を用いた実験に適している。組織に由来する個別のミトコンドリアの研究が著しく困難であり、ほとんどの方法はevaluと同時にミトコンドリアのサブセットを容易に識別を可能にしないミトコンドリア機能3のation。
このハードルに対処するために、ミトコンドリアげっ歯類組織から単離し、続いてフローサイトメトリーにより分析を免疫標識するための新規な方法が開発されている。これは、顕微鏡による分析に比べてミトコンドリア外膜に局在するタンパク質の迅速な検出および定量を可能にする、はるかに少ない労働集約的であり、単一のサンプル中のミトコンドリアの数千の分析を可能にする。このアッセイは、ミトコンドリアにおいて構成的に存在すると考えられているミトコンドリア外膜タンパク質の運命および相対量を監視するために適用することができ、ミトコンドリアの表面へのタンパク質の補充、または病理学的状態におけるミトコンドリアにmislocalizedタンパク質の検出。また、従来の蛍光指示色素の取り込みは、異なるミトコンドリアにおけるミトコンドリア機能の特定の側面の同時評価を可能にする亜集団。
プロトコル
本研究で用いた動物は、カナダ人によって概説されるように国の基準に従って動物の保護のためのセンター·デ·ルシェルシュ·デュ·センターHospitalierドゥモントリオール大学(CRCHUM)制度委員会により承認されたプロトコル(N08001CVsr)に厳密に従って処理した。動物管理評議会(CCAC)。
このプロトコール( 表1)を実行するために必要な全ての試薬 を準備する。機器、消耗品や仕入先に関する他のすべての詳細は、材料のリストに記載されています。
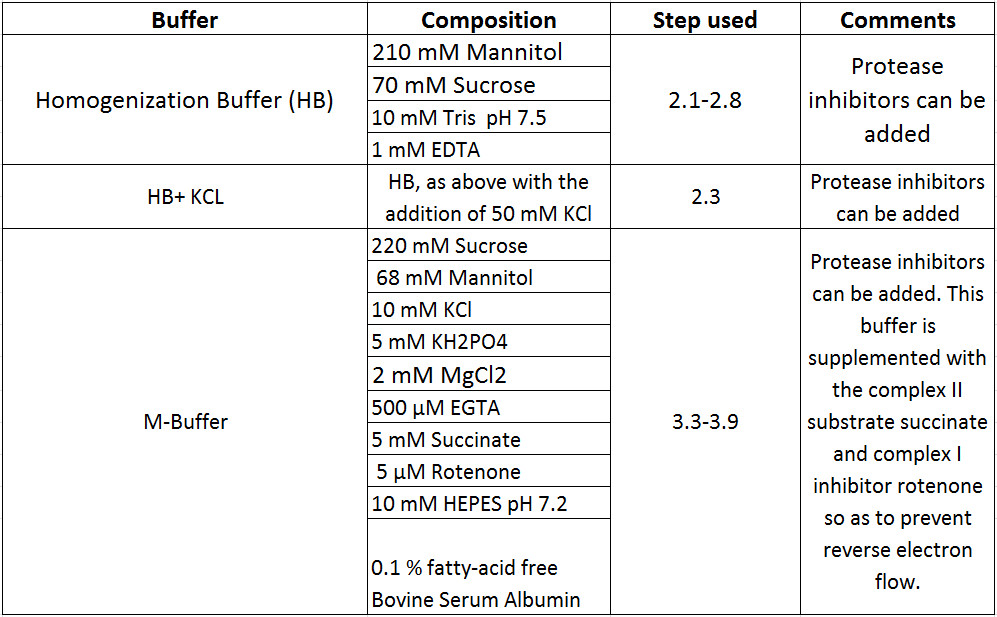
表1バッファー組成。
ラット脊髄の1集
- 深く4%イソフルランでラット(ドーリー)を麻酔し。目のピンチの際に反射の欠如によってanaesthetizationを確認する電子の前足。ギロチンを経由して断頭によりラットを安楽死させる。安楽死のこの方法は、脊髄を歪めるかもしれない他のものよりも好ましい。
- 背骨を露出させるために背中の皮膚をカット。ちょうど骨盤骨の上に骨ハサミで脊柱をカット。脊柱の開口部を可視化。
- 脊柱に、リン酸緩衝生理食塩水(PBS)で満たされ、(炎の上にわずかに融解を介して結合)を200μlピペットの先端で、10ミリリットルの注射器を挿入します。
- プランジャーに圧力媒体量を適用することにより、脊髄を洗い流す。
- いずれかの血液が脊髄に存在する場合、次の手順に進む前に、PBSですすいでください。
注:このメソッドはまた、脳や肝臓のために検証されています。これらの組織を含めた場合は、半分に安楽死させたラットからの脳や脊髄への重量の等しい肝臓の一部を収集します。他のすべての手順は同じままである。
脊髄ミットの2の単離(ヴァンデヴェルデらから適応。4)ochondria
- 5ボリューム(〜3.25ミリリットル)均質化バッファー(HB)と5ミリリットルガラスホモジナイザー中の全無傷の脊髄と場所を収集します。単離されたミトコンドリアの最適な回復のために、氷の上または低温室ですべての手順を実行します。組織の大きな片がなくなるまで、手で約8ストロークを、組織をホモジナイズする。 2(2 ml)または3(1.7ミリリットル)マイクロ遠心チューブにホモジネートを置きます。卓上型マイクロ遠心4℃で10分間遠心1300×gで。
- 5ミリリットルの超遠心管に上清と場所を回復します。ペレットを含むマイクロ遠心チューブに750μlの(〜0.5容量)HBを加え、穏やかにペレットを再懸濁します。繰り返し遠心分離および再懸濁をさらに2回繰り返します。上記と同じ5ミリリットル超遠心チューブにプールのすべての上清(S1aとS1bとして)。このステップは、小さな破片を除去するのに役立つ。
- 遠心分離機は、S1はスイングバケット腐敗を装備した超遠心機を使用してプールされたまたは4℃で15分間、17000×gで遠心する。
- 細胞質ゾル画分(ウエスタンブロット分析のためなど)興味がある場合は、さらなる処理のために上清(S2)を保つ。 4ミリリットルのHB + 50mMのKClで、ペレット(P2)、粗製のミトコンドリア分画を再懸濁します。スイングバケットローター中4℃で15分間遠心17000×gで。上清を捨て、軽く800μlのHBでペレット(P3)を懸濁します。
NOTE:ミトコンドリアは、任意の非特異的ミトコンドリア関連汚染物質を除去するHB + 50mMのKClで洗浄する。 - 新しい5ミリリットル超遠心管中で、再懸濁したペレット(P3)のちょうど800μlを添加する。
- この管に、それによって12%イオジキサノールの最終濃度を作成し、イオジキサノール(密度勾配培地)を200μlを追加。優しく、しかし徹底的にP1000とピペッティングを経由してチューブの内容を混ぜる。最初のイオジキサノールを加え、その後、ペレット(P3)は、完全な混合を容易にすることが好ましい場合がある。 ULT遠心し4°Cで15分間17000×gで、スイングバケットローターを備えracentrifuge。
- 注:肝臓は、ミエリンが含まれていないとだけ肝臓が処理されている場合は、そのため、この手順は必要ありません。肝臓は中枢神経系のミトコンドリアと同時に処理されている場合は、それは平等にすべての組織を治療することをお勧めします。
- 管の上部にあるミエリンの層を吸引し、慎重に取り外し、上清を捨てる。ペレットがゆるんでいる可能性があり。 4ミリリットルのHBでペレットを再懸濁。 4℃で10分間、17000×gで再び遠心分離します。上澄みを捨て、4ミリリットルのHBでペレットを再懸濁します。遠心分離を繰り返し、上清を除去します。
- 100-200μlのHBで最終ペレット(P7)を再懸濁し、1.7ミリリットルマイクロ遠心チューブに移す。このサンプルでは、単離されたミトコンドリアが含まれています。
- タンパク質の定量に進みます。ミトコンドリア対応時間の適切な可溶化を確実にするためにサンプルを、2%ドデシル硫酸ナトリウム(SDS)で標準曲線を希釈ngのタンパク質の定量。
フローサイトメトリー用単離されたミトコンドリアの3。免疫標識
- 試験対象の各染色ミックス1.7 mlマイクロ遠心チューブに単離されたミトコンドリアのピペット25μgのために。各実験で染色されていないサンプルを含める。そして各抗体について、適切なアイソタイプコントロールのためのサンプルを含めるようにしてください。
- 卓上型マイクロ遠心において、4℃で2分間17000×gで遠心分離します。
- 上清を除去し、4℃(ブロッキング工程)で15分間、10%の脂肪酸フリーのBSAを添加した50μlのミトコンドリアバッファー(Mバッファ)で単離されたミトコンドリアを懸濁します。
注:ラベルの間に、4℃の冷蔵庫でインキュベーションを行う。 - 管に一次抗体(ウサギ抗MFN2、1mlあたり20μgの)を追加し、4℃で30分間インキュベートする。
注:滴定により実験的に各抗体の最適濃度を決定する。により濃度の変動性および/またはpへurity、同一メーカーの同一の抗体の異なるロットは、異なる結果になる場合があります。したがって、滴定は、抗体のそれぞれの新しいロットのために必要とされる。 - 4℃で2分間17000×gで遠心分離:バインドされていない一次抗体を洗浄する。上清を除去し、穏やかに200μlのM緩衝液にペレットを再懸濁します。 4℃で2分間17000×gで遠心分離します。上清を除去し、50μlのMバッファーでペレットを再懸濁します。
- 管に二次抗体(ロバ抗ウサギIgGをフィコエリトリン(PE)1mlあたり、0.5μgの)を追加し、光から保護し、4℃で30分間、サンプルをインキュベートする。
- 4℃で2分間17000×gで遠心分離:未結合の二次抗体を洗浄する。上清を除去し、200μlのM緩衝液にペレットを再懸濁します。 4℃で2分間17000×gで遠心分離します。上清を除去し、500μlのM緩衝液にペレットを再懸濁します。
- イベントは実際にはミトコンドリア内にあることを確認するために、と汚れ単離されたミトコンドリア光から保護し、室温で15分間、ミトコンドリア特異的な蛍光色素。他の機能のパラメータ(ミトコンドリア膜電位またはスーパーオキシド産生)の染色が必要な場合は、そうでない場合は、取得のために、手順5に進み、ステップ4に進みます。
注:二次抗体の発光スペクトルは、機能性染料のそれと互換性があることを確認することが重要です。例えば、テトラメチルローダミンメチルエステル(TMRM)とFITC及び膜電位に類似のスペクトル特性を有する市販の色素でミトコンドリアの純度を確認した場合、実行可能な二次抗体は、(:元は650nm /エム660nmのAPC)アロされることになる。適用可能な場合、すなわち 、単一のフルオロフォアで免疫標識または染色された標本を補償コントロールを追加します。 - ロードフローサイトメーターに適したチューブに移します。 (小さなサンプルサイズを容易にするために、マイクロタイターチューブは3がチューブフローサイトメーターミリリットルの内側に配置されます。)サンプルを氷上に保ち、直ちに進める取得のためのフローサイトメーター。
フローサイトメトリーによる4のアッセイミトコンドリア膜電位およびミトコンドリアスーパーオキシド生産
- 単離されたミトコンドリアは、光から保護し、室温で15分間、のために、ステップ3.8で、100 nMのTMRM(例548 nmの/エム574 nm)を5で染色することにより無傷の膜電位を持っていることを確認します。サンプル集団間の膜電位、TMRM(1nMの30)の下側/非消光濃度の使用を比較するために、6より適切であるかもしれない。
- TMRM染色、100μMのカルボニルシアニドmのクロロフェニルヒドラジン(CCCP)の存在下で100 nMのTMRMで染色する単離されたミトコンドリア、ミトコンドリアを脱分極しますミトコンドリア脱共役剤の対照として。染料のより低い濃度が使用される場合、ミトコンドリアを脱分極するために必要なCCCPの濃度は、少なくてもよい。
- 単離されたミトコンドリアがSTによってミトコンドリアのスーパーオキシドを生成することを確認してください光から保護して室温で15分間、のために、また、ステップ3.8において、適切なミトコンドリアのスーパーオキシドインジケータ7 aining。
- ミトコンドリアのスーパーオキシド産生のための対照として、汚れを10μMアンチマイシンA、ミトコンドリアのスーパーオキシド産生を増大させるであろう呼吸鎖の複合体IIIの阻害剤の存在下で染料とミトコンドリアを単離した。
5。フローサイトメトリーによる免疫標識単離されたミトコンドリアの取得と解析に
- インストゥルメントを設定:リニアから切り替え電圧は、単離されたミトコンドリアの分析を容易にするためにモードを記録し、電圧(FSC:450; SSC:250)を設定する。イベントはFSC-A(面積)モードと同様に、FSC-W(幅)に回収されていることを確認し、FSC-H(高さ)、ダブレット( すなわち、2つのイベントを除外することができるように、同時に検出器を通過する)分析後のデータ収集中。 100,000収集されるイベントの数を設定します。補償のコントロールを取得(該当する場合)。
- データ収集:データ収集の前に、サンプルをボルテックス避ける。代わりに優しくチューブをタップして混ぜる。当初ゲー中に、低圧でイベントを収集。総人口上のゲート。それに応じてヒストグラムの電圧を調整し、通常は無染色サンプルのピークが2番目の10年(10 2)に対応することになる。ゲートが確立され、そしてサンプルが処理されると、圧力が高いに切り替えることができる。
- 分析:FSC対FSC-Wをプロットしてダブレットを可視化。シングレットダブレットを特定します。シングレット上のゲート。ミトコンドリア選択性色素で陽性に染色されたイベントにゲーティングすることによってミトコンドリアの人口を選択します。
- アイソタイプコントロールから背景ラベルを決定します。アイソタイプコントロールサンプルを使用して、MFN2抗体に対して陽性のミトコンドリアの人口ラベリングの割合を決定。
結果
ラット脊髄から派生ミトコンドリアはMitofusin2(MFN2)、ミトコンドリア8の外膜の融合に関与するタンパク質を標的とした抗体で免疫することができます。 MFN2特異的な抗体と、蛍光結合二次抗体を用いて単離およびラベリングの後、ミトコンドリアは、フローサイトメトリー( 図1)によって処理される。データ収集後、試料を第1のドットプロット( 図2A)?...
ディスカッション
これは、ミトコンドリアが正常な生理と病気の両方で重要なプレーヤーであることがますます明らかである。免疫ブロッティングながら全人口の平均で、この方法のレポートは、特定の条件でミトコンドリア内またはミトコンドリア表面で見出されるタンパク質を決定することができます。この方法は、ミトコンドリアの亜集団またはサブセットの相対存在量についての情報を得ることはで?...
開示事項
著者らは、開示することは何もない。
謝辞
私たちは、フローサイトメーターにアクセスするためのローリー·Destroismaisonsと卓越した技術サポートのためのサラPeyrardとDr.Alexandreプラットに感謝します。また、調製物からのミエリンの除去に関する彼の貢献のために博士ティモシー·ミラーを承認したいと思います。この作品は、ヘルスリサーチ(CIHR)神経筋研究パートナーシップ、革新のためのカナダの財団、カナダのALS協会、ALS研究フリック財団、CHUM財団とフォン·ド·ラ·ルシェルシュエンサンテ·デュ·ケベック(CVV)のカナダの研究所によってサポートされていました。 CVVおよびNAの両方がフォン·ド·ラ·ルシェルシュエンサンテ·デュ·ケベック州とCIHR新しい研究者の研究学者である。 SPはカナダのALS協会からティム·ノエル学生の身分によってサポートされています。
資料
| Name | Company | Catalog Number | Comments |
| Rats | Charles River | Strain code 400 | Adult (9 weeks to 18 weeks) male or female rats can be used for the isolation protocol. Weight of rats is dependent on gender and age (males between 300 to 500 g and females between 200 to 350 g) are typically used. |
| Dounce homogenizer | Kontes Glass Co. | 885450-0022 | Duall 22 |
| Microcentrifuge | Thermo Scientific | Sorvall Legend Micro 17 R | |
| Ultra-Clear Ultracentrifuge tubes | Beckman Coulter | 344057 | Transparent, thin walled |
| Sorvall Ultracentrifuge | Thermo Scientific | Sorvall WX UltraSeries | |
| AH-650 rotor and buckets | Thermo Scientific | ||
| Opti-prep | Axis-Shield | 1114542 | Iodixanol, density gradient medium |
| Fatty acid free Bovine Serum Albumin | Sigma | A8806 | Must be fatty acid free for mitochondria |
| Sodium succinate dibasic hexahydrate | Sigma | S9637 | |
| Rabbit anti-Mitofusin2 antibody | Sigma | M6319 | |
| Rabbit IgG | Jackson Immuno Research | 011-000-003 | |
| Anti-Rabbit IgG PE | eBioscience | 12-4739-81 | |
| Micro titer tube | Bio-Rad | 223-9391 | For sample acquisition by flow cytometry |
| MitoTrackerGreen (MTG) | Invitrogen | M7514 | 100 nM: Ex 490 nm/Em 516 nm |
| TMRM | Invitrogen | T668 | 100 nM: Ex 548 nm/Em 574 nm |
| CCCP | Sigma | C2759 | |
| MitoSOX Red | Invitrogen | M36008 | 5 µM: Ex 540 nm/Em 600 nm |
| Antimycin A | Sigma | A8874 | |
| LSR II flow cytometer | BD | ||
| BD FACSDiva Software | BD | ||
| FlowJo | TreeStar Inc. | Software used for analysis | |
| BCA protein assay kit | Pierce/Thermo Scientific | 23225 | Bradford assay is not recomended as it is not compatible with high concentrations of SDS |
参考文献
- Itoh, K., Nakamura, K., Iijima, M., Sesaki, H. Mitochondrial dynamics in neurodegeneration. Trends Cell Biol. 23, 64-71 (2013).
- Narendra, D., Tanaka, A., Suen, D. F., Youle, R. J. Parkin is recruited selectively to impaired mitochondria and promotes their autophagy. J Cell Biol. 183, 795-803 (2008).
- Zorov, D. B., Kobrinsky, E., Juhaszova, M., Sollott, S. J. Examining intracellular organelle function using fluorescent probes: from animalcules to quantum dots. Circ Res. 95, 239-252 (2004).
- Vande Velde, C., Miller, T., Cashman, N. R., Cleveland, D. W. Selective association of misfolded ALS-linked mutant SOD1 with the cytoplasmic face of mitochondria. Proc Natl Acad Sci U S A. 105, 4022-4027 (2008).
- Loew, L. M., Tuft, R. A., Carrington, W., Fay, F. S. Imaging in five dimensions: time-dependent membrane potentials in individual mitochondria. Biophys J. 65, 2396-2407 (1993).
- Perry, S. W., Norman, J. P., Barbieri, J., Brown, E. B., Gelbard, H. A. Mitochondrial membrane potential probes and the proton gradient: a practical usage guide. Biotechniques. 50, 98-115 (2011).
- Xu, X., Arriaga, E. A. Qualitative determination of superoxide release at both sides of the mitochondrial inner membrane by capillary electrophoretic analysis of the oxidation products of triphenylphosphonium hydroethidine. Free Radic Biol Med. 46, 905-913 (2009).
- Otera, H., Ishihara, N., Mihara, K. New insights into the function and regulation of mitochondrial fission. Biochim Biophys Acta. 1833, 1256-1268 (2013).
- de Brito, O. M., Scorrano, L. Mitofusin 2 tethers endoplasmic reticulum to mitochondria. Nature. 456, 605-610 (2008).
- Wikstrom, J. D., Twig, G., Shirihai, O. S. What can mitochondrial heterogeneity tell us about mitochondrial dynamics and autophagy. Int J Biochem Cell Biol. 41, 1914-1927 (2009).
- Pickles, S., Destroismaisons, L., Peyrard, S. L., Cadot, S., Rouleau, G. A., Brown, R. H., Julien, J. P., Arbour, N., Vande Velde, C. Mitochondrial damage revealed by immunoselection for ALS-linked misfolded SOD1. Hum Mol Genet. 22, 3947-3959 (2013).
- Frank, S., Gaume, B., Bergmann-Leitner, E. S., Leitner, W. W., Robert, E. G., Catez, F., Smith, C. L., Youle, R. J. The role of dynamin-related protein 1, a mediator of mitochondrial fission, in apoptosis. Dev Cell. 1, 515-525 (2001).
- West, A. P., Brodsky, I. E., Rahner, C., Woo, D. K., Erdjument-Bromage, H., Tempst, P., Walsh, M. C., Choi, Y., Shadel, G. S., Ghosh, S. TLR signalling augments macrophage bactericidal activity through mitochondrial ROS. Nature. 472, 476-480 (2011).
- Abad, M. F., Di Benedetto, G., Magalhães, P. J., Filippin, L., Pozzan, T. Mitochondrial pH monitored by a new engineered green fluorescent protein mutant. J Biol Chem. 279, 11521-11529 (2004).
- Murphy, A. N., Bredesen, D., Cortopassi, G., Wang, E., Fiskum, G. Bcl-2 potentiates the maximal calcium uptake capacity of neural cell mitochondria. Proc Natl Acad Sci U S A. 93, 9893-9898 (1996).
- Tantama, M., Martinez-François, J. R., Mongeon, R., Yellen, G. Imaging energy status in live cells with a fluorescent biosensor of the intracellular ATP-to-ADP ratio. Nat Commun. 4, 2550 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved