Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Immundetektion von Außenmembranproteinen mittels Durchflusszytometrie von isolierten Mitochondrien
In diesem Artikel
Zusammenfassung
Beschrieben wird hier ein Verfahren zur Detektion und Quantifizierung der mitochondrialen Außenmembran-Proteine durch Immunmarkierung von Mitochondrien aus Nagetiergewebe und Analyse durch Durchflusszytometrie Strom isoliert. Diese Methode kann erweitert werden, um funktionale Aspekte der mitochondrialen Subpopulationen zu bewerten.
Zusammenfassung
Methoden zur Erkennung und Überwachung der mitochondrialen Außenmembran Protein-Komponenten in tierischen Geweben sind entscheidend für mitochondriale Physiologie und Pathophysiologie zu studieren. Dieses Protokoll beschreibt eine Technik, bei der Mitochondrien aus Gewebe isoliert werden Nagetier immun und mittels Durchflusszytometrie analysiert. Mitochondrien werden von Nagetieren Rückenmark isoliert und zu einem schnellen Anreicherungsschritt unterzogen, Myelin, eine Hauptverunreinigung der mitochondrialen Fraktionen aus Nervengewebe vorbereitet zu entfernen. Isolierten Mitochondrien werden dann mit einem Antikörper, der Auswahl und einen fluoreszenz konjugierten sekundären Antikörper markiert. Analyse durch Durchflusszytometrie verifiziert die relative Reinheit der mitochondrialen Präparationen durch Anfärben mit einem Farbstoff spezifische mitochondriale, gefolgt von der Detektion und Quantifizierung von immunmarkierten Proteins. Diese Technik ist schnell, quantitativ und mit hohem Durchsatz, so dass für die Analyse von Hunderten von Tausenden von Mitochondrien pro Probe. Sie ist anwendbar auf Roman S. zu bewertenroteins auf mitochondrialer Oberfläche unter normalen physiologischen Bedingungen als auch die Proteine, die während der Pathologie mislocalized dieser Organellen werden kann. Wichtig ist, dass dieses Verfahren auf Fluoreszenzindikatorfarbstoffen gekoppelt werden, um für bestimmte Aktivitäten des mitochondrialen Subpopulationen melden und machbar für Mitochondrien aus dem zentralen Nervensystem (Gehirn und Rückenmark) sowie Leber.
Einleitung
Mitochondrien sind Organellen, die hochdynamische mehrere Runden von Spaltung und Kernfusion unterzogen werden, sind auf Seiten der hohen Energiebedarf transportiert und reagieren schnell auf Reize physiologischen 1. Da es zunehmend in verschiedenen Geweben erkannt, dass die Mitochondrien, auch unterschiedlichen zellulären Kompartimenten, haben unterschiedliche Funktionsprofile, neue Methoden benötigt werden, um diese verschiedenen mitochondrialen Untergruppen zu identifizieren.
Mikroskopie liefert ein Mittel, wodurch einzelne Mitochondrien sichtbar gemacht werden und die Anwesenheit eines Proteins an oder in Mitochondrien kann durch Immunfluoreszenz-2 bestimmt werden. Quantitative Analyse nach diesem Verfahren ist jedoch arbeitsintensiv und eignet sich besser für Experimente mit immortalisierten Zelllinien oder primäre. Das Studium der einzelnen Mitochondrien aus Gewebe abgeleitet ist deutlich schwieriger und die meisten Methoden nicht für eine einfache Identifizierung der mitochondrialen Untergruppen gleichzeitig mit der Evalu ermöglichenation der mitochondrialen Funktion 3.
Um diese Hürde, ein neues Verfahren zu Mitochondrien aus Nagetier Gewebe isoliert und anschließend mittels Durchflusszytometrie analysiert immunolabel Adresse entwickelt. Dies ermöglicht den schnellen Nachweis und die Quantifizierung von Proteinen an der äußeren Mitochondrienmembran, die einer Analyse durch Mikroskopie verglichen lokalisiert ist viel weniger arbeitsintensiv und erlaubt die Analyse von Tausenden von Mitochondrien in einer einzigen Probe. Dieser Test kann angewendet werden, um das Schicksal und die relative Menge der mitochondrialen Außenmembran-Proteine, die Gedanken zu sein konstitutiv an der Mitochondrien zu überwachen, die Rekrutierung von Proteinen an der Oberfläche der Mitochondrien oder die Detektion von Proteinen in die Mitochondrien in pathologischen Bedingungen mislocalized. Außerdem ist die Einarbeitung von herkömmlichen fluoreszierenden Indikatorfarbstoffen erlaubt die gleichzeitige Auswertung von bestimmten Aspekten der mitochondrialen Funktion in verschiedene mitochondrialeSubpopulationen.
Protokoll
Tiere in dieser Studie verwendet wurden in strikter Übereinstimmung mit einem Protokoll (N08001CVsr), die vom Centre de Recherche du Centre Hospitalier de l'Université de Montréal (CRCHUM) Institutionelle Ausschuss für den Schutz der Tiere zugelassen, die nationalen Normen im Sinne der kanadischen skizziert folgt behandelt Rates über Animal Care (CCAC).
Bereiten Sie alle erforderlich, um dieses Protokoll (Tabelle 1) durchführen Reagenzien. Alle anderen Details bezüglich Ausrüstung, Material und Lieferanten können in der Liste der Materialien gefunden werden.
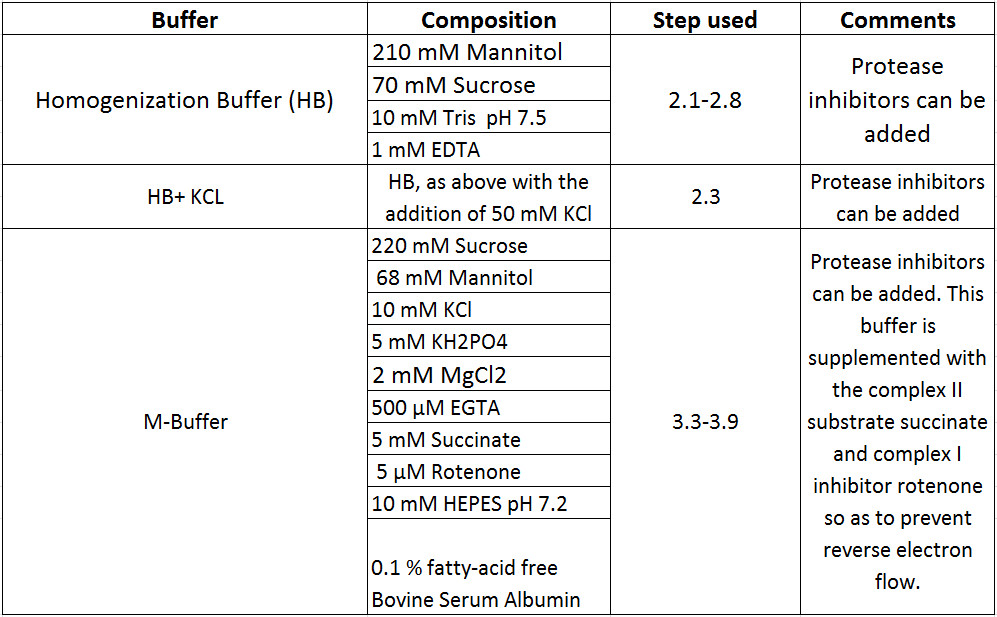
Tabelle 1. Pufferzusammensetzungen.
1. Erhebung von Rattenrückenmark
- Tief betäuben die Ratte (Sprague Dawley) mit 4% isoflorane. Stellen Sie sicher, Betäubung durch einen Mangel an Reflex auf Kneifen von the Vorderpfote. Euthanize die Ratte durch Enthauptung über Guillotine. Diese Methode der Euthanasie wird über andere, die das Rückenmark verzerren könnten bevorzugt.
- Schneiden Sie die Haut am Rücken, die Wirbelsäule freizulegen. Schneiden Sie die Wirbelsäule mit Knochen Schere knapp über dem Beckenknochen. Visualisierung der Öffnung der Wirbelsäule.
- Legen Sie eine 10 ml-Spritze mit einer Pipettenspitze 200 ul (durch Schmelzen leicht über Flamme angebracht), mit phosphatgepufferter Salzlösung (PBS) gefüllt ist, in der Wirbelsäule.
- Ausspülen des Rückenmarks unter Anwendung einer mittleren Menge von Druck auf den Plunger.
- Wenn kein Blut auf das Rückenmark vorhanden ist, mit PBS spülen, bevor Sie zum nächsten Schritt.
Hinweis: Diese Methode ist auch für Gehirn und Leber validiert. Wenn auch diese Gewebe, sammeln die Hälfte des Gehirns von der Ratte getötet und ein Stück Leber gleich im Gewicht des Rückenmarks. Alle anderen Schritte bleiben gleich.
2. Isolierung von Spinal Cord Mitochondria (von Vande Velde et al Angepasst 4.)
- Sammeln Sie die ganze intakte Rückenmark und in 5 ml Glas-Homogenisator mit 5 Volumina (~ 3,25 ml) Homogenisationspuffer (HB). Für eine optimale Erholung der isolierten Mitochondrien, alle Schritte auf Eis oder in kalten Raum. Homogenisieren Gewebe von Hand, bis keine großen Stücke von Gewebe bleiben, etwa acht Schlägen. Platzieren Homogenat in zwei (2 ml) oder drei (1,7 ml)-Mikrozentrifugenröhrchen. Zentrifuge 1.300 × g für 10 min bei 4 ° C in einer Tischmikrozentrifuge.
- Recover Überstand und in eine 5 ml Ultrazentrifugenröhrchen. Fügen Sie 750 ul (~ 0,5 Volumen) HB zum Pellet-haltigen Mikrozentrifugenröhrchen und sanft das Pellet. Wiederholen Sie die Schritte Zentrifugation und Resuspension zwei weitere Male. Pool alle Überstände (S1a und S1b) in der gleichen 5 ml Ultrazentrifugenröhrchen oben. Dieser Schritt dient dazu, kleine Fremdkörper zu entfernen.
- Zentrifuge gebündelt S1 mit einer Ultrazentrifuge mit einem schwingenden Eimer rot ausgestattetoder und Zentrifuge bei 17.000 × g für 15 min bei 4 ° C ist.
- Halten Überstand (S2) für die weitere Verarbeitung, wenn die cytosolische Fraktion von Interesse ist (beispielsweise für Western-Blot-Analyse). Das Pellet (P2), das rohe mitochondriale Fraktion, in 4 ml HB + 50 mM KCl. Zentrifuge 17.000 × g für 15 min bei 4 ° C in einem Schwingbecher-Rotor. Überstand verwerfen und das Pellet vorsichtig (P3) in 800 ul HB.
HINWEIS: Die Mitochondrien sind mit HB + 50 mM KCl gewaschen, um alle nicht-spezifische mitochondrial-assoziierte Verunreinigungen zu entfernen. - In einer neuen 5 ml Ultrazentrifugenröhrchen, fügen Sie genau 800 ul des resuspendierten Pellets (P3).
- Um dieses Rohr hinzuzufügen, 200 ul Iodixanol (Dichtegradienten-Medium), wodurch eine Endkonzentration von 12% Iodixanol schaffen. Mischen Sie den Inhalt des Rohres sanft, aber gründlich über Pipettieren mit einer P1000. Zugabe von Iodixanol zuerst, und dann resuspendiert Pellet (P3) kann bevorzugt sein, um ein gründliches Mischen zu erleichtern. Zentrifuge in einem ULTracentrifuge mit einem Schwingbecher-Rotor ausgestattet war, bei 17.000 × g für 15 min bei 4 ° C ist.
- HINWEIS: Leber nicht Myelin enthalten und daher ist dieser Schritt nicht erforderlich, wenn nur die Leber verarbeitet wird. Allerdings, wenn Leber, die gleichzeitig mit ZNS-Mitochondrien verarbeitet wird, ist es empfehlenswert, alle Gewebe gleich zu behandeln.
- Saugen Sie die Schicht von Myelin an der Spitze des Rohres und sorgfältig zu entfernen und den Überstand verwerfen. Pellet kann locker sein. Das Pellet in 4 ml HB. Zentrifuge wieder bei 17.000 × g für 10 min bei 4 ° C ist. Überstand verwerfen und das Pellet in 4 ml HB. Wiederholen Sie die Zentrifugation und Entfernen des Überstandes.
- Resuspendieren endgültige Pellet (P7) in 100-200 ul HB und in ein 1,7 ml Reaktionsgefäß. Diese Probe enthält isolierte Mitochondrien.
- Fahren Sie mit Proteinquantifizierung. Verdünnte Proben und der Standardkurve in 2% Natriumdodecylsulfat (SDS), um eine ausreichende Solubilisierung der Mitochondrien Duri gewährleistenng Protein-Quantifizierung.
3. Immunmarkierung von isolierten Mitochondrien für die Durchflusszytometrie
- Für jede zu testende Färbung Mix Pipette 25 ug der isolierten Mitochondrien in ein 1,7 ml Mikrozentrifugenröhrchen. Fügen Sie eine ungefärbte Probe in jedem Experiment; und für jeden Antikörper, sicher sein, um eine Probe für die entsprechende Isotyp-Kontrolle umfassen.
- Zentrifuge bei 17.000 × g für 2 min bei 4 ° C in einem Labor-Mikrozentrifuge.
- Überstand entfernen und resuspendieren isolierten Mitochondrien in 50 ul Puffer Mitochondrien (M-Puffer) mit 10% fettsäurefrei BSA ergänzt für 15 min bei 4 ° C (Blockierungsschritt).
HINWEIS: Während der Etikettierung, führen Inkubationen in einem Kühlschrank bei 4 ° C. - Fügen primären Antikörper (Kaninchen-Anti-Mfn2, 20 ug pro ml) Rohr und Inkubation für 30 min bei 4 ° C.
HINWEIS: Bestimmen Sie die optimale Konzentration von jedem Antikörper empirisch durch Titration. Aufgrund der Variabilität der Konzentration und / oder purity, verschiedenen Chargen des gleichen Antikörper vom gleichen Hersteller kann zu unterschiedlichen Ergebnissen führen; Daher Titration wird für jede neue Charge von Antikörper benötigt. - Auswaschen ungebundenen primären Antikörper: Zentrifuge bei 17.000 g für 2 min bei 4 ° C. Entfernen Sie den Überstand und sanft das Pellet in 200 ul M Buffer. Zentrifuge bei 17.000 × g für 2 min bei 4 ° C ist. Überstand entfernen und das Pellet in 50 ul M Buffer.
- Fügen Sekundärantikörper (Esel Anti-Kaninchen-IgG-Phycoerythrin (PE), 0,5 g pro ml) Rohr und Inkubation Proben für 30 min bei 4 ° C, vor Licht geschützt.
- Auswaschen ungebundenen Sekundärantikörper: Zentrifuge bei 17.000 g für 2 min bei 4 ° C. Entfernen Sie den Überstand und das Pellet in 200 ul M Buffer. Zentrifuge bei 17.000 × g für 2 min bei 4 ° C ist. Überstand entfernen und das Pellet in 500 ul M Buffer.
- Um sicherzustellen, dass Ereignisse sind in der Tat Mitochondrien, Flecken isolierten Mitochondrien mit einMitochondrien spezifischen Fluoreszenzfarbstoff für 15 min bei RT, vor Licht geschützt. Wenn Färbung von anderen Funktionsparameter (mitochondrialen Transmembranpotentials oder Superoxid-Produktion) gewünscht wird, gehen Sie zu Schritt 4. Wenn nicht, fahren Sie mit Schritt 5 für den Erwerb.
HINWEIS: Es ist wichtig, um sicherzustellen, dass das Emissionsspektrum des sekundären Antikörpers ist, dass mit der funktionellen Farbstoffe kompatibel. Wenn beispielsweise die Überprüfung der mitochondrialen Reinheit mit einem kommerziellen Farbstoff mit einer spektralen Eigenschaften ähnlich FITC und Transmembranpotential mit Tetramethylrhodamin Methylester (TMRM) würde eine brauchbare sekundäre Antikörper werden Allophycocyanin (APC: Ex 650 nm / Em 660 nm). Hinzufügen Kompensationen steuert, dh eine Probe immun oder mit einem einzigen Fluorophor, falls gefärbt. - Übertragen auf eine für Lade Durchflusszytometer Rohr. (Zur Erleichterung der geringen Stichprobengröße, eine Mikrotiterplatte Rohr innerhalb 3 platziert ml Durchflusszytometer Rohr fließen.) Halten Proben auf Eis und gehen sofort aufDurchflusszytometer für Erwerb.
4. Assaying Mitochondriale Transmembranpotentials und der mitochondrialen Superoxid-Produktion mittels Durchflusszytometrie
- Stellen Sie sicher, dass isolierte Mitochondrien haben eine intakte Transmembranpotential durch Färbung mit 100 nM TMRM (Ex 548 nm / Em 574 nm) 5, in Schritt 3.8, 15 min bei RT, vor Licht geschützt. Zum Vergleich der Transmembranpotential zwischen den Proben und Populationen, die Verwendung von niedrigeren / Nichtlöschkonzentrationen TMRM (1 bis 30 nM), kann es sinn 6 sein.
- Als Kontrolle für TMRM Färbung, Fleck isolierten Mitochondrien mit 100 nM TMRM in Gegenwart von 100 uM Carbonylcyanid m-Chlor Phenylhydrazin (CCCP), einem mitochondrialen Entkoppler, die Mitochondrien depolarisiert wird. Die Konzentration von CCCP erforderlich, um die Mitochondrien depolarisieren kann geringer sein, wenn niedrigere Konzentrationen von Farbstoff verwendet werden.
- Stellen Sie sicher, dass isolierte Mitochondrien produzieren mitochondrialen Superoxid von staining mit einem geeigneten mitochondrialen Superoxid-Indikator 7, auch in Schritt 3.8, 15 min bei RT, vor Licht geschützt.
- Als Kontrolle für mitochondrialen Superoxid-Produktion, Flecken isolierten Mitochondrien mit dem Farbstoff in Gegenwart von 10 uM Antimycin A, einem Inhibitor der Komplex III der mitochondrialen Atmungskette, die Superoxid-Produktion zu erhöhen wird.
5. Aufnahme und Analyse von immun isolierten Mitochondrien durch Durchflusszytometrie
- Instrument geschaffen werden: Schalterspannungen von linear auf Protokollmodus auf die Analyse von isolierten Mitochondrien und stellen Spannungen zu erleichtern (FSC: 450; SSC: 250). Stellen Sie sicher, dass die Ereignisse in FSC-A (Bereich)-Modus als auch FSC-W (Breite) und FSC-H (Höhe) gesammelt, um Dubletten (dh auszuschließen, zwei Ereignisse, die durch den Detektor zur gleichen Zeit ) in der Analyse nach der Datenerhebung. Stellen Sie die Anzahl der Ereignisse, bis zu 100.000 gesammelt werden. Erwerben Entschädigung Kontrollen, Falls zutreffend.
- Datenerfassung: Vor der Datenerfassung, zu vermeiden Vortexen Proben. Stattdessen mischen durch leichtes Antippen Röhre. Zunächst sammeln Ereignisse bei niedrigem Druck, während Gating. Tor an der Gesamtbevölkerung. Einzustellen Spannungen Histogramme entsprechend üblicherweise die Spitze der ungefärbten Probe in die zweite Dekade (10 2) entsprechen. Sobald Gates hergestellt und Proben verarbeitet werden, kann der Druck zu hoch geschaltet werden.
- Analyse: Visualisieren Dubletten durch Auftragen von FSC-W gegenüber FSC. Slips und Dubletten zu identifizieren. Tor auf Slips. Wählen Sie das mitochondriale Bevölkerung durch Gating auf Ereignisse, die positiv mit einer mitochondrialen selektiven Farbstoff angefärbt werden.
- Bestimmung von Hintergrund Kennzeichnung von Isotypenkontrolle. Verwendung der Isotyp-Kontrolle der Proben der Prozentanteil der Bevölkerung mitochondrialen Markierung positiv Mfn2 Antikörper.
Ergebnisse
Mitochondrien aus Rattenrückenmark abgeleitet ist, mit einem Antikörper zu Mitofusin2 (Mfn2), ein Protein in der Fusion der äußeren Membran der Mitochondrien 8 gebracht gezielt immun werden. Nach der Isolierung und Markierung mit einem Mfn2 spezifischen Antikörpers und eines fluoreszenz konjugierten sekundären Antikörper, Mitochondrien durch Durchflusszytometrie (Figur 1) verarbeitet. Nach der Datenerfassung werden die Proben mittels Durchflusszytometrie-Analyse-Software, indem Sie zue...
Diskussion
Es wird immer offensichtlicher, dass die Mitochondrien spielen eine Schlüsselrolle sowohl in der normalen Physiologie und Krankheit. Während Immunoblotting kann feststellen, welche Proteine in Mitochondrien oder an der Oberfläche der Mitochondrien in einem bestimmten Zustand zu finden sind, diese Methode berichtet über dem Durchschnitt der Gesamtbevölkerung. Diese Methode kann nicht liefern Informationen zu relativen Häufigkeiten der mitochondrialen Subpopulationen oder Teilmengen. Während es zuvor angenomm...
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Wir danken Laurie Destroismaisons und Sarah Peyrard für hervorragende technische Unterstützung und Dr.Alexandre Prat für den Zugang zum Durchflusszytometer. Wir möchten auch Dr. Timothy Miller für seinen Beitrag anerkennen, in Bezug auf die Entfernung von Myelin von den Vorbereitungen. Diese Arbeit wurde von der kanadischen Institutes of Health Research (CIHR) Neuromuskuläre Forschung Partnerschaft, kanadischen Stiftung für Innovation, ALS Society of Canada, der Frick-Stiftung für ALS-Forschung, CHUM Stiftung und Fonds de la Recherche en Santé du Québec (CVV) unterstützt. Sowohl CVV und NA sind Forschung Gelehrten des Fonds de la Recherche en Santé du Québec und New CIHR Ermittler. SP wird von der Tim Noël Studentship von der ALS-Gesellschaft von Kanada unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Rats | Charles River | Strain code 400 | Adult (9 weeks to 18 weeks) male or female rats can be used for the isolation protocol. Weight of rats is dependent on gender and age (males between 300 to 500 g and females between 200 to 350 g) are typically used. |
| Dounce homogenizer | Kontes Glass Co. | 885450-0022 | Duall 22 |
| Microcentrifuge | Thermo Scientific | Sorvall Legend Micro 17 R | |
| Ultra-Clear Ultracentrifuge tubes | Beckman Coulter | 344057 | Transparent, thin walled |
| Sorvall Ultracentrifuge | Thermo Scientific | Sorvall WX UltraSeries | |
| AH-650 rotor and buckets | Thermo Scientific | ||
| Opti-prep | Axis-Shield | 1114542 | Iodixanol, density gradient medium |
| Fatty acid free Bovine Serum Albumin | Sigma | A8806 | Must be fatty acid free for mitochondria |
| Sodium succinate dibasic hexahydrate | Sigma | S9637 | |
| Rabbit anti-Mitofusin2 antibody | Sigma | M6319 | |
| Rabbit IgG | Jackson Immuno Research | 011-000-003 | |
| Anti-Rabbit IgG PE | eBioscience | 12-4739-81 | |
| Micro titer tube | Bio-Rad | 223-9391 | For sample acquisition by flow cytometry |
| MitoTrackerGreen (MTG) | Invitrogen | M7514 | 100 nM: Ex 490 nm/Em 516 nm |
| TMRM | Invitrogen | T668 | 100 nM: Ex 548 nm/Em 574 nm |
| CCCP | Sigma | C2759 | |
| MitoSOX Red | Invitrogen | M36008 | 5 µM: Ex 540 nm/Em 600 nm |
| Antimycin A | Sigma | A8874 | |
| LSR II flow cytometer | BD | ||
| BD FACSDiva Software | BD | ||
| FlowJo | TreeStar Inc. | Software used for analysis | |
| BCA protein assay kit | Pierce/Thermo Scientific | 23225 | Bradford assay is not recomended as it is not compatible with high concentrations of SDS |
Referenzen
- Itoh, K., Nakamura, K., Iijima, M., Sesaki, H. Mitochondrial dynamics in neurodegeneration. Trends Cell Biol. 23, 64-71 (2013).
- Narendra, D., Tanaka, A., Suen, D. F., Youle, R. J. Parkin is recruited selectively to impaired mitochondria and promotes their autophagy. J Cell Biol. 183, 795-803 (2008).
- Zorov, D. B., Kobrinsky, E., Juhaszova, M., Sollott, S. J. Examining intracellular organelle function using fluorescent probes: from animalcules to quantum dots. Circ Res. 95, 239-252 (2004).
- Vande Velde, C., Miller, T., Cashman, N. R., Cleveland, D. W. Selective association of misfolded ALS-linked mutant SOD1 with the cytoplasmic face of mitochondria. Proc Natl Acad Sci U S A. 105, 4022-4027 (2008).
- Loew, L. M., Tuft, R. A., Carrington, W., Fay, F. S. Imaging in five dimensions: time-dependent membrane potentials in individual mitochondria. Biophys J. 65, 2396-2407 (1993).
- Perry, S. W., Norman, J. P., Barbieri, J., Brown, E. B., Gelbard, H. A. Mitochondrial membrane potential probes and the proton gradient: a practical usage guide. Biotechniques. 50, 98-115 (2011).
- Xu, X., Arriaga, E. A. Qualitative determination of superoxide release at both sides of the mitochondrial inner membrane by capillary electrophoretic analysis of the oxidation products of triphenylphosphonium hydroethidine. Free Radic Biol Med. 46, 905-913 (2009).
- Otera, H., Ishihara, N., Mihara, K. New insights into the function and regulation of mitochondrial fission. Biochim Biophys Acta. 1833, 1256-1268 (2013).
- de Brito, O. M., Scorrano, L. Mitofusin 2 tethers endoplasmic reticulum to mitochondria. Nature. 456, 605-610 (2008).
- Wikstrom, J. D., Twig, G., Shirihai, O. S. What can mitochondrial heterogeneity tell us about mitochondrial dynamics and autophagy. Int J Biochem Cell Biol. 41, 1914-1927 (2009).
- Pickles, S., Destroismaisons, L., Peyrard, S. L., Cadot, S., Rouleau, G. A., Brown, R. H., Julien, J. P., Arbour, N., Vande Velde, C. Mitochondrial damage revealed by immunoselection for ALS-linked misfolded SOD1. Hum Mol Genet. 22, 3947-3959 (2013).
- Frank, S., Gaume, B., Bergmann-Leitner, E. S., Leitner, W. W., Robert, E. G., Catez, F., Smith, C. L., Youle, R. J. The role of dynamin-related protein 1, a mediator of mitochondrial fission, in apoptosis. Dev Cell. 1, 515-525 (2001).
- West, A. P., Brodsky, I. E., Rahner, C., Woo, D. K., Erdjument-Bromage, H., Tempst, P., Walsh, M. C., Choi, Y., Shadel, G. S., Ghosh, S. TLR signalling augments macrophage bactericidal activity through mitochondrial ROS. Nature. 472, 476-480 (2011).
- Abad, M. F., Di Benedetto, G., Magalhães, P. J., Filippin, L., Pozzan, T. Mitochondrial pH monitored by a new engineered green fluorescent protein mutant. J Biol Chem. 279, 11521-11529 (2004).
- Murphy, A. N., Bredesen, D., Cortopassi, G., Wang, E., Fiskum, G. Bcl-2 potentiates the maximal calcium uptake capacity of neural cell mitochondria. Proc Natl Acad Sci U S A. 93, 9893-9898 (1996).
- Tantama, M., Martinez-François, J. R., Mongeon, R., Yellen, G. Imaging energy status in live cells with a fluorescent biosensor of the intracellular ATP-to-ADP ratio. Nat Commun. 4, 2550 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten