É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Imunodetecção de membrana externa proteínas por citometria de fluxo de mitocôndrias isoladas
Neste Artigo
Resumo
Aqui descrito é um método para detectar e quantificar as proteínas da membrana exterior mitocondrial por imunomarcação das mitocôndrias isoladas a partir de tecidos de roedores e de análise por citometria de fluxo. Este método pode ser estendido para avaliar os aspectos funcionais de subpopulações mitocondriais.
Resumo
Métodos para detectar e monitorar os componentes proteína da membrana externa mitocondrial nos tecidos animais são vitais para estudar a fisiologia mitocondrial e fisiopatologia. Este protocolo descreve uma técnica em que as mitocôndrias isoladas de tecidos de roedores são immunolabeled e analisadas por citometria de fluxo. As mitocôndrias são isoladas a partir de medulas espinhais de roedores e submetido a um passo de enriquecimento rápido, de modo a remover a mielina, um contaminante de fracções mitocondriais preparadas a partir de tecido nervoso. Mitocôndrias isoladas são então marcadas com um anticorpo de escolha e um anticorpo secundário conjugado com fluorescência. Análise por citometria de fluxo, verifica a pureza relativa das preparações mitocondriais por coloração com um corante específico mitocondrial, seguido por detecção e quantificação de proteínas immunolabeled. Esta técnica é rápida, quantificável e de elevado rendimento, que permite a análise de centenas de milhares de mitocôndrias por amostra. É aplicável para avaliar novela proteins na superfície mitocondrial sob condições fisiológicas normais, bem como as proteínas que se podem tornar mislocalized para este organelo durante a patologia. Importante, este método pode ser acoplado a corantes indicadores fluorescentes para informar sobre certas actividades das subpopulações mitocondriais e é possível para as mitocôndrias do sistema nervoso central (cérebro e medula espinal), bem como o fígado.
Introdução
As mitocôndrias são organelas altamente dinâmicos que passam por vários ciclos de fissão e fusão, são transportados para locais de alta demanda energética e responder rapidamente a estímulos fisiológicos 1. Uma vez que é cada vez mais reconhecido que as mitocôndrias dentro de tecidos diferentes, mesmo diferentes compartimentos celulares, têm perfis funcionais distintos, são necessários novos métodos para identificar esses subconjuntos mitocondriais distintas.
Microscopia fornece um meio pelo qual as mitocôndrias individuais pode ser visualizada e a presença de uma proteína com ou em mitocôndrias pode ser determinada por imunofluorescência 2. No entanto, a análise quantitativa por este método é de trabalho intensivo e é mais adequado para as experiências utilizando linhas de células imortalizadas ou primárias. O estudo das mitocôndrias indivíduo derivado de tecido é significativamente mais difícil, e a maioria dos métodos de não permitir a fácil identificação de subconjuntos mitocondriais concorrentemente com a avação da função mitocondrial 3.
A fim de resolver este obstáculo, um novo método para immunolabel mitocôndrias isoladas a partir de tecidos de roedores e, subsequentemente, analisadas por citometria de fluxo foi desenvolvido. Isto permite a rápida detecção e quantificação de proteínas localizadas na membrana mitocondrial externa, o que em comparação com a análise por microscopia, é muito menos trabalho intensivo e permite a análise de milhares de mitocôndrias em uma única amostra. Este ensaio pode ser aplicado para monitorizar o destino e a quantidade relativa de proteínas de membrana exterior mitocondrial que se pensa estar constitutivamente presente na mitocôndria, o recrutamento de proteínas à superfície mitocondrial, ou a detecção de proteínas mislocalized para a mitocôndria em condições patológicas. Além disso, a incorporação de corantes indicadores fluorescentes convencionais permite a avaliação simultânea de certos aspectos da função mitocondrial em mitocondrial distintasubpopulações.
Protocolo
Os animais utilizados neste estudo foram tratados em estrita conformidade com um protocolo (N08001CVsr), aprovado pelo du Centre Hospitalier de l'Université de Montréal (CRCHUM) Comitê Institucional Centre de Recherche para a Protecção dos Animais, que segue padrões nacionais indicados pela Canadian Conselho on Animal Care (CCAC).
Prepare todos os reagentes necessários para realizar esse protocolo (Tabela 1). Todos os outros detalhes sobre equipamentos, suprimentos e fornecedores podem ser encontrados na lista de materiais.
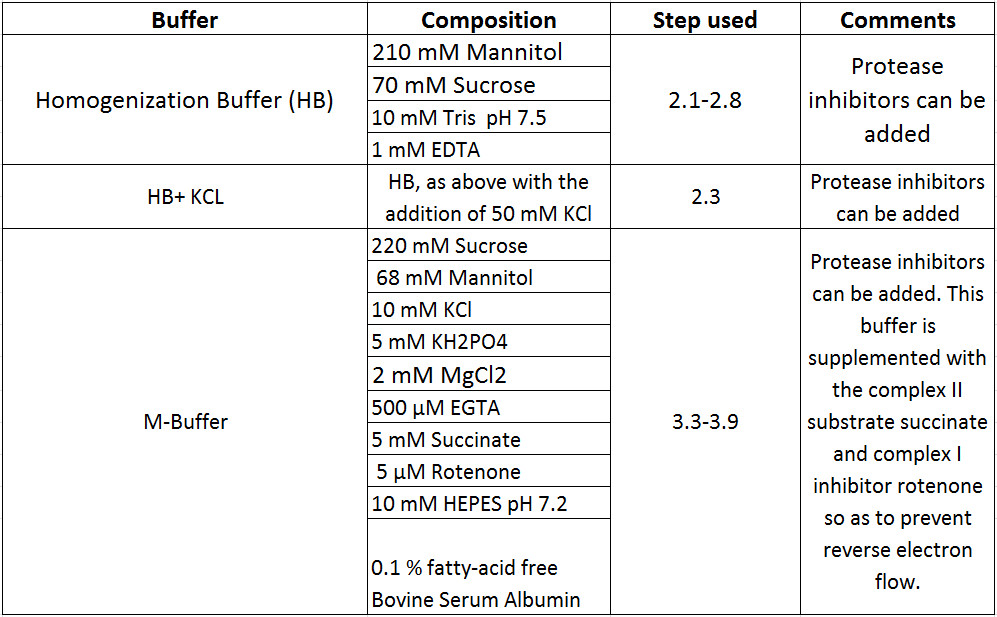
Tabela 1 Composições de buffer.
1 Coleção de Rat Medula Espinhal
- Profundamente anestesiar o rato (Sprague Dawley) com 4% isoflorane. Verifique anaesthetization pela falta de reflexo sobre beliscar of the pata dianteira. Eutanásia do rato por decapitação com uma guilhotina. Este método é o preferido da eutanásia sobre os outros, o que poderia distorcer a medula espinhal.
- Cortar a pele do para trás para expor a coluna vertebral. Corte a coluna vertebral com tesoura osso logo acima do osso pélvico. Visualize a abertura da coluna vertebral.
- Inserir uma seringa de 10 ml, com uma ponta de pipeta de 200 uL (ligado através de fusão ligeiramente mais de chama), cheio com salina tamponada com fosfato (PBS), para a coluna vertebral.
- Lave a espinal medula por meio da aplicação de uma quantidade de pressão para o êmbolo.
- Se houver sangue na medula espinhal, lavar com PBS, antes de prosseguir para o próximo passo.
NOTA: Este método também foi validado para o cérebro e fígado. Se estes tecidos incluindo, recolher metade do cérebro do rato sacrificados e um pedaço de fígado, em igual peso para a medula espinhal. Todas as outras medidas idênticas.
2 Isolamento de Medula Espinhal Mitochondria (Adaptado de Vande Velde et al. 4)
- Recolhe toda a medula espinhal e lugar intacto em 5 ml homogeneizador de vidro com 5 volumes (~ 3,25 mL) Tampão de homogeneização (HB). Para a recuperação ideal de mitocôndrias isoladas, realizar todas as etapas no gelo ou em câmara fria. Homogeneizar o tecido com a mão até que não haja grandes pedaços de tecido permanecem, cerca de oito cursos. Coloque homogeneizado em duas (2 ml) ou três (1,7 ml) tubos de microcentrífuga. Centrífuga 1300 xg durante 10 min a 4 ° C numa microcentrífuga de bancada.
- Recuperar sobrenadante e colocar em um tubo de ultracentrífuga 5 ml. Adicionar 750 mL (~ 0,5 volumes) HB ao tubo de microcentrífuga contendo sedimento e ressuspender cuidadosamente o sedimento. Repita os passos de centrifugação e ressuspensão mais duas vezes. Piscina todos os sobrenadantes (S1a e s1b) para o mesmo tubo de 5 mL ultracentrífuga acima. Este passo serve para remover pequenos fragmentos.
- Centrífuga reunidas S1 usando uma ultracentrífuga equipado com uma podridão balde oscilanteou e centrifugar a 17000 xg durante 15 min a 4 ° C.
- Manter o sobrenadante (S2) para posterior processamento, se a fracção citosólica é de interesse (por exemplo, por análise de Western blot). Ressuspender o sedimento (P2), a fracção mitocondrial em bruto, em 4 ml de HB + 50 mM de KCl. Centrífuga 17.000 xg durante 15 min a 4 ° C num rotor de balde oscilante. Descartar o sobrenadante e ressuspender o pellet gentilmente (P3) em 800 mL HB.
NOTA: As mitocôndrias são lavadas com KCl HB + 50 mM para remover quaisquer contaminantes mitocôndrias-associados não-específicos. - Em um novo tubo de 5 ml de ultracentrífuga, adicionar exactamente 800 ul do sedimento ressuspenso (P3).
- A este tubo adicionar, 200 ul de iodixanol (meio de gradiente de densidade), criando deste modo uma concentração final de 12% de iodixanol. Misture o conteúdo do tubo com cuidado, mas completamente via pipeta com um P1000. A adição de iodixanol primeiro, e em seguida sedimento ressuspenso (P3) pode ser preferível para facilitar a mistura completa. Centrifugar em um ultracentrifuge equipado com um rotor basculante a 17.000 xg durante 15 min a 4 ° C.
- NOTA: O fígado não contêm mielina e, portanto, este passo não é necessário se somente o fígado está sendo processado. No entanto, se o fígado está a ser processado em simultâneo com a mitocôndria do SNC, é recomendado para o tratamento de todos os tecidos de forma igual.
- Aspirar a camada de mielina na parte superior do tubo e cuidadosamente remover e descartar o sobrenadante. Pellet pode estar solto. Ressuspender o sedimento em 4 ml de HB. Centrifugar novamente a 17000 xg durante 10 min a 4 ° C. Descartar o sobrenadante e ressuspender o sedimento em 4 ml HB. Voltar a centrifugar e remover o sobrenadante.
- Ressuspender o sedimento final (P7) em 100-200 ul HB e transferir para um tubo de microcentrífuga de 1,7 ml. Este exemplo contém mitocôndrias isoladas.
- Vá para a quantificação de proteínas. Diluir as amostras da curva padrão e em 2% de dodecilsulfato de sódio (SDS) para assegurar a solubilização adequada das mitocôndrias during quantificação da proteína.
3. imunomarcação de mitocôndrias isoladas de Citometria de Fluxo
- Para cada mistura de coloração para ser testado, pipeta 25 ug de mitocôndrias isoladas para um tubo de microcentrífuga de 1,7 ml. Incluir uma amostra unstained em cada experimento; e para cada anticorpo, não se esqueça de incluir uma amostra para o controlo apropriado do isotipo.
- Centrifuga-se a 17000 xg durante 2 min a 4 ° C numa microcentrífuga de bancada.
- Remover o sobrenadante e ressuspender mitocôndrias isoladas em 50 uL Tampão de mitocôndrias (M Tampão) suplementado com 10% de ácido gordo livre de BSA durante 15 min a 4 ° C (passo de bloqueio).
NOTA: Durante a rotulagem, realizar incubações em uma geladeira a 4 ° C. - Adicionar o anticorpo primário (anti-coelho MFN2, 20 ug por ml) para o tubo e incubar durante 30 min a 4 ° C.
NOTA: Determinar a concentração ideal de cada anticorpo empiricamente por titulação. Devido à variabilidade da concentração e / ou purity, diferentes lotes do mesmo anticorpo do mesmo fabricante pode levar a resultados diferentes; Por conseguinte, a titulação é necessária para cada novo lote de anticorpo. - Lavar o anticorpo primário não ligado: Centrifugar a 17.000 xg durante 2 min a 4 ° C. Remover o sobrenadante e ressuspender cuidadosamente o sedimento em 200 ul M Tampão. Centrifuga-se a 17000 xg durante 2 min a 4 ° C. Remover o sobrenadante e ressuspender o sedimento em 50 mL M Tampão.
- Adicionar anticorpo secundário (de burro anti-IgG de coelho de ficoeritrina (PE), 0,5 mg por ml) para o tubo e incubar as amostras durante 30 min a 4 ° C, protegidos da luz.
- Lavar o anticorpo secundário não ligado: Centrifugar a 17.000 xg durante 2 min a 4 ° C. Remover o sobrenadante e ressuspender o sedimento em 200 ul M Tampão. Centrifuga-se a 17000 xg durante 2 min a 4 ° C. Remover o sobrenadante e ressuspender o sedimento em 500 ul M Tampão.
- Para garantir os eventos são de fato mitocôndria, mancha mitocôndrias isoladas com umacorante fluorescente específico para mitocôndrias 15 min à temperatura ambiente, protegida da luz. Se a coloração de outros parâmetros funcionais (potencial transmembrana mitocondrial ou a produção de superóxido) é desejada, vá para a etapa 4 Se não, vá para a etapa 5 para aquisição.
NOTA: É importante verificar que o espectro de emissão do anticorpo secundário é compatível com aquela dos corantes funcionais. Por exemplo, se a verificação de pureza mitocondrial com um corante comercial com propriedades espectrais semelhantes à potencial transmembrana com FITC e éster metílico de tetrametilrodamina (TMRM), um anticorpo secundário seria viável aloficocianina (APC: Ex 650 nm / Em 660 nm). Adicionar controlos compensações, por exemplo, uma amostra immunolabeled ou coradas com uma única fluoroforo, quando aplicável. - Transferir para um tubo de fluxo adequado para o carregamento citómetro. (Para facilitar o pequeno tamanho da amostra, um tubo de microtitulação é colocado dentro de 3 ml citômetro de fluxo tubo.) Manter as amostras em gelo e proceder imediatamente àcitometria de fluxo para a aquisição.
4. Assaying mitocondrial potencial transmembrana mitocondrial e Superoxide Produção por citometria de fluxo
- Verificar que as mitocôndrias isoladas têm um potencial transmembrana intacta por coloração com 100 nM TMRM (Ex 548 nm / Em 574 nm) 5, no passo 3.8, durante 15 min à temperatura ambiente, protegida da luz. Para comparação do potencial transmembranar entre as amostras e as populações, a utilização de concentrações inferior / não-extinção de TMRM (1 a 30 nM), pode ser mais adequado 6.
- Como controlo para a coloração TMRM, mancha mitocôndrias isoladas com 100 nM TMRM na presença de 100 ^ M de cianeto de carbonilo m-cloro-fenil hidrazina (CCCP), um desacoplador mitocondrial que despolarizará mitocôndrias. A concentração de CCCP necessária para despolarizar a mitocôndria pode ser menor se as concentrações mais baixas de corante são utilizados.
- Verifique se mitocôndrias isoladas produzir superóxido mitocondrial por Sãoaining com um indicador de superóxido mitocondrial 7 apropriado, também na etapa 3.8, durante 15 min à temperatura ambiente, protegida da luz.
- Como um controlo para a produção de superóxido mitocondrial, mancha mitocôndrias isoladas com o corante na presença de 10 uM antimicina A, um inibidor do complexo III da cadeia respiratória, que irá aumentar a produção de superóxido mitocondrial.
5. Aquisição e Análise de immunolabeled mitocôndrias isoladas por citometria de fluxo
- Instrumento criado: tensões mudar de linear para o modo de log para facilitar a análise das mitocôndrias isoladas e definidas tensões (FSC: 450; SSC: 250). Certifique-se de que os eventos são recolhidos em modo de FSC-A (área) bem como FSC-W (largura) e FSC-H (altura), para ser capaz de excluir dupletos (isto é, dois eventos, que passam pelo detector, ao mesmo tempo ) na análise de recolha de pós-dados. Defina o número de eventos a serem coletados para 100.000. Adquirir controles de compensação, Se aplicável.
- Aquisição de dados: Antes de aquisição de dados, evitar vórtex amostras. Em vez disso, misture batendo suavemente tubo. Inicialmente coletar eventos a uma pressão baixa, durante gating. Portão em população total. Ajustar tensões de histogramas em conformidade, normalmente o pico da amostra não corada irá corresponder à segunda década (10 2). Uma vez que portas estão estabelecidas, e as amostras estão sendo processados, a pressão pode ser ligado à alta.
- Análise: Visualize doublets traçando FSC-W contra FSC. Identificar singlets e doublet. Portão em singlets. Selecione a população mitocondrial pela passagem em eventos que são marcadas positivamente com um corante mitocondrial seletivo.
- Determine rotulagem fundo do controle isotipo. Utilizando o exemplo de controlo de isotipo, determinar a percentagem da população rotulagem mitocondrial positivo para anticorpo MFN2.
Resultados
As mitocôndrias derivadas de medulas espinais de rato pode ser immunolabeled com um anticorpo direcionado para Mitofusin2 (MFN2), uma proteína implicada na fusão da membrana externa da mitocôndria 8. A seguir ao isolamento e marcação com um anticorpo específico MFN2 e um anticorpo secundário conjugado com fluorescência, as mitocôndrias são processadas por citometria de fluxo (Figura 1). Após a aquisição de dados, as amostras são analisadas utilizando o software de análise de c...
Discussão
É cada vez mais evidente que as mitocôndrias são jogadores-chave na fisiologia normal e na doença. Enquanto imunotransferência pode determinar quais as proteínas são encontradas dentro da mitocôndria ou na superfície mitocondrial em uma determinada condição, este método relatórios sobre a média da totalidade da população. Este método não pode dar informações sobre abundância relativa de subpopulações mitocondriais ou subconjuntos. Embora tenha sido previamente assumido que todas as mitocôndrias s...
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Agradecemos Laurie Destroismaisons e Sarah Peyrard para excelente suporte técnico e Dr.Alexandre Prat para o acesso ao citômetro de fluxo. Gostaríamos também de agradecer o Dr. Timothy Miller, por sua contribuição em relação à remoção da mielina dos preparativos. Este trabalho foi financiado pelos Institutos Canadenses de Pesquisa (CIHR) Neuromuscular Parceria de Pesquisa em Saúde, Fundação Canadense para Inovação, Sociedade ALS do Canadá, a Fundação para a Pesquisa Frick ALS, Fundação CHUM e Fonds de la Recherche en Santé du Québec (CVV). Ambos CVV e NA são estudiosos de Pesquisa do Fonds de la Recherche en Santé du Québec e CIHR novos pesquisadores. SP é apoiado pela Tim Noël Studentship da Sociedade ALS do Canadá.
Materiais
| Name | Company | Catalog Number | Comments |
| Rats | Charles River | Strain code 400 | Adult (9 weeks to 18 weeks) male or female rats can be used for the isolation protocol. Weight of rats is dependent on gender and age (males between 300 to 500 g and females between 200 to 350 g) are typically used. |
| Dounce homogenizer | Kontes Glass Co. | 885450-0022 | Duall 22 |
| Microcentrifuge | Thermo Scientific | Sorvall Legend Micro 17 R | |
| Ultra-Clear Ultracentrifuge tubes | Beckman Coulter | 344057 | Transparent, thin walled |
| Sorvall Ultracentrifuge | Thermo Scientific | Sorvall WX UltraSeries | |
| AH-650 rotor and buckets | Thermo Scientific | ||
| Opti-prep | Axis-Shield | 1114542 | Iodixanol, density gradient medium |
| Fatty acid free Bovine Serum Albumin | Sigma | A8806 | Must be fatty acid free for mitochondria |
| Sodium succinate dibasic hexahydrate | Sigma | S9637 | |
| Rabbit anti-Mitofusin2 antibody | Sigma | M6319 | |
| Rabbit IgG | Jackson Immuno Research | 011-000-003 | |
| Anti-Rabbit IgG PE | eBioscience | 12-4739-81 | |
| Micro titer tube | Bio-Rad | 223-9391 | For sample acquisition by flow cytometry |
| MitoTrackerGreen (MTG) | Invitrogen | M7514 | 100 nM: Ex 490 nm/Em 516 nm |
| TMRM | Invitrogen | T668 | 100 nM: Ex 548 nm/Em 574 nm |
| CCCP | Sigma | C2759 | |
| MitoSOX Red | Invitrogen | M36008 | 5 µM: Ex 540 nm/Em 600 nm |
| Antimycin A | Sigma | A8874 | |
| LSR II flow cytometer | BD | ||
| BD FACSDiva Software | BD | ||
| FlowJo | TreeStar Inc. | Software used for analysis | |
| BCA protein assay kit | Pierce/Thermo Scientific | 23225 | Bradford assay is not recomended as it is not compatible with high concentrations of SDS |
Referências
- Itoh, K., Nakamura, K., Iijima, M., Sesaki, H. Mitochondrial dynamics in neurodegeneration. Trends Cell Biol. 23, 64-71 (2013).
- Narendra, D., Tanaka, A., Suen, D. F., Youle, R. J. Parkin is recruited selectively to impaired mitochondria and promotes their autophagy. J Cell Biol. 183, 795-803 (2008).
- Zorov, D. B., Kobrinsky, E., Juhaszova, M., Sollott, S. J. Examining intracellular organelle function using fluorescent probes: from animalcules to quantum dots. Circ Res. 95, 239-252 (2004).
- Vande Velde, C., Miller, T., Cashman, N. R., Cleveland, D. W. Selective association of misfolded ALS-linked mutant SOD1 with the cytoplasmic face of mitochondria. Proc Natl Acad Sci U S A. 105, 4022-4027 (2008).
- Loew, L. M., Tuft, R. A., Carrington, W., Fay, F. S. Imaging in five dimensions: time-dependent membrane potentials in individual mitochondria. Biophys J. 65, 2396-2407 (1993).
- Perry, S. W., Norman, J. P., Barbieri, J., Brown, E. B., Gelbard, H. A. Mitochondrial membrane potential probes and the proton gradient: a practical usage guide. Biotechniques. 50, 98-115 (2011).
- Xu, X., Arriaga, E. A. Qualitative determination of superoxide release at both sides of the mitochondrial inner membrane by capillary electrophoretic analysis of the oxidation products of triphenylphosphonium hydroethidine. Free Radic Biol Med. 46, 905-913 (2009).
- Otera, H., Ishihara, N., Mihara, K. New insights into the function and regulation of mitochondrial fission. Biochim Biophys Acta. 1833, 1256-1268 (2013).
- de Brito, O. M., Scorrano, L. Mitofusin 2 tethers endoplasmic reticulum to mitochondria. Nature. 456, 605-610 (2008).
- Wikstrom, J. D., Twig, G., Shirihai, O. S. What can mitochondrial heterogeneity tell us about mitochondrial dynamics and autophagy. Int J Biochem Cell Biol. 41, 1914-1927 (2009).
- Pickles, S., Destroismaisons, L., Peyrard, S. L., Cadot, S., Rouleau, G. A., Brown, R. H., Julien, J. P., Arbour, N., Vande Velde, C. Mitochondrial damage revealed by immunoselection for ALS-linked misfolded SOD1. Hum Mol Genet. 22, 3947-3959 (2013).
- Frank, S., Gaume, B., Bergmann-Leitner, E. S., Leitner, W. W., Robert, E. G., Catez, F., Smith, C. L., Youle, R. J. The role of dynamin-related protein 1, a mediator of mitochondrial fission, in apoptosis. Dev Cell. 1, 515-525 (2001).
- West, A. P., Brodsky, I. E., Rahner, C., Woo, D. K., Erdjument-Bromage, H., Tempst, P., Walsh, M. C., Choi, Y., Shadel, G. S., Ghosh, S. TLR signalling augments macrophage bactericidal activity through mitochondrial ROS. Nature. 472, 476-480 (2011).
- Abad, M. F., Di Benedetto, G., Magalhães, P. J., Filippin, L., Pozzan, T. Mitochondrial pH monitored by a new engineered green fluorescent protein mutant. J Biol Chem. 279, 11521-11529 (2004).
- Murphy, A. N., Bredesen, D., Cortopassi, G., Wang, E., Fiskum, G. Bcl-2 potentiates the maximal calcium uptake capacity of neural cell mitochondria. Proc Natl Acad Sci U S A. 93, 9893-9898 (1996).
- Tantama, M., Martinez-François, J. R., Mongeon, R., Yellen, G. Imaging energy status in live cells with a fluorescent biosensor of the intracellular ATP-to-ADP ratio. Nat Commun. 4, 2550 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados