Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Иммунологический из белков наружной мембраны с помощью проточной цитометрии из изолированных митохондрий
В этой статье
Резюме
Описанный здесь метод для обнаружения и количественной оценки митохондриальных белков наружной мембраны путем иммунного митохондрий, выделенных из ткани грызунов и анализа с помощью проточной цитометрии. Этот метод может быть расширен, чтобы оценить функциональные аспекты митохондриальных субпопуляций.
Аннотация
Методы для обнаружения и мониторинга митохондриальные внешние компоненты мембранного белка в животных тканях являются жизненно важными для изучения митохондриальной физиологии и патофизиологии. Этот протокол описывает способ, где митохондрии, выделенные из ткани грызунов immunolabeled и анализировали с помощью проточной цитометрии. Митохондрии изолированы от грызунов спинного мозга и подвергали быстрому обогащению этапе с тем, чтобы удалить миелина, важную примеси митохондриальных фракций, полученных из нервной ткани. Изолированные митохондрии затем метили антителом выбора и флуоресцентно конъюгированного второго антитела. Анализ с помощью проточной цитометрии проверяет относительную чистоту митохондриальных препаратов путем окрашивания с митохондриальной специфической краски, а затем обнаружения и количественного определения immunolabeled белка. Эта техника является быстрое, количественной оценке и высокой пропускной, позволяя для анализа сотен тысяч митохондрий на образец. Он применим для оценки нового рroteins в митохондриальной поверхности при нормальных физиологических условиях, а также белки, которые могут стать mislocalized к этому органеллы во патологии. Важно отметить, что этот метод может быть соединен с флуоресцентными красителями индикаторов сообщить о некоторых видах деятельности митохондриальных групп населения и является допустимым для митохондрий из центральной нервной системы (головного и спинного мозга), а также печени.
Введение
Митохондрии являются высокая динамика органеллы, которые подвергаются несколько раундов деления и синтеза, транспортируются к местам высокой потребности в энергии и быстро реагировать на физиологические стимулы 1. Так как это все чаще признается, что митохондрии в различных тканях, даже различные сотовой отсеков, имеют различные функциональные профили, новые методы необходимы для выявления этих различных митохондриальных подмножества.
Микроскопии обеспечивает средства, посредством которых отдельные митохондрии могут быть визуализированы и присутствие белка в митохондрии или в можно определить с помощью иммунофлюоресценции 2. Тем не менее, количественный анализ с помощью этого метода является трудоемким и больше подходит для экспериментов с использованием иммортализованные или первичные клеточные линии. Изучение индивидуального митохондрий, полученной из ткани значительно труднее, и большинство методы не позволяют легко идентифицировать митохондриальных подмножеств одновременно с evaluвания митохондриальной функции 3.
Для решения этого препятствия, новый метод immunolabel митохондрии, выделенные из грызунов тканей и затем анализируют с помощью проточной цитометрии была разработана. Это позволяет для быстрого обнаружения и определения количества белков, локализованных в митохондриальной наружной мембраны, который по сравнению с анализом микроскопией, гораздо менее трудоемким и позволяет анализ тысяч митохондрий в одном образце. Этот анализ может быть применен для контроля за судьбу и относительное количество митохондриальных белков наружной мембраны, что, как считается, конститутивно присутствует в митохондриях, набор белков в митохондриальной поверхности, или обнаружение белков mislocalized в митохондрии в патологических условиях. Кроме того, включение обычных флуоресцентных красителей показатель позволяет одновременно оценку некоторых аспектов функции митохондрий в разных митохондриальныхсубпопуляции.
протокол
Животные, используемые в этом исследовании были рассмотрены в строгом соответствии с протоколом (N08001CVsr), утвержденного Центр по исследованиям дю Клинический центр де l'Университета Монреаля (CRCHUM) Институциональная Комитета по защите животных, по которым следует национальные стандарты, изложенные в канадской Совет по уходу за животными (CCAC).
Подготовить все реагенты, необходимые для выполнения этого протокола (Таблица 1). Все остальные подробности, касающиеся оборудования, принадлежностей и поставщиков можно найти в Список материалов.
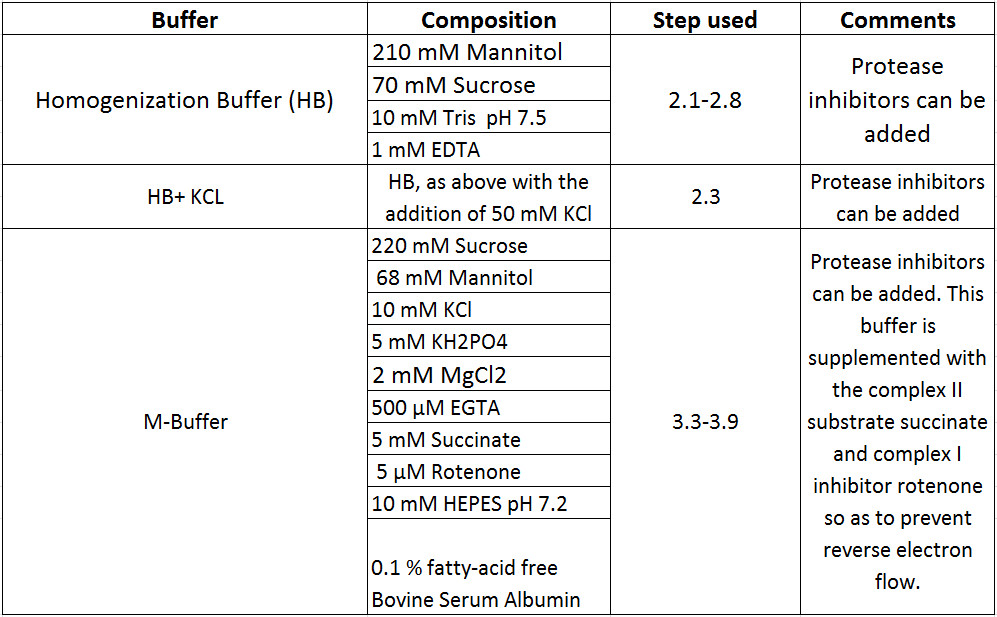
Таблица 1 Buffer Композиции.
1 Коллекция спинного мозга крысы
- Глубоко анестезировать крысу (Sprague Dawley) с 4% isoflorane. Убедитесь, обезболивание отсутствием рефлекса на защемление гоэ лапка. Усыпить крысу декапитацией через гильотину. Этот метод эвтаназии является предпочтительным по сравнению с другими, которые могут исказить спинной мозг.
- Разрежьте кожу обратно, чтобы разоблачить позвоночник. Вырезать позвоночник ножницами кости чуть выше тазовой кости. Визуализируйте открытие позвоночника.
- Вставка 10 мл шприц с наконечником 200 мкл пипетки (прикрепленной с помощью плавления чуть больше пламени), заполненной фосфатным буферным раствором (PBS), в позвоночнике.
- Промыть спинного мозга, применяя среднее количество давления на поршень.
- Если в крови присутствует на спинной мозг, промыть PBS, прежде чем перейти к следующему шагу.
Примечание: Этот метод также была подтверждена в головном мозге и печени. Если в том числе этих тканей, собрать половину мозг от эвтаназии крысы и кусок печени равен по весу спинного мозга. Все остальные шаги остаются идентичными.
2 Выделение спинного мозга Mitochondria (Взято из Ванде Вельде и соавт. 4)
- Соберите всю неповрежденную спинной мозг и место в 5 мл стеклянном гомогенизаторе с 5-ти томах (~ 3,25 мл) буфере для гомогенизации (HB). Для оптимального восстановления изолированными митохондриями, выполнить все шаги на льду или в холодной комнате. Перемешать ткани вручную до нет больших кусков ткани остаются, около восьми ударов. Поместите гомогената в двух (2 мл) или три (1,7 мл) микроцентрифужных пробирках. Центрифуга 1300 мкг в течение 10 мин при 4 ° С в настольной микроцентрифуге.
- Восстановление супернатанта и место в 5 мл ультрацентрифужную пробирку. Добавить 750 мкл (~ 0,5 объема) HB к гранул, содержащих микроцентрифужную пробирку и осторожно ресуспендируют осадок. Повторите центрифугирования и ресуспендирования шаги еще два раза. Бассейн все супернатанты (S1A и S1b) в ту же 5 мл ультрацентрифужную пробирку выше. Этот шаг служит для удаления мелкого мусора.
- Центрифуга объединяли S1 с помощью ультрацентрифуги оснащенный Бакет гнилиили и центрифугируют при 17000 х г в течение 15 мин при 4 ° С.
- Хранить супернатант (S2) для дальнейшей обработки, если цитозольной фракции представляет интерес (например, для Вестерн-блоттинга). Ресуспендируют гранул (P2), сырой митохондриальной фракции, в 4 мл НВ + 50 мМ KCl. Центрифуга 17000 мкг в течение 15 мин при 4 ° С в роторе Бакет. Удалите супернатант и осторожно ресуспендируют осадок (P3) в 800 мкл HB.
ПРИМЕЧАНИЕ: Митохондрии промывают HB + 50 мМ KCl, чтобы удалить любые неспецифические митохондриально-связанные загрязнений. - В новом 5 мл ультрацентрифужную пробирку, добавить ровно 800 мкл Ресуспендированный осадок (Р3).
- Для этого пробирку добавить 200 мкл иодиксанол (градиент плотности среды), тем самым создавая конечной концентрации 12% иодиксанола. Смешайте содержимое пробирки осторожно, но тщательно через пипетки с P1000. Добавление иодиксанола, а затем ресуспендировали осадок (Р3) может быть предпочтительным, чтобы облегчить полное смешение. Центрифуга в прошлого месяцаracentrifuge снабжен ротором ковша поворотной при 17000 х г в течение 15 мин при 4 ° С.
- ПРИМЕЧАНИЕ: Печень не содержит миелин и поэтому этот шаг не является необходимым, если только печень обрабатывается. Однако, если печень обрабатывается одновременно с ЦНС митохондрий, рекомендуется для лечения всех тканей одинаково.
- Аспирируйте слой миелина в верхней части трубки и осторожно удалить и отбросить супернатант. Пелле может быть свободной. Ресуспендируют гранул в 4 мл НВ. Центрифуга снова при 17000 х г в течение 10 мин при 4 ° С. Удалите супернатант и ресуспендируют осадок в 4 мл НВ. Повторите центрифугирования и удаления супернатанта.
- Ресуспендируют конечный осадок (P7) в 100-200 мкл HB и перенести в 1,7 мл микроцентрифужных трубки. Этот образец содержит изолированные митохондрии.
- Перейдите к белковой количественного. Развести образцы и стандартной кривой в 2% додецилсульфата натрия (SDS) для обеспечения адекватного растворение митохондрий Дуринг белка количественная.
3 иммунноокрашивания из изолированными митохондриями для проточной цитометрии
- Для каждого окрашивания смесь для тестирования, пипетка 25 мкг изолированных митохондрий в 1,7 мл микроцентрифужных трубки. Включите безупречной образца в каждом эксперименте; и для каждого антитела, не забудьте включить образец для надлежащего контроля изотипа.
- Центрифуга на 17000 мкг в течение 2 мин при 4 ° С в настольном микроцентрифуги.
- Удалить супернатант и ресуспендируют изолированный митохондрий в 50 мкл буфера митохондрий (М буфере), дополненной 10% жирных кислот БСА в течение 15 мин при 4 ° С (блокирование шага).
Примечание: В маркировки, выполняют инкубацию в холодильнике при 4 ° С. - Добавить первичное антитело (кроличье анти-Mfn2, 20 мкг на мл) в пробирку и инкубируют в течение 30 мин при 4 ° С.
ПРИМЕЧАНИЕ: Определить оптимальную концентрацию каждого антитела эмпирически путем титрования. Благодаря изменчивости концентрации и / или рurity, различные партии того же антитела того же производителя может привести к разным результатам; Поэтому титрование необходима для каждого нового большого количества антител. - Промыть несвязанного первичное антитело: центрифуге при 17000 х г в течение 2 мин при 4 ° С. Удалить супернатант и осторожно ресуспендируют осадок в 200 мкл буфера M. Центрифуга при 17000 х г в течение 2 мин при 4 ° С. Удалить супернатант и ресуспендируют осадок в 50 мкл М буфера.
- Добавить вторичного антитела осла (анти-кроличий IgG Фикоэритрин (ПЭ), 0,5 мкг на мл) в пробирку и инкубируют образцы в течение 30 мин при 4 ° С в защищенном от света.
- Промыть несвязанного вторичное антитело: центрифуге при 17000 х г в течение 2 мин при 4 ° С. Удалить супернатант и ресуспендируют осадок в 200 мкл М буфера. Центрифуга при 17000 х г в течение 2 мин при 4 ° С. Удалить супернатант и ресуспендируют осадок в 500 мкл М буфера.
- Для обеспечения мероприятия на самом деле являются митохондрии, пятен изолированы митохондрии смитохондрии конкретных флуоресцентный краситель в течение 15 мин при комнатной температуре, в защищенном от света. Если окрашивание других функциональных параметров (трансмембранного потенциала митохондрий или производственных супероксид) желательно, перейдите к пункту 4 Если нет, перейдите к шагу 5 для приобретения.
ПРИМЕЧАНИЕ: Важно убедиться, что спектр излучения вторичного антитела совместим с, что из функциональных красителей. Например, если проверка чистоты митохондриальной с коммерческой красителя со спектральными свойствами, подобными FITC и трансмембранного потенциала с тетраметилродамин метилового эфира (TMRM), жизнеспособным вторичное антитело будет аллофикоцианином (APC: Ex 650 нм / Em 660 нм). Добавить компенсаций управления, т.е. образец immunolabeled или окрашивали одной флуорофором, если он имеется. - Трансфер в трубке, подходящей для загрузки проточной цитометрии. (Для облегчения небольшого размера выборки, микротитровальный трубка находится внутри 3 мл проточного цитометра трубки.) Держите образцы на льду и немедленно приступить кпроточного цитометра для приобретения.
4 Опробование трансмембранного потенциала митохондрий и митохондриальной супероксид Производство цитометрическим
- Убедитесь, что изолированные митохондрии имеют нетронутыми трансмембранный потенциал окрашиванием 100 нМ TMRM (Ex 548 нм / Em 574 нм) 5, на этапе 3.8, в течение 15 мин при комнатной температуре, в защищенном от света. Для сравнения трансмембранного потенциала между образцами и населения, использования ниже / не-тушения концентрации TMRM (от 1 до 30 нМ), может быть более подходящим 6.
- В качестве контроля для TMRM окрашивания окрашивающим, изолированных митохондрий с 100 нМ TMRM в присутствии 100 мкМ карбонил цианида м-хлор фенил гидразина (СССР), митохондриальной разобщитель, которые будут деполяризовать митохондрии. Концентрация CCCP требуется деполяризовать митохондрии может быть меньше, если используются более низкие концентрации красителя.
- Убедитесь, что изолированные митохондрии производят митохондриальную перекислов улAining с соответствующим митохондриального индикатора супероксид-7, а также на этапе 3,8, в течение 15 мин при комнатной температуре в защищенном от света.
- В качестве контроля для производства митохондриальной супероксиддисмутазы, пятен изолированными митохондриями с красителем в присутствии 10 мкМ антимицин А, ингибитора комплекса III дыхательной цепи, что увеличит митохондриальную производство супероксид.
5 Приобретение и анализ Immunolabeled изолированными митохондриями цитометрическим
- Инструмент создан: Переключение напряжения от линейной в режим войти, чтобы облегчить анализ изолированных митохондрий и установленных напряжений (FSC: 450; SSC: 250). Убедитесь, что события собраны в FSC-A (область) режиме, а также FSC-W (ширина) и FSC-H (высота), чтобы иметь возможность исключить дублетов (т.е. два события, проходящие через детектор в то же время ) в коллекции после анализа данных. Установите количество мероприятий, которые будут собраны в 100 тысяч. Приобретать управления компенсации, Если это применимо.
- Сбор данных: До получения данных, избежать встряхивания образцов. Вместо смешать, аккуратно постукивая трубку. Сначала собирают события при низком давлении, в течение стробирования. Ворота на общей численности населения. Регулировка напряжения гистограмм, соответственно, как правило, пик неокрашенной пробы будет соответствовать второй декады (10 2). После того, как ворота устанавливаются и обрабатываются образцы, давление может быть переключена на высокой.
- Анализ: Визуализация дублеты путем построения FSC-Вт против ФСБ. Определить фуфайки и дублеты. Ворота на майках. Выберите митохондриальную населения по стробирования о событиях, которые окрашенных положительно с митохондриальной-селективный красителя.
- Определите фона маркировку от изотипического контроля. Использование контрольного образца изотипа, определить процент митохондриальной маркировки населения положительного для Mfn2 антитела.
Результаты
Митохондрии, полученные из крысиных спинного мозга может быть immunolabeled с антителом, адресованный Mitofusin2 (Mfn2), белок вовлечен в слиянии наружной мембраны митохондрий 8. После изоляции и маркировки с Mfn2 специфических антител и флуоресцентной сопряженного вторичным антителом, митохон...
Обсуждение
Становится все более очевидным, что митохондрии являются ключевыми игроками в обоих нормальной физиологии и болезней. В то время как иммуноблотинг может определить, какие белки были найдены в митохондриях или в митохондриальной поверхности в определенном состоянии, этот метод отчеты...
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
Мы благодарим Лори Destroismaisons и Сара Пейрар за выдающиеся технической поддержки и Dr.Alexandre Prat для доступа к проточной цитометрии. Мы также хотели бы выразить признательность доктору Тимоти Миллера за его вклад относительно изъятия миелина от препаратов. Эта работа была поддержана Канадским институтом исследований (CIHR) нервно-мышечной исследовательского партнерства в области здравоохранения, Канадский фонд инноваций, ALS общества Канады, Фрик фонда ALS исследований, CHUM фонда и Fonds-де-ла Recherche ан Санте Квебека (CVV). Оба CVV и NA являются исследования ученых из Fonds-де-ла Recherche ан Здоровье Квебека и CIHR Новые Следователи. SP поддерживается Тим Ноэль студенчества от ALS общества Канады.
Материалы
| Name | Company | Catalog Number | Comments |
| Rats | Charles River | Strain code 400 | Adult (9 weeks to 18 weeks) male or female rats can be used for the isolation protocol. Weight of rats is dependent on gender and age (males between 300 to 500 g and females between 200 to 350 g) are typically used. |
| Dounce homogenizer | Kontes Glass Co. | 885450-0022 | Duall 22 |
| Microcentrifuge | Thermo Scientific | Sorvall Legend Micro 17 R | |
| Ultra-Clear Ultracentrifuge tubes | Beckman Coulter | 344057 | Transparent, thin walled |
| Sorvall Ultracentrifuge | Thermo Scientific | Sorvall WX UltraSeries | |
| AH-650 rotor and buckets | Thermo Scientific | ||
| Opti-prep | Axis-Shield | 1114542 | Iodixanol, density gradient medium |
| Fatty acid free Bovine Serum Albumin | Sigma | A8806 | Must be fatty acid free for mitochondria |
| Sodium succinate dibasic hexahydrate | Sigma | S9637 | |
| Rabbit anti-Mitofusin2 antibody | Sigma | M6319 | |
| Rabbit IgG | Jackson Immuno Research | 011-000-003 | |
| Anti-Rabbit IgG PE | eBioscience | 12-4739-81 | |
| Micro titer tube | Bio-Rad | 223-9391 | For sample acquisition by flow cytometry |
| MitoTrackerGreen (MTG) | Invitrogen | M7514 | 100 nM: Ex 490 nm/Em 516 nm |
| TMRM | Invitrogen | T668 | 100 nM: Ex 548 nm/Em 574 nm |
| CCCP | Sigma | C2759 | |
| MitoSOX Red | Invitrogen | M36008 | 5 µM: Ex 540 nm/Em 600 nm |
| Antimycin A | Sigma | A8874 | |
| LSR II flow cytometer | BD | ||
| BD FACSDiva Software | BD | ||
| FlowJo | TreeStar Inc. | Software used for analysis | |
| BCA protein assay kit | Pierce/Thermo Scientific | 23225 | Bradford assay is not recomended as it is not compatible with high concentrations of SDS |
Ссылки
- Itoh, K., Nakamura, K., Iijima, M., Sesaki, H. Mitochondrial dynamics in neurodegeneration. Trends Cell Biol. 23, 64-71 (2013).
- Narendra, D., Tanaka, A., Suen, D. F., Youle, R. J. Parkin is recruited selectively to impaired mitochondria and promotes their autophagy. J Cell Biol. 183, 795-803 (2008).
- Zorov, D. B., Kobrinsky, E., Juhaszova, M., Sollott, S. J. Examining intracellular organelle function using fluorescent probes: from animalcules to quantum dots. Circ Res. 95, 239-252 (2004).
- Vande Velde, C., Miller, T., Cashman, N. R., Cleveland, D. W. Selective association of misfolded ALS-linked mutant SOD1 with the cytoplasmic face of mitochondria. Proc Natl Acad Sci U S A. 105, 4022-4027 (2008).
- Loew, L. M., Tuft, R. A., Carrington, W., Fay, F. S. Imaging in five dimensions: time-dependent membrane potentials in individual mitochondria. Biophys J. 65, 2396-2407 (1993).
- Perry, S. W., Norman, J. P., Barbieri, J., Brown, E. B., Gelbard, H. A. Mitochondrial membrane potential probes and the proton gradient: a practical usage guide. Biotechniques. 50, 98-115 (2011).
- Xu, X., Arriaga, E. A. Qualitative determination of superoxide release at both sides of the mitochondrial inner membrane by capillary electrophoretic analysis of the oxidation products of triphenylphosphonium hydroethidine. Free Radic Biol Med. 46, 905-913 (2009).
- Otera, H., Ishihara, N., Mihara, K. New insights into the function and regulation of mitochondrial fission. Biochim Biophys Acta. 1833, 1256-1268 (2013).
- de Brito, O. M., Scorrano, L. Mitofusin 2 tethers endoplasmic reticulum to mitochondria. Nature. 456, 605-610 (2008).
- Wikstrom, J. D., Twig, G., Shirihai, O. S. What can mitochondrial heterogeneity tell us about mitochondrial dynamics and autophagy. Int J Biochem Cell Biol. 41, 1914-1927 (2009).
- Pickles, S., Destroismaisons, L., Peyrard, S. L., Cadot, S., Rouleau, G. A., Brown, R. H., Julien, J. P., Arbour, N., Vande Velde, C. Mitochondrial damage revealed by immunoselection for ALS-linked misfolded SOD1. Hum Mol Genet. 22, 3947-3959 (2013).
- Frank, S., Gaume, B., Bergmann-Leitner, E. S., Leitner, W. W., Robert, E. G., Catez, F., Smith, C. L., Youle, R. J. The role of dynamin-related protein 1, a mediator of mitochondrial fission, in apoptosis. Dev Cell. 1, 515-525 (2001).
- West, A. P., Brodsky, I. E., Rahner, C., Woo, D. K., Erdjument-Bromage, H., Tempst, P., Walsh, M. C., Choi, Y., Shadel, G. S., Ghosh, S. TLR signalling augments macrophage bactericidal activity through mitochondrial ROS. Nature. 472, 476-480 (2011).
- Abad, M. F., Di Benedetto, G., Magalhães, P. J., Filippin, L., Pozzan, T. Mitochondrial pH monitored by a new engineered green fluorescent protein mutant. J Biol Chem. 279, 11521-11529 (2004).
- Murphy, A. N., Bredesen, D., Cortopassi, G., Wang, E., Fiskum, G. Bcl-2 potentiates the maximal calcium uptake capacity of neural cell mitochondria. Proc Natl Acad Sci U S A. 93, 9893-9898 (1996).
- Tantama, M., Martinez-François, J. R., Mongeon, R., Yellen, G. Imaging energy status in live cells with a fluorescent biosensor of the intracellular ATP-to-ADP ratio. Nat Commun. 4, 2550 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены