このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ザリガニのSwimmeretシステム:神経索と運動パターンの細胞外記録の解剖のための実践ガイド
要約
Here we describe the dissection of the crayfish abdominal nerve cord. We also demonstrate an electrophysiological technique to record fictive locomotion from swimmeret motor neurons.
要約
ここでは、ザリガニ腹部神経索の解剖を実証する。準備は最後の2胸部神経節(T4、T5)と腹部神経節(A6にA1)の鎖を含む。 swimmeretシステム:神経節のこのチェーンは、腹肢(swimmerets)の協調運動を駆動し、中枢神経系(CNS)の一部を含む。これは、ザリガニの各swimmeretがリズミカルな交互作用1-3を生成し、独自の独立したパターン生成カーネルによって駆動され、5 20年以上前から知られている。運動ニューロンは、2つの解剖学的および機能的に異なる集団4を含み、各swimmeretの筋肉組織を支配する。一つはswimmeretの後退(パワーストローク、PS)を担当しています。他のswimmeretの延長(戻り行程、RS)を駆動する。 swimmeretシステムの運動ニューロンは、生体内で記録されたパターンと同一である、自然に仮想運動パターンを生成することができる1。
このレポートの目的は、学生の実践的な実験室のコースに独立した微細回路のネットワークとの連携を生成するリズムを研究するための興味深いと便利なモデルシステムを導入することである。提供されたプロトコルは、神経節をdesheathingと孤立神経系から細胞外にswimmerets架空の運動パターンを記録し、神経節の孤立したチェーンのピン止め、ザリガニの腹部神経索の解剖のためのステップバイステップの手順が含まれています。
さらに、当社は、樹状突起から細胞内に記録されたswimmeretニューロンの活動を監視することができます。ここでは、また簡単にこれらの技術を説明し、いくつかの例を提供する。さらに、swimmeretニューロンの形態は、様々な染色技術を用いて評価することができる。ここでは、染料いっぱいニューロンとswimmeret運動ニューロンのプールのバックフィル(イオントフォレーシスによる)細胞内の例を提供する。私たちの研究室では、我々は、この準備仮想運動の基本的な機能を研究するために、CNSの活性に対する感覚フィードバックの効果、および細胞レベルで微細回路間の調整を使用しています。
概要
ザリガニのswimmerets姿勢制御に機能を果たすと動物が前方に泳ぐときリズミカルに打つ、彼らの巣穴やメスが卵5、6の通気換気。シグナルザリガニのswimmerets、Pacifastacusのleniusculusは 、1/5に第二のペアで起こる腹部7の両側に1つずつ手足と腹部のセグメント、。中枢神経系は、無傷動物ならびに単離された神経索の調製においてswimmeret運動を駆動する独自のリズミカルな運動パターに生成する。全く感覚フィードバックまたは降順入力が存在しない場合に生成リズミカルな運動パターンは、仮想移動1、2と呼ばれている。swimmeretシステムでは、この運動パターンが無傷動物で測定されたswimmeretsの活動からの任意のパラメータが異なっていません。
各swimmeretの移動はに位置し、1℃に制限されているマイクロ回路によって駆動され、hemiganglion 1 orresponding - 。3に各マイクロ回路では5同定された非スパイクニューロンを含み、カーネルを生成するパターンがあります。機能的にはパワーストローク(IPS)の阻害剤又は戻りストロークのインヒビター(IRS)8のいずれかとして特徴付けることができる。これらのIPSとIRSの介在ニューロンは、交互の活動が相互抑制9によって駆動され、むしろ、内因性の発振器ではありません。これらのニューロンは、直接swimmeret運動ニューロンを阻害するので、交 互のPS-RSの動きは10が生成される。ロコモーションしかし、活動の生成を必要とするだけでなく、別の独立したマイクロ回路の協調んばかり。 swimmeretシステムでは、このような調整は手足が正しい時間にアクティブであることを確実に配位マイクロ回路によって確立される。このマイクロ回路は、各セグメント11-15で3識別さニューロンによって構築されています。
このプロトコルは、目を提供eは、初めてステップバイステップ解剖ガイドは神経節(A6にT4、 図1)の鎖を分離する。私たちは、孤立した腹部神経索とdesheathe各神経節をピンする方法を示しています。この単離された神経系の調製においては、swimmeret運動に関与する神経細胞は、電気生理学的および形態学的実験に使用するための準備ができている。このプロトコルの第2の部分は、swimmeret運動パターンの主な特徴を示しています。これはswimmeret運動ニューロンの活動を記録するために細胞外にステップバイステップガイドが含まれています。 RSの運動ニューロンの軸索は、PS運動ニューロンの軸索は、同じ神経の後枝を通して( 図1)プロジェクトながら、神経N1の前方支店を通じてプロジェクト4。したがって、それらの活性は、差動ピン電極と、これらの枝から記録することができる。

図1:腹部神経節6(A6)とそれ T4 の模式図に胸部神経節4(T4)から単離し神経系:胸部神経節4。 T5:胸部神経節5。 A1、A2、... A6腹部神経節1、腹部神経節2 ...腹部神経節6。 N1:神経N1。 N2:神経N2。 N3:神経N3。 PS:パワーストローク。 RS:リターンストローク。方向性略語: =前部。 P =後部。
この解剖手順および実証電気生理学的手法は、学部学生のための便利であり、生理中の学生実用的コースを補完することがあります。神経節の孤立したチェーンは、神経系の機能、調整、またはswimmeretマイクロ回路6の変調など運動16、17で適応行動の神経細胞の制御を研究するために多数の実験で使用されてきた。ザリガニswimmeretシステムは、このように膨大な量を提供しています面白い授業またはTのすべてのザリガニと仮想運動パターンの細胞外記録の腹側神経索の解剖で始まる機会を雨。
Access restricted. Please log in or start a trial to view this content.
プロトコル
この解剖手順は、欧州共同体理事会22の指令ND 2010年9月(63分の2010 / EU)に従っている。
1.準備
- サイズは≥8センチ両性のザリガニ、Pacifastacusのleniusculus(ダナ)を得る。動物が不可欠であり、腹部、腹部、四肢に異常がないことを確認してください。
- 甲羅を検査し、このキューティクルが硬いと剛性であることに注意してください。前およびpostmolt動物は柔らかい甲羅を持っており、なぜなら、多くのパラメータが変更さ脱皮処理中に実験用に適していない( 例えば、自発運動の減少)。
- 図2に示されているし、提供サプリメントに記載されている、解剖時に使用されるすべてのツールと資料を揃えピン止めし、神経索のdesheathing。

図2: 材料と解剖のために使用されるツール、ピン止めと神経索のdesheathing。
(1)氷で満たされた大きなバケツを。 (2)ザリガニの生理食塩水; (3)生理食塩水ディスペンサー。 (4)解剖顕微鏡。 (5)解剖ディッシュ。 (6)強いはさみ。 (7)鉗子(8)春のはさみ。 (9)ペトリ皿をクリアシルガードと並ぶ。 (10)固定ピン。 (11)冷ランプ光源。
2.グロス解剖
- 20分 - 15氷上で動物を麻酔。それは放血工程を含む、試料が処置中にザリガニの生理食塩水を定期的にすすがれる必要があるので、シンクの近くラボベンチ総解剖の最初の部分を実行する。
- 動物腹側を上に持ち、胸部( 図3-1)の近くに彼らの拠点で両方の爪をカットする強力なハサミを使用しています。左右の腹肢( 図3-2)を外します。
- 黒シルガードが並んで解剖皿に動物腹側を上に置きます。 Eleva下に氷を挿入し、尾節( 図4A)で腹部をピンによってTE頭胸部。
- 〜60ミリリットルチルドザリガニ生理食塩水生理食塩水ディスペンサーを埋める。爪開口部( 図4B)を介して冷生理食塩水でザリガニを灌流。過剰食塩水はuropodsでカットを通じてオフ排出されます。失血中に氷でザリガニをカバー
- ただ強いはさみ( 図5(a))を用いて動物の目に後方単一横カットで動物を首を切る。 図5Bに示されるように、ベースジョイントの近くにある全てのウォーキング脚を外します。
- 頭胸部の残りの部分から最後の胸部セグメントと腹部を分離します。第二歩行脚の開口部にハサミの先端を挿入し、反対側に切断することにより、第二歩行の脚のレベル(胸部セグメント3)での最初のカットを行います。 ( 図6A-1)。
- Tを通じて両側に、この最初のカットを拡張彼は( 図6A-2)を頭胸部。
- 内臓の一部が見えるようにするために開いている動物を裏返し。試料の前の部分に目立つ消化腺( 図6B-3)を押して、腹腔から生殖器官を削除する鉗子を使用しています。
- 頭胸部( 図6C)の前方部分を削除します。残りの胸部( 図6D-4)の両側に、鰓をカバー甲の横の部分を除去するために横方向のカットを使用してください。鰓を削除し、冷生理食塩水で試料をすすぐ。
- 図6E-5に示すように胸骨プレートの全長を通じてカットと解剖を続行します。側板とswimmerets間の最大横方向の位置( 図6E赤のマーク)でこのカットを行います。同じカットと反対側に進みます。冷生理食塩水で試料をすすぐ。
- dissectioの下で残りの解剖を行ってくださいn個の顕微鏡。黒シルガードが並んで、それは、検体を覆うようにザリガニの生理食塩水で満たされた解剖皿にザリガニの腹部腹側を上に置きます。
注:以下のステップ(2.12から4.8)は、右利きの実験者には適用され、方向指示が含まれています。次の手順(2.12から6.8)、それは健全な神経系を維持するために、冷生理食塩水で、定期的にすべての20〜30分のザリガニの生理食塩水を交換することが重要である。 - 尾節で後方に虫ピンで試料を修正し、前方に甲の遺跡で。左にテルソンポイントと、テーブルの縁に平行になるように試料を置きます。
- 歩行脚開口部( 図7A)を介して取得し、( 図7B白矢印)オープン標本を引っ張って左手に粗い鉗子を使用してください。大型2背屈筋ストランド( 図7B-1、C-1)を特定し、彼らの腹側をカット図7Bに示すように、基礎。
- 4 番目の胸部セグメントで、腹側に背側(心臓)から下降胸骨動脈( 図7C-2)を 、特定します。それは腹動脈形成、神経索の下に突出する前に、この動脈は、右の神経索( 図7C-3)の上にある。
- 胸骨動脈を横断する。 図7Cに示すように、はさみの1のブレードを使用して、最初の動脈を持ち上げ、腹側に位置する神経索が表示されている場合にのみカット。
- (右側に)前方に背屈筋を修正。彼らはビジョンをブロックしませんので、これがピンと最大伸ばした位置で行う必要があり、試料を延伸されたままになります。背部の筋肉ストランドは固定されている場合( 図8-1)、最初の腹部神経節、関連する神経N1、N2、及びN3でA1、A2は、( 図8)表示されます。
- スペックをつかむために左手に鉗子を使用してください歩行脚の一方の開口部に試料ク。以下の解剖を通しての手順はオープン標本を維持するために慎重に引き抜いてください。
- 神経索から最も離れた位置に神経N3を横断する。 ( 図8-3)。
- 図8-4に示すように、腹内突起に近い屈筋をカット。神経索または神経N2を損傷しないように注意してください。
- A5にステップ2.18と神経N3のための2.19、残りの腹部神経節A2の屈筋を繰り返します。
- 最後の腹部神経節では、A6は、腹内突起から背屈筋をカットし、 図9に示すように、試料が見えるはずです。
- A6( 図9-1)の神経に胸骨のプレート後部をカットし、腹側部分( 図9-2)を保つ。屈筋( 図9-3)と背の部分を破棄します。歩行脚の開口部を介してピンと前方に胸骨のプレートを修正し、と後方A6へ。
3.ファイン解剖
- 離れる方向前方部分とテーブル「縁部に向かって後部に顕微鏡下で試料を置きます。
- cephalothoracic胸骨の最も前方部分を削除するには、図10(a)に示すように鉗子を使用してください。
注:胸部神経節と関連する神経は、部分的に脚の筋肉組織とcephalothoracic胸骨で覆われている。 cephalothoracic胸骨は、互いに腹側神経索が常駐している内側の空洞から歩いて足の横方向に位置して空洞を分離骨格を形成。 - 図10B -1とB2に示すように、残りの外骨格構造の間の筋肉をカットします。腹側神経索( 図10C)の前端をつかみ、持ち上げるために鉗子を使用してください。
注:神経索は、プロセス中に破損されますので、NERVを拾っ避ける電子コードが複数回。 - 神経索(図10C-3)を持ち上げながら横方向に胸部神経をカット。ピン止めのために適当な長さでこれらの神経してください。 T4( 図10C-4)の全ての組織前部を離れて切断することにより、ピンセットで取り上げられた神経節のチェーン、の絞った部分を削除します。
- 左の前方部分に試料を置き、A1に焦点を当てる。それらをピン止めするための適切な長さ(最大1センチ)で、A1のN1、N2の神経をカット。
- A2に焦点を当て、神経N1、N2、このセグメントのN3( 図11)を特定。腹部神経節A2-A5の神経N1は、各セグメント( 図11A-1)に2胸骨クチクラinfoldingsの間に存在し、筋肉組織で覆われている。後部胸骨クチクラ陥入に沿って1カットを行います。腹部の横方向の縁に起動し、 図11(a)に示すように正中線に向かって進んでください。
- ターゲットN1はまだ入り江である場合図11B(赤い矢印)に示すように、組織と赤、筋肉の束を横断するが、両方の胸骨クチクラinfoldingsと神経N1( 図11B-2)にこの時間前部。
- 遠位に可能な限り( 図11C-3)などの神経N1をカット。 ( 図11C)神経N1が完全に表示され、前方および後方の枝を特定することができる。
- 神経節( 図11D)の近くに、内側から始めて、反対側の神経N1に進み、最初の後部胸骨クチクラ陥入に沿って筋肉をカット。神経がまだ組織で覆われている場合は、筋肉の束を横断しますが、今回の前方胸骨クチクラinfoldingsと神経N1の両方には、同じような11B-2図 。として遠位に可能な限りの神経N1をカット。
- 適当な長さ(約0.5 cm)のピン止めのために、この神経節の神経N2をカット。
- 繰り返しますA3-A5の神経のための3.7から3.11繰り返します。
- NERをカット遠位側( 図12A)はできるだけ神経節A6のVES。この神経節を持ち上げ、胸骨のプレートから神経節の連鎖を隔離開始するA6の複数の神経をつかむために鉗子を使用してください。
- 神経索を持ち上げながら、図12B(白矢印)で示したように、前方方向にそっと引き出します。個々の神経節が解除されると、神経索( 図12C)の腹側に取り付けることができる腹動脈を削除します。神経索が完全に分離されるまで、この(優しく)、プルカットシーケンスを続行します。
- 明確なシルガードが並ぶとザリガニの生理食塩水( 図12D)で満たされたペトリ皿に神経節の孤立チェーンを転送します。
4.ペトリ皿に神経索をピン留め
注:神経索ピンに(サプリメントを参照)ステンレス鋼線からカット小さなピンを使用してください。鉗子で終わるだけ神経をタッチしないSQUEEZ接続詞や神経節をメール。
- 穏やかなストレッチをかけながら、直線での神経節のチェーンをピン。
- 上向きに背側とのペトリ皿に神経索( 図13、黒線)を配置します。神経節の腹側が凸によって同定することができる。背側は平坦である。両側に胸部神経をピン。その縦軸に沿って神経索を伸ばし、A6の神経を続行します。
- 神経索に対して90°の角度でA1の神経をピン。
- A2に進み、神経索( 図1A)に35〜45°の角度で神経N2をピン。
- 図14に示されているようにピン止めする前に彼らの前方および後方の枝の神経N1を分離する。鉗子の1組の前方で、神経N1の他の後枝を拾うために細かい鉗子の二組を使用してください。唯一の最も遠位端部を選ぶように注意してください神経枝のS。今、慎重にそれらを離れて引っ張る。
- 神経索( 図1A)に対して90°の角度で神経N1の前方の分岐をピン。前方N1枝と神経N2との間に神経N1の後枝をピン。
- 神経節A3〜A5の神経のためのステップ4.4から4.6を繰り返します。縦方向における神経索ストレッチそれだけでなく、横断方向を固定している。
5.神経節Desheathing
- 実験者の手が常に揺れを避けるために、安定した平面上に休んでいるように準備を置きます。神経節をdesheathするために、以下の神経索を照らす。
- A5への腹部神経節A1に焦点を当てる。神経節シースを通して、後部神経節に、N2の神経とN3( 図15A赤い矢印)との間に小さな横カットを作るために細かい春のはさみを使用してください。
- 非常にFを用いて神経鞘をピックアップナイン鉗子および図15A-1に示されるように、接続詞上記シースを横切って横方向に切断。はさみで神経索を絞るか、カットしないように注意してください。
- それでもピンセットで神経鞘を保持して持ち上げると、神経節の横方向の境界線( 図15B-2および-3)に沿ってそれをカットし続ける。シースを除去します。代替的に、固定されているが、神経索が圧迫されないように、接続詞の両側にピン。
- 繰り返しますA5にすべての腹部神経節A1のための5.2から5.4を繰り返します。
- 胸部神経節と同様に神経節A6をDesheathe。神経節にA6開始前方にdesheatheと後部の方向に進行するために。神経節のチェーンの後端にA6の神経節シースをピン。
運動ニューロンから6細胞外記録
- 私を示す細胞外記録のために使用されるすべてのツールや材料を組み立てN 図16Bやサプリメントに記載されている。録画設定の概要を図16Aに示されている。アンプは記録前に、少なくとも30分間のウォームアップができるように、この実験( 図16C)で使用されるすべての電子機器を起動します。コンピュータの電源を入れ、録音ソフトウェアを起動。
- 顕微鏡テーブルの上に神経節のチェーンを配置し、下側から照らす。神経節( 図17AおよびB)への標的神経と近くの位置での参照電極に近いが、横方向のシルガードに記録電極を挿入します。ベンド記録電極( 図17C)の周りの標的神経。
- 電極と神経の間の接触を確実にし、サイド(のF igure 17D)にそれをピンに、少し神経をストレッチ。粘土を用いて顕微鏡テーブルに電極ケーブルを固定し、そのようにそれらが所望の位置に留まる。
- 使用してください注射器は、入浴液から標的神経を分離するためにワセリン(丸い先端を持つ)20ゲージの針( 図17E-3)を充填した。最初の記録電極の周りのシルガードにいくつかのワセリンを軽くたたく。その結果、記録電極( 図17E-4)の近傍にシルガードをカバーワセリンの層である。直接この層に気泡を神経に軽くして回避しないように注意してください。
- 生理食塩水( 図17F)の表面レベルまでのすべての側面からワセリンと記録電極を封止する。
- その活性が監視する必要があるすべてのターゲットの神経のために、この手順を繰り返します。
- 記録を開始。連続またはギャップ無料の取得モードと5 kHzのサンプリングレートを使用してください。次のパラメータに細胞外アンプを設定します。 1000ゲイン(取得ソフトウェアの設定で、この増幅パラメータを含めるように注意して、信号を千回を増幅)AN2000ヘルツ(ハイカット)に300ヘルツ(ローカット)のダ·バンドパスフィルタの範囲。
Access restricted. Please log in or start a trial to view this content.
結果
RS及びPSつ神経の運動ニューロンからの同時細胞外記録して、これらの運動ニューロンプールの交流活動は、仮想歩行パターンを表す( 図18)を監視することができる。
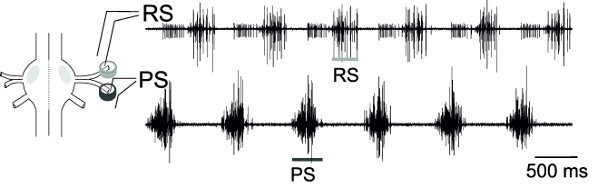
図18:差動ピン電極の一方の神経節および配置の概略外RS運動ニューロンの記録(上のトレース)およびPS運動ニュー?...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
ザリガニの解剖学とその腹部神経節を前に5、18、19、20に記載されている、それは重要な神経の切断を回避するために、解剖前にそれらに慣れることをお勧めします。
それは、単離された神経索の劣化を防止するために、23℃未満の温度で調製しておくことが重要である。これは、すべての20-30分を冷ザリガニ生理食塩水を浴溶液で置換することによって容易?...
Access restricted. Please log in or start a trial to view this content.
開示事項
The authors declare that they have no competing financial interests.
謝辞
私たちは、図のいくつかと助けるためヨスBurgertに感謝。私たちは、インゴSelbach(とグループ「Edelkrebsprojekt NRW」)は、実験動物と実験室を供給するために彼の努力のために感謝しています。私たちは、原稿の最初のバージョンの校正のためのアンナC.シュナイダーに感謝。この研究は、エミー·ネーターDFGグラントSM 206 / 3-1と女性教員のためのケルン大学のスタートアップ助成金によってサポートされていました。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 4-channel extracellular amplifier: MA 102 | Amplifier | Elektroniklabor, Zoologie, Universität zu Köln, Germany | |
| air-table | Technical Manufacturing Corporation (TMC) a unit of AMETEK Ultra Precision Technologies, Peabody, MA, USA | 63-534 | |
| Axon Digidata 1440A | Digitizer | Axon Instruments, Molecular Devices Design, Union City, CA | DD1440A |
| big bucket | |||
| Clampex & Clampfit | pClamp 10, recording and analysis software | Molecular Devices Design, Union City, CA | pClamps 10 Standard |
| cold lamp source | with flexible light guide (fiber optic bundle) | Euromex microscopes holland, Arnhem, BD | LE.5211 & LE.5235 |
| computer and monitor | equipped with recording software | ||
| container and pipette for liquid waste | |||
| crayfish saline | contains (in mM): 5.4 KCl, 2.6 MgCl2, 13.5 CaCl2, and 195 NaCl, buffered with 10mM Tris base and 4.7mM maleic acid; aerated for 3 hours. Adjust at pH of 7.4. | ||
| dextran, Texas Red (3000MW, lysine fixable) | fluorescent dye, lysine fixable | Life Technologies GmbH, Darmstadt, Germany | D3328 |
| dissection dish | (l x w x h) 15x7x5 cm; linned with black silicone | ||
| faraday cage | |||
| fixing pins | |||
| forceps (biology, Dumont #5) | Forceps: Biology, tip 0.05 x 0.02 mm, length 11cm, INOX | Fine Science Tools (FST), Germany | 11252-20 |
| forceps (biology, Dumont #55) | Forceps: Biology, tip 0.05 x 0.02 mm, length 11cm, INOX | Fine Science Tools (FST), Germany | 11255-20 |
| forceps (electronic, Dumont #5) | Forceps: Standard, tip 0.1 x 0.06 mm, length 11cm, INOX | Fine Science Tools (FST), Germany | 11251-20 |
| intracellular electrode | Borosilicate glass capillaries (outer/inner diameter: 1mm/0.5mm), with filament | Sutter Instruments, Novato, CA | BF100-50-10 |
| Leica S8 Apo StereoZoom | Dissection Microscope Zoom 1x - 8x | Leica, Germany | 10446298 |
| microscope table | |||
| mirror | to illuminate preparation from below | ||
| modeling clay | |||
| Olympus SZ61 | Dissection Microscope Zoom 0.67x - 4.5x | Olympus, Germany | |
| petri dish | 94 x 16 mm; lined with clear silicone | Greiner bio-one, Germany | 633180 |
| ring scissors | ThoughCut, cutting edge: sharp/blunt, straight: 13cm | Fine Science Tools (FST), Germany | 14054-13 |
| spring scissors or alternative: Vannas spring scissors | cutting edge: 8 mm, tip diameter: 0.2mm, straight: 10cm or cutting edge 2.5 mm, tip diameter 0.075 mm, straight: 8cm | Fine Science Tools (FST), Germany | 15024-10 or 15000-08 |
| student Vannas spring scissors or alternative: Moria Spring Scissors | cutting edge: 5mm, tip diameter: 0.35mm, straight: 9cm or cutting edge: 5mm, tip diameter 0,1 mm, straight: 8 cm | Fine Science Tools (FST), Germany | 91500-09 or 15396-00 |
| sylgard | 184 Silicone Elastomer Base and Curing Agent; for black sylgard add activated carbon | Dow Corning, Midland, MI, USA | |
| syringe filled with petroleum jelly and equipped with a 20 gauche needle with rounded tip |
参考文献
- Hughes, G. M., Wiersma, C. A. G. The Co-Ordination of Swimmeret Movements in the Crayfish, Procambarus-Clarkii (Girard). J Exp Biol. 37 (4), 657-670 (1960).
- Mulloney, B., Smarandache, C. Fifty Years of CPGs: Two Neuroethological Papers that Shaped the Course of Neuroscience. Front Behav Neurosci. 4, 45(2010).
- Murchison, D., Chrachri, A., Mulloney, B. A Separate Local Pattern-Generating Circuit Controls the Movements of Each Swimmeret in Crayfish. J Neurophys. 70 (6), 2620-2631 (1993).
- Mulloney, B., Hall, W. M. Functional organization of crayfish abdominal ganglia. III. Swimmeret motor neurons. J Comp Neurol. 419 (2), 233-243 (2000).
- Davis, W. J. Lobster Righting Responses and Their Neural Control. Proc R Soc Ser B-Bio. 170 (1021), 435-456 (1968).
- Mulloney, B., Smarandache-Wellmann, C. Neurobiology of the crustacean swimmeret system. Prog Neurobiol. 96 (2), 242-267 (2012).
- Huxley, T. H. The crayfish: An introduction to the study of zoology. , MIT Press. Cambridge, MA. (1980).
- Smarandache-Wellmann, C., Weller, C., Wright, T. M., Mulloney, B. Five types of nonspiking interneurons in local pattern-generating circuits of the crayfish swimmeret system. J Neurophys. 110 (2), 344-357 (2013).
- Skinner, F. K., Mulloney, B. Intersegmental coordination of limb movements during locomotion: mathematical models predict circuits that drive swimmeret beating. J Neurosci. 18 (10), 3831-3842 (1998).
- Mulloney, B. During fictive locomotion, graded synaptic currents drive bursts of impulses in swimmeret motor neurons. J Neurosci. 23 (13), 5953-5962 (2003).
- Smarandache-Wellmann, C., Grätsch, S. Mechanisms of coordination in distributed neural circuits: Encoding coordinating information. J Neurosci. 34 (16), 5627-5639 (2014).
- Mulloney, B., Hall, W. M. Local commissural interneurons integrate information from intersegmental coordinating interneurons. J Comp Neurol. 466 (3), 366-376 (2003).
- Mulloney, B., Harness, P. I., Hall, W. M. Bursts of information: Coordinating interneurons encode multiple parameters of a periodic motor pattern. J Neurophys. 95 (2), 850-861 (2006).
- Smarandache, C., Hall, W. M., Mulloney, B. Coordination of Rhythmic Motor Activity by Gradients of Synaptic Strength in a Neural Circuit That Couples Modular Neural Oscillators. J Neurosci. 29 (29), 9351-9360 (2009).
- Smarandache-Wellmann, C., Weller, C., Mulloney, B. Mechanisms of Coordination in Distributed Neural Circuits: Decoding and Integration of Coordinating Information. J Neurosci. 34 (3), 793-803 (2014).
- Chrachri, A., Neil, D., Mulloney, B. State-Dependent Responses of 2 Motor Systems in the Crayfish, Pacifastacus leniusculus. J Comp Physiol A. 175 (3), 371-380 (1994).
- Chrachri, A., Neil, D. M. Interaction and Synchronization between 2 Abdominal Motor Systems in Crayfish. J Neurophys. 69 (5), 1373-1383 (1993).
- Skinner, K. The Structure of the 4th Abdominal-Ganglion of the Crayfish, Procambarus-Clarki (Girard) II. Synaptic Neuropils. J Comp Neurol. 234 (2), 182-191 (1985).
- Skinner, K. The Structure of the 4th Abdominal-Ganglion of the Crayfish, Procambarus-Clarki (Girard) I. Tracts in the Ganglionic Core. J Comp Neurol. 234 (2), 168-181 (1985).
- Mulloney, B., Tschuluun, N., Hall, W. M. Architectonics of crayfish ganglia. Microsc Res Techniq. 60 (3), 253-265 (2003).
- Braun, G., Mulloney, B. Cholinergic modulation of the swimmeret motor system in crayfish. J Neurophys. 70 (6), 2391-2398 (1993).
- Davis, W. J. Motoneuron Morphology and Synaptic Contacts - Determination by Intracellular Dye Injection. Science. 168 (3937), 1358-1360 (1970).
- Altman, J. S., Tyrer, N. M. Filling Selected Neurons with Cobalt through Cut Axons. Neuroanatomical Techniques. Strausfeld, N. J., Miller, T. A. , Springer. New York, NY. 373-402 (1980).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved