È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Il Sistema swimmeret di gamberi: Una guida pratica per la dissezione del cavo di Nerve e extracellulari registrazioni del modello Motor
In questo articolo
Riepilogo
Here we describe the dissection of the crayfish abdominal nerve cord. We also demonstrate an electrophysiological technique to record fictive locomotion from swimmeret motor neurons.
Abstract
Qui mostriamo la dissezione del cordone nervoso addominale gamberi. La preparazione comprende gli ultimi due gangli toracica (T4, T5) e la catena di gangli addominali (A1 al A6). Questa catena di gangli comprende la parte del sistema nervoso centrale (CNS) che guida locomozione coordinata dei pleopodi (swimmerets): il sistema swimmeret. E 'noto per oltre cinque decenni in gamberi ogni swimmeret è guidato da un proprio kernel generano tracciati indipendenti che genera attività alternanza ritmica 1-3. I motoneuroni che innervano la muscolatura di ogni swimmeret comprendono due anatomicamente e funzionalmente distinte popolazioni 4. Uno è responsabile per la retrazione (corsa di potenza, PS) del swimmeret. Altre unità la protrazione (corsa di ritorno, RS) del swimmeret. Neuroni motori del sistema swimmeret sono in grado di produrre spontaneamente uno schema motorio fittizia, che è identico al modello registrato in vivo 1.
Lo scopo di questo rapporto è quello di introdurre un interessante e conveniente sistema modello per lo studio delle reti di generazione del ritmo e il coordinamento di microcircuiti indipendenti per i corsi di laboratorio pratico degli studenti. Il protocollo fornito include le istruzioni passo-passo per la dissezione del cordone nervoso addominale del gambero di fiume, pinning della catena isolato di gangli, desheathing gangli e registrando il swimmerets fittizia pattern motorio extracellulare dal sistema nervoso isolato.
Inoltre, siamo in grado di monitorare l'attività dei neuroni swimmeret registrati intracellulare di dendriti. Qui abbiamo anche una breve descrizione di queste tecniche e fornire alcuni esempi. Inoltre, la morfologia dei neuroni swimmeret può essere valutata utilizzando varie tecniche di colorazione. Qui forniamo esempi di intracellulare (dalla ionoforesi) tintura piena neuroni e riporti di pool di motoneuroni swimmeret. Nel nostro laboratoriousiamo questa preparazione per studiare le funzioni di base di locomozione fittizia, l'effetto di feedback sensoriale sull'attività del SNC, e il coordinamento tra microcircuiti a livello cellulare.
Introduzione
I swimmerets di gamberi hanno una funzione di controllo della postura e battere ritmicamente quando gli animali nuotano in avanti, ventilare le loro tane o femmine aerare le loro uova 5, 6. I swimmerets del gambero del segnale, Pacifastacus leniusculus, si verificano in coppie dalla seconda alla quinta segmento addominale, con un arto su ciascun lato dell'addome 7. Il sistema nervoso centrale produce propria ticchettio motore ritmica che aziona il movimento swimmeret nell'animale intatto nonché nella preparazione isolato cordone nervoso. Quando non c'è feedback sensoriale o discendente ingresso presente modello motore ritmica prodotta viene chiamato locomozione fittizia 1, 2. Nel sistema swimmeret questo schema motorio non differisce in qualsiasi parametro dall'attività delle swimmerets misurati nell'animale intatto.
Il movimento di ciascun swimmeret è guidato da un microcircuito che si trova dentro e limitato a una corresponding hemiganglion 1 -. 3 In ogni microcircuito c'è un kernel generano tracciati che comprende cinque interneuroni identificati non spike. Essi possono essere funzionalmente caratterizzati come sia Inhibitor of Power Stroke (IPS) o inibitore della corsa di ritorno (IRS) 8. Questi IPS e interneuroni IRS non sono oscillatori endogeni, piuttosto la loro attività di alternanza è guidato da inibizione reciproca 9. Poiché questi interneuroni inibiscono direttamente i motoneuroni swimmeret, il movimento alternato PS-RS è generato 10. Locomotion tuttavia, non solo richiede la generazione di attività, ma anche il coordinamento dei vari microcircuiti indipendenti. Nel sistema swimmeret tale coordinamento è stabilito dal microcircuito coordinamento che assicura che gli arti sono attivi a volte corretti. Questo microcircuito è costruito da tre neuroni identificati in ogni segmento 11-15.
Questo protocollo prevede the prima volta una guida passo-passo dissezione per isolare la catena di gangli (T4 al A6, Figura 1). Mostriamo come al pin isolato cordone nervoso addominale e desheathe ogni ganglio. In questo isolato preparazione del sistema nervoso, i neuroni responsabili del movimento swimmeret sono pronti per l'uso negli esperimenti elettrofisiologici e morfologici. La seconda parte di questo protocollo illustra le caratteristiche principali del modello del motore swimmeret. Ciò include una guida step-by-step per registrare extracellulare l'attività dei motoneuroni swimmeret. Gli assoni dei neuroni motori RS proiettano attraverso il ramo anteriore del nervo N1, mentre assoni dei motoneuroni PS proiettano attraverso il ramo posteriore dello stesso nervo (Figura 1) 4. Quindi la loro attività può essere registrato da questi rami con elettrodi pin differenziali.

Figura 1: Isolati sistema nervoso dal ganglio toracico 4 (T4) per ganglio addominale 6 (A6) e un diagramma schematico di esso T4:. Ganglio toracico 4; T5: ganglio toracico 5; A1, A2 ... A6 ganglio addominale 1, ganglio addominale 2 ... ganglio addominale 6; N1: nervo N1; N2: nervo N2; N3: nervo N3; PS: power-stroke; RS: return-stroke. Abbreviazioni direzionali: A = anteriore; P = posteriori.
Questa procedura dissezione e la tecnica dimostrata elettrofisiologico sono convenienti per gli studenti universitari e studenti possono integrare corsi pratici in fisiologia. La catena di gangli isolato è stato utilizzato in una serie di esperimenti per studiare la funzione del sistema nervoso, coordinamento, o la modulazione di microcircuiti swimmeret 6 così come il controllo neuronale del comportamento adattativo in locomozione 16, 17. Il sistema gamberi swimmeret fornisce pertanto una quantità enorme di insegnamento interessanti o tPiove opportunità che iniziano tutti con la dissezione del cordone nervoso ventrale di gamberi e la registrazione extracellulare del pattern motorio fittizia.
Access restricted. Please log in or start a trial to view this content.
Protocollo
Questa procedura dissezione è in conformità con la Comunità europee Direttiva del Consiglio del 22 settembre 2010 (2010/63 / UE).
1. Preparazione
- Ottenere gamberi, Pacifastacus leniusculus (Dana), di entrambi i sessi ≥8 cm di dimensione. Assicurarsi che gli animali sono di vitale importanza e gli arti addome e addominali sono intatte.
- Fare attenzione a ispezionare il carapace e che questa cuticola è dura e rigida. Pre e animali postmolt hanno un carapace morbido e non sono adatti per gli esperimenti perché durante il processo di muta cambiare molti parametri (ad esempio, diminuzione dell'attività locomotoria).
- Montare tutti gli strumenti ei materiali utilizzati durante la dissezione, pinning e desheathing del cordone nervoso illustrato nella figura 2 ed elencati nei supplementi previsti.

Figura 2: Materiali e strumenti utilizzati per la dissezione, pinning e desheathing del cordone nervoso.
(1) grande secchio pieno di ghiaccio; (2) salina gamberi; (3) dispenser salina; (4) microscopio dissezione; (5) piatto dissezione; (6) forbici forti; (7) forcipe (8) forbici primavera; (9) piastra Petri rivestito con chiaro Sylgard; (10) perni di fissaggio; (11) con lampade a freddo.
2. Gross Dissection
- Anestetizzare animali sul ghiaccio per il 15 - 20 min. Effettuare la prima parte della dissezione lordo a un banco di laboratorio vicino al lavandino quanto comprende una fase dissanguamento e il campione deve essere risciacquato regolarmente con gamberi salina durante la procedura.
- Tenere animali lato ventrale e usare le forbici per tagliare entrambi forti artigli alle loro basi vicino al torace (Figura 3-1). Rimuovere uropod sinistra e destra (Figura 3-2).
- Posizionare il lato ventrale degli animali nel piatto dissezione allineato con Sylgard nero. Elevate cefalotorace inserendo ghiaccio sotto e appuntare l'addome al telson (Figura 4A).
- Riempire il dispenser salina con ~ 60 ml di soluzione salina fredda gamberi. Profumato gamberi con soluzione salina fredda attraverso l'apertura artiglio (Figura 4B). Salina eccesso sgocciolare attraverso i tagli alle uropods. Coprire gamberi con ghiaccio durante dissanguamento
- Decapitarlo l'animale con un unico taglio trasversale appena posteriormente agli occhi dell'animale con le forbici forti (Figura 5A). Rimuovere tutte le gambe che camminano vicino alle articolazioni di base come indicato nella figura 5B.
- Isolare l'addome con gli ultimi segmenti toracici dal resto del cefalotorace. Fare un primo taglio a livello della seconda gambe piedi (segmento toracico 3) inserendo la punta delle forbici nell'apertura della seconda gamba piedi e taglio al lato opposto. (Figura 6A-1).
- Estendere questo primo taglio per entrambe le parti attraverso tegli cefalotorace (Figura 6A-2).
- Capovolgere l'animale aperto per fare alcuni degli organi interni visibili. Premere il prominente ghiandola digestiva (Figura 6B-3) per la parte anteriore del campione e utilizzare pinze per rimuovere gli organi riproduttivi dalla cavità addominale.
- Togliere la parte anteriore del cefalotorace (Figura 6C). Utilizzare tagli laterali per rimuovere le parti laterali del carapace, che coprono le branchie, su entrambi i lati del torace rimanente (Figura 6D-4). Rimuovere le branchie e risciacquare il campione con soluzione fisiologica fredda.
- Continuare la dissezione con un taglio attraverso l'intera lunghezza della piastra sternale come indicato nella figura 6E-5. Rendere questo taglio in posizioni laterali massime tra Pleuron e swimmerets (segni rossi Figura 6 sexies). Procedere sull'altro lato con un stesso taglio. Sciacquare il campione con soluzione fisiologica fredda.
- Effettuare la dissezione rimanendo sotto un dissection microscopio. Posizionare addome lato ventrale del gambero di fiume nel piatto dissezione allineato con Sylgard nero e pieno di gamberi salina in modo da coprire il campione.
NOTA: Le seguenti operazioni (2,12-4,8) contengono istruzioni direzionali che si applicano a sperimentatori mano destra. Nei passi seguenti (2,12-6,8), è importante sostituire gamberi salina in intervalli regolari, ogni 20-30 minuti con soluzione salina fredda, per mantenere il sistema nervoso sano. - Fissare il campione con perni di insetti posteriormente al telson e anteriormente ai resti del carapace. Posizionare il campione in modo che i punti Telson a sinistra ed è parallela al bordo del tavolo.
- Utilizzare pinze grossolani nella mano sinistra per afferrare attraverso un'apertura gamba piedi (Figura 7A) ed estrarre il campione aperto (Figura 7B freccia bianca). Identificare i grandi due dorsali filoni flessore muscolari (Figura 7B-1 e C-1) e tagliare loro ventralebase come illustrato nella Figura 7B.
- Identificare l'arteria sternale (Figura 7C-2), che scende dalla dorsale (cuore) per ventrale, al segmento toracico 4 °. Questa arteria si trova proprio sopra il cordone nervoso (Figura 7C-3), prima che si proietta sotto il cordone nervoso, formando l'arteria ventrale.
- Transetto l'arteria sternale. Come mostrato in Figura 7C, sollevare l'arteria prima, usando una lama di forbici, e solo tagliare quando il cordone nervoso ventrale trova è visibile.
- Fissare i muscoli flessori dorsali anteriormente (a destra). Questo dovrebbe essere fatto in posizione di massima allungato con perni in modo da non bloccare la visione e il campione rimane tesa. Quando i filamenti muscolari dorsali sono fissi (Figura 8-1), il primo gangli addominali, A1 e A2, con i nervi associati N1, N2, N3 e sono visibili (Figura 8).
- Utilizzare pinze nella mano sinistra per afferrare le specificheImen in una sola apertura delle gambe a piedi. Durante il seguente dissezione passaggi tirare delicatamente per mantenere il campione aperto.
- Transect i nervi N3 nella posizione più distante dal cordone nervoso. (Figura 8-3).
- Tagliare i muscoli flessori vicino al apodeme ventrale come mostrato nella Figura 8-4. Fare attenzione a non danneggiare il cordone nervoso o nervi N2.
- Ripetere i passaggi 2.18 e 2.19 per i nervi N3 e dei muscoli flessori della restante gangli A2 addominale A5.
- Nell'ultima ganglio addominale, A6, tagliare i muscoli flessori dorsali dal apodeme ventrale e il campione dovrebbe apparire come mostrato nella Figura 9.
- Tagliare la piastra posteriore sternale ai nervi della A6 (Figura 9-1) e tenere la parte ventrale (Figura 9-2). Eliminare la parte dorsale con i muscoli flessori (Figura 9-3). Fissare la piastra sternale anteriormente con perni attraverso le aperture delle gambe piedi,e posteriormente a A6.
3. Belle Dissection
- Porre il preparato al microscopio con la parte anteriore rivolta di distanza e la parte posteriore verso il bordo dei tavoli.
- Utilizzare pinze come mostrato in Figura 10A per rimuovere le parti più anteriori della sterna cephalothoracic.
NOTA: I gangli del torace e nervi associati sono in parte coperti dalla muscolatura delle gambe e sterna cephalothoracic. La sterna cephalothoracic formare uno scheletro che separa le cavità situate lateralmente delle gambe piedi una dall'altra e dalla cavità mediale in cui il cordone nervoso ventrale risiede. - Tagliare i muscoli tra le rimanenti strutture Esoscheletriche come indicato in Figura 10B -1 e B2. Utilizzare pinze per afferrare e sollevare l'estremità anteriore del cordone nervoso ventrale (Figura 10C).
NOTA: Il cordone nervoso sarà danneggiato nel processo in modo da evitare raccogliendo Nerve il cavo più volte. - Tagliare i nervi toracici laterale mentre si solleva il cordone nervoso (Figura 10C-3). Mantenere questi nervi a lunghezza adeguata per appuntare. Rimuovere la parte spremuto della catena di gangli, che è stato raccolto con una pinza, tagliando via tutto il anterior tessuto T4 (Figura 10C-4).
- Posizionare il campione con la parte anteriore verso sinistra e concentrarsi su A1. Tagliare il N1 e N2 di nervi A1 ad una lunghezza adeguata (max. 1 cm) di spinatura fuori.
- Focus su A2 e identificare i nervi N1, N2, N3 e di questo segmento (Figura 11). I nervi N1 di gangli addominali A2-A5 risiedono tra due ripiegamenti cuticolari sternale in ogni segmento (Figura 11A-1) e sono coperti da muscolatura. Fare un taglio lungo la parte posteriore dello sterno ripiegamento cuticolare. Inizia il bordo laterale dell'addome e procedere verso la linea mediana, come mostrato in Figura 11A.
- Se la destinazione è ancora N1 coverosso con il tessuto come mostrato in Figura 11B (freccia rossa), tutto il taglio del fascio muscolare, ma questa volta anterior per entrambi ripiegamenti cuticolari sternali e il nervo N1 (Figura 11B-2).
- Tagliare nervo N1 distale possibile (Figura 11 C-3). Nerve N1 è completamente visibile e il ramo anteriore e posteriore può essere identificato (Figura 11C).
- Procedere alla N1 nervo controlaterale e la prima tagliare i muscoli lungo la parte posteriore dello sterno ripiegamento cuticolare, partendo medialmente, vicino il ganglio (Figura 11D). Se il nervo è ancora coperto da tessuto, tagliare il fascio muscolare, ma questa volta anterior per entrambi ripiegamenti cuticolari sternali e il nervo N1, simile alla figura 11B-2. Tagliare il N1 nervo distale possibile.
- Tagliare il nervi N2 del ganglio ad una lunghezza adatta (circa. 0,5 centimetri) di spinatura.
- Ripetere i passaggi 3,7-3,11 per i nervi di A3-A5.
- Tagliare il nerves di ganglio A6 distalmente possibile (Figura 12A). Utilizzare pinze per afferrare più nervi di A6 per sollevare questo ganglio e avviare isolare la catena dei gangli dalla piastra sternale.
- Mentre si solleva il cordone nervoso, tirare delicatamente nella parte anteriore, come mostrato nella Figura 12B (freccia bianca). Poiché i singoli gangli sono sollevati, rimuovere l'arteria ventrale che può essere attaccato al lato ventrale del cordone nervoso (Figura 12C). Continua questa sequenza (delicatamente) tirare taglio fino a quando il cordone nervoso è completamente isolato.
- Trasferire la catena isolata dei gangli di una capsula di Petri rivestito con chiaro Sylgard e riempito con soluzione salina gamberi (Figura 12D).
4. Pinning cordone nervoso nella piastra di Petri
NOTA: Usare piccoli perni tagliati da filo di acciaio inossidabile (vedi supplementi) per bloccare il cordone nervoso. Toccare solo il nervo che termina con le pinze e non fare squeezvia e connettivi o gangli.
- Pin la catena di gangli in linea retta, mentre si applica tratto delicato.
- Disporre il cordone nervoso nella capsula di Petri con il lato dorsale verso l'alto (Figura 13, linea nera). Il lato ventrale dei gangli può essere identificato dal suo convessità; lato dorsale è piatto. Pin i nervi toracici ai lati. Continuare con i nervi di A6, si estende il cordone nervoso lungo il suo asse longitudinale.
- Pin i nervi di A1 ad un angolo di 90 ° rispetto al cordone nervoso.
- Procedere alla A2 e pin nervi N2 ad un angolo di 35-45 ° rispetto al cordone nervoso (Figura 1A).
- Separare i nervi N1 nelle loro anteriori e posteriori rami prima pinning come mostrato nella Figura 14. Utilizzare due coppie di pinze sottili a prendere con un paio di pinze anteriore e con l'altra il ramo posteriore del nervo N1. Fare attenzione a scegliere solo alla fine più distales dei rami nervosi. Ora tirare con cautela.
- Pin il ramo anteriore del nervo N1 ad un angolo di 90 ° rispetto al cordone nervoso (Figura 1A). Pin il ramo posteriore del nervo N1 tra il ramo N1 anteriore e il nervo N2.
- Ripetere la procedura 4,4-4,6 per i nervi dei gangli A3-A5. Mentre fissarsi il tratto cordone nervoso in longitudinale e senso trasversale.
5. Desheathing gangli
- Posizionare il preparato in modo tale che le mani del sperimentatore sono sempre appoggiati su un piano stabile per evitare scuotimento. Per desheath i gangli illuminano il cordone nervoso dal basso.
- Focus su qualsiasi gangli A1 addominale A5. Usare le forbici primavera pregiati per fare un piccolo taglio laterale attraverso la guaina gangli, posteriore al ganglio e tra i nervi N2 e N3 (Figura 15A freccia rossa).
- Sollevare la guaina ganglio utilizzando molto fpinze ine e tagliati trasversalmente attraverso la guaina sopra connettivi, come indicato in Figura 15A-1. Fare attenzione a non comprimere o tagliare il cordone nervoso con le forbici.
- Sempre tenendo e sollevando la guaina gangli con una pinza continuano a tagliare lungo i bordi laterali del ganglio (Figura 15B-2 e -3). Rimuovere la guaina. Alternativamente pin per entrambi i lati dei connettivi in modo tale che è fisso, ma il cordone nervoso non venga schiacciato.
- Ripetere i passaggi 5,2-5,4 per tutti addominale gangli A1 a A5.
- Desheathe i gangli del torace e il ganglio A6 in modo simile. Per desheathe A6 anteriori inizio al ganglio e procedere in direzione posteriori. Pin guaina gangli della A6 alla estremità posteriore della catena di gangli.
6. extracellulare registrazioni da Motor neuroni
- Montare tutti gli strumenti ei materiali utilizzati per le registrazioni extracellulari indicati in Figura 16B ed elencati nei supplementi. Una panoramica del sistema di registrazione è mostrato in Figura 16A. Avviare tutte le apparecchiature elettroniche utilizzate in questo esperimento (Figura 16C), in modo che gli amplificatori possono riscaldarsi per almeno 30 minuti prima della registrazione. Accendere il computer e avviare il software di registrazione.
- Posizionare la catena di gangli sul tavolo microscopio e illuminare dal basso. Inserire l'elettrodo di registrazione nel sylgard vicino al nervo bersaglio e l'elettrodo di riferimento in una posizione vicina, ma lateralmente alla gangli (Figura 17A e B). Piegare il nervo target intorno l'elettrodo di registrazione (Figura 17C).
- Stretch il nervo leggermente, per assicurare il contatto tra l'elettrodo e il nervo e il pin di lato (F IGURA 17D). Fissare i cavi degli elettrodi al tavolo del microscopio con plastilina, in modo da rimanere nella posizione desiderata.
- Utilizzare unsiringa piena di vaselina e un ago calibro 20 (con punta arrotondata) (Figura 17E-3) per isolare il nervo bersaglio dalla soluzione di balneazione. Prima tamponare alcuni vaselina sulla sylgard intorno l'elettrodo di registrazione. Il risultato è uno strato di vaselina copre il Sylgard in prossimità dell'elettrodo di registrazione (Figura 17E-4). Fare attenzione a non tamponare direttamente sul nervo e di evitare bolle d'aria in questo strato.
- Sigillare l'elettrodo di registrazione con vaselina da tutti i lati fino al livello della superficie della soluzione salina (Figura 17F).
- Ripetere questa procedura per tutti i nervi di destinazione cui attività devono essere monitorati.
- Avviare la registrazione. Utilizzare una modalità di acquisizione gratuita continuo o gap e una frequenza di campionamento di 5 kHz. Impostare l'amplificatore extracellulare ai seguenti parametri; guadagnare a 1.000 (amplifica il segnale 1.000 volte, aver cura di includere questo parametro di amplificazione nelle impostazioni del software di acquisizione) unada gamma filtro passa-banda di 300 Hz (taglio basso) a 2.000 Hz (high cut).
Access restricted. Please log in or start a trial to view this content.
Risultati
Con le registrazioni extracellulari simultanee da RS e PS, motoneuroni di uno ganglio, l'attività alternata di queste piscine motoneuroni, può essere monitorato (Figura 18), che rappresenta lo schema locomozione fittizia.
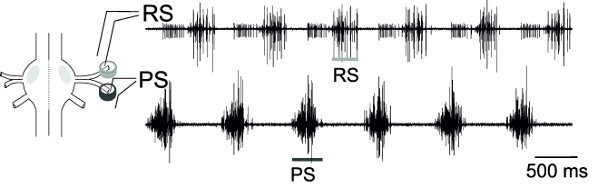
Figura 18: Schema di un ganglio e il posizionamento di elettrodi pin differenziale registrazione extracellulare di RS motoneuroni (traccia superiore) e P...
Access restricted. Please log in or start a trial to view this content.
Discussione
L'anatomia di gamberi e la loro gangli addominali è stata descritta in precedenza 5, 18, 19, 20 e si consiglia di acquisire familiarità con essi prima della dissezione, per evitare il taglio dei nervi importanti.
È fondamentale per mantenere il preparato a temperature inferiori a 23 ° C per evitare la degradazione del cordone nervoso isolato. Ciò può essere ottenuto facilmente mediante sostituzione della soluzione di balneazione ogni 20-30 min con soluzione s...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
The authors declare that they have no competing financial interests.
Riconoscimenti
Ringraziamo Jos Burgert per aiutare con alcune delle figure. Siamo grati a Ingo Selbach (e il gruppo "Edelkrebsprojekt NRW") per i suoi sforzi per fornire il laboratorio con animali da esperimento. Ringraziamo Anna C. Schneider per la correzione prime versioni del manoscritto. Questa ricerca è stata sostenuta da un Emmy Noether DFG concessione SM 206 / 3-1 e una sovvenzione di avvio dell'Università di Colonia per docenti di sesso femminile.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| 4-channel extracellular amplifier: MA 102 | Amplifier | Elektroniklabor, Zoologie, Universität zu Köln, Germany | |
| air-table | Technical Manufacturing Corporation (TMC) a unit of AMETEK Ultra Precision Technologies, Peabody, MA, USA | 63-534 | |
| Axon Digidata 1440A | Digitizer | Axon Instruments, Molecular Devices Design, Union City, CA | DD1440A |
| big bucket | |||
| Clampex & Clampfit | pClamp 10, recording and analysis software | Molecular Devices Design, Union City, CA | pClamps 10 Standard |
| cold lamp source | with flexible light guide (fiber optic bundle) | Euromex microscopes holland, Arnhem, BD | LE.5211 & LE.5235 |
| computer and monitor | equipped with recording software | ||
| container and pipette for liquid waste | |||
| crayfish saline | contains (in mM): 5.4 KCl, 2.6 MgCl2, 13.5 CaCl2, and 195 NaCl, buffered with 10mM Tris base and 4.7mM maleic acid; aerated for 3 hours. Adjust at pH of 7.4. | ||
| dextran, Texas Red (3000MW, lysine fixable) | fluorescent dye, lysine fixable | Life Technologies GmbH, Darmstadt, Germany | D3328 |
| dissection dish | (l x w x h) 15x7x5 cm; linned with black silicone | ||
| faraday cage | |||
| fixing pins | |||
| forceps (biology, Dumont #5) | Forceps: Biology, tip 0.05 x 0.02 mm, length 11cm, INOX | Fine Science Tools (FST), Germany | 11252-20 |
| forceps (biology, Dumont #55) | Forceps: Biology, tip 0.05 x 0.02 mm, length 11cm, INOX | Fine Science Tools (FST), Germany | 11255-20 |
| forceps (electronic, Dumont #5) | Forceps: Standard, tip 0.1 x 0.06 mm, length 11cm, INOX | Fine Science Tools (FST), Germany | 11251-20 |
| intracellular electrode | Borosilicate glass capillaries (outer/inner diameter: 1mm/0.5mm), with filament | Sutter Instruments, Novato, CA | BF100-50-10 |
| Leica S8 Apo StereoZoom | Dissection Microscope Zoom 1x - 8x | Leica, Germany | 10446298 |
| microscope table | |||
| mirror | to illuminate preparation from below | ||
| modeling clay | |||
| Olympus SZ61 | Dissection Microscope Zoom 0.67x - 4.5x | Olympus, Germany | |
| petri dish | 94 x 16 mm; lined with clear silicone | Greiner bio-one, Germany | 633180 |
| ring scissors | ThoughCut, cutting edge: sharp/blunt, straight: 13cm | Fine Science Tools (FST), Germany | 14054-13 |
| spring scissors or alternative: Vannas spring scissors | cutting edge: 8 mm, tip diameter: 0.2mm, straight: 10cm or cutting edge 2.5 mm, tip diameter 0.075 mm, straight: 8cm | Fine Science Tools (FST), Germany | 15024-10 or 15000-08 |
| student Vannas spring scissors or alternative: Moria Spring Scissors | cutting edge: 5mm, tip diameter: 0.35mm, straight: 9cm or cutting edge: 5mm, tip diameter 0,1 mm, straight: 8 cm | Fine Science Tools (FST), Germany | 91500-09 or 15396-00 |
| sylgard | 184 Silicone Elastomer Base and Curing Agent; for black sylgard add activated carbon | Dow Corning, Midland, MI, USA | |
| syringe filled with petroleum jelly and equipped with a 20 gauche needle with rounded tip |
Riferimenti
- Hughes, G. M., Wiersma, C. A. G. The Co-Ordination of Swimmeret Movements in the Crayfish, Procambarus-Clarkii (Girard). J Exp Biol. 37 (4), 657-670 (1960).
- Mulloney, B., Smarandache, C. Fifty Years of CPGs: Two Neuroethological Papers that Shaped the Course of Neuroscience. Front Behav Neurosci. 4, 45(2010).
- Murchison, D., Chrachri, A., Mulloney, B. A Separate Local Pattern-Generating Circuit Controls the Movements of Each Swimmeret in Crayfish. J Neurophys. 70 (6), 2620-2631 (1993).
- Mulloney, B., Hall, W. M. Functional organization of crayfish abdominal ganglia. III. Swimmeret motor neurons. J Comp Neurol. 419 (2), 233-243 (2000).
- Davis, W. J. Lobster Righting Responses and Their Neural Control. Proc R Soc Ser B-Bio. 170 (1021), 435-456 (1968).
- Mulloney, B., Smarandache-Wellmann, C. Neurobiology of the crustacean swimmeret system. Prog Neurobiol. 96 (2), 242-267 (2012).
- Huxley, T. H. The crayfish: An introduction to the study of zoology. , MIT Press. Cambridge, MA. (1980).
- Smarandache-Wellmann, C., Weller, C., Wright, T. M., Mulloney, B. Five types of nonspiking interneurons in local pattern-generating circuits of the crayfish swimmeret system. J Neurophys. 110 (2), 344-357 (2013).
- Skinner, F. K., Mulloney, B. Intersegmental coordination of limb movements during locomotion: mathematical models predict circuits that drive swimmeret beating. J Neurosci. 18 (10), 3831-3842 (1998).
- Mulloney, B. During fictive locomotion, graded synaptic currents drive bursts of impulses in swimmeret motor neurons. J Neurosci. 23 (13), 5953-5962 (2003).
- Smarandache-Wellmann, C., Grätsch, S. Mechanisms of coordination in distributed neural circuits: Encoding coordinating information. J Neurosci. 34 (16), 5627-5639 (2014).
- Mulloney, B., Hall, W. M. Local commissural interneurons integrate information from intersegmental coordinating interneurons. J Comp Neurol. 466 (3), 366-376 (2003).
- Mulloney, B., Harness, P. I., Hall, W. M. Bursts of information: Coordinating interneurons encode multiple parameters of a periodic motor pattern. J Neurophys. 95 (2), 850-861 (2006).
- Smarandache, C., Hall, W. M., Mulloney, B. Coordination of Rhythmic Motor Activity by Gradients of Synaptic Strength in a Neural Circuit That Couples Modular Neural Oscillators. J Neurosci. 29 (29), 9351-9360 (2009).
- Smarandache-Wellmann, C., Weller, C., Mulloney, B. Mechanisms of Coordination in Distributed Neural Circuits: Decoding and Integration of Coordinating Information. J Neurosci. 34 (3), 793-803 (2014).
- Chrachri, A., Neil, D., Mulloney, B. State-Dependent Responses of 2 Motor Systems in the Crayfish, Pacifastacus leniusculus. J Comp Physiol A. 175 (3), 371-380 (1994).
- Chrachri, A., Neil, D. M. Interaction and Synchronization between 2 Abdominal Motor Systems in Crayfish. J Neurophys. 69 (5), 1373-1383 (1993).
- Skinner, K. The Structure of the 4th Abdominal-Ganglion of the Crayfish, Procambarus-Clarki (Girard) II. Synaptic Neuropils. J Comp Neurol. 234 (2), 182-191 (1985).
- Skinner, K. The Structure of the 4th Abdominal-Ganglion of the Crayfish, Procambarus-Clarki (Girard) I. Tracts in the Ganglionic Core. J Comp Neurol. 234 (2), 168-181 (1985).
- Mulloney, B., Tschuluun, N., Hall, W. M. Architectonics of crayfish ganglia. Microsc Res Techniq. 60 (3), 253-265 (2003).
- Braun, G., Mulloney, B. Cholinergic modulation of the swimmeret motor system in crayfish. J Neurophys. 70 (6), 2391-2398 (1993).
- Davis, W. J. Motoneuron Morphology and Synaptic Contacts - Determination by Intracellular Dye Injection. Science. 168 (3937), 1358-1360 (1970).
- Altman, J. S., Tyrer, N. M. Filling Selected Neurons with Cobalt through Cut Axons. Neuroanatomical Techniques. Strausfeld, N. J., Miller, T. A. , Springer. New York, NY. 373-402 (1980).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon