Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Die swimmeret System der Crayfish: Ein praktischer Leitfaden für die Dissektion der Nervenstrang und extrazellulären Recordings der Motor Pattern
In diesem Artikel
Zusammenfassung
Here we describe the dissection of the crayfish abdominal nerve cord. We also demonstrate an electrophysiological technique to record fictive locomotion from swimmeret motor neurons.
Zusammenfassung
Hier zeigen wir die Dissektion der Krebse Bauchnervenstrang. Die Herstellung umfasst den letzten zwei Thoracalganglien (T4, T5) und die Kette der Abdominalganglien (A1 bis A6). Diese Kette von Ganglien umfasst den Teil des zentralen Nervensystems (ZNS), die koordinierte Bewegungs der Pleopoden (swimmerets) treibt: der swimmeret System. Es ist für mehr als fünf Jahrzehnten, die in Flusskrebse jeweils swimmeret wird durch eine eigene, unabhängige Mustererzeugungs Kernel, der rhythmischen Wechselaktivität 1-3 erzeugt angetrieben bekannt. Die Motoneuronen innervieren die Muskulatur jeder swimmeret anatomisch und funktionell unterschiedliche Populationen 4 umfassen zwei. Einer ist für den Rückzug (Arbeitstakt, PS) des swimmeret verantwortlich. Die andere treibt die Verschleppung (Rücklauf, RS) des swimmeret. Motoneuronen des swimmeret Systems sind in der Lage, spontan eine fiktive Motor Muster, welches identisch mit dem in vivo aufgezeichnete Muster ist 1.
Das Ziel dieses Berichts ist es, eine interessante und bequeme Modellsystem zur Untersuchung Rhythmus erzeugenden Netzwerke und Koordination von unabhängigen Mikroschaltungen aus praktischen Laborkurse Schüler einzuführen. Die zur Verfügung gestellten Protokoll enthält Schritt-für-Schritt-Anleitung für die Präparation der Bauchnervenstrang der Krebse ist, Pinning der isoliert Kette von Ganglien, desheathing die Ganglien und die Aufzeichnung der swimmerets fiktiven Motor Muster extrazellulär aus dem isolierten Nervensystem.
Darüber hinaus können wir die Aktivität von Neuronen swimmeret intrazellulär von Dendriten, aufgezeichnet. Hier beschreiben wir kurz auch diese Techniken und stellen einige Beispiele. Weiterhin kann die Morphologie swimmeret Neuronen mit Färbetechniken beurteilen. Hier stellen wir Beispiele für intrazelluläre (durch Iontophorese) Farbstoff gefüllt Neuronen und Hinterfüllungen von Pools von swimmeret Motoneuronen. In unserem Laborwir diese Vorbereitung auf die Grundfunktionen des fiktiven Fortbewegung, die Wirkung der sensorischen Rückmeldung über die Aktivität des ZNS, und die Koordinierung zwischen Mikroschaltungen auf zellulärer Ebene zu untersuchen.
Einleitung
Die swimmerets von Krebsen dienen eine Funktion in Lageregelung und schlugen rhythmisch, wenn die Tiere schwimmen freuen, lüften ihre Höhlen oder Weibchen ihre Eier belüften 5, 6. Die swimmerets der Signalkrebs, Pacifastacus leniusculus treten paarweise vom zweiten bis zum fünften Abdominalsegment, mit einem Schenkel auf jeder Seite des Bauches 7. Das Zentralnervensystem produziert eigener rhythmischen Motor Rüttler, der die swimmeret Bewegung in intakten Tier als auch in der isolierten Nervenstrang Herstellung antreibt. Wenn es keine sensorische Rückmeldung oder absteige gegenwärtigen Eingangs die erzeugte rhythmische Motormuster heißt fiktive Lokomotion 1, 2. Im swimmeret System dieser Motor Muster nicht in jedem Parameter aus der Aktivität der swimmerets im intakten Tier gemessen abweichen.
Die Bewegung jedes swimmeret wird durch eine Mikroschaltung, die in sich und mit einem c beschränkt angetriebenhenden hemiganglion. 1 - 3 In jedem Mikro es eine Mustererzeugungs Kernel, der fünf identifizierten nicht Spiking Inter umfasst. Sie können funktionell als charakterisiert werden entweder Inhibitor of Power Stroke (IPS) oder Inhibitor of Return Stroke (IRS) 8. Diese IPS und IRS Inter nicht endogene Oszillatoren, sondern ihre Wechselaktivität wird durch reziproke Hemmung 9 angetrieben. Da diese Inter direkt hemmen die swimmeret Motoneurone wird die Wechsel PS-RS Bewegung erzeugt 10. Locomotion jedoch erfordert nicht nur die Erzeugung der Aktivität, sondern auch die Koordination der verschiedenen unabhängigen Mikroschaltungen. Im swimmeret System wird von der koordinierenden Mikroschaltung, die gewährleistet, dass Gliedmaßen richtigen Zeiten aktiv sind, eine solche Koordinierung etabliert. Diese Mikroschaltung wird von drei identifizierten Neuronen in jedem Segment 11 bis 15 aufgebaut.
Dieses Protokoll sieht the erstmals ein Schritt-für-Schritt-Dissektion Führung, um die Kette der Ganglien (T4 bis A6, 1) zu isolieren. Wir zeigen, wie man den Stift isoliert Bauchnervenstrang und desheathe jedes Ganglion. In diesem isoliert Nervensystem Vorbereitung sind die Neuronen für swimmeret Bewegung verantwortlich bereit für den Einsatz in elektrophysiologischen und morphologischen Experimente. Der zweite Teil dieses Protokolls zeigt die Hauptmerkmale des Motor swimmeret Muster. Dies beinhaltet eine Schritt-für-Schritt-Anleitung zum extrazellulär Rekord die Aktivität swimmeret Motoneuronen. Axone RS Motorneuronen projizieren durch den vorderen Ast von Nerven N1, während Axone PS Motorneuronen projizieren durch den hinteren Ast desselben Nerven (Abbildung 1) 4. Daher kann ihre Tätigkeit den folgenden Buchhandlungen mit Differenzstiftelektroden aufgezeichnet werden.

1: Getrenntes Nervensystems aus Brustganglion 4 (T4) zu Abdominalganglion 6 (A6) und ein schematisches Diagramm davon T4. Brustganglion 4; T5: thorakalen Ganglion 5; A1, A2 ... A6 Abdominalganglion 1, Abdominalganglion 2 ... Abdominalganglion 6; N1: Nerven N1; N2: Nerven N2; N3: Nerven N3; PS: Macht-Takt; RS: Rücktakt. Directional Abkürzungen: A = Front; P = posterior.
Diese Dissektion Verfahren und die elektrophysiologische Technik gezeigt, sind geeignet für Studenten und Schüler können Praktika in der Physiologie zu ergänzen. Die isolierte Kettenganglien wurde in einer Reihe von Versuchen verwendet worden, um Funktion des Nervensystems, Koordination oder Modulation swimmeret Mikro 6 sowie neuronalen Steuerung der adaptiven Verhaltens der Lokomotion 16, 17 untersucht werden. Das Krebs swimmeret System stellt somit einen enormen von interessanten Unterricht oder tregnet Möglichkeiten, die alle beginnen mit der Präparation der Bauchmark von Flusskrebsen und extrazelluläre Aufnahme der fiktiven Motor Muster.
Access restricted. Please log in or start a trial to view this content.
Protokoll
Diese Dissektion Verfahren ist gemäß der Europäischen Gemeinschaften Richtlinie des Rates vom 22. nd September 2010 (2010/63 / EU).
1. Vorbereitung
- Erhalten Krebse, Pacifastacus leniusculus (Dana), beider Geschlechter ≥8 cm groß. Stellen Sie sicher, dass die Tiere sind von entscheidender Bedeutung und den Bauch und Bauch Gliedmaßen intakt sind.
- Achten Sie darauf, um den Panzer zu untersuchen und dass diese Schuppenschicht ist hart und steif. Vor- und postmolt Tiere haben einen weichen Panzer und werden, weil während der Häutungsprozess viele Parameter verändern nicht für Experimente geeignet (zB Verringerung der Bewegungsaktivität).
- Montieren Sie alle Werkzeuge und Materialien während der Präparation verwendet, Pinning und desheathing der Nervenstrang in Abbildung 2 dargestellt und in den Ergänzungen geliefert wurde.

Abbildung 2: Materialien und Werkzeuge für die Zerlegung verwendet, Pinning und desheathing der Nervenstrang.
(1) großen Eimer mit Eis gefüllt; (2) Krebse Kochsalzlösung; (3) Kochsalzspender; (4) Dissektionsmikroskop; (5) Dissektion Gericht; (6) starke Schere; (7) Pinzetten (8) Frühling Schere; (9) Petrischale mit klaren Sylgard gesäumten; (10) Befestigungsstifte; (11) kalt Lampenquelle.
2. Brutto-Dissektion
- Anesthetize Tier auf Eis für 15 - 20 min. Führen Sie den ersten Teil des Brutto-Dissektion bei einem Labortisch in der Nähe der Spüle, da sie einen Schritt Ausbluten und die Probe muss während des Verfahrens regelmäßig mit Flusskrebsen Kochsalzlösung gespült werden.
- Halten Tierbauchseite nach oben und nutzen starke Schere beide Klauen an ihren Basen in der Nähe des Brustkorbs (Abbildung 3-1) zu schneiden. Entfernen Sie links und rechts Uropod (Abbildung 3-2).
- Legen Sie das Tier Bauchseite nach oben in der Dissektion Gericht mit schwarzen Sylgard ausgekleidet. Elevate Cephalothorax indem Eis unter und stecken Sie den Bauch an Telsons (4A).
- Füllen Sie den Salzspender mit ~ 60 ml gekühltes Krebse Kochsalzlösung. Perfuse Krebse mit kalter Kochsalzlösung durch die Krallenöffnung (4B). Überschüssiges Salz wird durch die Einschnitte bei den Uropoden abtropfen. Bedecken Sie Krebse mit Eis während Ausbluten
- Enthaupten das Tier mit einem einzigen Quer schneiden nur die Augen der Tiere mit starken Schere (5A) posterior. Entfernen Sie alle Laufbeinen in der Nähe der Grundgelenke, wie in 5B dargestellt.
- Isolieren Sie den Bauch mit den letzten Thoraxsegmente vom Rest Cephalothorax. Einen ersten Schnitt in der Ebene der zweiten Schreitbeine (Brustsegment 3) durch Einführen der Spitze der Schere in die Öffnung des zweiten Schreitbein und Schneiden auf der gegenüberliegenden Seite. (6A-1).
- Verlängern Sie diesen ersten Schnitt zu beiden Seiten durch ter Cephalothorax (6A-2).
- Klappen Sie den Tier offen machen einige der inneren Organe sichtbar. Drücken Sie die prominente Verdauungsdrüse (6B-3) auf den vorderen Teil der Probe und verwenden Pinzette, um die Fortpflanzungsorgane aus der Bauchhöhle zu entfernen.
- Entfernen Sie den vorderen Teil des Cephalothorax (6C). Verwenden seitliche Schnitte, die seitlichen Teile des Panzers, die die Kiemen decken auf beiden Seiten des verbleibenden Brustkorb (6D-4) zu entfernen. Entfernen Sie die Kiemen und spülen Sie die Probe mit kaltem Salzlösung.
- Weiterhin die Präparation mit einem Schnitt durch die gesamte Länge des Brustbeinplatte, wie in 6E-5 angegeben. Machen Sie diesen Schnitt bei maximaler seitlichen Positionen zwischen pleuron und swimmerets (6E rote Markierung). Gehen Sie auf der anderen Seite mit einem gleichen Schnitt. Spülen Sie die Probe mit kaltem Salzlösung.
- Führen Sie die verbleibenden Dissektion unter DISSECTIOn Mikroskop. Zeigen Bauch Bauchseite der Flusskrebs ist in der Dissektion Gericht mit schwarzen Sylgard gesäumten und mit Flusskrebsen Kochsalzlösung gefüllt, so dass es die Probe umfasst.
HINWEIS: In den folgenden Schritten (2,12 bis 4,8) enthalten Richtungsanweisungen, die Rechtshänder Experimentatoren anzuwenden. In den folgenden Schritten (2,12 bis 6,8) ist es wichtig, Krebse Kochsalzlösung in regelmäßigen Abständen mit kalter Kochsalzlösung zu ersetzen, alle 20-30 Minuten, um das Nervensystem gesund zu halten. - Befestigen Sie die Probe mit Insektenstifte hinten an der Telson und nach vorn auf die Überreste des Panzers. Legen Sie die Probe, so dass die telson Punkte links und parallel zu der Tischkante.
- Verwenden Grobzange in der linken Hand, um durch eine Laufbeinöffnung (7A) zu packen und ziehen Sie die Probe geöffnet (7B weißer Pfeil). Identifizieren Sie die großen zwei Rückenbeugemuskelstränge (7B-1 und C-1) und schneiden ihre ventraleBasis, wie in 7B gezeigt.
- Identifizieren Sie die Brustbeinschlagader (7C-2), die von Rücken (das Herz), senkt sich auf ventralen, auf der 4. Brustsegment. Diese Arterie liegt direkt über dem Nervenstrang (7C-3), bevor sie Projekte unter dem Nervenstrang und bilden die Bauchschlagader.
- Durchschneiden die Brustbeinarterie. Wie in 7C gezeigt, heben Sie die Arterie ersten, mit einer Klinge der Schere, und nur unterbrochen, wenn das ventral Nervenstrang sichtbar ist.
- Befestigen Sie die Rückenbeugemuskeln nach vorn (nach rechts). Dies sollte in maximal gestreckte Lage mit Stiften getan, damit sie nicht Vision zu sperren und die Probe bleibt gespannt. Wenn die Rückenmuskelstränge fixiert (Figur 8-1), die erste Abdominalganglien, A1 und A2, mit zugeordneten Nerven N1, N2 und N3 sind sichtbar (Figur 8).
- Verwenden einer Pinzette in der linken Hand, um die Spezifikation zu packenimen an einer Öffnung der Laufbeine. In der folgenden Sektion Schritte ziehen Sie vorsichtig, um die Probe offen zu halten.
- Durchschneiden die Nerven N3 an der entferntesten Position von der Nervenstrang. (Bild 8-3).
- Schneiden Sie die Beugemuskeln in der Nähe des ventralen apodeme wie in Abbildung 8-4 gezeigt. Achten Sie darauf, den Nervenstrang oder die Nerven N2 beschädigen.
- Wiederholen Sie die Schritte 2.18 und 2.19 für die Nerven N3 und die Beugemuskeln des verbleibenden Bauchganglien A2 bis A5.
- Bei der letzten Abdominalganglion, A6, schneiden Sie die Rückenbeugemuskeln von der ventralen apodeme und sollte die Probe, wie in Abbildung 9 gezeigt aussehen.
- Schneiden Sie die Sternalplatte posterior an den Nerven der A6 (Bild 9-1) und halten Sie die Bauchteil (Bild 9-2). Entsorgen Sie das Rückenteil mit Beugemuskeln (Bild 9-3). Befestigen Sie die Sternalplatte vorne mit Nadeln durch die Öffnungen der Laufbeinen,und nach hinten bis A6.
3. Fein Dissection
- Legen Sie die Probe unter dem Mikroskop mit dem vorderen Teil weg gerichtet und den hinteren Teil in Richtung der Tabellen Rand.
- Pinzette benutzen, wie in Figur 10A gezeigt ist, um die vorderen Teile der kephalothorakalen sterna entfernen.
HINWEIS: Die Brustganglien und Nerven verbunden sind teilweise durch die Beinmuskulatur und kephalothorakalen sterna bedeckt. Kephalothorakalen sterna bilden ein Gerüst, das die seitlich angeordneten Hohlräume der Laufbeine voneinander und von der medialen Hohlraum, in dem die Bauchmark befindet trennt. - Schneiden die Muskeln zwischen den verbleibenden exoskeletal Strukturen, wie in 10B angegeben -1 und B2. Verwenden einer Pinzette zu greifen und heben Sie das vordere Ende des Bauchmark (Abbildung 10C).
HINWEIS: Der Nervenstrang wird dabei beschädigt werden, vermeiden Abheben des nerve Kabel mehrmals. - Schneiden Sie die Thorakalnerven seitlich beim Anheben der Nervenstrang (10C-3). Bewahren Sie diese Nerven bei geeigneter Länge für das Feststecken. Entfernen Sie den gepressten Teil der Kette der Ganglien, die sich mit einer Pinzette aufgenommen wurde, durch Wegschneiden alle Gewebe anterior T4 (10C-4).
- Legen Sie die Probe mit dem vorderen Teil auf der linken Seite und konzentrieren sich auf A1. Schneiden die Nerven N1 und N2 von A1 an einer geeigneten Länge (max. 1 cm) dem Pinnen sie aus.
- Konzentrieren Sie sich auf A2 und identifizieren die Nerven N1, N2 und N3 in diesem Segment (Abbildung 11). Die Nerven N1 Abdominalganglien A2-A5 liegen zwischen zwei Sternalpe kutikulären Einfaltungen in jedes Segment (11A-1) und von Muskeln bedeckt. Machen Sie einen Schnitt entlang der hinteren Brustbein Kutikula Einfaltung. Beginnen am seitlichen Rand der Bauch und dann in Richtung der Mittellinie, wie in 11A gezeigt.
- Wenn die Ziel N1 noch Buchtrot mit Gewebe, wie in Figur 11B (roter Pfeil) gezeigt, entlang der Muskelbündel geschnitten, aber diesmal vorderen sowohl sternal kutikulären Einstülpungen und die Nerven N1 (11B-2).
- Schneiden Nerven N1 als distal wie möglich (11C-3). Nerve N1 vollständig sichtbar ist und die vorderen und hinteren Niederlassung identifiziert werden können (Abbildung 11C).
- Fahren Sie mit der kontralateralen Nerven N1 und ersten Schnitt die Muskeln entlang der hinteren Brustbein Kutikula Einfaltung, beginnend medial, in der Nähe des Ganglion (11D). Wenn der Nerv noch von Gewebe bedeckt ist, auf der Muskelbündel geschnitten, aber diesmal vorderen sowohl sternal kutikulären Einstülpungen und die Nerven N1, ähnlich zu 11B-2 Abbildung. Schneiden Sie den Nerven N1 als distal wie möglich.
- Schneiden Sie die Nerven N2 dieses Ganglion auf eine geeignete Länge (ca. 0,5 cm) für das Feststecken.
- Wiederholen Sie die Schritte 3,7 bis 3,11 für die Nerven der A3-A5.
- Schneiden Sie den Download vonves von Ganglien A6 als distal wie möglich (Abbildung 12A). Verwenden einer Pinzette, um mehrere Nerven des A6 zu greifen, diese Ganglien heben und starten Isolierung der Kette von Ganglien von der Brustbeinplatte.
- Heben Sie den Nervenstrang, ziehen Sie es vorsichtig in die vordere Richtung wie in 12B (weißer Pfeil) demonstriert. Da die einzelnen Ganglien aufgehoben werden, entfernen Sie die Bauchschlagader, die auf der Bauchseite der Nervenstrang (12C) befestigt werden kann. Setzen Sie diese (leicht) Pull-Schnitt-Sequenz, bis der Nervenstrang ist komplett isoliert.
- Übertragen Sie die isoliert Kette von Ganglien in eine Petrischale mit klaren Sylgard gesäumten und mit Flusskrebsen Salzlösung (12D) gefüllt.
4. abstecken Nervenstrang in die Petrischale
HINWEIS: Verwenden Sie kleine Stifte aus Edelstahldraht geschnitten (siehe Ergänzungsmittel), um den Nervenstrang zu befestigen. Berühren Sie nur die Nervenende mit der Zange und nicht squeezE die Verknüpfungen oder Ganglien.
- Pin der Kette von Ganglien in einer geraden Linie, während leichtem Stretch.
- Ordnen Sie den Nervenstrang in der Petrischale mit der Rückenseite nach oben (Abbildung 13, schwarze Linie). Die ventrale Seite des Ganglien kann durch seine Konvexität identifiziert werden; die Rückenseite ist flach. Stecken Sie die Brustnerven an den Seiten. Weiterhin mit den Nerven A6, Strecken des Nervenstrang entlang seiner Längsachse.
- Pinanordnung die Nerven der A1 in einem 90 ° Winkel relativ zu dem Nervenstrang.
- Fahren Sie mit A2 und Pin die Nerven N2 in einem Winkel von 35 bis 45 ° gegenüber der Nervenstrang (1A).
- Trennen Sie die Nerven N1 in ihrem vorderen und hinteren Äste vor Pinning wie in Abbildung 14 gezeigt. Mit zwei Paar feinen Pinzette zu holen mit einer Pinzette die vordere und mit der anderen den hinteren Ast des Nervus N1. Achten Sie darauf, nur den distalen Ende abholens der Nervenäste. Nun ziehen Sie sie sorgfältig auseinander.
- Pin der vordere Ast des Nervus N1 in einem 90 ° Winkel relativ zu dem Nervenstrang (1A). Pin den hinteren Ast des Nervus N1 zwischen der vorderen N1 Zweig und dem Nerven N2.
- Wiederholen Sie die Schritte 4,4-4,6 für die Nerven der Ganglien A3-A5. Während Fixierung der Nervenstrang Strecke in Längs- als auch in Querrichtung.
5. Desheathing die Ganglien
- Stellen Sie das Präparat in der Weise, dass die Hände des Experimentators werden immer auf eine stabile Ebene ruhen, um zu vermeiden Schütteln. Um desheath beleuchten die Ganglien des Nervenstrang von unten.
- Konzentrieren Sie sich auf jeden Abdominalganglion A1 bis A5. Verwenden Sie feinen Federschere, einen kleinen seitlichen Schnitt durch das Ganglion Mantel machen, posterior zum Ganglion und zwischen die Nerven N2 und N3 (15A roter Pfeil).
- Nehmen Sie den Ganglien Mantel mit sehr fine Pinzette und quer über die Hülle über die Verknüpfungen zu schneiden, wie in 15A-1 angegeben. Achten Sie darauf, nicht zu drücken oder schneiden Sie den Nervenstrang mit der Schere.
- Noch halten und Anheben des Ganglion Mantel mit einer Pinzette es weiterhin entlang der seitlichen Ränder des Ganglion (15B-2 und -3) geschnitten. Entfernen Sie den Mantel. Alternativ Pin es zu beiden Seiten der Verknüpfungen in einer Weise, dass sie befestigt ist aber der Nervenstrang nicht gequetscht.
- Wiederholen Sie die Schritte 5,2-5,4 für alle Bauchganglien A1 bis A5.
- Desheathe den Brustganglien und die Ganglien A6 in ähnlicher Weise. Um A6 Start vorderen zum Ganglion desheathe und fahren nach posterior. Pin das Ganglion Hülle des A6 bis zum hinteren Ende der Kette von Ganglien.
6. extrazellulären Recordings von Motoneuronen
- Montieren Sie alle Werkzeuge und Materialien für angezeigt i extrazelluläre Ableitungen verwendetn 16B und in den Ergänzungen aufgeführt. Ein Überblick über die Aufnahme-Setup ist in 16A gezeigt. Starten Sie alle Geräte in diesem Experiment (Abbildung 16C) verwendet, so dass die Verstärker können sich für mindestens 30 Minuten vor der Aufnahme zu wärmen. Schalten Sie den Computer und starten Sie die Aufnahme-Software.
- Die Kette der Ganglien auf dem Mikroskoptisch und beleuchten von unten. Legen Sie die Aufnahme-Elektrode in die Sylgard in der Nähe des Zielnerven und der Referenzelektrode in einer Position in der Nähe, aber lateral der Ganglien (17A und B). Biegen Sie die Zielnerven um die Aufzeichnungselektrode (17C).
- Dehnen Sie den Nerven leicht, um den Kontakt zwischen der Elektrode und dem Nerven gewährleisten und stecken Sie es auf der Seite (B ild 17D). Befestigen Sie die Elektrodenkabel mit dem Mikroskoptisch mit Modelliermasse, so dass sie in der gewünschten Position zu bleiben.
- Verwenden Sie einSpritze mit Vaseline und einer 20-Gauge-Nadel (mit abgerundeten Spitze) gefüllt (17E-3), um das Zielnerven aus der Badlösung zu isolieren. Erste dab etwas Vaseline auf die Sylgard um die Aufzeichnungselektrode. Das Ergebnis ist eine Schicht Vaseline Abdecken der Sylgard in der Nähe der Aufzeichnungselektroden (17E-4). Achten Sie darauf, direkt auf die Nerven in dieser Schicht tupfen und vermeiden Sie Luftblasen.
- Verschließen Sie die Aufzeichnungselektrode mit Vaseline von allen Seiten bis an die Oberfläche Ebene der Kochsalzlösung (17F).
- Wiederholen Sie diesen Vorgang für alle Zielnerven, deren Aktivität überwacht werden soll.
- Starten Sie die Aufnahme. Verwenden Sie eine kontinuierliche oder eine Lücke frei Erfassungsmodus und eine Abtastrate von 5 kHz. Set für die extrazelluläre Verstärkers mit den folgenden Parametern; gewinnen, um 1000 (verstärkt das Signal 1000 mal darauf achten, dass diese Verstärkungsparameter in den Erfassungssoftware Einstellungen umfassen) einda Bandpassfilter Bereich von 300 Hz (Low Cut) auf 2000 Hz (high cut).
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Mit der gleichzeitigen extrazelluläre Ableitungen von RS und PS, Motorneuronen von einem Ganglion, das Wechselaktivität dieser Motorneuronenpools, kann überwacht werden (Abbildung 18), die die fiktive Fortbewegungsmuster.
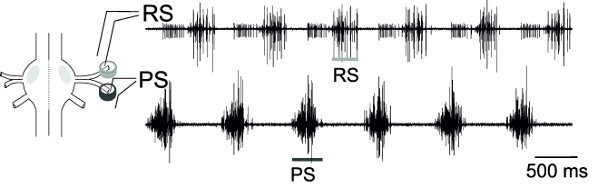
Abbildung 18: Schematische Darstellung einer Ganglien und Platzierung der Differenzstiftelektrode extrazellulären Aufzeichnung von RS Motorneuronen (obere Kurve) ...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Die Anatomie der Krebse und ihre Bauchganglien zuvor 5, 18, 19, 20 beschrieben, und es wird empfohlen, vor der Dissektion, um Schneiden von wichtigen Nerven zu vermeiden mit ihnen vertraut machen.
Es ist entscheidend, um die Vorbereitung bei Temperaturen unter 23 ° C zu halten, um den Abbau des isolierten Nervenstrang zu vermeiden. Dies kann einfach durch Austausch der Badlösung alle 20-30 min mit kaltem Krebse Salz erreicht werden. Unter diesen Umständen ist die Ke...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
The authors declare that they have no competing financial interests.
Danksagungen
Wir bedanken uns bei Jos Burgert für die Hilfe bei einigen der Figuren. Wir danken Ingo Selbach (und der Gruppe "Edelkrebsprojekt NRW") für seine Bemühungen um das Labor mit Versuchstieren zu versorgen. Wir danken Anna C. Schneider für das Korrekturlesen ersten Versionen des Manuskripts. Diese Arbeit wurde durch ein Emmy Noether-Stipendium der DFG SM 206 / 3-1 und dem Start Gewährung der Universität zu Köln für weibliche Dozenten unterstützt.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| 4-channel extracellular amplifier: MA 102 | Amplifier | Elektroniklabor, Zoologie, Universität zu Köln, Germany | |
| air-table | Technical Manufacturing Corporation (TMC) a unit of AMETEK Ultra Precision Technologies, Peabody, MA, USA | 63-534 | |
| Axon Digidata 1440A | Digitizer | Axon Instruments, Molecular Devices Design, Union City, CA | DD1440A |
| big bucket | |||
| Clampex & Clampfit | pClamp 10, recording and analysis software | Molecular Devices Design, Union City, CA | pClamps 10 Standard |
| cold lamp source | with flexible light guide (fiber optic bundle) | Euromex microscopes holland, Arnhem, BD | LE.5211 & LE.5235 |
| computer and monitor | equipped with recording software | ||
| container and pipette for liquid waste | |||
| crayfish saline | contains (in mM): 5.4 KCl, 2.6 MgCl2, 13.5 CaCl2, and 195 NaCl, buffered with 10mM Tris base and 4.7mM maleic acid; aerated for 3 hours. Adjust at pH of 7.4. | ||
| dextran, Texas Red (3000MW, lysine fixable) | fluorescent dye, lysine fixable | Life Technologies GmbH, Darmstadt, Germany | D3328 |
| dissection dish | (l x w x h) 15x7x5 cm; linned with black silicone | ||
| faraday cage | |||
| fixing pins | |||
| forceps (biology, Dumont #5) | Forceps: Biology, tip 0.05 x 0.02 mm, length 11cm, INOX | Fine Science Tools (FST), Germany | 11252-20 |
| forceps (biology, Dumont #55) | Forceps: Biology, tip 0.05 x 0.02 mm, length 11cm, INOX | Fine Science Tools (FST), Germany | 11255-20 |
| forceps (electronic, Dumont #5) | Forceps: Standard, tip 0.1 x 0.06 mm, length 11cm, INOX | Fine Science Tools (FST), Germany | 11251-20 |
| intracellular electrode | Borosilicate glass capillaries (outer/inner diameter: 1mm/0.5mm), with filament | Sutter Instruments, Novato, CA | BF100-50-10 |
| Leica S8 Apo StereoZoom | Dissection Microscope Zoom 1x - 8x | Leica, Germany | 10446298 |
| microscope table | |||
| mirror | to illuminate preparation from below | ||
| modeling clay | |||
| Olympus SZ61 | Dissection Microscope Zoom 0.67x - 4.5x | Olympus, Germany | |
| petri dish | 94 x 16 mm; lined with clear silicone | Greiner bio-one, Germany | 633180 |
| ring scissors | ThoughCut, cutting edge: sharp/blunt, straight: 13cm | Fine Science Tools (FST), Germany | 14054-13 |
| spring scissors or alternative: Vannas spring scissors | cutting edge: 8 mm, tip diameter: 0.2mm, straight: 10cm or cutting edge 2.5 mm, tip diameter 0.075 mm, straight: 8cm | Fine Science Tools (FST), Germany | 15024-10 or 15000-08 |
| student Vannas spring scissors or alternative: Moria Spring Scissors | cutting edge: 5mm, tip diameter: 0.35mm, straight: 9cm or cutting edge: 5mm, tip diameter 0,1 mm, straight: 8 cm | Fine Science Tools (FST), Germany | 91500-09 or 15396-00 |
| sylgard | 184 Silicone Elastomer Base and Curing Agent; for black sylgard add activated carbon | Dow Corning, Midland, MI, USA | |
| syringe filled with petroleum jelly and equipped with a 20 gauche needle with rounded tip |
Referenzen
- Hughes, G. M., Wiersma, C. A. G. The Co-Ordination of Swimmeret Movements in the Crayfish, Procambarus-Clarkii (Girard). J Exp Biol. 37 (4), 657-670 (1960).
- Mulloney, B., Smarandache, C. Fifty Years of CPGs: Two Neuroethological Papers that Shaped the Course of Neuroscience. Front Behav Neurosci. 4, 45(2010).
- Murchison, D., Chrachri, A., Mulloney, B. A Separate Local Pattern-Generating Circuit Controls the Movements of Each Swimmeret in Crayfish. J Neurophys. 70 (6), 2620-2631 (1993).
- Mulloney, B., Hall, W. M. Functional organization of crayfish abdominal ganglia. III. Swimmeret motor neurons. J Comp Neurol. 419 (2), 233-243 (2000).
- Davis, W. J. Lobster Righting Responses and Their Neural Control. Proc R Soc Ser B-Bio. 170 (1021), 435-456 (1968).
- Mulloney, B., Smarandache-Wellmann, C. Neurobiology of the crustacean swimmeret system. Prog Neurobiol. 96 (2), 242-267 (2012).
- Huxley, T. H. The crayfish: An introduction to the study of zoology. , MIT Press. Cambridge, MA. (1980).
- Smarandache-Wellmann, C., Weller, C., Wright, T. M., Mulloney, B. Five types of nonspiking interneurons in local pattern-generating circuits of the crayfish swimmeret system. J Neurophys. 110 (2), 344-357 (2013).
- Skinner, F. K., Mulloney, B. Intersegmental coordination of limb movements during locomotion: mathematical models predict circuits that drive swimmeret beating. J Neurosci. 18 (10), 3831-3842 (1998).
- Mulloney, B. During fictive locomotion, graded synaptic currents drive bursts of impulses in swimmeret motor neurons. J Neurosci. 23 (13), 5953-5962 (2003).
- Smarandache-Wellmann, C., Grätsch, S. Mechanisms of coordination in distributed neural circuits: Encoding coordinating information. J Neurosci. 34 (16), 5627-5639 (2014).
- Mulloney, B., Hall, W. M. Local commissural interneurons integrate information from intersegmental coordinating interneurons. J Comp Neurol. 466 (3), 366-376 (2003).
- Mulloney, B., Harness, P. I., Hall, W. M. Bursts of information: Coordinating interneurons encode multiple parameters of a periodic motor pattern. J Neurophys. 95 (2), 850-861 (2006).
- Smarandache, C., Hall, W. M., Mulloney, B. Coordination of Rhythmic Motor Activity by Gradients of Synaptic Strength in a Neural Circuit That Couples Modular Neural Oscillators. J Neurosci. 29 (29), 9351-9360 (2009).
- Smarandache-Wellmann, C., Weller, C., Mulloney, B. Mechanisms of Coordination in Distributed Neural Circuits: Decoding and Integration of Coordinating Information. J Neurosci. 34 (3), 793-803 (2014).
- Chrachri, A., Neil, D., Mulloney, B. State-Dependent Responses of 2 Motor Systems in the Crayfish, Pacifastacus leniusculus. J Comp Physiol A. 175 (3), 371-380 (1994).
- Chrachri, A., Neil, D. M. Interaction and Synchronization between 2 Abdominal Motor Systems in Crayfish. J Neurophys. 69 (5), 1373-1383 (1993).
- Skinner, K. The Structure of the 4th Abdominal-Ganglion of the Crayfish, Procambarus-Clarki (Girard) II. Synaptic Neuropils. J Comp Neurol. 234 (2), 182-191 (1985).
- Skinner, K. The Structure of the 4th Abdominal-Ganglion of the Crayfish, Procambarus-Clarki (Girard) I. Tracts in the Ganglionic Core. J Comp Neurol. 234 (2), 168-181 (1985).
- Mulloney, B., Tschuluun, N., Hall, W. M. Architectonics of crayfish ganglia. Microsc Res Techniq. 60 (3), 253-265 (2003).
- Braun, G., Mulloney, B. Cholinergic modulation of the swimmeret motor system in crayfish. J Neurophys. 70 (6), 2391-2398 (1993).
- Davis, W. J. Motoneuron Morphology and Synaptic Contacts - Determination by Intracellular Dye Injection. Science. 168 (3937), 1358-1360 (1970).
- Altman, J. S., Tyrer, N. M. Filling Selected Neurons with Cobalt through Cut Axons. Neuroanatomical Techniques. Strausfeld, N. J., Miller, T. A. , Springer. New York, NY. 373-402 (1980).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten