JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
왕새우의 Swimmeret 시스템 : 신경 코드 및 모터 패턴의 세포 외 녹음의 해부를위한 실무 가이드
요약
Here we describe the dissection of the crayfish abdominal nerve cord. We also demonstrate an electrophysiological technique to record fictive locomotion from swimmeret motor neurons.
초록
여기에서 우리는 왕새우 복부 신경 코드의 해부를 보여줍니다. 제제는 지난 흉부 신경절 (T4, T5) 및 복부 신경절 쇄 (A1 내지 A6)을 포함한다. swimmeret 시스템 : 신경절이 체인 pleopods (swimmerets)의 운동을 구동 코디 중추 신경계 (CNS)의 일부를 포함한다. 그것은 가재의 각 swimmeret이 리듬 교류 활동 1-3를 생성 독자적 패턴 생성 커널에 의해 구동되는 다섯 년 이상으로 알려져있다. 운동 뉴런 swimmeret 각 근육의 해부학 적 및 기능적으로 구별되는 4 개의 집단에 분포를 포함한다. 하나는 swimmeret의 후퇴 (전원 뇌졸중, PS)에 대한 책임이 있습니다. 다른 하나는 swimmeret의 길게 끌기 (귀국일 스트로크, RS)를 구동한다. swimmeret 시스템의 운동 뉴런은 생체 내에서 자연적으로 기록 된 패턴과 동일하다 허구 모터 패턴을 생성 할 수있다 1.
이 보고서의 목적은 리듬을 생성하는 네트워크와 학생들의 실제적인 실험 과정에 대한 독립적 인 초소형의 조정을 공부 재미 있고 편리한 모델 시스템을 소개하는 것입니다. 제공하는 프로토콜은 신경의 절연 체인의 달아 신경을 desheathing와 격리 신경 시스템에서 세포 외로 swimmerets 허구 모터 패턴을 기록, 왕새우의 복부 신경 코드의 해부에 대한 단계별 지침이 포함되어 있습니다.
또한, 우리는 수상 돌기에서 세포 내 기록 swimmeret 신경 세포의 활동을 모니터 할 수 있습니다. 여기에서 우리는 간단히 이러한 기술을 설명하고 몇 가지 예를 제공합니다. 또한, swimmeret 뉴런의 형태는 다양한 염색 기술을 사용하여 평가할 수있다. 여기에서 우리는 염료 가득 뉴런과 swimmeret 운동 신경의 풀 backfills (이온 토 포레 시스에 의해) 세포의 예를 제공합니다. 우리가 실험실에서우리는 세포 수준에서 미세 회로 사이의 허구 운동, 중추 신경계의 활동에 대한 감각 피드백의 효과 및 조정의 기본 기능을 연구하기 위해이 준비를 사용합니다.
서문
왕새우 swimmerets는 자세 제어의 기능을 수행하고, 동물이 앞으로 수영 리듬 때 이길 자신의 굴 또는 암컷이 알 5, 6 탄산 가스를 환기 시키십시오. 신호 가재, Pacifastacus의 leniusculus의 swimmerets을, 다섯 번째 두 번째에서 쌍으로 발생 복부 (7)의 각 측면에 하나의 다리와 복부 세그먼트. 중추 신경계 손상은 동물뿐만 아니라 절연 신경 코드 준비 swimmeret 운동 자체를 구동 모터 두둑 리듬에 생성한다. 더 감각 피드백 또는 내림차순 입력되는 현재 존재하지 않는 경우 생성 된 리듬 모터 패턴은 허구 식 이동 (1, 2)라고한다. swimmeret 시스템에서는이 모터 패턴이 그대로 동물에서 측정 swimmerets의 활성에서 어떤 파라미터에서 다르지 않다.
각 swimmeret의 움직임의 위치는 하나의 C로 제한되는 미세 회로에 의해 구동hemiganglion 1 orresponding -. 3 각 저항기에서 다섯 식별 비 요동 치고의 interneurons를 포함하는 패턴 생성 커널이있다. 그들은 기능적 것을 특징으로 할 수 있습니다 동력 행정의 억제제 (IPS) 또는 Return 키 스트로크의 억제제 (IRS) 8. 자신의 교류 활동이 상호 억제 (9)에 의해 구동 오히려 이러한 IPS와 국세청의 interneurons는 내생 발진기 없습니다. 이들의 interneurons 직접 swimmeret 운동 뉴런을 억제하기 때문에, 상기 교류 PS-RS 운동은 열을 발생한다. 운동력은 그러나, 또한 다른 독립 미소의 코디 활성의 생성을 필요로하지 않지만. swimmeret 시스템에서 이러한 조정은 사지가 정확한 시간에 활성화되어 있도록 보장하는 조정 저항기에 의해 설정됩니다. 이 마이크로는 각 세그먼트 11 ~ 15 세 확인 된 신경 세포에 의해 만들어집니다.
이 프로토콜은 일 제공E는 처음 단계별 해부 가이드 신경절 (A6 T4에,도 1)의 체인을 분리. 우리는 고립 된 복부 신경 코드를 고정하고 각 신경절을 desheathe하는 방법을 보여줍니다. 이 격리 신경계 대비, swimmeret 운동을 담당하는 신경 세포 전기 생리 및 형태 학적 실험에 사용하기위한 준비가되어 있습니다. 이 프로토콜의 두번째 부분은 모터 swimmeret 패턴의 주요 특징을 설명한다. 이 세포 외로 레코드에 대한 단계별 가이드를 swimmeret 운동 뉴런의 활동을 포함한다. RS의 운동 신경의 축색 돌기 (axon)은 PS 모터 신경의 축색 돌기 (axon)가 같은 신경의 후방 지점을 통해 (그림 1) 프로젝트 동안, 신경 N1의 전방 지점을 통해 프로젝트 4. 따라서 그들의 활동은 차동 핀 전극이 지점에서 녹음 할 수 있습니다.

그림 1 : 복부 신경절 6 (A6)과 T4의 개략도에 흉부 신경절 4 (T4)에서 고립 신경계 :. 흉부 신경절 4; T5 : 흉부 신경절 5; A1, A2 ... A6 복부 신경절 1, 복부 신경절이 ... 복부 신경절 (6); N1 : 신경 N1; N2 : 신경 N2; N3 : 신경 N3; PS : 파워 스트로크; RS : 리턴 스트로크. 방향 약어 : A = 전방; P = 후방.
이 해부 절차 및 시연 전기 생리학 기술 학부 학생들을위한 편리하고 생리 학생 실용적인 교육 과정을 보완 할 수있다. 신경절 절연 체인 신경계 기능, 조정, 또는 swimmeret 미세 회로 (6)의 변조뿐 아니라 운동 (16) (17) 적응 행동의 신경 조절을 연구하기 위해 다수의 실험에 사용되었다. 가재 swimmeret 시스템은 이와 같이 방대한드립니다 흥미로운 교육 또는 t의모든 가재와 허구 모터 패턴의 세포 외 기록의 복부 신경 코드의 절개로 시작하는 기회를 비가.
Access restricted. Please log in or start a trial to view this content.
프로토콜
이 절차는 해부 유럽 공동체위원회 (22)의 지령 ND 2010년 9월 (63분의 2,010 / EU)에 따른다.
1. 준비
- 크기 ≥8 cm 남녀 가재, Pacifastacus의 leniusculus (다나)를 얻습니다. 동물은 매우 중요하고 복부와 복부 사지가 그대로 있는지 확인합니다.
- 등딱지를 검사하는주의이 표피는 단단하고 견고한입니다. 사전 및 postmolt 동물 소프트 갑이 때문에 많은 매개 변수 변경 털갈이 과정에서 실험에 적합하지 않다 (예를 들면, 운동 활성의 감소).
- , 해부하는 동안 사용되는 모든 도구 및 재료를 조립 달아 및 신경 코드의 desheathing 그림 2와 제공되는 보충 교재에 나와.

그림 2 : 재료 및 도구를 달아 및 신경 코드의 desheathing, 해부에 사용됩니다.
(1) 얼음을 가득 큰 양동이; (2) 왕새우 식염수; (3) 염수 디스펜서; (4) 해부 현미경; (5) 해부 접시; (6) 강한 가위; (7) 집게 (8) 스프링 가위; 분명 실 가드 늘어서 (9) 페트리 접시; (10)의 고정 핀; (11) 감기 램프 소스.
2. 총 해부
- 20 분 - 15 얼음에 동물을 마취. 이 방혈 단계와, 상기 표본이 절차 동안 가재 식염수로 세정 정기적해야 보낸 싱크대 랩 벤치 총 해부의 첫 번째 부분을 수행한다.
- 동물의 복부 측면을 잡고 흉부 (그림 3-1)에 가까운 자신의 기지를 모두 발톱을 잘라 강력한 가위를 사용합니다. 왼쪽과 오른쪽 uropod (그림 3-2)를 제거합니다.
- 검은 실 가드 늘어서 해부 접시에 동물의 복부 측면을 놓습니다. Eleva텔슨 (그림 4A)에서 복부를 아래에 얼음을 넣고 핀 테 두흉부.
- 60 ml의 냉장 왕새우 식염수 ~와 식염수 디스펜서를 입력합니다. 발톱 개방 (그림 4B)를 통해 차가운 식염수로 가재를 관류. 과도한 염분은 uropods의 인하를 통해 오프 배출됩니다. 일어난 과다 출혈 동안 얼음으로 가재를 커버
- 단지 강한 가위 (도 5a)를 사용하여 동물의 눈 후부 절단 한 횡으로 동물을 참살. 그림 (b)에 나타낸 바와 같이 기본 관절 근처의 모든 걷고 다리를 제거합니다.
- 두흉부의 나머지 부분에서 마지막 흉부 세그먼트와 복부를 분리합니다. 두 번째 도보 다리의 구멍에 가위의 끝을 삽입하고 반대편에 절단하여 두 번째 도보 다리의 레벨 (흉부 세그먼트 3)에서 첫 번째 컷을 확인합니다. (도 6A-1).
- t을 통해 양측이 첫 번째 컷을 확장그는 (그림 6A-2) 두흉부.
- 내부 장기의 일부 볼 수 있도록 열려있는 동물을 뒤집습니다. 시편의 앞쪽 부분에 눈에 띄는 소화선 (그림 6B-3)을 누르고 복강에서 생식 기관을 제거하기 위해 집게를 사용합니다.
- 두흉부 (그림 6C)의 앞쪽 부분을 제거합니다. 나머지 흉부 (그림 6D-4)의 양면에, 아가미를 커버 등딱지의 측면 부분을 제거하는 측면 컷을 사용합니다. 아가미를 제거하고 차가운 식염수 표본을 씻어.
- 그림 6E-5에 표시된대로 흉골 판의 전체 길이를 잘라 해부를 계속합니다. pleuron 및 swimmerets (그림 6E 빨간색 표시) 사이의 최대 수평 위치에서이 컷을 확인합니다. 같은 컷 반대편에 진행합니다. 차가운 식염수 표본을 씻어.
- dissectio에서 나머지 해부을 수행N 현미경입니다. 검은 실 가드 늘어서하고 표본을 덮도록 왕새우 식염수로 채워진 해부 접시에 왕새우의 복부 복부 측면을 놓습니다.
참고 : 다음 단계 (2.12-4.8)는 오른 손잡이 실험자에 적용 방향 지시 사항이 포함되어 있습니다. 다음 단계 (2.12-6.8)에서는 차가운 생리 식염수, 등 간격으로 매 20-30 분 바닷가 식염수를 교체 건강한 신경 시스템을 유지하는 것이 중요하다. - 후방 텔슨에서와 전방 등딱지의 유적에서 곤충 핀 시편을 고정합니다. 왼쪽 텔슨 점과 테이블의 가장자리에 평행하도록 시험편을 놓는다.
- 걷는 다리 구멍 (그림 7A)를 통해 잡아 표본을 엽니 다 (그림 7B 흰색 화살표)를 당겨 왼쪽 손에 거친 집게를 사용합니다. 그들의 복부 대형 2 배측 굴근 가닥 (도 7b-1, C-1)를 식별 및 컷도 7b에 도시 된 바와 같이 기초.
- 지느러미 (심장)에서 내려 흉골 동맥 (그림 7C-2)를 식별하기 위해 복부, 4 번째 흉부 세그먼트에서. 이 복부 동맥을 형성, 신경 코드에서 프로젝트 전에이 동맥은 바로 신경 코드 (그림 7C-3) 위에 자리 잡고 있습니다.
- 흉골 동맥을 가로로 쪼개다. 그림 7 (c)에서 알 수 있듯이, 가위 중 하나 블레이드를 사용하여, 먼저 동맥을 들어 올려 복부에 위치한 신경 코드가 표시되는 경우에만 잘라.
- (오른쪽) 전방 지느러미 굴근을 수정합니다. 그들은 비전을 차단하지 않도록이 핀 최대 뻗어 위치에서 수행되어야하며, 시편 뻗어 상태를 유지합니다. 등쪽 근육 가닥 (그림 8-1을), 관련 신경과 최초의 복부 신경절, A1 및 A2를 고정 할 때 N1, N2, N3와 볼 (그림 8)입니다.
- 사양을 잡고 왼쪽 손에 집게를 사용하여도보로 다리 중 하나 오프닝에서 imen. 다음 해부 전반에 걸쳐 단계 개방 시편을 유지하기 위해 부드럽게 잡아 당깁니다.
- 신경 코드로부터 가장 먼 위치에 신경을 횡단면 N3. (그림 8-3).
- 그림 8-4에서와 같이 복부 apodeme에 가까운 굴곡 근육을 잘라. 신경 코드 나 신경 N2 손상되지 않도록주의하십시오.
- 단계 2.18 및 신경 N3 2.19와 A5에 남아있는 복부 신경절 A2의 굴근를 반복합니다.
- 지난 복부 신경절에서, A6는 복부 apodeme에서 지느러미 굴근을 절감하고 시편은 그림 9와 같이 보일 것입니다.
- A6 (그림 9-1)의 신경 흉골 플레이트 뒤쪽으로 절단하고 복부 부분 (그림 9-2)를 유지한다. 굴근 (그림 9-3)와 지느러미 부분을 폐기하십시오. 걷는 다리의 구멍을 통해 핀 전방 흉골 판을 수정,및 후방 A6에.
3. 미세 해부
- 바로 입력 전방 부분과 테이블 '가장자리쪽으로 후방 부분 현미경으로 시료를 놓습니다.
- cephalothoracic sterna의 가장 앞쪽 부분을 제거하기 위해 그림 10A와 같이 집게를 사용합니다.
참고 : 흉부 신경과 관련된 신경이 부분적으로 다리 근육과 cephalothoracic sterna이 적용됩니다. cephalothoracic sterna 서로로부터 복부 신경 코드가있는 내측 캐비티로부터 보행 다리의 측 방향 위치 공동을 분리하는 골격을 형성한다. - 나머지 외골격도 10b에 표시된 구조 -1 B2 사이의 근육을 잘라. 잡아 복부 신경 코드 (그림 10C)의 앞쪽 끝을 들어 올려 집게를 사용합니다.
주 : 신경 선이 과정에서 손상 될 수 있으므로 NERV 발생을 방지전자 코드를 여러 번. - 신경 코드 (그림 10C-3)를 들어 올리고 옆으로 흉부 신경을 잘라. 피닝에 적합한 길이의이 신경을 유지합니다. 집게로웠다 신경의 체인의 압착 부분을 제거합니다 (그림 10C-4) T4 모든 조직 전방을 멀리 절단하여.
- 왼쪽의 앞쪽 부분에 시편을 놓고 A1에 초점을 맞 춥니 다. 적당한 길이 (최대. 1cm)을 밖으로 달아위한에서 A1의 신경 N1과 N2를 잘라.
- A2에 초점 신경 N1, N2,이 세그먼트의 N3 (그림 11)를 식별합니다. 복부 신경절 A2-A5의 신경 N1은 각 세그먼트 (그림 11A-1)에서 두 흉골 cuticular infoldings 사이에 거주하는 근육에 의해 보호됩니다. 후방 흉골 cuticular infolding 함께 한 컷을 확인합니다. 복부의 측면 가장자리에서 시작도 11a에 도시 된 바와 같이 중간 선을 향해 진행합니다.
- 타겟 N1은 여전히 코브이면조직과 빨간 근육 번들 가로 질러, 그림 11B (빨간색 화살표)에 표시하지만,이 때 앞쪽 흉골 cuticular infoldings 및 신경 N1 모두 (그림 11B-2).
- 가능 (그림 11C-3)로 같은 말단 신경 N1을 잘라. 신경 N1 완전히 볼 수 있으며 전방 및 후방 분기 (그림 11C)에서 확인할 수 있습니다.
- 반대측 신경 N1을 진행하고 먼저 신경절 (그림 11D)에 가까운 내측 시작, 후방 흉골 cuticular infolding을 따라 근육을 잘라. 신경이 여전히 조직이 적용되는 경우, 근육 번들 가로 질러, 이번에 전방 흉골 cuticular infoldings 및 신경 N1 모두가 비슷한 11B-2 그림. 같은 말단 가능한 신경 N1을 잘라.
- 적당한 길이 (약. 0.5 cm) 핀 고정이 신경절의 신경 N2를 잘라.
- 반복 A3-A5의 신경에 대한 3.7-3.11 단계를 반복합니다.
- NER을 잘라같은 원심 가능 (그림 12A)와 같은 신경절 A6의 보이는 군. 이 신경절을 들어 올려 흉골 판에서 신경의 체인을 분리 시작 A6의 여러 신경 잡아 집게를 사용합니다.
- 신경 코드를 해제하는 동안 그림 12B (흰색 화살표)에서 입증 된 바와 같이, 전방 방향으로 부드럽게 잡아 당깁니다. 개개의 신경이 해제됨에 따라, 신경 코드 (도 12C)의 측 복부에 부착 될 수 복부 동맥을 제거한다. 신경 코드가 완전히 격리 될 때까지이 (부드럽게) 컷 당겨 순서를 계속합니다.
- 분명 실 가드 늘어서과 왕새우 식염수 (그림 12D) 가득 페트리 접시에 신경절의 절연 체인을 전송합니다.
4. 페트리 접시에 신경 코드 피닝
참고 : 신경 코드를 핀 (보충 참조) 스테인레스 스틸 와이어에서 잘라 작은 핀을 사용합니다. 집게로 끝나는에만 신경을 터치 squeez을하지 않습니다접속사 또는 신경 전자.
- 부드러운 스트레칭을 적용하는 동안, 직선 신경의 사슬을 핀입니다.
- 위를 향 등의면 페트리 접시에 신경 코드 (그림 13, 검은 선)을 정렬합니다. 신경절의 복부 측면은 그 볼록 의해 식별 될 수있다; 몸 윗면은 평평하다. 측면에 흉부 신경을 핀입니다. 길이 방향 축을 따라 신경 코드를 스트레칭, A6의 신경을 계속합니다.
- 신경 코드에 90 ° 각도로 A1의 신경을 핀입니다.
- A2로 넘어 신경 코드 (도 1A)에 대하여 35~45 °의 각도로 신경 N2 핀.
- . 그림 14에 설명 된대로 달아 전에 전방 및 후방 지점에 신경 N1을 분리 신경 N1의 후방 지점 집게 일쌍 전방으로 다른 손으로 집어 미세 집게 두 쌍을 사용합니다. 만 대부분의 선단부를 선택하는주의신경 가지들. 이제 조심스럽게 잡아 당겨서.
- 신경 코드 (그림 1A)에 90 ° 각도로 신경 N1의 전방 지점을 핀입니다. 전방 N1 분기 및 신경 N2 사이에 신경 N1의 후방 지점을 핀입니다.
- 신경 A3-A5의 신경의 단계 4.4-4.6를 반복합니다. 길이에 신경 코드 스트레치 그것뿐만 아니라 횡 방향 관념 동안.
5. 신경절을 Desheathing
- 실험자의 손은 항상 흔들림 방지하기 위해 안정적인 비행기에 쉬고하는 방식으로 준비를 놓습니다. desheath하기 위해서는 아래에서 신경절 신경 코드를 밝히는.
- A5에 복부 신경절 A1에 초점을 맞 춥니 다. 신경절과 신경 N2 및 N3 (그림 15A 빨간색 화살표) 사이에 후부, 신경절 칼집을 통한 소정의 측면 컷을 만들기 위해 좋은 봄 가위를 사용합니다.
- 매우 f를 사용하여 신경절 칼집을 선택도 15a-1에 나타낸 바와 같이 오프라인 집게와, 상기 시스 접속사 횡 방향으로 가로 질러 절단. 짜거나 가위로 신경 코드를 절단하지 않도록주의하십시오.
- 아직도 잡고 집게가 신경절 (그림 15B-2, -3)의 측면 테두리를 따라 잘라 지속적으로 신경절 칼집을 해제합니다. 덮개를 제거합니다. 대안은 고정되어 있지만, 신경 코드가 압착되지 않는 그런 방법으로 접속사의 양측에 Pin.
- 반복 A5 모든 복부 신경절 A1에 대한 5.2-5.4 단계를 반복합니다.
- 흉부 신경절과 유사한 방식으로 신경절 A6를 Desheathe. 신경절에 A6 시작 전방을 desheathe 후방 방향으로 진행하기 위해. 신경절의 체인의 후단에 A6의 신경절 칼집을 핀입니다.
모터 뉴런 6. 세포 외 녹음
- 내가 보여 세포 외 녹음에 사용되는 모든 도구 및 재료를 조립N 그림 16B와 보충 교재에 나와. 녹화 설정의 개요는도 16a에 도시된다. 앰프는 이전의 기록에 적어도 30 분 동안 워밍업 할 수 있도록,이 실험 (그림 16C)에 사용 된 모든 전자 기기를 시작합니다. 컴퓨터를 켜고 레코딩 소프트웨어를 시작합니다.
- 현미경 테이블에 신경절의 체인을 놓고 아래에서 조명. 신경절 (도 17A 및 B) 상기 표적 신경과 가까운 위치에서 상기 기준 전극에 근접하지만, 실 가드 측에 기록 전극을 삽입한다. 기록 전극 (그림 17C) 주위 대상 신경을 구부리고.
- 전극과 신경 사이의 접촉을 보장하고 측면 (F의 igure 17D)에 핀, 약간 신경을 스트레칭. 점토를 이용하여 현미경 테이블 전극 케이블을 고정하므로 원하는 위치에 유지.
- 사용바셀린 (둥근 팁) 20 게이지 바늘로 채워진 주사기 (도 17E-3) 입욕 용액으로부터 표적 신경 차단. 우선, 기록 전극의 주위에 약간의 실 가드 바셀린을 한 덩어리. 결과는 기록 전극 (도 17E-4)의 근방을 덮는 실 가드 바셀린의 층이다. 바로이 계층에 공기 방울을 신경에 가볍게 두드 피하기 않도록주의하십시오.
- 식염수 (도 17F)의 액면까지의 모든면에서 바세린 기록 전극 봉쇄.
- 누구의 활동을 모니터링해야 모든 대상 신경에 대해이 절차를 반복합니다.
- 녹음을 시작합니다. 연속적 또는 프리 갭 획득 모드 5 kHz의 샘플링 레이트를 사용한다. 다음 매개 변수에 세포 외 앰프를 설정하고, (신호 1,000 배를 증폭 수집 소프트웨어 설정이 증폭 매개 변수를 포함하는데주의를 기울여야) 1000 얻기2,000 Hz에서 (하이 컷) 300 헤르츠 (Hz 로우 컷)의 다 대역 통과 필터 범위.
Access restricted. Please log in or start a trial to view this content.
결과
RS 및 PS 번 신경절의 운동 신경 세포에서 동시 녹화,이 운동 신경 풀 교류 활성은, 허구 식 이동 패턴을 나타내는 (도 18)를 모니터링 할 수있다.
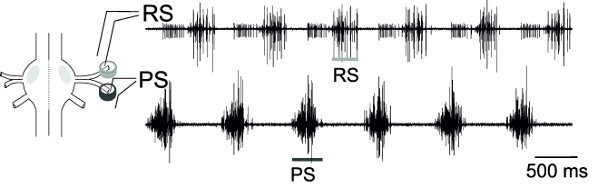
그림 18 : 하나의 신경절 및 차등 핀 전극의 배치의 개략도 세포 외 RS 모터 뉴런의 기록 (상단 트레이스) 및 PS 모터 뉴런 (낮은 추적).....
Access restricted. Please log in or start a trial to view this content.
토론
가재의 해부학 및 복부 신경절 이전에 5, 18, 19, 20을 설명되었지만 그것은 중요한 신경의 절단을 방지하기 위해 절개 전에 급 숙지 권장된다.
그것은 고립 된 신경 코드의 저하를 방지하기 위해 23 ° C 이하의 온도에서 준비를 유지하는 것이 중요합니다. 이 용액을 차가운 입욕 가재 염수 매 20-30 분 여분으로 쉽게 달성 될 수있다. 이러한 상황에서 신경절 체인?...
Access restricted. Please log in or start a trial to view this content.
공개
The authors declare that they have no competing financial interests.
감사의 말
우리는 그림의 일부 돕는 호세 Burgert 감사합니다. 우리는 잉고 Selbach (및 그룹 "Edelkrebsprojekt NRW") 실험 동물 연구실을 공급하기 위해 자신의 노력에 감사드립니다. 우리는 원고의 첫 번째 버전을 교정 안나 C. 슈나이더 감사합니다. 이 연구는 에미 뇌터 DFG 보조금 SM 206 / 3-1과 여성의 능력에 대한 쾰른 대학의 시작 기금에 의해 지원되었다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 4-channel extracellular amplifier: MA 102 | Amplifier | Elektroniklabor, Zoologie, Universität zu Köln, Germany | |
| air-table | Technical Manufacturing Corporation (TMC) a unit of AMETEK Ultra Precision Technologies, Peabody, MA, USA | 63-534 | |
| Axon Digidata 1440A | Digitizer | Axon Instruments, Molecular Devices Design, Union City, CA | DD1440A |
| big bucket | |||
| Clampex & Clampfit | pClamp 10, recording and analysis software | Molecular Devices Design, Union City, CA | pClamps 10 Standard |
| cold lamp source | with flexible light guide (fiber optic bundle) | Euromex microscopes holland, Arnhem, BD | LE.5211 & LE.5235 |
| computer and monitor | equipped with recording software | ||
| container and pipette for liquid waste | |||
| crayfish saline | contains (in mM): 5.4 KCl, 2.6 MgCl2, 13.5 CaCl2, and 195 NaCl, buffered with 10mM Tris base and 4.7mM maleic acid; aerated for 3 hours. Adjust at pH of 7.4. | ||
| dextran, Texas Red (3000MW, lysine fixable) | fluorescent dye, lysine fixable | Life Technologies GmbH, Darmstadt, Germany | D3328 |
| dissection dish | (l x w x h) 15x7x5 cm; linned with black silicone | ||
| faraday cage | |||
| fixing pins | |||
| forceps (biology, Dumont #5) | Forceps: Biology, tip 0.05 x 0.02 mm, length 11cm, INOX | Fine Science Tools (FST), Germany | 11252-20 |
| forceps (biology, Dumont #55) | Forceps: Biology, tip 0.05 x 0.02 mm, length 11cm, INOX | Fine Science Tools (FST), Germany | 11255-20 |
| forceps (electronic, Dumont #5) | Forceps: Standard, tip 0.1 x 0.06 mm, length 11cm, INOX | Fine Science Tools (FST), Germany | 11251-20 |
| intracellular electrode | Borosilicate glass capillaries (outer/inner diameter: 1mm/0.5mm), with filament | Sutter Instruments, Novato, CA | BF100-50-10 |
| Leica S8 Apo StereoZoom | Dissection Microscope Zoom 1x - 8x | Leica, Germany | 10446298 |
| microscope table | |||
| mirror | to illuminate preparation from below | ||
| modeling clay | |||
| Olympus SZ61 | Dissection Microscope Zoom 0.67x - 4.5x | Olympus, Germany | |
| petri dish | 94 x 16 mm; lined with clear silicone | Greiner bio-one, Germany | 633180 |
| ring scissors | ThoughCut, cutting edge: sharp/blunt, straight: 13cm | Fine Science Tools (FST), Germany | 14054-13 |
| spring scissors or alternative: Vannas spring scissors | cutting edge: 8 mm, tip diameter: 0.2mm, straight: 10cm or cutting edge 2.5 mm, tip diameter 0.075 mm, straight: 8cm | Fine Science Tools (FST), Germany | 15024-10 or 15000-08 |
| student Vannas spring scissors or alternative: Moria Spring Scissors | cutting edge: 5mm, tip diameter: 0.35mm, straight: 9cm or cutting edge: 5mm, tip diameter 0,1 mm, straight: 8 cm | Fine Science Tools (FST), Germany | 91500-09 or 15396-00 |
| sylgard | 184 Silicone Elastomer Base and Curing Agent; for black sylgard add activated carbon | Dow Corning, Midland, MI, USA | |
| syringe filled with petroleum jelly and equipped with a 20 gauche needle with rounded tip |
참고문헌
- Hughes, G. M., Wiersma, C. A. G. The Co-Ordination of Swimmeret Movements in the Crayfish, Procambarus-Clarkii (Girard). J Exp Biol. 37 (4), 657-670 (1960).
- Mulloney, B., Smarandache, C. Fifty Years of CPGs: Two Neuroethological Papers that Shaped the Course of Neuroscience. Front Behav Neurosci. 4, 45(2010).
- Murchison, D., Chrachri, A., Mulloney, B. A Separate Local Pattern-Generating Circuit Controls the Movements of Each Swimmeret in Crayfish. J Neurophys. 70 (6), 2620-2631 (1993).
- Mulloney, B., Hall, W. M. Functional organization of crayfish abdominal ganglia. III. Swimmeret motor neurons. J Comp Neurol. 419 (2), 233-243 (2000).
- Davis, W. J. Lobster Righting Responses and Their Neural Control. Proc R Soc Ser B-Bio. 170 (1021), 435-456 (1968).
- Mulloney, B., Smarandache-Wellmann, C. Neurobiology of the crustacean swimmeret system. Prog Neurobiol. 96 (2), 242-267 (2012).
- Huxley, T. H. The crayfish: An introduction to the study of zoology. , MIT Press. Cambridge, MA. (1980).
- Smarandache-Wellmann, C., Weller, C., Wright, T. M., Mulloney, B. Five types of nonspiking interneurons in local pattern-generating circuits of the crayfish swimmeret system. J Neurophys. 110 (2), 344-357 (2013).
- Skinner, F. K., Mulloney, B. Intersegmental coordination of limb movements during locomotion: mathematical models predict circuits that drive swimmeret beating. J Neurosci. 18 (10), 3831-3842 (1998).
- Mulloney, B. During fictive locomotion, graded synaptic currents drive bursts of impulses in swimmeret motor neurons. J Neurosci. 23 (13), 5953-5962 (2003).
- Smarandache-Wellmann, C., Grätsch, S. Mechanisms of coordination in distributed neural circuits: Encoding coordinating information. J Neurosci. 34 (16), 5627-5639 (2014).
- Mulloney, B., Hall, W. M. Local commissural interneurons integrate information from intersegmental coordinating interneurons. J Comp Neurol. 466 (3), 366-376 (2003).
- Mulloney, B., Harness, P. I., Hall, W. M. Bursts of information: Coordinating interneurons encode multiple parameters of a periodic motor pattern. J Neurophys. 95 (2), 850-861 (2006).
- Smarandache, C., Hall, W. M., Mulloney, B. Coordination of Rhythmic Motor Activity by Gradients of Synaptic Strength in a Neural Circuit That Couples Modular Neural Oscillators. J Neurosci. 29 (29), 9351-9360 (2009).
- Smarandache-Wellmann, C., Weller, C., Mulloney, B. Mechanisms of Coordination in Distributed Neural Circuits: Decoding and Integration of Coordinating Information. J Neurosci. 34 (3), 793-803 (2014).
- Chrachri, A., Neil, D., Mulloney, B. State-Dependent Responses of 2 Motor Systems in the Crayfish, Pacifastacus leniusculus. J Comp Physiol A. 175 (3), 371-380 (1994).
- Chrachri, A., Neil, D. M. Interaction and Synchronization between 2 Abdominal Motor Systems in Crayfish. J Neurophys. 69 (5), 1373-1383 (1993).
- Skinner, K. The Structure of the 4th Abdominal-Ganglion of the Crayfish, Procambarus-Clarki (Girard) II. Synaptic Neuropils. J Comp Neurol. 234 (2), 182-191 (1985).
- Skinner, K. The Structure of the 4th Abdominal-Ganglion of the Crayfish, Procambarus-Clarki (Girard) I. Tracts in the Ganglionic Core. J Comp Neurol. 234 (2), 168-181 (1985).
- Mulloney, B., Tschuluun, N., Hall, W. M. Architectonics of crayfish ganglia. Microsc Res Techniq. 60 (3), 253-265 (2003).
- Braun, G., Mulloney, B. Cholinergic modulation of the swimmeret motor system in crayfish. J Neurophys. 70 (6), 2391-2398 (1993).
- Davis, W. J. Motoneuron Morphology and Synaptic Contacts - Determination by Intracellular Dye Injection. Science. 168 (3937), 1358-1360 (1970).
- Altman, J. S., Tyrer, N. M. Filling Selected Neurons with Cobalt through Cut Axons. Neuroanatomical Techniques. Strausfeld, N. J., Miller, T. A. , Springer. New York, NY. 373-402 (1980).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유