Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Le système swimmeret des écrevisses: Un guide pratique pour la dissection de la corde nerveuse et extracellulaires enregistrements du schéma moteur
Dans cet article
Résumé
Here we describe the dissection of the crayfish abdominal nerve cord. We also demonstrate an electrophysiological technique to record fictive locomotion from swimmeret motor neurons.
Résumé
Ici, nous démontrons la dissection de l'écrevisse abdominale cordon nerveux. La préparation comprend les deux derniers ganglions thoraciques (T4, T5) et la chaîne de ganglions abdominaux (A1 à A6). Cette chaîne de ganglions comprend la partie du système nerveux central (SNC) qui entraîne la locomotion coordonnée des pléopodes (pattes natatoires): le système de swimmeret. Il est connu depuis plus de cinq décennies que, dans chaque écrevisses swimmeret est entraînée par son propre modèle générer noyau indépendant qui génère une activité alternative rythmique 1-3. Les neurones moteurs qui innervent les muscles de chaque swimmeret comprennent deux anatomiquement et fonctionnellement quatre populations distinctes. On est responsable de la rétraction (course de puissance, PS) de la swimmeret. L'autre entraîne l'allongement (de course de retour, RS) de la swimmeret. Les neurones moteurs du système swimmeret sont capables de produire spontanément une configuration de moteur fictif, qui est identique au motif enregistré in vivo 1.
Le but de ce rapport est d'introduire un système de modèle intéressant et pratique pour l'étude des réseaux de production de rythme et la coordination des microcircuits indépendants pour les cours pratiques de laboratoire des élèves. Le protocole fourni comprend des instructions étape-par-étape pour la dissection des abdominale cordon nerveux de l'écrevisse, l'épinglage de la chaîne isolé de ganglions, dégainage les ganglions et l'enregistrement du schéma moteur fictive de pléopodes extracellulaire du système nerveux isolé.
En outre, nous pouvons surveiller l'activité des neurones swimmeret enregistrées intracellulaire de dendrites. Ici, nous décrivons brièvement ces techniques et de fournir quelques exemples. En outre, la morphologie des neurones swimmeret peut être évaluée en utilisant diverses techniques de coloration. Ici, nous donnons des exemples de intracellulaire (par iontophorèse) neurones et remblais de piscines de neurones moteurs swimmeret colorant rempli. Dans notre laboratoirenous utilisons cette préparation pour étudier les fonctions de base de la locomotion fictive, l'effet de rétroaction sensorielle sur l'activité du système nerveux central, et la coordination entre les microcircuits à un niveau cellulaire.
Introduction
Les natatoires d'écrevisses ont une fonction dans le contrôle de la posture et battent rythmiquement lorsque les animaux nagent en avant, ventiler leurs terriers ou femelles aèrent leurs œufs 5, 6. Les pléopodes de l'écrevisse signal, Pacifastacus leniusculus, se produisent par paires de la deuxième à la cinquième segment abdominal, avec une branche de chaque côté de l'abdomen 7. Le système nerveux central produit de sa propre le crépitement du moteur rythmique qui entraîne le mouvement de swimmeret chez l'animal intact ainsi que dans la préparation nerf cordon isolé. Quand il n'y a pas de rétroaction sensorielle ou décroissant entrée présente le modèle de moteur rythmique produit est appelé la locomotion fictive 1, 2. Dans le système de swimmeret ce modèle de moteur ne diffère pas dans ne importe quel paramètre de l'activité des pléopodes mesurées dans l'animal intact.
Le mouvement de chaque swimmeret est entraîné par un microcircuit qui est situé dans et limité à une corresponding hemiganglion 1 -. 3 Dans chaque microcircuit il ya un noyau de motif génération qui comprend cinq identifiés interneurones de dopage non. Ils peuvent être caractérisés comme étant soit fonctionnellement inhibiteur de Power Stroke (IPS) ou un inhibiteur de la course de retour (IRS) 8. Ces IPS et des interneurones IRS ne sont pas oscillateurs endogènes plutôt leur activité alternatif est entraîné par inhibition réciproque neuf. Parce que ces interneurones inhibent les motoneurones swimmeret directement, l'alternance PS-RS mouvement est généré 10. Locomotion toutefois, ne exige pas seulement la génération de l'activité, mais aussi la coordination des différents microcircuits indépendants. Dans le système de swimmeret telle coordination est établie par le microcircuit de coordination qui garantit que les branches sont actifs à des moments appropriés. Ce microcircuit est construit par trois neurones identifiés dans chaque segment 11-15.
Ce protocole prévoit ee première fois un guide étape par étape la dissection d'isoler la chaîne de ganglions (T4 à A6, Figure 1). Nous montrons comment la broche isolée abdominale cordon nerveux et desheathe chaque ganglion. Dans cette préparation du système nerveux isolé, les neurones responsables du mouvement de swimmeret sont prêts pour une utilisation dans des expériences électrophysiologiques et morphologiques. La deuxième partie de ce protocole montre les principales caractéristiques du modèle de moteur swimmeret. Cela comprend un guide étape par étape pour enregistrer l'activité extracellulaire des neurones moteurs swimmeret. Les axones des neurones moteurs RS projet par la branche antérieure du nerf N1, tandis que les axones des neurones moteurs PS projettent à travers la branche postérieure de la même nerf (Figure 1) 4. Par conséquent, leur activité peut être enregistré à partir de ces branches avec des électrodes à broche différentielles.

Figure 1: système nerveux isolé à partir de ganglion thoracique 4 (T4) de ganglion abdominal 6 (A6) et un diagramme schématique de ce T4:. Ganglion thoracique 4; T5: ganglion thoracique 5; A1, A2 ... A6 du ganglion abdominal 1, ganglion abdominal 2 ... ganglion abdominal 6; N1: nerf N1; N2: nerf N2; N3: nerf N3; PS: puissance-temps; RS: retour-course. Abréviations directionnelles: A = antérieure; P = postérieure.
Cette procédure de dissection et la technique électrophysiologique démontré sont pratiques pour les étudiants de premier cycle et peuvent compléter les cours pratiques des étudiants en physiologie. La chaîne isolé des ganglions a été utilisé dans un certain nombre d'expériences pour étudier la fonction du système nerveux, la coordination, ou la modulation de microcircuits swimmeret 6 ainsi que le contrôle neuronal du comportement adaptatif dans la locomotion 16, 17. Le système écrevisses de swimmeret fournit ainsi une énorme quantité de l'enseignement ou t intéressantepleuvoir possibilités qui commencent toutes par la dissection de la corde nerveuse ventrale des écrevisses et l'enregistrement extracellulaire du schéma moteur fictive.
Access restricted. Please log in or start a trial to view this content.
Protocole
Cette procédure de dissection est en conformité avec la directive Communautés européennes du 22 e Conseil Septembre 2010 (2010/63 / UE).
1. Préparation
- Obtenir écrevisses, Pacifastacus leniusculus (Dana), des deux sexes ≥8 cm en taille. Veiller à ce que les animaux sont vitales et les membres de l'abdomen et de l'abdomen sont intacts.
- Prenez soin d'inspecter la carapace et que cette cuticule est dur et rigide. Avant et animaux de postmue ont une carapace molle et ne sont pas adaptés pour les expériences parce que pendant le processus de mue de nombreux paramètres changent (par exemple, diminution de l'activité locomotrice).
- Assemblez tous les outils et les matériaux utilisés lors de la dissection, épinglage et dégainage de la corde nerveuse montre la figure 2 et figurant dans les suppléments fournis.

Figure 2: Matériaux et outils utilisés pour la dissection, épinglage et dégainage de la corde nerveuse.
(1) grand seau rempli de glace; (2) une solution saline écrevisses; (3) distributeur de solution saline; (4) microscope de dissection; (5) plat de dissection; (6) de forts ciseaux; (7) forceps (8) ciseaux à ressort; (9) boîte de Pétri bordée de Sylgard clair; (10) broches de fixation; (11) source de lampe froide.
2. Dissection brut
- Anesthésier animaux sur la glace pendant 15 à 20 min. Effectuer la première partie de la dissection brut sur un banc près de l'évier de laboratoire car il comprend une étape d'exsanguination et l'échantillon doit être rincé régulièrement avec une solution saline écrevisses pendant la procédure.
- Tenez face ventrale animaux et utiliser des ciseaux pour couper les deux fortes griffes à leurs bases près du thorax (Figure 3-1). Retirer uropode gauche et à droite (figure 3-2).
- Placez la face ventrale de l'animal dans le plat de dissection Sylgard bordée de noir. Elevate céphalothorax en insérant de glace sous l'abdomen et l'épingler au telson (figure 4A).
- Remplissez le distributeur de solution saline avec ~ 60 ml refroidi écrevisses saline. Perfuser écrevisses avec une solution saline froide à travers l'ouverture de griffe (figure 4B). L'excès de solution saline se écouler à travers les coupes à uropodes. Couvrir avec de la glace pendant écrevisses exsanguination
- Décapiter l'animal avec une seule coupe transversale à juste derrière les yeux de l'animal à l'aide de ciseaux forts (figure 5A). Retirez toutes les jambes qui marchent près des articulations de base comme indiqué sur la figure 5B.
- Isoler l'abdomen avec les derniers segments thoraciques en provenance du reste du céphalothorax. Faire une première découpe au niveau des seconds bras de marche (segment thoracique 3) par l'insertion, la pointe des ciseaux dans l'ouverture de la deuxième branche de marche et de coupe vers le côté opposé. (Figure 6A-1).
- Étendre cette première coupe des deux côtés par til céphalothorax (figure 6A-2).
- Retournez l'animal ouverte pour faire partie des organes internes visible. Poussez la glande digestive importante (figure 6B-3) à la partie antérieure de l'échantillon et utiliser une pince pour retirer les organes reproducteurs de la cavité abdominale.
- Retirer la partie antérieure du céphalothorax (Figure 6C). Utilisation coupes latérales pour éliminer les parties latérales de la carapace, qui couvrent les branchies, des deux côtés du thorax restant (figure 6D-4). Retirez les branchies et rincer l'échantillon avec une solution saline froide.
- Poursuivre la dissection avec une coupe à travers toute la longueur de la plaque sternale, comme indiqué sur la figure 6E-5. Faire de cette coupe à positions latérales maximales entre pleuron et natatoires (Figure 6E marquages rouges). Passez de l'autre côté avec une même coupe. Rincer l'échantillon avec une solution saline froide.
- Effectuer la dissection restant sous une dissection microscope. Placez la face ventrale de l'abdomen de l'écrevisse dans le plat de dissection Sylgard bordée de noir et rempli de solution saline écrevisses de sorte qu'il couvre l'échantillon.
REMARQUE: Les étapes (02/12 au 04/08) suivantes contiennent des instructions directionnelles qui se appliquent aux expérimentateurs droitiers. Dans les étapes suivantes (02/12 au 06/08), il est important de remplacer écrevisses solution saline à des intervalles réguliers, tous les 20 à 30 min avec une solution saline froide, pour maintenir la santé du système nerveux. - Fixer l'éprouvette avec des épingles insectes arrière au telson et en avant les restes de la carapace. Placer l'échantillon de manière que les points de Telson vers la gauche et est parallèle au bord de la table.
- Utilisez une pince grossières dans la main gauche pour saisir à travers une ouverture de jambe de marche (figure 7A) et tirez le spécimen ouverte (Figure 7B flèche blanche). Identifier les grandes dorsales deux brins fléchisseur musculaires (Figure 7B-1 et C-1) et réduire leur ventralebase comme indiqué sur la figure 7B.
- Identifier l'artère sternale (Figure 7C-2), qui descend de dorsale (le cœur) pour ventrale, à la 4 e segment thoracique. Cette artère se trouve juste au-dessus du cordon nerveux (Figure 7C-3), avant qu'il projette dans le cordon nerveux, formant l'artère ventrale.
- Transect l'artère sternale. Comme le montre la figure 7C, soulever l'artère abord, en utilisant une lame des ciseaux, couper et seulement lorsque le cordon nerveux ventral situé est visible.
- Fixer les muscles fléchisseurs dorsale en avant (vers la droite). Cela devrait être fait en position maximale étiré avec des épingles pour ne pas bloquer la vision et le spécimen reste tendue. Lorsque les brins dorsale musculaires sont fixes (figure 8-1), la première ganglions abdominaux, A1 et A2, avec les nerfs associés N1, N2, N3 et sont visibles (figure 8).
- Utilisez une pince dans la main gauche pour saisir la specImen à une ouverture des jambes de marche. Tout au long de la dissection suivant les étapes tirez doucement pour garder les échantillons ouverte.
- Transect les nerfs N3 à la position la plus éloignée du cordon nerveux. (Figure 8-3).
- Couper les muscles fléchisseurs proches de la apodeme ventrale comme le montre la Figure 8-4. Prenez soin de ne pas endommager le cordon d'nerf ou les nerfs N2.
- Répétez les étapes 2,18 et 2,19 pour la N3 nerfs et les muscles fléchisseurs des ganglions abdominale reste A2 à A5.
- Lors de la dernière ganglion abdominal, A6, couper les muscles fléchisseurs dorsale de la apodeme ventrale et l'échantillon devrait ressembler comme le montre la figure 9.
- Coupez la plaque postérieure du sternum aux nerfs de A6 (figure 9-1) et de garder la partie ventrale (figure 9-2). Jeter la partie dorsale avec des muscles fléchisseurs (Figure 9-3). Fixer la plaque sternale avant avec broches à travers les ouvertures des jambes de marche,et en arrière à A6.
3. dissection fine
- Placer l'échantillon sous le microscope à la partie antérieure et dirigée à l'opposé de la partie postérieure vers le bord de la table.
- Utilisez une pince comme le montre la figure 10A pour retirer les pièces les plus antérieures du Sterna céphalothoracique.
NOTE: Le ganglions thoraciques et des nerfs associés sont en partie couverts par la musculature de la jambe et Sterna céphalothoracique. Le sterna céphalothoracique former un squelette qui sépare les cavités situées latéralement des pattes de marche de l'autre et de la cavité interne dans laquelle le cordon nerveux ventral réside. - Couper les muscles entre les structures restantes exosquelette comme indiqué sur la Figure 10B -1 et B2. Utilisez une pince pour saisir et soulever l'extrémité antérieure de la chaîne nerveuse ventrale (figure 10C).
REMARQUE: Le cordon de nerf peut être endommagé dans le processus afin d'éviter ramasser le NERVe cordon à plusieurs reprises. - Couper les nerfs thoraciques latéralement tout en soulevant le cordon nerveux (Figure 10C-3). Gardez ces nerfs à longueur appropriée pour épingler. Retirer la partie pressé de la chaîne de ganglions, qui a été repris avec une pince, en coupant tous les antérieure de tissu à T4 (Figure 10C-4).
- Placer l'échantillon avec la partie antérieure vers la gauche et se concentrer sur A1. Couper le nerfs N1 et N2 de A1 à une longueur appropriée (max. 1 cm) pour les épingler sur.
- Focus sur A2 et identifier les nerfs N1, N2, N3 et de ce segment (figure 11). Les nerfs des ganglions abdominaux N1 A2-A5 résident entre deux replis cuticulaires sternale dans chaque segment (Figure 11A-1) et sont couverts par la musculature. Faire une coupe le long de la cuticule sternale invagination postérieure. Commencer à la bordure latérale de l'abdomen et continuer en direction de la ligne médiane comme représenté sur la Figure 11A.
- Si la N1 cible est encore Coverouge avec des tissus comme le montre la figure 11B (flèche rouge), couper à travers le faisceau musculaire, mais cette fois en avant de deux replis cuticulaires sternum et le nerf N1 (Figure 11B-2).
- Couper nerf N1 distale que possible (Figure 11C-3). Nerve N1 est entièrement visible et la branche antérieure et postérieure peut être identifié (Figure 11C).
- Procéder au nerf controlatéral N1 et couper d'abord les muscles le long de la cuticule sternale invagination postérieure, à partir dedans, près du ganglion (Figure 11D). Si le nerf est encore couvert par le tissu, coupez à travers le faisceau musculaire, mais cette fois en avant de deux replis cuticulaires sternum et le nerf N1, similaire à la Figure 11B-2. Couper le N1 de nerf que distalement que possible.
- Couper les nerfs N2 du ganglion ce sur une longueur suffisante (env. 0,5 cm) pour l'épinglage.
- Répétez les étapes 3.7 à 3.11 pour les nerfs de A3-A5.
- Couper le TNSves de ganglion A6 distal que possible (Figure 12A). Utilisez une pince pour saisir plusieurs nerfs de A6 à lever ce ganglion et commencer à isoler la chaîne de ganglions de la plaque sternale.
- Tout en soulevant le cordon nerveux, tirez-le doucement dans la direction antérieure comme le montre la figure 12B (flèche blanche). Comme les noyaux individuels sont levées, retirez l'artère ventrale qui peut être attaché à la face ventrale de la corde nerveuse (Figure 12C). Continuer cette séquence (doucement) Tirez coupe jusqu'à la corde nerveuse est complètement isolé.
- Transférer la chaîne isolé de ganglions à une boîte de Pétri bordée de Sylgard clair et rempli de solution saline écrevisses (Figure 12D).
4. Épingler le cordon de nerf dans la boîte de Pétri
REMARQUE: Utilisez de petites épingles coupées de fil d'acier inoxydable (voir suppléments) à la broche le cordon nerveux. Ne toucher que le nerf se terminant avec la pince et ne pas Squeeze les connecteurs ou les ganglions.
- Epingler la chaîne de ganglions en ligne droite, tout en appliquant léger étirement.
- Disposez le cordon nerveux dans la boîte de Pétri avec la face dorsale vers le haut (figure 13, ligne noire). La face ventrale des noyaux peut être identifié par sa convexité; la face dorsale est plat. Epingler les nerfs thoraciques sur les côtés. Continuer avec les nerfs de A6, qui se étend le cordon nerveux le long de son axe longitudinal.
- Epingler les nerfs de A1 à un angle de 90 ° par rapport à la corde nerveuse.
- Passez à A2 et épingler le nerfs N2 à un angle de 35 à 45 ° par rapport à la corde nerveuse (figure 1A).
- Séparer les nerfs N1 dans leurs branches antérieures et postérieures avant épinglant comme le montre la figure 14. Utilisez deux paires de pinces fines pour ramasser avec une paire de pinces antérieur et de l'autre la branche postérieure de la N1 nerveuse. Prenez soin de choisir seulement l'extrémité la plus distales des branches nerveuses. Maintenant, tirez-les soigneusement à part.
- Epingler la branche antérieure du nerf de N1 à un angle de 90 ° par rapport à la corde nerveuse (figure 1A). Epingler la branche postérieure du nerf N1 entre la branche antérieure N1 et le nerf N2.
- Répétez les étapes 4.4 à 4.6 pour les nerfs des ganglions A3-A5. Alors que le tronçon fixateur nerf cordon dans longitudinale ainsi que les directions transverses.
5. dégainage les ganglions
- Placer la préparation d'une manière telle que les mains de l'expérimentateur sont toujours posés sur un plan stable pour éviter de secouer. Pour desheath les ganglions illuminent le cordon nerveux par le bas.
- Focus sur toute ganglion A1 abdominale à A5. Utilisez des ciseaux fins de printemps pour faire une petite coupure latérale à travers la gaine de ganglion, postérieure au ganglion et entre les nerfs N2 et N3 (Figure 15A flèche rouge).
- Ramassez la gaine de ganglion en utilisant très fPince ine et coupées transversalement à travers la gaine au-dessus des connecteurs, comme indiqué sur la figure 15A-1. Prenez soin de ne pas presser ou couper le cordon nerveux avec les ciseaux.
- Tout en maintenant et en soulevant la gaine ganglionnaires avec une pince continuent à couper le long des bords latéraux du ganglion (Figure 15B-2 et -3). Retirer la gaine. En variante la broche à deux côtés des connecteurs de telle manière qu'il est fixe, mais le cordon de nerf ne est pas pressé.
- Répétez les étapes 5.2 à 5.4 pour tous les ganglions abdominaux A1 à A5.
- Desheathe les ganglions thoraciques et le ganglion A6 d'une manière similaire. Pour desheathe A6 début antérieure au ganglion et continuer en direction postérieure. Pin de la gaine de ganglion de A6 à l'extrémité postérieure de la chaîne de ganglions.
6. extracellulaire enregistrements à partir de motoneurones
- Assemblez tous les outils et les matériaux utilisés pour les enregistrements extracellulaires indiqués in Figure 16B et figurant dans les suppléments. Un aperçu de la configuration d'enregistrement est illustré à la figure 16A. Lancer tout l'équipement électronique utilisé dans cette expérience (Figure 16C), de sorte que les amplificateurs peuvent se réchauffer pendant au moins 30 min avant l'enregistrement. Allumez l'ordinateur et lancez le logiciel d'enregistrement.
- Placer la chaîne de ganglions sur la table de microscope et éclairer par le bas. Insérez l'électrode d'enregistrement dans le Sylgard à proximité du nerf cible et l'électrode de référence à une position à proximité mais en dehors de la noyaux (figure 17A et B). Pliez le nerf cible autour de l'électrode d'enregistrement (Figure 17C).
- Étirer le nerf légèrement, pour assurer le contact entre l'électrode et le nerf et l'épingler sur le côté (F igure 17D). Fixer les câbles d'électrodes à la table de microscope à l'aide de pâte à modeler, afin qu'ils restent dans la position souhaitée.
- Utilisez unseringue remplie avec de la vaseline et une aiguille de calibre 20 (avec pointe arrondie) (Figure 17E-3) pour isoler le nerf cible de la solution de bain. Première mettez un peu de gelée de pétrole sur le Sylgard autour de l'électrode d'enregistrement. Le résultat est une couche de gelée de pétrole recouvrant le Sylgard à proximité de l'électrode d'enregistrement (figure 17E-4). Prenez soin de ne pas tamponner directement sur le nerf et éviter les bulles d'air dans cette couche.
- Sceller l'électrode d'enregistrement avec de la vaseline de tous côtés jusqu'au niveau de la solution saline (figure 17F) de surface.
- Répétez cette procédure pour tous les nerfs cibles dont l'activité doit être surveillé.
- Démarrez l'enregistrement. Utiliser un mode d'acquisition de droits continu ou écart et un taux de 5 kHz d'échantillonnage. Réglez l'amplificateur extracellulaire des paramètres suivants; gagner à 1000 (1000 amplifie le signal temps, prendre soin d'inclure ce paramètre d'amplification dans les paramètres du logiciel d'acquisition) d'uneda gamme de filtre passe-bande de 300 Hz (coupe-bas) à 2000 Hz (coupe-haut).
Access restricted. Please log in or start a trial to view this content.
Résultats
Avec les enregistrements extracellulaires simultanées de RS et PS, les neurones moteurs d'un ganglion, l'activité alternatif de ces groupes de neurones moteurs, peut être contrôlé (figure 18), représentant le motif de la locomotion fictive.
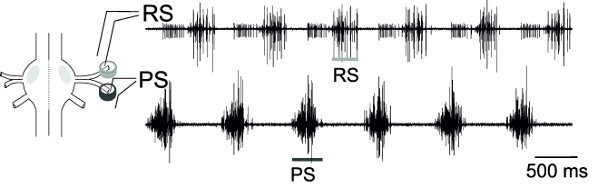
Figure 18: Représentation schématique d'un ganglion différentiel et le placement de l'électrode à broche enregist...
Access restricted. Please log in or start a trial to view this content.
Discussion
L'anatomie d'écrevisses et de leur ganglions abdominaux a été décrit précédemment 5, 18, 19, 20 et il est recommandé de se familiariser avec eux avant la dissection afin d'éviter la coupe des nerfs importants.
Il est essentiel de garder la préparation à des températures inférieures à 23 ° C pour éviter la dégradation du nerf cordon isolé. Ceci peut être réalisé facilement par le remplacement de la solution de bain de 20 à 30 minutes cha...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
The authors declare that they have no competing financial interests.
Remerciements
Nous remercions Jos Burgert pour aider avec certains des chiffres. Nous sommes reconnaissants à Ingo Selbach (et le groupe "Edelkrebsprojekt NRW») pour ses efforts pour fournir le laboratoire avec des animaux de laboratoire. Nous remercions Anna C. Schneider pour la relecture premières versions du manuscrit. Cette recherche a été financée par une subvention SM Emmy Noether DFG 206 / 3-1 et une subvention de démarrage de l'Université de Cologne pour professeures.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| 4-channel extracellular amplifier: MA 102 | Amplifier | Elektroniklabor, Zoologie, Universität zu Köln, Germany | |
| air-table | Technical Manufacturing Corporation (TMC) a unit of AMETEK Ultra Precision Technologies, Peabody, MA, USA | 63-534 | |
| Axon Digidata 1440A | Digitizer | Axon Instruments, Molecular Devices Design, Union City, CA | DD1440A |
| big bucket | |||
| Clampex & Clampfit | pClamp 10, recording and analysis software | Molecular Devices Design, Union City, CA | pClamps 10 Standard |
| cold lamp source | with flexible light guide (fiber optic bundle) | Euromex microscopes holland, Arnhem, BD | LE.5211 & LE.5235 |
| computer and monitor | equipped with recording software | ||
| container and pipette for liquid waste | |||
| crayfish saline | contains (in mM): 5.4 KCl, 2.6 MgCl2, 13.5 CaCl2, and 195 NaCl, buffered with 10mM Tris base and 4.7mM maleic acid; aerated for 3 hours. Adjust at pH of 7.4. | ||
| dextran, Texas Red (3000MW, lysine fixable) | fluorescent dye, lysine fixable | Life Technologies GmbH, Darmstadt, Germany | D3328 |
| dissection dish | (l x w x h) 15x7x5 cm; linned with black silicone | ||
| faraday cage | |||
| fixing pins | |||
| forceps (biology, Dumont #5) | Forceps: Biology, tip 0.05 x 0.02 mm, length 11cm, INOX | Fine Science Tools (FST), Germany | 11252-20 |
| forceps (biology, Dumont #55) | Forceps: Biology, tip 0.05 x 0.02 mm, length 11cm, INOX | Fine Science Tools (FST), Germany | 11255-20 |
| forceps (electronic, Dumont #5) | Forceps: Standard, tip 0.1 x 0.06 mm, length 11cm, INOX | Fine Science Tools (FST), Germany | 11251-20 |
| intracellular electrode | Borosilicate glass capillaries (outer/inner diameter: 1mm/0.5mm), with filament | Sutter Instruments, Novato, CA | BF100-50-10 |
| Leica S8 Apo StereoZoom | Dissection Microscope Zoom 1x - 8x | Leica, Germany | 10446298 |
| microscope table | |||
| mirror | to illuminate preparation from below | ||
| modeling clay | |||
| Olympus SZ61 | Dissection Microscope Zoom 0.67x - 4.5x | Olympus, Germany | |
| petri dish | 94 x 16 mm; lined with clear silicone | Greiner bio-one, Germany | 633180 |
| ring scissors | ThoughCut, cutting edge: sharp/blunt, straight: 13cm | Fine Science Tools (FST), Germany | 14054-13 |
| spring scissors or alternative: Vannas spring scissors | cutting edge: 8 mm, tip diameter: 0.2mm, straight: 10cm or cutting edge 2.5 mm, tip diameter 0.075 mm, straight: 8cm | Fine Science Tools (FST), Germany | 15024-10 or 15000-08 |
| student Vannas spring scissors or alternative: Moria Spring Scissors | cutting edge: 5mm, tip diameter: 0.35mm, straight: 9cm or cutting edge: 5mm, tip diameter 0,1 mm, straight: 8 cm | Fine Science Tools (FST), Germany | 91500-09 or 15396-00 |
| sylgard | 184 Silicone Elastomer Base and Curing Agent; for black sylgard add activated carbon | Dow Corning, Midland, MI, USA | |
| syringe filled with petroleum jelly and equipped with a 20 gauche needle with rounded tip |
Références
- Hughes, G. M., Wiersma, C. A. G. The Co-Ordination of Swimmeret Movements in the Crayfish, Procambarus-Clarkii (Girard). J Exp Biol. 37 (4), 657-670 (1960).
- Mulloney, B., Smarandache, C. Fifty Years of CPGs: Two Neuroethological Papers that Shaped the Course of Neuroscience. Front Behav Neurosci. 4, 45(2010).
- Murchison, D., Chrachri, A., Mulloney, B. A Separate Local Pattern-Generating Circuit Controls the Movements of Each Swimmeret in Crayfish. J Neurophys. 70 (6), 2620-2631 (1993).
- Mulloney, B., Hall, W. M. Functional organization of crayfish abdominal ganglia. III. Swimmeret motor neurons. J Comp Neurol. 419 (2), 233-243 (2000).
- Davis, W. J. Lobster Righting Responses and Their Neural Control. Proc R Soc Ser B-Bio. 170 (1021), 435-456 (1968).
- Mulloney, B., Smarandache-Wellmann, C. Neurobiology of the crustacean swimmeret system. Prog Neurobiol. 96 (2), 242-267 (2012).
- Huxley, T. H. The crayfish: An introduction to the study of zoology. , MIT Press. Cambridge, MA. (1980).
- Smarandache-Wellmann, C., Weller, C., Wright, T. M., Mulloney, B. Five types of nonspiking interneurons in local pattern-generating circuits of the crayfish swimmeret system. J Neurophys. 110 (2), 344-357 (2013).
- Skinner, F. K., Mulloney, B. Intersegmental coordination of limb movements during locomotion: mathematical models predict circuits that drive swimmeret beating. J Neurosci. 18 (10), 3831-3842 (1998).
- Mulloney, B. During fictive locomotion, graded synaptic currents drive bursts of impulses in swimmeret motor neurons. J Neurosci. 23 (13), 5953-5962 (2003).
- Smarandache-Wellmann, C., Grätsch, S. Mechanisms of coordination in distributed neural circuits: Encoding coordinating information. J Neurosci. 34 (16), 5627-5639 (2014).
- Mulloney, B., Hall, W. M. Local commissural interneurons integrate information from intersegmental coordinating interneurons. J Comp Neurol. 466 (3), 366-376 (2003).
- Mulloney, B., Harness, P. I., Hall, W. M. Bursts of information: Coordinating interneurons encode multiple parameters of a periodic motor pattern. J Neurophys. 95 (2), 850-861 (2006).
- Smarandache, C., Hall, W. M., Mulloney, B. Coordination of Rhythmic Motor Activity by Gradients of Synaptic Strength in a Neural Circuit That Couples Modular Neural Oscillators. J Neurosci. 29 (29), 9351-9360 (2009).
- Smarandache-Wellmann, C., Weller, C., Mulloney, B. Mechanisms of Coordination in Distributed Neural Circuits: Decoding and Integration of Coordinating Information. J Neurosci. 34 (3), 793-803 (2014).
- Chrachri, A., Neil, D., Mulloney, B. State-Dependent Responses of 2 Motor Systems in the Crayfish, Pacifastacus leniusculus. J Comp Physiol A. 175 (3), 371-380 (1994).
- Chrachri, A., Neil, D. M. Interaction and Synchronization between 2 Abdominal Motor Systems in Crayfish. J Neurophys. 69 (5), 1373-1383 (1993).
- Skinner, K. The Structure of the 4th Abdominal-Ganglion of the Crayfish, Procambarus-Clarki (Girard) II. Synaptic Neuropils. J Comp Neurol. 234 (2), 182-191 (1985).
- Skinner, K. The Structure of the 4th Abdominal-Ganglion of the Crayfish, Procambarus-Clarki (Girard) I. Tracts in the Ganglionic Core. J Comp Neurol. 234 (2), 168-181 (1985).
- Mulloney, B., Tschuluun, N., Hall, W. M. Architectonics of crayfish ganglia. Microsc Res Techniq. 60 (3), 253-265 (2003).
- Braun, G., Mulloney, B. Cholinergic modulation of the swimmeret motor system in crayfish. J Neurophys. 70 (6), 2391-2398 (1993).
- Davis, W. J. Motoneuron Morphology and Synaptic Contacts - Determination by Intracellular Dye Injection. Science. 168 (3937), 1358-1360 (1970).
- Altman, J. S., Tyrer, N. M. Filling Selected Neurons with Cobalt through Cut Axons. Neuroanatomical Techniques. Strausfeld, N. J., Miller, T. A. , Springer. New York, NY. 373-402 (1980).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon