Method Article
再構成ヒト角膜上皮様(RHCE)組織モデルを使用して眼刺激性化学物質の有害性の同定のための眼刺激性試験(EIT)
要約
我々は、3次元再構成人間の角膜のような上皮(RHCE)組織モデルを利用した眼刺激性試験を開発しました。テストは、眼刺激性及び腐食性物質(GHSカテゴリー1と組み合わせた2)とラベル(GHSなしカテゴリ)を必要としないものとを区別することができます。
要約
EU化粧品指令、欧州REACH法規に第七改正に準拠するために、ヒトの眼毒性の信頼性と正確な評価のための検証非動物代替の方法が必要とされています。このニーズに応えるために、我々は正常なヒト細胞に基づいて3次元再構成人間の角膜のような上皮(RHCE)組織モデルを利用した眼刺激性試験(EIT)を開発しました。 EITは、眼刺激物や腐食(GHSカテゴリー1と2を組み合わせ)とラベリング(GHSなしカテゴリ)を必要としないものを分離することができます。テストは、2つの別々のプロトコル、液体化学物質と第二のために設計された1つ、固体試験物品のための同様のプロトコルを利用しています。 EIT予測モデルは、単一の露光期間(液体で30分間、固形分6時間)、および単一の組織の生存率のカットオフ(MTTアッセイによって決定される60.0%)を使用します。 EITは95.5 / 68.2 / 81.8パーセントとのSENSを達成した(44液体および固体39)83化学物質の結果に基づいて、液体用itivity /特異性と精度(SS&A)、100.0 / 68.4 / 84.6パーセントとSS&A固体用、および97.6 / 68.3 /と全体のSS&Aの83.1パーセント。 EITは、規制テスト要件を満たすために、動物を使用することなく、液体及び固体の化学物質の広範囲の眼刺激性を分類に大きく貢献します。 EpiOcular EIT法は、TG 492としてOECDテストガイドラインに2015年に実施されました。
概要
このような化粧品、洗剤、家庭用クリーナーとして消費者製品は、彼らが目に連絡した場合、重大な損傷を誘発する可能性が種々の化学物質が含まれています。そのため、目への刺激のためのこれらの薬剤のテストは、消費者の安全を確保するための1、米国とEUの規制当局によって必要とされます。混合物および製剤の眼刺激性の評価はまた、化学物質の輸送のためのEUの化粧品指令の下で化粧品成分の標識のためにREACH(登録、評価、認可および化学物質の使用制限)法律を遵守する要件である、とのために殺虫剤や家庭用製品2のラベル。現在、規制当局は、化学品の分類およびラベリングに関する世界調和システム(GHS)3を用いて、眼のハザード評価が必要です。 GHSは、主にドレイズ眼刺激性試験に基づいており、最も広く使用されている眼刺激アッセイもので異物とマイルxturesは、ウサギの眼4の結膜嚢に直接導入されています。 GHS分類によると、GHS区分1(眼腐食)は、露光3,5以下の21日以内に眼の組織または完全に可逆的ではない、目と視力に重大な損傷に深刻な最初の損傷の原因となる化学物質をテストすることを指します。 GHS区分2は、露出の21日以内に完全に可逆的で目に有意な変化を生じる化学物質をテストすることを指します。腐食性または刺激性物質ではない試験化学物質はGHSはありませんカテゴリと呼ばれています。
40年以上にわたり、ドレイズウサギの目のテストでは、その再現性の欠如、人間の応答の過大評価、そして生きている動物5-8の使用のために批判されています。これらの懸念は、洗練、縮小、およびin vivo試験 9の交換のための多くの提案を奨励しています。検証非動物代替物の必要性がさらに強化されました(2009年)化粧品(2005年)化粧品の安全性評価における動物の使用を禁止指令、および成分に第七改正の採用により2。
1996年から、再構成された角膜のような組織モデルは、広く目、原料、界面活性剤ベースの製剤、および、または近傍で使用するために設計された配合混合物の刺激性を評価するために化粧品業界で使用されています10-13。 RHCEの組織モデルの使用は、その本来の、希釈しない形で、組織表面への試験物質の直接局所適用することができます。この方法では、非水溶性製剤は溶剤でそれらを希釈することなく試験することができます。 (代替法の検証のための欧州連合(EU)のリファレンスラボラトリーヨーロッパセンター)EURL ECVAMのに対応して広く、該当簡単で、経済法の要求SINGLを利用眼刺激性試験(EIT)電子露光時間とラベリングを必要としない材料から眼刺激物や腐食を分離することができる(図1)14を開発しました。 83化学物質(44液体および39固体)の結果をもとに、EITは95.5 / 68.2 /と81.8パーセントの感度/特異度と精度(SS&A)液体のため、固体のための100.0 / 68.4 /と84.6パーセントSS&A、および97.6を/達成しました68.3 /と全体のSS&Aの83.1パーセント。
2007年には、EURL ECVAMの後援化粧品ヨーロッパ(旧COLIPA)が主催する多実験室前の検証研究では、正式な検証15にそれをもたらすことを目的としたEITの妥当性と信頼性を評価しました。本研究では、298の独立した試験では、7つの独立の研究室で行いました。研究結果は、すべての参加研究室15全体の変動の低い係数の予測で99.7%の契約を実証しました。その結果、2010年にはEITプロトコルは正式なEURL ECVAMに入りました検証プログラム。バリデーション試験は、in vivoでの参照データ(ドレイズ眼刺激性データ)が利用可能であった対象の個々の物質と化学の混合物、を含む104コード化されたテスト化学物質を利用しました。この作品の成功に基づき、OECDドラフトテストガイドラインには、それは、EITは、国連GHS分類および表示システムによる材料の広い範囲の眼刺激性の分類に大きく貢献することが期待される2014年に提出されました。
プロトコル
治療のためのRHCE組織の調製 - 0日
- 市販のヒト角膜のような上皮(RHCE)キットを受信すると、オン。EITアッセイ( 表2)を実行するために必要なすべてのキットの整合性(キットの詳細については、コンポーネントの参照標準アッセイキットコンポーネント( 表1)、装置材料を確認します領収書の日は、15分間、室温に(その24ウェル輸送用コンテナ内の)組織を平衡化。
| 額 | 試薬 | 条件 | ソース | 説明 | 有効期限 |
| 1 | EpiOcular組織の密封された24ウェルプレート (OCL-200) | 2〜8℃ | マテック | 24 TISSが含まれていますアガロース上での細胞培養インサート、パッケージのUE | 72時間 |
| 1瓶、 200ミリリットル | EpiOcularアッセイ培地 (OCL-200-ASY) | 2〜8℃ | マテック | DMEMベースの培地 | 21日 |
| 1瓶、 100ミリリットル | Ca ++ Mg ++を-無料のダルベッコ-PBS(DPBS) | RT | Sigma-Aldrich社、D5652、または当量。 | インサートをすすぎに使用します | 1年 |
| 4 | 6ウェルプレート | RT | ファルコン | アッセイプロトコールの間に組織を維持するために使用 | NA |
| 2 | 12ウェルプレート | RT | ファルコン | アッセイプロトコルの間に使用されます | NA |
| 2 | 24ウェルプレート | RT | ファルコン | MTTアッセイを実行するために使用 | NA |
| 1バイアル、 0.5ミリリットル | 酢酸メチル (CAS#79-20-9) | RT | シグマアルドリッチ、 猫#186325 | アッセイでのPCとして使用 | 1か月 |
表1:標準アッセイキットコンポーネント。
| 装置/材料 | 必要な: |
| 加湿インキュベーター(37±1℃、5±1%CO 2、90±10%湿度) | 前アッセイとの間に組織をインキュベート |
| 層流フード | 無菌条件下での安全な作業 |
| 真空ポンプ(オプション) | メディアとソリューションを吸引 |
| プレートリーダー光度計(96ウェルプレート用) | ODを読みます |
| プレートシェーカー | エキスホルマザンのイオン |
| 滅菌、鈍い刃の鉗子 | 組織インサートをハンドリング |
| ストップウォッチを | 試験材料とプロトコルの他の時限ステップの適用のタイミング |
| ウォーターバス(37±1℃) | 温暖化メディアとMTT溶液 |
| すり鉢とすりこぎ | 粒状固形物を粉砕 |
| 正の変位ピペット(50μL) | 粘性および半固体材料及び懸濁液の応用 |
| 調節可能なピペット(200μL-2ミリリットル) | 液体材料の応用、アッセイ培地およびMTT |
| 滅菌済みのヒント(200μL、20μL)、レイニン猫#のHR-200FとHR-20F(または同等) | 液体材料の応用、アッセイ培地およびMTT |
| ワイドオリフィス予め滅菌チップ(250μl)を、レイニン猫#のHR-250WS(または当量alent) | 粘性および半固体材料及び懸濁液の応用 |
| 8オンス/ 220ミリリットルの検体容器、ファルコンカタログ番号3540200(または同等品) | すすぎ組織 |
| 滅菌使い捨ての注射器(例えば、1ミリリットルtuberkulinシリンジOmnifix-F、ビー・ブラウン社、カタログ番号9161406V) | 〜50mgの固体材料の配達(オプション) |
| テッド・ペラマイクロへら/スプーン、テッド・ペラ社、カタログ#13504(または同等の、鋭いスプーンや骨キュレット、 例えば AESCULAP、番号:FK 623) | 〜50mgの固体材料の配達 |
| Ca ++およびMg ++を含まないダルベッコのリン酸緩衝生理食塩水(CA ++ Mg ++を無料-DPBS):シグマアルドリッチ、カタログ番号D5652(または同等) | アッセイの間に組織をすすぎ |
| 滅菌脱イオン水、組織培養グレード(質の生物学的または同等品) | NCとして使用します |
| 96ウェル平底プレート、ファルコン(または同等品) | ODを読み取ります |
| コットンチップスワップ(無菌) | 組織表面を乾燥させる(オプション) |
| 粘着テープまたはパラフィルム | ホルマザン抽出中にプレートをカバー |
| MTT-100アッセイキット | MTTチアゾリルブルーテトラゾリウムブロマイド試薬(シグマ#M-5655)およびイソプロパノール抽出物が含まれています。 |
表2:EITを実行するために必要な装置および材料。
- 無菌条件下で、RHCE組織に24ウェルプレートを含むプラスチック袋を開き、滅菌ガーゼを除去します。アガロースゲルの間に気泡のためのすべての組織を点検し、挿入します。 >カバーインサートの下に挿入エリア、欠陥組織、または組織WHIの50%を気泡と文化を使用しないでください CH完全に液体で覆われています。
- 試験物品または制御コードと露光時間で6ウェルプレートにラベルを付けます。 (キットに付属)アッセイ培地のアリコート1.0mlを、予め標識した6ウェルプレートのウェルに、約37℃に予熱しました。
- RHCE組織を含む各カバーを取り外しおよび標識された6ウェルプレートに挿入部を配置するために滅菌ピンセットを使用してください。このステップの間、滅菌ろ紙にやさしいブロット法によりインサートの外側に付着して残りの出荷アガロースを削除します。インサートの下に閉じ込められた気泡をリリース。
- 1時間の標準的な培養条件(SCC、37±1℃、5±1%CO 2を含む加湿雰囲気)を6ウェルプレートでRHCE組織をプレインキュベートします。
- 1時間後、37℃に予熱し、新鮮なアッセイ培地1.0 mlのアッセイ培地を交換し、SCC条件でRHCE組織をインキュベート(一晩= O / N)(16〜24時間)。
- O / Nインキュベーションした後、適切なピペット装置を使用して(提供DPBS)のCa 2+のMg 2+を含まない 、ダルベッコのリン酸緩衝生理食塩水を20μlを適用します。 DPBSを組織全体に広がらない場合は、ゆっくりDPBS全体組織表面を濡らすことを確実にするために、プレート上に挿入]をタップします。
- 30±2分間のSCCでRHCE組織をインキュベートします。
注:この手順は、組織水和のために必要であり、 生体内条件で模倣します。
3.試験材料の露出手続き
- RHCE組織を複製するために、各試験品およびコントロールを適用した(n = 2)。試験品の投与手順は、液体と固体のために異なっています。局所ピペットを用いて液体試験品の50μLを適用します。液体のための露光時間は30分です。 (塩化ナトリウム50mgを保持するためにキャリブレーション)平らにさじを用いた固体試験品50mgを適用します。元固体用posure時間は6時間です。
注:液体がピペット装置を利用して適用することができる液体物質 (例えば、液体、ゲル、及びクリーム)として定義されます。固体をピペットを用いて適用することができない非液体物質 (例えば、粉末 、樹脂またはワックス状材料)として定義されます。- 被験物質の物理的状態を決定することは容易ではない場合は、15分(37℃)で水浴中で被験物質とのバイアルを置きます。 37℃で液化これらの試験品のための液体のためのEITのプロトコルに従ってください。
- 特に粘性材料のための肯定的な変位のピペットを使用してください。
- 最初のネガティブコントロールおよびポジティブコントロールを用量し、テストの記事を用量。
- ネガティブコントロール(NC)と標準的なピペットを用いてRHCE組織へのポジティブコントロール(PC)の50μLを適用します。 NCは、滅菌脱イオン水です。 PCは、酢酸メチル(CAS#79-20-9)です。時テスト30分間のNCとPCを適用します液体試験品をると6時間固体試験品をテストする場合。
4.テスト記事の露出 - 1日目
- 液体被験物質の治療のために、 表3に示すタイミングスケジュールに従ってください。全ての組織のための同等の露出を確実にするために、各試験品のアプリケーション間の1分間隔のままにしておきます。
- 30±2分のDPBS前処理した後、局所的に適切なピペット装置を用いて、RHCE組織に局所的に50μlのNCとPC、および各液体被験物質を適用します。
- 上面を覆うために、組織に直接液体試験品の50μLを適用します。粘性材料のための開口部を広くするためにピペットチップの狭い点をカット。非常に粘性材料については、投与装置(組織の挿入やプラスチック画鋲の内径よりわずかに小さい直径の平らな双頭気筒)に被験物質を適用し、投与Dを反転eviceおよび組織の上に置き、試験品が均等に接触する組織表面をするように。
- 試験品は、組織全体に広がらない場合は、ゆっくり、それは全体の組織表面に広がることを確認するために挿入]をタップします。機械(ピペットチップで、 例えば )試験物品の広がり、それが組織に損傷を与える可能性があるため推奨されません。
- 30±2分間のSCCで組織をインキュベートします。
- 固体試験記事の治療のために- 。1日目、 表4に示すタイミングスケジュールに従う全ての組織のための同等の露出を確実にするために、各試験品のアプリケーション間の2分間隔のままにしておきます。
- 30±2分のDPBS前処理した後、適切なピペット装置を用いて、RHCE組織に局所的に50μlのNCとPCを適用します。
- 固体試験品のアプリケーションでは、(N = 2)井戸からインサートを除去し、無菌の表面( 例えば 、午前の蓋の上に置きます培地中にこぼれる試験品を避けるためにultiwellプレート)。
- 平らにスプーンを使用して、局所的に組織表面上に試験品の約50 mgの適用されます。組織の表面が完全に被験物質で覆われていることを確認してください。試験品は、組織全体に広がらない場合は、組織が完全に被験物質で覆われていることを確実にするために左右に軽く挿入を振ります。機械(ピペットチップで、 例えば )試験物品の広がり、それが組織に損傷を与える可能性があるため推奨されません。
- 必要に応じて、試験物品と組織との間のより良好な接触を保証するために乳鉢と乳棒を有する結晶粉末を挽きます。
- また、その頭で1mlの注射器を使用することにより、インサートの内側の組織培養に直接場所粉末を遮断。プランジャが引き戻された後、プランジャーを押し下げて適用されるシリンジにスタッフ粉末。
- インサートの外壁は、Cである場合ontaminated 例えば 、粉末により、滅菌ガーゼで粒子を拭き取ってください。
- 投与後、培養培地を含む6ウェルプレートに組織を戻し、15分±6時間SCCでインキュベートします。
5.すすぎ
- 試験物品ごとに3つのきれいなビーカー(150ミリリットル容量)のセットを準備し、DPBS 100mlでそれらのそれぞれを埋めます。各試験品について、3ビーカーの異なるセットを使用しています。
- それが使用された場合は、液体材料または固体材料のための15分間の暴露±6時間30±2分間の曝露の終了時に、投与装置を取り外し、廃棄します。
- 細かいピンセットでプラスチック「カラー」の上端をつかんで、媒体のうちRHCE組織を含むインサートを持ち上げます。取扱い及びデカンテーションを容易にするために、湾曲鉗子を使用してください。鉗子を使用して、カラーによって一緒に重複インサートを保持することにより、一度に組織2をすすぎます。 nは注意してください鉗子で組織を損傷するOT。
- きれいな吸収性材料上に組織表面から試験品またはコントロール(紙タオル、ガーゼなど )をデカント
- 、DPBS、約2秒間DPBSで円を描くように渦の最初のビーカーへの挿入をつけ、彼らは主にDPBSで満たされるようにインサートを持ち上げ、バックビーカーに液体をデカント。第1のビーカー内で、このプロセスを3回繰り返します。
- 同じように、DPBS各3回の第2および第3のビーカー内のインサートをすすぎます。
- 吸収性材料上に、インサートに残っている液体をデカントします。おおよそ45°の角度(オープンエンドダウン)にインサートを回転させて、吸収材料に上唇をタッチします。
注:これは目に見える試験材料のすべてを除去することが可能でない場合、さらなるすすぎないが過度の取り扱いに起因する組織の損傷を避けるために行われるべきです。
6.ポスト・ソーク
- すすいだ後、直前に前標識された12ウェルプレート中で室温に温めアッセイ培地5ml中に組織を浸します。
- 任意の残留被験物質の除去を容易にするために室温で浸漬固体材料のための液体材料または25±2分間12±2分間組織をインキュベートします。
7.ポストインキュベーション
- ポストソーク浸漬期間の終わりに、組織からアッセイ培地をデカントし、吸収性材料上にインサートをブロット。
- 暖かいアッセイ培地の1ミリリットルを含む前標識された6ウェルプレートへの挿入を転送します。
- 液体試験材料のためのSCCで120±15分間組織をインキュベートします。
- 固体試験材料のためのSCCで18±0.25時間の組織をインキュベートします。
8. MTT生存率アッセイ - 1日目(液体用プロトコル)と2日目(固体のためのプロトコル)
- 120の後のインキュベーション後にMTTアッセイを実施77;液体のための15分をそれぞれ固形物、18±0.25時間。
- 前標識された24ウェルプレートの各ウェルに1.0 mg / mlのMTT溶液と溶液のアリコート0.3ミリリットルを準備します。
- 商業MTTキット( 表5)を使用してください :
- 使用前に2時間は、室温でのMTT濃縮物を解凍します。 2 MTT濃縮物mlおよび1.0 mg / mlのMTT溶液を生成するためのMTT希釈の8ミリリットルを組み合わせます。
- 使用するまで暗所で4℃でのMTT溶液を保管してください。 1日以上のためのMTT溶液を保管しないでください。
- ポストインキュベーションの終わりに、6ウェルプレートの各インサートを除去し、穏やかに吸収材料にブロット。
- MTT溶液0.3 mlを含有する24ウェルプレートに挿入を置きます。インサートの下に閉じ込められた気泡をリリース。 SCCで180±10分間プレートをインキュベートします。
- MTT抽出
- MTT溶液を180±10分間のインキュベーション後、各インサートを除去します24ウェルプレートからの吸収性材料にインサートの底ブロット。
- 非着色液体試験品(水没抽出)の場合:これは、インサートを水没するように抽出液(イソプロパノール)の2.0ミリリットルを含む前標識された24ウェルプレートにインサートを移します。
- 固体と液体の着色剤のための(非沈め抽出液の汚染を回避するために抽出):これは、インサートを水没しないように、抽出溶液1.0ml(イソプロパノール)を含む前標識された6ウェルプレートにインサートを転送は。
注:対応する陰性および陽性対照のための同じ非水没抽出を行います。
- (プレートカバー、ウェルの上端との間に、または標準プレートシーラーでパラフィルムで、例えば )プレートをシール。オービタルプレートシェーカー上でプレートを配置し、MTTを抽出するために、室温で2〜3時間振とうします。
- また、2-8で抽出O / Nを実行します76;振とうせずに暗闇の中で、C。
- 非着色液体試験品(水没抽出)の場合:抽出期間の終了時に、バックウェルに挿入し、RHCE組織と挿入を破棄し、それぞれから液体をデカント。
- 抽出液を混合し、プレート構成( 図2)に記載の標識済み96ウェルプレートの適切なウェルに2200μlのアリコートを移します。
- 固体と液体の着色剤(非水没抽出)の場合:抽出期間の終わりに、(組織に穴を開けないようにしてください)組織を捨てます。
- 組織から抽出された溶液を含む24ウェルプレートの各ウェルに抽出溶液1.0mlを加えます。抽出溶液を混合し、プレート構成( 図2)に記載の標識済み96ウェルプレートの適切なウェルに2200μlのアリコートを移します。
- Tを決定します彼は550と590 nmの単一波長で抽出したサンプルの光学密度(OD)プレートリーダーまたは分光光度計(実験室内で一貫している必要があります)。
- 不溶性固形物によって生じる濁った抽出液の場合には、遠心分離前にOD(蒸発を避けるために°C〜4遠心分離機をクールダウン)を測定するソリューションを提供しています。すすぎは、試験物品(TA)を削除しないとTAはMTT還元に干渉する場合には、追加のコントロールを使用する必要があります。 MTT還元16を補正するために、詳細なSOPを参照してください。
- ケースでTAが有するように、またはMTT測定と相互作用することができる色を開発するために示されているが、追加のテストはに結合した色の量を決定し、その後、組織から抽出されなければなりません。色付きの試験品16を補正するために、詳細なSOPを参照してください。
組織生存率試験(表6および図3)&#9.計算160;
- 一般的な計算
- 各実験のためのブランク対照ウェル(OD Blkに)の平均OD値を計算します。
- 同じ実験(BLKは、データを補正した)のそれぞれのOD値からOD Blkにを引きます。
- 各組織(=補正しOD)のための2つのアリコートの平均値を計算します。
- 平均陰性対照(100%コントロール)にそれぞれ制御し、試験品の相対のための2つの反復の各組織の生存率パーセントを計算します。
生存率(%)= [補正さOD処理した組織/修正さOD陰性対照]×100% - 生存能力(2反復組織間の生存率の差)の違いを計算します。
- 平均試験品の生存率(TAの生存率)を計算し、予測モデルによる試験品を分類します。
10.予測モデル(図3)
- TA-処理された組織の生存率は、NC-治療された組織vに> 60.0相対的なものである場合iabilityは、非刺激性(NI)などの試験品(GHSなしカテゴリ)を標識します。
- TA-処理した組織の生存率は、NC-治療された組織の生存率を60.0相対≤であれば、刺激物(I)(GHSカテゴリー1及び2)などの試験物品にラベルを付けます。
注:EITテスト結果があれば適格とみなされます。- EITのNC OD> 0.8および<2.5;
- (ノースカロライナ州からの相対%)EIT PC組織の生存率は≤50.0%です。
- 2つのレプリカの組織(NC、PC、および被験物質)との差が<20.0%です。
結果
10試験物品(TA)および陰性および陽性対照で行わ代表EIT 結果を表6および図3に示されている。NCは100%の組織の生存率に相当するOD = 1.31のために、そのためのPC(平均OD = 0.41)の平均でした31.2パーセントの相対的な組織の生存率。 EITプロトコルは固体露光プロトコルを使用して、液体暴露プロトコルを使用して7ラボ15の有効な独立した実験で4実験室で8つの独立した有効な実験で行ったところ、液体のプロトコルを使用してPCの平均組織生存率は36.4±4.0でした固体プロトコルの%および32.3±6.4%。すべての場合において、陽性対照の結果は60.0%15のカットオフ値以下でした。
図3に示すように 、TA1、TA2、TA4、TA7、TA8とは> 60.0%の組織の生存率を持っていたので、「NI」に分類されました。 TA3、TA5、TA6、TA9、TA10とは、組織の生存率Xを持っていました04; 60.0%、したがって、「I」に分類されました。重複する組織間の組織の生存率の違いは、
EIT試験方法RHCE組織モデルを利用し、本明細書に記載されているようEURL ECVAM /化粧品によって、正式な検証ヨーロッパ15,17-19を含むいくつかのmultilaboratory検証研究、内眼の刺激を評価するために使用しました。研究の全てにおいて、EITは再現性があることが示されており、正しく化学物質(物質および混合物の両方)を識別することができた眼刺激または重篤な眼の損傷の交流のための分類と表示を必要としないました国連GHS 15,17-19によれ。 EIT試験方法は、感度、特異性、および全体的な精度のために眼の刺激のための検証管理グループ(VMG)の合格基準を満たしており、現在、それは 、生体内ウサギドレイズ試験19のための部分的な代替品としての正式な実施を保留されています。
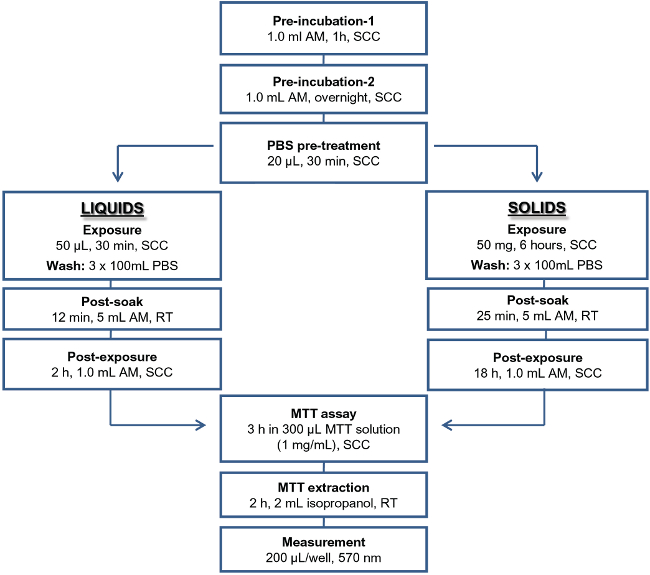
図1:液体と固体試験物品用EITプロトコルの概要の略語を使用:AM、アッセイ培地;。 SCC、標準的な培養条件。 PBS、ダルベッコのリン酸緩衝生理食塩水; RT、室温。
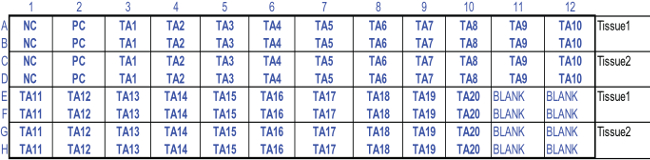
図2:MTT組織の生存能力試験のための標準化96ウェルプレート構成二つの200μlのアリコートをTRAです。前標識された96ウェルプレートの適切なウェルにnsferred。使用される略語:NC、ネガティブコントロール; PC、ポジティブコントロール; TA1-TA20、テスト記事1月20日;ブランク、抽出ソリューション。 96 MTTプレート構成はRHCE組織生存率およびEIT結果を計算するように設計されたExcelスプレッドシートに使用されます。
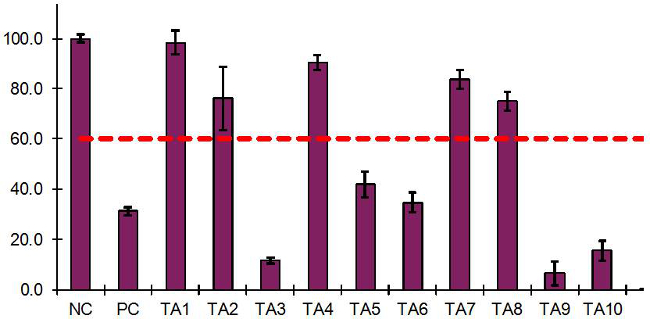
図3:EIT結果は、10のテスト記事、ノースカロライナとRHCEの組織モデルを使用してPCを制御するために得られたグラフは、EIT結果を提示するように設計されたExcelスプレッドシートから生成されます。 NCに60.0%の相対≤組織の生存率を減少させた試験化学物質は「刺激物(「I」、TA3、TA5、TA6、TA9、およびTA10)および組織生存率は> 60.0%が非刺激物として分類されていたテスト化学物質(として分類されていますNI」、TA1、TA2、TA4、TA7、およびTA8)。
| EITプロトコル作業ステップの開始時間(1オペレータのための一日の仕事) | |||||||
| 各行は、組織の1組に対応 | |||||||
| ステップの順序: | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 液体: | PBS | TA 暴露 | ポスト ソーク | ポスト Incub。 | MTT 反応 | MTT 抜き取り | メジャー |
| 30分 | 30分 | 12分 | 120分 | 180分 | 120分 | OD | |
| ノースカロライナ州 | 午前9時00分 | 午前9時30分 | 10時 | 10:12 | 12:12 | 15時12 | 後に |
| パーソナルコンピュータ | 9:01 | 午前9時31分 | 午前10時01分 | 10:13 | 12:13 | 15:13 | 17時30分 |
| TA-1 | 9:02 | 9:32 | 午前10時02分 | 10時14分 | 午前12時14分 | 15:14 | |
| TA-2 </強いです> | 9:03 | 9時33分 | 10時03分 | 10時15分 | 12時15 | 午後03時15 | |
| TA-3 | 午前9時04分 | 9時34分 | 10時04分 | 10時16分 | 12:16 | 15:16 | |
| TA-4 | 午前9時05分 | 9時35分 | 10時05分 | 10時17分 | 午前12時17分 | 午後3時17分 | |
| TA-5 | 9時06 | 9時36分 | 10:06 | 10時18分 | 12時18分 | 午後3時18分 | |
| TA-6 | 9時07分 | 9時37分 | 10時07分 | 10時19分 | 午前12時19分 | 午後3時19分 | |
| TA-7 | 9時08分 | 9時38分 | 10時08分 | 午前十時20分 | 12時20分 | 15:20 | |
| NG> TA-8 | 9時09分 | 9時39分 | 10時09分 | 10時21分 | 12時21分 | 15時21分 | |
| TA-9 | 9時10分 | 9時40分 | 午前10時10分 | 10時22分 | 12時22分 | 午前15時22分 | |
| TA-10 | 午前9時11分 | 9時41 | 10:11 | 10時23分 | 午前12時23分 | 15時23分 | |
表3:液体試験品プロトコルステップDPBS、テストの記事(TAS)の適用、すすぎとポスト浸し、ポストインキュベーション時間、MTTアッセイ、MTTの抽出とプリウェット組織を含むのテストのためのサンプル・タイムスケジュール 、そしてMTT ODの測定は、列に示されています。重複する組織のためのタイムズは、行で構成されています。 10のTAとコントロールをテスト全体のアッセイは、一日で仕上げることができます。
e_content ">| (2日は一人のオペレータのために働く)EITプロトコルステップのための時間を開始 | |||||||
| 各行は、組織の1組に対応 | |||||||
| 1日目 | 2日目(次の日) | ||||||
| ステップの順序: | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 固体: | PBS | TA 暴露 | ポスト ソーク | ポスト Incubaction | MTT 反応 | MTT 抜き取り | メジャー |
| 30分 | 6時間 | 26分 | 18時間 | 180分 | 120分 | OD | |
| ノースカロライナ州 | 午前9時00分 | 午前9時30分 | 午後03時30分 | 午後3時56分 | 9時56分 | 午前12時56分 | 後に |
| パーソナルコンピュータ | 9:02 | 9:32 | 15時32分 | 午後3時58分 | 9時58分 | 午前12時58分 | 午後03時30分 |
| TA-1 | 午前9時04分 | 9時34分 | 15時34分 | 16時00分 | 10時 | 13時00分 | |
| TA-2 | 9時06 | 9時36分 | 15時36分 | 夜04時02分 | 午前10時02分 | 13時02分 | |
| TA-3 | 9時08分 | 9時38分 | 15時38分 | 16:04 | 10時04分 | 13時04分 | |
| TA-4 | 9時10分 | 9時40分 | 15時40分 | 16:06 | 10:06 | 13:06 | |
| TA-5 | 午前9時12分 | 9時42分 | 15時42分 | 16:08 | 10時08分 | 13:08 | |
| TA-6 | 午前9時14分 | 9時44分 | 15時44分 | 16時10分 | 午前10時10分 | 午前13時10分 | |
| TA-7 | 9時16分 | 9時46分 | 夜3時46 | 午後04時12 | 10:12 | 午後1時12 | |
| TA-8 | 9時18分 | 9時48分 | 15:48 | 午前16時14 | 10時14分 | 午後01時14分 | |
| TA-9 | 9時20分 | 午前9時50分 | 午後3時50分 | 午前16時16分 | 10時16分 | 13時16分 | |
| TA-10 | 9時22分 | 9時52分 | 15時52 | 午後4時18分 | 10時18分 | 13:18 | |
表4:固体試験品の試験のためのサンプル・タイムスケジュールDPBS、テストの記事の適用、すすぎとポスト浸し、ポストインキュベーション時間、MTTアッセイ、MTTの抽出、およびMTT ODの測定にプリウェット組織を含む。プロトコルステップは列に示されています。重複する組織のためのタイムズは、行で構成されています。全アッセイ試験10のTAとコントロールは2日間にわたり行われます。
| 額 | 試薬 | 保管条件 | ソース | 説明 | 有効期限 |
| 1バイアル、 2ミリリットル | MTT濃縮物(MTT-100-CON) | 光から保護された(-20℃) | マテック | 冷凍MTT濃縮物 | 2ヶ月 |
| 1バイアル、 8ミリリットル | MTT希釈剤 | 2-8&#186; C | マテック | MTTアッセイで使用する前にMTT濃縮物を希釈するための | 2ヶ月 |
| 1瓶、 60ミリリットル | イソプロパノール (CAS#67-63-0) | RT | シグマアルドリッチ | 抽出ソリューション | NA |
表5:MTT-100アッセイキットコンポーネント。
| コードN° | 組織 | 生データ | ブランク補正されたデータ | ODの平均 | 生存率% | ||
| N | Aliq。 1 | Aliq。 2 | Aliq。 1 | Aliq。 2 | |||
| NC | 1 | 1.316 | 1.352 | 1.316 | 1.352 | 1.334 | 101.6 |
| 2 | 1.277 | 1.309 | 1.277 | 1.309 | 1.293 | 98.4 | |
| パーソナルコンピュータ | 1 | 0.379 | 0.397 | 0.379 | 0.397 | 0.388 | 29.6 |
| 2 | 0.419 | 0.442 | 0.419 | 0.442 | 0.431 | 32.8 | |
| TA1 | 1 | 1.213 | 1.244 | 1.213 | 1.244 | 1.229 | 93.5 |
| 2 | 1.355 | 1.355 | 1.355 | 1.355 | 1.355 | 103.2 | |
| TA2 | 1 | 1.210 | 1.122 | 1.210 | 1.122 | 1.166 | 88.7 |
| 2 | 0.828 | 0.837 | 0.828 | 0.837 | 0.833 | 63.4 | |
| TA3 | 1 | 0.167 | 0.168 | 0.167 | 0.168 | 0.167 | 12.7 |
| 2 | 0.138 | 0.136 | 0.138 | 0.136 | 0.137 | 10.4 | |
| TA4 | 1 | 1.137 | 1.160 | 1.137 | 1.160 | 1.149 | 87.4 |
| 2 | 1.262 | 1.191 | 1.262 | 1.191 | 1.227 | 93.4 | |
| TA5 | 1 | 0.610 | 0.621 | 0.610 | 0.621 | 0.616 | 46.9 |
| 2 | 0.480 | 0.484 | 0.480 | 0.484 | 0.482 | 36.7 | |
| TA6 | 1 | 0.502 | 0.513 | 0.502 | 0.513 | 0.508 | 38.7 |
| 2 | 0.396 | 0.407 | 0.396 | 0.407 | 0.402 | 30.6 | |
| TA7 | 1 | 1.048 | 1.050 | 1.048 | 1.050 | 1.049 | 79.9 |
| 2 | 1.149 | 1.150 | 1.149 | 1.150 | 1.150 | 87.5 | |
| TA8 | 1 | 1.032 | 1.034 | 1.032 | 1.034 | 1.033 | 78.7 |
| 2 | 0.941 | 0.935 | 0.941 | 0.935 | 0.938 | 71.4 | |
| TA9 | 1 | 0.022 | 0.022 | 0.022 | 0.022 | 0.022 | 1.7 |
| 2 | 0.144 | 0.149 | 0.144 | 0.149 | 0.147 | 11.2 | |
| TA10 | 1 | 0.150 | 0.150 | 0.150 | 0.150 | 0.150 | 11.4 |
| 2 | 0.254 | 0.255 | 0.254 | 0.255 | 0.255 | 19.4 | |
| 平均 | DIF。 | の平均 | DIF。 | DIF / 2 | 類別 | ||
| ODの | ODの | 生存率[%] | 生存率の | ||||
| NC | 1.314 | 0.041 | 100.0 | 3.12 | 1.56 | NI | 資格のあります |
| パーソナルコンピュータ | 0.410 | 0.043 | 31.2 | 3.23 | 1.62 | 私 | 資格のあります |
| TA1 | 1.292 | 0.127 | 98.3 | 9.63 | 4.81 | NI | 資格のあります |
| TA2 | 0.999 | 0.333 | 76.1 | 25.36 | 12.68 | NI | D> 20 |
| TA3 | 0.152 | 0.030 | 11.6 | 2.32 | 1.16 | 私 | 資格のあります |
| TA4 | 1.188 | 0.078 | 90.4 | 5.94 | 2.97 | NI | 資格のあります |
| TA5 | 0.549 | 0.134 | 41.8 | 10.16 | 5.08 | 私 | 資格のあります |
| TA6 | 0.455 | 0.106 | 34.6 | 8.07 | 4.03 | 私 | 資格のあります |
| TA7 | 1.100 | 0.101 | 83.7 | 7.65 | 3.82 | NI | 資格のあります |
| TA8 | 0.986 | 0.095 | 75.0 | 7.23 | 3.62 | NI | 資格のあります |
| TA9 | 0.085 | 0.125 | 6.4 | 9.48 | 4.74 | 私 | 資格のあります |
| TA10 | 0.203 | 0.105 | 15.4 | 7.95 | 3.98 | 私 | 資格のあります |
表6:10のテスト記事、NCとPCのコントロールのために得られた結果EITテーブルがPRODです。組織の生存率とEIT結果を計算するように設計されたExcelのスプレッドシートによってuced。ノースカロライナ州に60.0%の相対≤組織の生存率を減少させた試験化学物質は組織の生存率を持っていた刺激物(「I」、TA3、TA5、TA6、TA9、およびTA10)とテスト化学物質として分類されている> 60.0%が「(非刺激物として分類されていますNI」、TA1、TA2、TA4、TA7、およびTA8)。
ディスカッション
我々はEpiOcular組織モデルのために開発された眼刺激性試験( 図1)を提示しています。 GHS区分とを区別しない、本明細書に提示されるようEITは、感度と特異17 EITを度の高いラベル(GHSなしカテゴリ)を必要としない材料から眼刺激物や腐食(GHSカテゴリー1と2を組み合わせ)を分離することができます1カテゴリからの2物質。 EITは、化粧品および医薬成分を含む化学物質の広い範囲の眼刺激性の分類と表示のために検証されました。他のin vitro試験に関連して、EITは、in vivoウサギ眼刺激性試験の代替として機能します。
EITは露光および露光後のインキュベーション期間の長さ( 図1)に変化する液体および固体材料のための2つの類似するが異なるプロトコルを使用します。 EITで使用するエンドポイント以前に検証されたヒト上皮組織モデル20,21で使用されているMTTアッセイによって決定し、組織の生存率です。このアッセイを行うために、標準的な細胞培養装置の他に特別な装置が必要とされません。高い組織対組織の再現性のレベル、n = 2の組織の代わりに通常推奨されるN = 3が使用されます。それはそれによって個々の組織14の異なる取り扱いをすると生じる可能性がアッセイのばらつきを最小限に抑え、同時に2つの組織を処理するために、経験豊富なオペレータを可能にするため、2組織を使用し、N =能力は、プロトコルの重要な側面です。また、陽性対照および陰性対照と一緒に、被験物質あたりn = 2の組織、同一の物理的状態(液体または固体)の10の試験物質の刺激を用いて、1キット(24組織)を用いて評価することができます。
材料の信頼性の分類を確保する他の重要なポイントは、陽性コントロールのsuの仕様ですbstance(組織生存率≤50.0%)、重複した組織(差<20.0%)、およびネガティブコントロールOD読み取り値(> 0.8 <2.5)との間の再現性。
EIT試験を行う場合、インキュベーション期間中にプロトコルまたは変化の偏差が変化した結果をもたらすことができるので、それは、検証プロトコルと推奨投薬およびすすぎスケジュール( 表3および4)に接着することが重要です。同様に、MTTインキュベーションのための3時間の時間からの偏差は異なるMTTの読みになり、アッセイの結果に影響を与える可能性があります。
時折、試験化学物質は、MTT組織生存率アッセイ又はMTTの原因の減少を妨害することができる光学的または他の特性を有していてもよいです。例えば、試験化学物質を直接青紫色の反応生成物にMTTを低減することができる、またはMTTホルマザン(〜570ナノメートル)と同じ範囲の光を吸収する着色された物質であってもよいです。しかし、これらの試験の化学物質はPRますMTTアッセイの際に、材料の十分な量は、依然として上に存在する(またはによって吸収)である場合にのみ、組織の問題をESENT。この干渉を回避するために、大規模な洗浄手順は、EITプロトコルに組み込まれています。すすぎはTAを削除しないとTAはMTT還元を妨害した場合、追加のコントロールはそれを検出し、修正するために使用されなければなりません。被験物質の直接MTT還元が疑われる場合に簡単に説明すると、当該化学物質の50μlの(又は固体50 mg)をSCC(NC、滅菌脱イオン水50μlで作業MTT溶液で3時間インキュベートする、であるべきです同時に実行)。 MTT溶液が青紫色になった場合、試験物品を、MTTが低下していると推定されます。この場合、凍結殺し組織コントロールを使用して機能的なチェックは、試験物質は、組織に結合し、偽のMTT低減信号に先行しているかどうかを評価するために行われるべきです。 TA-さらされ、殺された組織制御でかなりのMTT還元がある場合(未処理の生存組織内の量に対して)、試験品の平均組織の生存率は、殺された対照の平均生存率を差し引くことにより補正しなければなりません。
偽陰性分類14,15,18の発生率が低いことによって実証されるように、EITは、安全性の側面に誤差が生じるが。重要なのは、目には腐食性であり、GHS区分1の化学物質のいずれもが、最も深刻な眼の危険性を表していませんこのアッセイ14,15,18,19に非刺激性として分類されました。最後に、 インビトロ試験方法で RHCEの主要な利点の一つは、原液と(2次元、沈められた細胞培養物では不可能である)固体材料を試験する可能性があります。
EITは、国連GHS分類および表示システムによる材料の広い範囲の眼刺激性を決定する際に重要な一因になります。 Oを決定するために、動物の交換cular毒性は、長年にわたって毒物学研究の目標でした。 EIT試験方法は、2014年にEURL ECVAMでサポートされている正式なバリデーション試験を完了したとEpiOcular EITは、2015年にはOECD TG 492としてOECDテストガイドラインに実装されました。
開示事項
この記事の発行手数料はマテック社が支払われました。
謝辞
著者は、EITプロジェクト専用の彼の科学的な支援と時間のためにドクター・ジョンHarbellに感謝したいと思います。著者らはまた、バイヤスドルフAG(ドイツ)、IIVS(米国)、メアリーケイ社(米国)、エイボンプロダクツ社(米国)、プロクター・アンド・ギャンブル/ Cosmital(スイス)、ラボラトリーピエール・ファーブル(フランス)に感謝したいと思いますハーランラボラトリーズ(イギリス)、および眼刺激性試験15の多施設国際事前検証と検証研究に参加するためのLVMH Parfume(フランス)。
参考文献
- National Toxicology Program (NTP) Interagency Center for the Evaluation of Alternative Toxicological Methods (NICEATM). Request for Ocular Irritancy Test Data From Human, Rabbit, and In Vitro Studies Using Standardized Testing Methods. Federal Register. 72 (109), 31582-31583 (2007).
- . Regulation (EC) No 1907/2006 of the European Parliament and of the Council of 18 December 2006 concerning the Registration, Evaluation, Authorisation and Restriction of Chemicals (REACH), establishing a European Chemicals Agency, amending Directive 1999/45/EC and repealing Council Regulation (EEC) No 793/93 and Commission Regulation (EC) No 1488/94 as well as Council Directive 76/769/EEC and Commission Directives 91/155/EEC, 93/67/EEC, 93/105/EC and 2000/21/EC. OJ. L396 (49), 1-849 (2006).
- . . Globally Harmonized System of Classification and Labelling of Chemicals (GHS). , (2013).
- Draize, J. H., Woodard, G., Calvery, H. O. Methods for the Study of Irritation and Toxicity of Substances Applied Topically to the Skin and Mucous Membranes. J Pharmacol Exp Ther November. 82, 377-390 (1944).
- Adriaens, E. Retrospective analysis of the Draize test for serious eye damage/eye irritation: importance of understanding the in vivo endpoints under UN GHS/EU CLP for the development and evaluation of in vitro test methods. Arch tox. 88, 701-723 (2014).
- Balls, M., Botham, P. A., Bruner, L. H., Spielmann, H. The EC/HO international validation study on alternatives to the Draize eye irritation test. Toxicol in Vitro. 9, 871-929 (1995).
- Curren, R. D., Harbell, J. W. Ocular safety: a silent (in vitro) success story. Altern Lab Anim. 30, 69-74 (2002).
- Wilhelmus, K. R. The Draize Eye Test. Survey of Ophthalmology. 45, 493-515 (2001).
- Curren, R. D., Harbell, J. W. In vitro alternatives for ocular irritation. Environ health persp. 106, 485-492 (1998).
- McCain, N. E., Binetti, R. R., Gettings, S. D., Jones, B. C. Assessment of ocular irritation ranges of market-leading cosmetic and personal-care products using an in vitro tissue equivalent. Toxicologist. 66, 243 (2002).
- Niranjan, P., Dang, A. H., January, B. G., Gomez, C., Harbell, J. W. Use of the EpiOcular assay for preclinical qualification of formulas for human clinical studies. Toxicologist. 96, 249 (2007).
- Yin, X. J. Prediction of ocular irritation potential of surfactants-based formulations at different concentrations using the EpiOcular model. Toxicologist. 108, 378 (2009).
- Harbell, J., Curren, R. In vitro methods for the prediction of ocular and dermal toxicity. Handbook of Toxicology. , (2001).
- Kaluzhny, Y. Development of the EpiOcular(TM) eye irritation test for hazard identification and labelling of eye irritating chemicals in response to the requirements of the EU cosmetics directive and REACH legislation. Altern Lab Anim. 39, 339-364 (2011).
- Pfannenbecker, U. Cosmetics Europe Multi-Laboratory Pre-Validation of the EpiOcular Reconstituted Human Tissue Test Method for the Prediction of Eye Irritation. Toxicol in vitro. , (2013).
- MatTek Corporation. . EpiOcular™ Eye Irritation Test (OCL-200-EIT) for the prediction of acute ocular irritation of chemicals for use with Reconstructed Human EpiOcular Model (OCL-200-EIT). Protocol#MK-24-007-0055. , (2014).
- Kaluzhny, Y. EpiOcular Eye Irritation Test (EIT) for Hazard Identification and Labeling of Eye Irritating Chemicals: Protocol Optimization for Solid Materials and Extended Shipment Times. Altern Lab Anim. 43 (2), 101-127 (2015).
- Kolle, S. N., Kandarova, H., Wareing, B., van Ravenzwaay, B., Landsiedel, R. In-house validation of the EpiOcular(TM) eye irritation test and its combination with the bovine corneal opacity and permeability test for the assessment of ocular irritation. Altern Lab Anim. 39, 365-387 (2011).
- . Reconstructed Human Cornea-like Epithelium (RhCE) Test Method for Identifying Chemicals Not Requiring Classification and Labelling for Eye Irritation or Serious Eye Damage. Draft proposal for a new test guideline.. OECD Guideline for the Testing of Chemicals. , (2014).
- Blazka, M. E., Harbell, J. Evaluating the ocular irritation potential of 54 test articles using the EpiOcular Human tissue Construct Model. Toxicol. In Vitro. , (2003).
- Kandarova, H. The EpiDerm Test Protocol for the Upcoming ECVAM Validation Study on In Vitro Skin Irritation Tests — An Assessment of the Performance of the Optimised Test. Altern Lab Anim. 33, 351-367 (2005).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved