Method Article
代謝サポートの切除、生体脳磁気共鳴顕微鏡集録時に
要約
現在のプロトコルでは、ユーザーは磁気共鳴顕微鏡データの収集中に急性海馬と大脳皮質のスライス標本の生存率を維持できる方法について説明します。
要約
このプロトコルでは、磁気共鳴 (MR) 顕微鏡データの収集中に急性脳スライス標本の正常な代謝機能をサポートするために必要な手順について説明します。生活、摘出した哺乳類の組織に氏のコレクションを行うことが可能ですが、そのような実験は従来解像度制限によって制約されているおり、組織の微細構造を可視化することができます。逆に、氏のプロトコル顕微鏡画像の解像度を達成して静的、不変条件で長いスキャン時間を必要に合わせて固定サンプルの使用が必須。現在のプロトコルでは、顕微鏡の解像度での生活は、哺乳類の組織サンプルのイメージ投射を可能にする最初の利用可能な MR 手法について説明します。このようなデータは、クリニックで使用されるどの病理に基づく微視的レベル影響でコントラスト変化など巨視的氏スキャンの内容の理解に非常に重要なのです。一度このような理解を実現することより高感度、高精度の診断法開発でき、以前の病気の治療、治療のより正確な監視および改善された忍耐強い結果に直接翻訳します。
記述の方法論は、脳スライス標本に焦点を当てて、プロトコルは、代謝組織のニーズに合わせてガスと液の準備が変更されることを考えれば、摘出組織スライスに適応されます。プロトコルの実行が成功は 15.5 h までの期間にわたって MR 拡散信号の安定性を示す生活、急性のスライス標本になります。他氏互換性潅流装置に現在のシステムの主な利点より高い解像度の画像とで一定、途切れない流れを慎重に提供する能力を達成するために必要な MR 顕微鏡ハードウェアとの互換性規制による条件。低下したサンプル スループットは、一度に 1 つだけの組織スライスをイメージ可能性がありますこのデザインの一考察です。
概要
磁気共鳴画像 (MRI) システムは、これまでより高い分野強さに着実に進歩した、組成および生体の状態の詳細についての認識となっています。このようなハードウェア進歩にもかかわらず組織の細胞の構造を可視化するための十分な解像度で MRI はクリニックでまだ利用できません。その結果、臨床スキャンの内容を検討する際は、組織の細胞レベルの特性を推測することが。このような推論には、モデル系を直接観察することができます撮影したデータから得られた同等のプロセスに関する知識が必要です。伝統的に、これらのモデルには、アフリカツメガエル卵母細胞とアメフラシL7 ニューロン1,2など水生生物から細胞が含まれています。これらはサイズが異常に大きいため氏の方法と観察のため利用可能な最初の動物細胞の中にあった: 約 1000 μ m、300 μ m の直径、それぞれ。最近では、ハードウェア設計の進歩は哺乳類セルの最大の例の 1 つの許可されている-α 運動ニューロン-固定ティッシュ3,4MR 顕微鏡技術を使用してイメージを作成します。これらの研究は、MR を用いた哺乳類細胞材料の直接可視化を実証、採用固定サンプル ライブの組織からの MR 特性に大幅に異なる、従って同等の代表的なモデル5、務めることはできません。 6。もっと重要なは、複雑な生物学的プロセスとのコンサートで発生した氏のコントラスト変化を観察することと、摂動およびイメージングの実験の経過を測定できる生体試料が必要です。
7建て氏互換性、ボアの人工、灌流装置前述8 ユーザビリ ティーの高い商業マイクロ イメージング ハードウェアを含むプロトコルを提示氏生体顕微鏡研究を容易にするには、.このデザインのユニークな利点としては、哺乳類動物組織と溶存ガスの含有量と組織灌流のサイトで pH を精密制御の携帯レベルの解像度機能があります。また、工芸品の流れを避けるために画像集録時に血流を割り込み植氏の研究の大半とは異なりこのデザイン サポートの生理学的条件を改善するために示されているデータ収集中持続灌流の使用組織9,10を分離しました。最後に、それ以外の場合に発生する可能性が動アーティファクトの可能性を減らすことで閉じた記録室とスライス保存ハードウェア援助長引くイメージのコレクションです。
現在のプロトコルは、急性海馬と大脳皮質のスライスを使用するための適切な手順を説明します、出納代謝を正確に制御できます多様な組織型および実験条件の広い配列に対応するこのシステム。このデザインの制限は、マルチ スライス灌流チャンバー11; に比べてサンプル スループットの減少を含むただし、コイル型配列を使用して、将来的にこの制限を克服する可能性があります。
また、水平または垂直の構成で記述されたシステムを用いることが、現在のプロトコル機能で垂直方向の 600 MHz の分光器の使用。MR マイクロ イメージング研究の体制-通常ナローボア (≤6 cm)、強磁場 (≥500 MHz) 分光計-説明肺灌流機器を収容します。ただし、イメージングのコイル、グラデーション、プローブ システム、または他の重要なイメージング ハードウェア採用に変更灌流装置、MR スキャン パラメーターに変更が生じます。
プロトコル
記述されているすべての動物実験科学国立アカデミーのガイドラインに従ってください ' ケアおよび実験動物の使用のためのガイド とレビューされ、フロリダ大学によって承認された ' s制度上のアニマル ・ ケアおよび使用委員会 (IACUC)。すべての適用可能な規則および規制に従う動物の対象研究に従事するとき
。1 です中枢神経組織の維持のための準備の出納
- 作る新鮮な人工髄液 (アプライド)。。
- アプライドの重炭酸塩緩衝液 2 リットルを生成、1,500 mL の 4 L フラスコに二重蒸留または逆浸透膜で精製した水を測定します。フラスコ内電磁攪拌棒を置き、撹拌プレートを使用して液体をかき混ぜなさい 。
- 精製水に溶解塩の次の量: 14.03 g (120 mM) 塩化ナトリウム、4.37 g (26 mM) 重炭酸ナトリウム、リン酸一カリウム 0.41 g (1.5 mM)、0.69 g (1.4 mM) 硫酸マグネシウム七水和物、0.59 g (2 mM) カルシウム塩化物の二水化物、塩化カリウム 0.45 g (3 mM)、および 3.6 g (10 mM) ブドウ糖
。 メモ: 液の化学の内容は、組織、実験の希望条件の特定の代謝の要件に応じて異なります 。
- では、このソリューションを徹底的にミックスすべて塩が溶解するまで。2 l その他の精製水を使用して音量を調整します 。
- は、凍結ポイント不況 osmometer を使用してアプライドの浸透圧をテストします。調整 300 mOsm/kg ソルビトールを使用します。299 mOsm/kg アプライド出納の 2 リットルに 324 mg ソルビトール添加が 300 mOsm/kg (324 mg 当たり約 1 mOsm) 浸透圧を増加します
。 注意: アプライドが 4 ° c 24 時間を超えない期間の密閉、密閉瓶で保存することができます
2。灌流システムの設定
- アプライド出納を準備します。
- Equilibrate アプライド周囲温度 (~ 23 ° C) 未満 1 h. の直接バブリングを介してカーボゲン ・ 95% (95% O 2, 5% CO 2; 1/16 L/min) を毒ガス攻撃中に
注: 異なる組織の種類または目的の実験条件は、液の温度やガスの内容の調整を必要があります。液溶存ガスの含有量の望ましい条件を供給ガス ( 図 1) の個々 のコンポーネントのパーセントの濃度を変化させることにより正確にコントロールできる 。
- 、アプライド カーボゲン ・彩度、必要な温度に達すると pH は、生理学的な範囲 (7.3 7.4) を確認します。適切な溶存酸素濃度と健康な組織代謝に資する pH 条件を維持するために実験の過程で出納貯水池 (1/16 L/分) に直接泡ガスし続ける 。
- Equilibrate アプライド周囲温度 (~ 23 ° C) 未満 1 h. の直接バブリングを介してカーボゲン ・ 95% (95% O 2, 5% CO 2; 1/16 L/min) を毒ガス攻撃中に
- 灌流線をプライムします。
- (300 mOsm, pH 7.3 7.4, 継続的に毒ガス) 準備のアプライドに蠕動マイクロ ポンプに接続されている入口管埋没 。 磁石を退屈させる
- パス、人工デバイス ( 図 2) と両方を通る血流線と傾斜磁場コイル (上下から) をスタックし、プローブ組立まで脇コイルします。アプライド排水をキャッチするビーカーの上肺をハングします
。 注: MRI システムの設計によって灌流線はアプライドでシステムをプライミングする前に基本プローブ本体のグラジェント ・ コイルや磁石の穴を通して渡される必要があります。プローブ本体のプライミングの手順を開始する前に穴にプローブの挿入アセンブリでその潅流線配置に干渉しないことを確認します 。
- 目的の流量 (2 mL/分) が選択されていることを確認し、ポンプに切り替えることにより灌流行の入力を開始します 。
- アプライドが中含まれている空気を転置するように、空行でバブル トラップを反転します 。
- 接続、人工 ' s ガス カーボゲン ・ (マニホールドまたはセカンダリ カーボゲン ・ シリンダー) の 2 番目のソース ポートと 1/16 L/分の流量を設定
- そのカーボゲン ・は、肺を流れることを確認 ' s ガス交換膜、肺の上に排気口を水に浸漬します 。
- 灌流チャンバーから滴り落ちるアプライドが検出されると、手動攪拌による流入ラインからの任意の目に見える気泡を削除します 。
- 灌流チャンバーから流れるアプライドの酸素電極の沈没によって、肺が正常に動作ことを確認します
。 注: 酸素計の読みに近いガスに含まれる酸素の割合 。
3。ティッシュの準備
- 安楽死
- 場所の 4 分の 1 L/分の速度でガスの麻酔器、酸素運搬で 4% イソフルランに公開の誘導室にラット (125-150 g)
- 麻酔室から無意識のラットを削除します 。
- は、仰臥位でラットを配置することによって立ち直り反射テストを実行します。あらゆる動きをチェック — 頭の回転、脚上げ、脊柱屈曲等 — 動物は胃袋に回して直説法 。
- は、綿棒を使用して動物の開いた目に触れることにより瞬目再帰テストを実行します。任意の応答をチェック — 蓋の閉鎖、筋肉がぴくぴく、等 — この感覚入力する 。 最後に、
- を実行、手足は、ラットの足の指の間の皮膚をつまんで、反射テストを撤回 ' s 伸ばした後ろ足ピンセットや止血剤を使用します。脚の屈曲を確認
注: 場合正再帰テスト結果、安楽死を 続行しないでください します 。
- 反応を引き出す 3 つの反射テストのいずれかの場合に、ラットを麻酔室にすぐに戻るし、4% イソフルラン暴露のさらに 2 分間許可します 。
- は、完全に上すべての 3 つの再帰テストを実行します。必要に応じて 2 分麻酔の露出を繰り返し、すべての 3 つの再帰テストの応答の完全な欠如を観察されている一度にのみ続行します 。
- ギロチン斬首を介してラットを安楽死させる 。
- 脳切除
- 総郭清によるラット脳を削除します。腹臥位で頭を開始します。はさみを使用して、吻方鼻に、首の後ろから皮膚を切って、頭蓋骨を公開します 。
- 鈍プローブと頭蓋骨の表面から軟部組織を削除します 。
- 後頭, 頭頂部, と rongeurs を用いた頭蓋の頭骨尾側から動作している、削除します 。
- マイクロはさみで縦裂に沿って切ると戻る両半球から層を剥離によって硬膜をリトラクトします 。
- 頭蓋骨から仰臥位に頭を回すと腹側脳神経を切断して脳を削除します 。
- スライス分離
- 脳を腹臥位に戻り、横の割れ目に尾と、采に吻側すべてのティッシュの取り外しによって海馬を含む中央部を分離します。ストレート エッジかみそりで横断面 (すなわち コロナ スライス) に沿って 2 つのカットを作る 。
- 脳を貼る ' シアノアクリ レート系接着剤を使用して vibratome 切削風呂の中央に s 尾ほとんど平面です 。
- 冷たい追加、カーボゲン ・ vibratome 切削風呂にアプライド、内側ナイロン保持ハードウェアを配置します 。
- 半球 (6 に 8 の合計) あたり 3 に 4 使用可能なスライスを取得するカット 300 μ m の厚さのスライスします 。
- 海馬や大脳皮質のセクション 1 つの半球から分離し、病巣内に収まるようにスライスをトリム ' s 5 mm 径組織も 。
4。サンプル位置決めと灌流システム アセンブリ
- 塗りつぶし、mi を 調製をコイル のcrocoil '、vibratome から酸素アプライドの組織室 ' 転送ピペットを使用して s 切削風呂 。
- トリム脳サンプルを取るし、関心領域の位置 (例えば錐体細胞層) 切り裂くスコープを使用して病巣を。 。
- 挿入組織保持デバイス (ナイロン メッシュ ネット ナイロン洗濯機に貼付) イメージング実験を通してサンプル位置を保持する
。 注: は、強いライトへの露出を最小限に抑える手順を位置決めサンプルをすぐに続行します。必要に応じて転送ピペットを使用して、追加の酸素アプライドを提供します 。
- 穴で肺栓塞、プローブを組み立てる
- テーブル留め具で変更された病巣アセンブリ ( 図 3) をセキュリティで保護し、挿入して穴に人工デバイスを貼る、コイルの上に穴にアセタール サポート ペグ 。
- 、病巣を灌流チェンバを配置することによって灌流システムをシール ' s 組織と一緒にミニチュアのケーブルタイを使用して 2 つの cinching です 。
- がワイヤー カッターを使用してケーブル ネクタイから余分な長さをトリムします
。 注: 成功のシールに出納されるべき流出の行を終了して漏れがありません灌流チェンバのシリコーンのシールの周りにわかるでしょう。プローブ組立前にこれらの条件を確認する失敗は、イメージング ハードウェアに深刻な被害とされる可能性があります 。
- 廃棄物の貯留層に滴下アプライドがわかる、一度病巣と肺を取るし、イメージング プローブ本体の上部にアセンブリを取り付けます 。
- は、アセンブリ上でグラデーションのスタックをスライドし、プローブの上にグラデーションを座席します。相対位置とコイルの適切な接続の詳細写真、人工とプローブのハードウェア コンポーネント提供 ( 図 4).
5。氏の画像コレクションを実行する
- 磁石に組み立てられたプローブ穴挿入
- 場所分光計に近接プローブ本体穴磁石の下部に開始 。
- 磁石の上部に開く穴を通る血流線の余分な長さをリトラクトします 。
- 磁石進出プローブ本体穴穴の上から潅流線からさらにたるみを同時に除去しながらベースで利用可能な余裕期間のすべては灌流線から撮影されている、一度します 。
- Shim スタックの対応するスロットにプローブの基部に 2 本の固定ネジをスレッドします 。
- 前に、灌流線のピンチまたは廃棄物の貯留層にアプライドの流出を確認することによりプローブの挿入中にねじれて行われていないを確認します
。 注: 障害による流出は MRI ハードウェアに灌流線とリスク壊滅的な被害に永久的な損傷で起因できることを確認する 。
- 廃棄物の貯留層に戻りラインを終了する出納がない場合は、プローブ本体を外し、流量が再挿入を試みる前に再開したことを確認します。組み立て灌流システムおよびイメージ投射分光計のスケマティック レイアウトがされている 8 を前述します 。
- プローブ本体を接続する
- グラデーション チラーから流入と流出水行を添付します 。
- グラデーション チラー用ポンプをオンに水温度設定 (19 ° C) を確認します 。
- 空気冷凍機ユニットから空気ホースのホースのクランプを使用してプローブ本体に接続します 。
- 空気冷却装置の流れをノブ、" 1 " 位置 。
- プローブ本体に熱電対線をアタッチします 。
- 無線周波数 (RF) プローブ本体の入力/出力をプリアンプから同軸ケーブルを添付 ' s プロトン (H) チャネル 。
- プローブ本体にグラデーションのアンプから電源ケーブルを接続します 。
- 内の RF、キャビネットは B0 補償装置、3 つすべてのグラデーション アンプ (x、y、z)、マスター ユニットの電源を入れます
- 分光計を準備する
- コンソールで温度可変調整モジュールを使用して目的の穴温度を設定します 。
- (インピー ダンス) を一致し、プローブ内の可変コンデンサーを調整することによって (rf) 回路をチューニングします。これは、プローブ本体の基地でワンドを操作することで 。
- 分光計の現在の設定を調整する ' s シム コイル サンプルで磁界の均一性を最大限にします 。
- 画像コレクションの開始
- 磁石内サンプルの空間的な位置の穴を決定するためのパイロットの画像を収集します。2 つの標準のパラメーター次元グラジエント エコーは、次のとおりです (TR ・ TE = 100/4 ms、平均 = 1、パルス角度 = 30 o、時間 = 6 秒、行列 = 64 × 64、ビューのフィールド = 0.3 × 0.3 cm、解像度 47 x 47 μ m =)。 。
- は、該当する場合適切なスキャンの幾何学と組織の位置を確認するためにパイロットの拡散強調を収集します。2 つの標準のパラメーター次元拡散強調パイロット スキャンは、次のとおりです (TR ・ TE = 2000/11.6 ms、時間 = 4.3 分、Δ = 6 ms、δ = 1 ms、平均 = 1、b = 1200 (1860 付) s/mm 2、マトリックス = 64 × 64、ビューのフィールド = 0.2 x 0.2 cm。、解像度 31 μ m を =)。
- 急性スライス標本の安定性を決定する拡散強調の時系列を収集します。二次元拡散強調画像の一般的なパラメーターは次のとおりです。 (TR ・ TE = 2000/11.6 ms、時間 = 1.5 h、Δ = 6 ms、δ = 1 ms、平均 = 42, b = 1200 s/mm 2、マトリックス = 64 × 64、ビューのフィールド = 0.2 x 0.2 cm、解像度 = 31 μ m)。単位時間あたり MR 信号の変化と, 物理的な摂動注: (例えば T1、T2、拡散、感受性) の氏のコントラストを採用などの要因によって記述されているプロトコルから異なります特定のシステムで安定性を評価摂動は言ったから生じる 。
結果
出納の準備
ボアで酸素化デバイスの巧妙な雇用時にガスに指定されたカーボゲン ・ アプライド出納内の飽和状態を 100% に到達します。これは、給ガスの酸素濃度の変化と酸素計 (図 1)8を使用して灌流チェンバ内アプライド液溶存酸素の変化を測定して実証することができます。ヘンリーの法則によるとが平衡にある液体試料溶存気体の量はその気体の分圧に比例温度が一定12。この知識と高精度のガス規格を使用して、前述のアプライド サンプルに含まれている溶存酸素量を定量化することが可能です。これは、知られている組成のガスにさらされているアプライドの飽和溶液 (1 h 以上直接バブル) を用いた酸素計のキャリブレーションによって達成される: カーボゲン ・ (95% O2) など低酸素と高酸素濃度と 1 つのガス濃度は、窒素 (0% O2) など。その後、サンプルに酸素電極の先端を水没によって測定ができます。ボアで肺が正常に機能していることの確認は、灌流から排水をよく測定することにより実現できます。パーセントの溶存酸素酸素計によって測定される配信供給ガス中の酸素のパーセントの濃度に合わせてください。測定値よりも低い場合供給ガスで、これは組織スライスの代謝不全につながる可能性がハードウェア障害を示唆するでしょう。
サンプルの外観と動作
必要な代謝産物を供給し、すぐに代謝廃棄物を運び去るに十分な血流を受ける急性スライス標本相対的な安定性の状態に達する。その時点から、急性スライスは外部摂動を受けることが、科学的な研究におけるこれらの変更への応答を測定できます。氏の実験時間をかけて目的の信号を追跡する急性スライス準備13の相対的な安定性を示すための一般的に使用される練習です。拡散強調信号は虚血性脳卒中14,15で梗塞を検出するには、このコントラスト メカニズムの使用によって理解できるように組織の水の移動、コンテンツ、および分布の変化に特に敏感です。各種血流条件下で維持される急性皮質スライスで時間をかけて正規化拡散信号をプロット比較的安定性を示し (2 ± 3% 以上 15.5 h) 組織分離が達成された後 (図 5)。拡散信号の安定性は血流条件 (間欠的または連続的な) または MRI スキャンの長さに関係なく維持された (短い 【 4 分 】 または long [1.5 h])8。スライスは灌流、受け取っていない生活野鋭い拡散信号の増加など、時間をかけて信号の安定性を示さない場合これは最適実験条件の暗示です。スライス標本の安定した信号条件の確認前に摂動実験を試みていないする必要があります。
信号の安定性に加えて、画像コレクションの時に正しい位置決めを確認する必要があります。にもかかわらず、サンプル位置は解剖顕微鏡で組織配置中に制御を灌流装置のコイルまたは磁石への挿入前にプローブのラフ処理のため組み立て時のサンプル位置ずれが発生します。短い収集により適切な海馬の配置の確認が可能 (2 分)、拡散コントラスト (図 6) でパイロットをスキャンします。錐体細胞層が隣接する海馬ラミナより拡散重みに敏感、ので、この構造は拡散強調画像の暗いバンドとして表示されます。この特徴を表示しない設定はオフ中心のサンプルが含まれて、繰り返される必要があります。
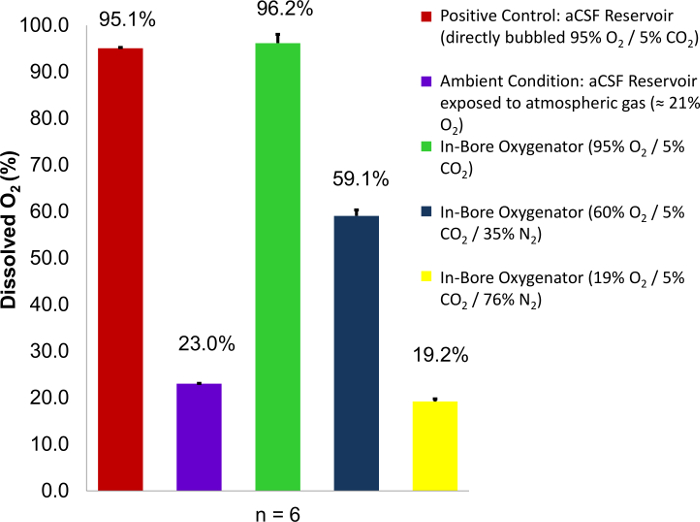
図 1: % O2コンテンツ供給ガス中の関数としてアプライド液中の酸素濃度を溶解しました。カーボゲン ・混合変数 (95%、60% と 19%) の酸素濃度は、供給ガスとして採用されています。パーセントの溶存酸素の測定値は灌流からも撮影され、知られている 2 つのコントロールと比較して: 出納貯水池は直接カーボゲン ・ (95% O2) と液貯留層大気条件 (23 %o2 にさらされるバブル).都度、組織灌流のアプローチ 100% 使用カーボゲン ・混合物内 O2濃度のサイトでパーセント酸素飽和度。誤差は、標本の平均の標準偏差に等しい。図は、元の記事8の許可を得て再現。この図の拡大版を表示するのにはここをクリックしてください。
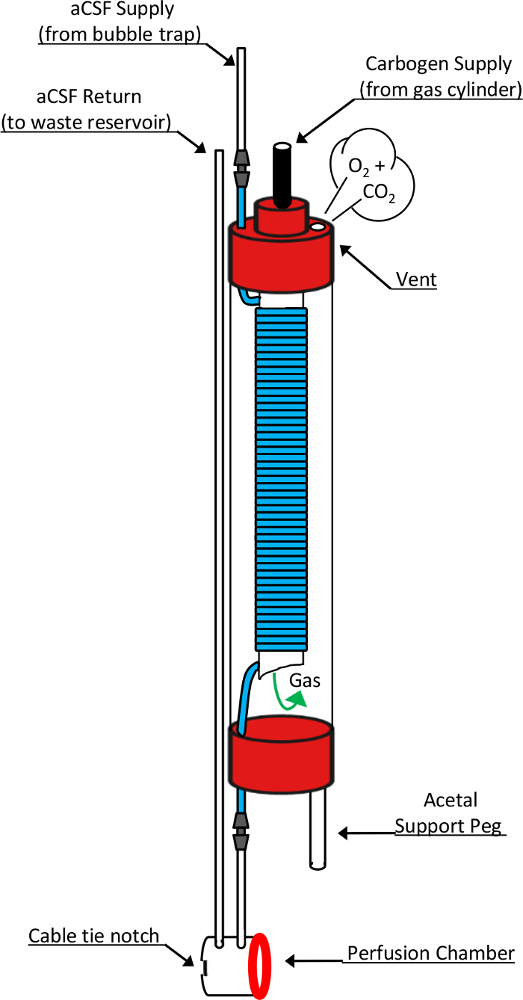
図 2: 穴で肺と灌流チャンバー模式。この図は、これらの重要なデバイスの機能を担当詳細設計要素を示しています。バブル トラップを介して励起されている新鮮な出納 10 mm NMR チューブの上部を介して肺に入ります。そうすることで、高いガスに遷移オープン エンド、5 mm NMR チューブに巻きついた透過性シリコーン チューブ (ブルー セグメント) の入れ子。カーボゲン ・ ガス 5 mm チューブの上部から供給はオープン エンドの下を通ってチャンバーに入るし、10 mm チューブ キャップの通気穴から肺を終了する前にコイル状のシリコーン チューブの上を通過します。この露出の間にシリコン チューブを流れる出納は、供給ガスの混合物の化学成分飽和状態になります。つとめてを終了時に液を廃棄物収集タンクにつながるリターン ラインに入る前に灌流チェンバに直接渡します。このデザインに重要なその他のコンポーネントは変更された RF 栓塞、肺の灌流チャンバー間液密シールを形成シリコーン洗濯機 (赤リング) の上に垂直に立って肺ができるアセタール サポート ペグを含めるとこの可逆的なシールを形成するために使用ケーブルタイの配置に対応するも、病巣の組織とケーブル ネクタイのノッチ。この数字を変更して元の記事8から許可を得て再現します。この図の拡大版を表示するのにはここをクリックしてください。

図 3: 穴で肺にインターフェイスを可能にする高解像度アセンブリへの変更。2 溝 3.0 mm × 1.5 mm (黒矢印) は灌流チェンバのシールに使用ケーブルタイ幅を収容するアセンブリの側面に切られました。チャネル (15 mm × 3 × 4 mm) は、コイルの裏の顔で、畑を接続します。2 つのナイロン スペースはシールの手順を容易にケーブル ネクタイ頭にキャッチとしてチャネル (赤矢印) 行為の側面に配置。コイル (黄色 arr の上部にドリル穴 (2 mm × 14 mm)ow)、アセタールの結合をサポートして、肺を保護するペグ。この数字を変更して元の記事8から許可を得て再現します。この図の拡大版を表示するのにはここをクリックしてください。

図 4: 写真のモンタージュの相対配置と栓塞、肺、および探査機のコンポーネントの適切なアセンブリを詳述します。これらのイメージは、ボアで肺と microperfusion デバイスの主要なハードウェア コンポーネントの機能し、別の部分が互いにどのようにインターフェイスを取るかを説明します。(A)分解ビューの写真もティッシュのシールやプローブ本体の組立の前にすべてのコンポーネントの相対位置を示します。部品の相対的な位置を正確に表示する注意しましたただし、画像フレーム内のすべてのコンポーネントが収まるように、灌流行のセクションをバックにこのシリーズで倍増されてしています。(1 = プローブ ・ ヘッド、2 病巣アセンブリ、3 を = = ナイロン組織保持リング、4 = 血流よく、5 = ケーブル ネクタイ、6 = 7 穴で人工グラジェント ・ コイル、8 = バブル トラップを =)。以下のコイルと人工のアセンブリ(B)コンポーネント。この画像でナイロンの保持リングを病巣の組織よくサンプルを確保するために配置されています。アセタール サポート ペグ、人工の基盤の対応する穴に、病巣の上に確保しました。灌流のオープン エンドのガスケットのシリコーンも組織も上配置されている、ケーブル ネクタイが灌流チェンバの密封するこれらのコンポーネントの周り強化されました。最後に、病巣のベースは、プローブ ・ ヘッドの上部に接続されています。以下のプローブ(C)コンポーネント。最後のパネルで、ケーブル ネクタイから余分な長さフラッシュ、高解像度でトリミングされています。グラジェント ・ コイル スタックは、過剰灌流線、肺、および病巣をその中空部を通過しながらプローブに向かってシリンダーを慎重に進めることによって、位置に滑り込ませた。グラデーションはプローブ ・ ヘッドにつながったら、適所にグラデーションのスレッド ベースを介してプローブの固定カラーをねじ止めで保持している彼ら。この図の拡大版を表示するのにはここをクリックしてください。

図 5: 隔急性皮質スライスの拡散信号安定性。(A)次の安楽死 21.5 h までの期間に時間をかけて異なる superfusion パラダイムを受ける 4 つの急性スライスで正規化拡散信号の値がプロットされます。スライスのまま 15.5 h superfusion かどうかに関係なく、安楽死を次の期間のそれらの初期拡散信号測定の ± 5% 以内、連続または断続的に MR スキャンの長さ (1.5 h または 4 分) の独立しました。肯定的な制御としてホルマリン固定皮質から信号録音 (n = 1) 固定ティッシュ サンプルの静的、不変の性質のための安定性のため。逆に、拡散信号は superfusion サポートの不在ライブ スライス単位 (n = 1) 代謝欠乏のコントロールとして提供しています。別の superfusion 試験の実験パラメーターは次のとおりです: 連続 (常に、スキャンごとの時間 superfusion = 1.5 h)、断続的 (スキャン、10 分間隔のために superfusion スキャンごとの時間 = 1.5 h)、長い間隔、長いスキャン (スパーフュー ジョン法で。スキャン、間 10 分間一時停止のスキャン中にスキャンごと時間 = 1.5 h)、間隔の長い、短いスキャン (1.5 時間間隔のための superfusion スキャンごとの時間 = 4 分)。(B)パネル (A) から 4 つのライブ スライス superfusion 実験の解析データ表示グループを意味します。拡散に対し、隔野展示時間 (2 ± 3% 以上 15.5 h) による小さな変化からグループ化、プロファイルの信号非灌流制御 (n = 1) 実験 (6.5 h 15%) の早い段階で劇的な信号の不安定性を展示します。この数字を変更して元の記事8から許可を得て再現します。この図の拡大版を表示するのにはここをクリックしてください。
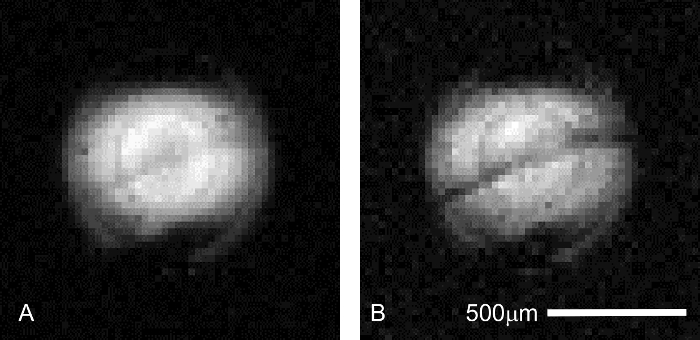
図 6: パイロット イメージング中に海馬スライス配置の確認。拡張 MR 顕微鏡セッションを実行、する前に正しいサンプルの配置は、スキャナーの時間などのリソースを確保するため重要な高価な液添加物は無駄にしません。海馬の ca1 錐体細胞層は高速 (4.3 分) で視覚化することができます、興味の組織はマイクロ コイルに関連して正しく配置ことを確認する解像度 (31 μ x 31 μ m で面内) パイロットのスキャンを下げます。両方のイメージに共通のスキャン パラメーターは次のとおり: TR ・ TE = 2000/11.6 ms、Δ = 6 ms、δ = 1 ms、平均 = 1。( B) = 0 (有効 227) s/mm2。この事前のスキャンで地層属三角骨がグレー、斜め帯コイルの励起プロファイルを中心としてだけ表示されます。( B) = 1,200 (1,860 効果的な) s/mm2。錐体細胞層に隣接するラミナの組織よりも暗くなるにつれて高い拡散で重み付け、マトリックス コントラストを増加させる (上: 地層オリエンス; 以下: 地層結腸寄生虫)。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
現在のプロトコルでは、磁気共鳴顕微鏡を受ける急性期脳スライス標本の標準的な代謝の維持のために必要な手順について説明します。この手順は、セルを解決することができる解像度で氏と生きている哺乳類組織の可視化を可能にする現在利用可能な唯一の方法です。出納の条件は、中枢神経系組織向けに設定されて、プロトコルはあらゆる生活に広く適応灌流量と同様、出納およびガス成分の調整を通して組織の準備温度。
代謝産物の供給の障害に関連するものに記載されている手順中に発生する可能性がある最も一般的な問題が含まれます。重炭酸塩システムのバッファリングの失敗の結果としてガス不足中、アプライド内カルシウム塩の沈殿が発生します。そのような沈殿物は灌流線を詰まらせるし、深刻なハードウェア障害が発生できます。塩の析出物は、次のプローブ出納で観察される場合、血流を直ちに中止蠕動性ポンプをオフにします。供給ガスの貯留と肺の両方にカーボゲン ・ ガス流れ (1/16 L/分)、出納、CO2レベル (5.0%) で十分な炭酸水素ナトリウム レベル (4.37 g/2 L) の存在を確認します。最後に、生理的な範囲 (7.3 7.4) で安定する pH のレベルを確認します。まだ酸素ガスと pH のレベルは適切に規制していない場合に、ガス交換膜を置き換える必要があります。
スライスは意図されていた実験の経過を信号の安定性を示さない、アプライド混合物に正しい成分があるし、正しい浸透圧 (300 mOsm) と pH (7.3 7.4) を維持することを確認します。また、カーボゲン ・ ガスが液貯留層と 1/16 L/分で肺に供給されていることを確認します。手順は出納状況を解決しない場合、ガス交換膜の交換をお勧めします。出納状況のトラブルシューティングの後組織安定性が得られない場合は、組織の収穫と灌流アプリケーション間の時間間隔の最小化に焦点を外科手術の改良を検討してください。
開示事項
著者はある利益相反を開示します。
謝辞
この仕事は健康の国民の協会 (1R21NS094061-01A1) (NIH 1R01EB012874-01) からの助成金によって支えられた (S10RR031637)、および全米科学財団 (協力協定第DMR-1157490) フロリダ大学、フロリダ州の国立高磁場研究所 (NHMFL) 高度な磁気共鳴イメージングと分光法 (AMRIS) の機能を使用します。
資料
| Name | Company | Catalog Number | Comments |
| Perfusate Preparation | |||
| Osmette A | Precision Systems Inc. | 5002 | freezing point depression osmometer |
| Stir Plate Type 1000 | Barnstead/Thermodyne | SPA1025B | magnetic stir plate with heating element |
| Accumet Basic pH Meter | Fisher Scientific | AB15 | pH Meter |
| pH Probe | Fisher Scientific | 13-620-AP61 | probe for pH measurement |
| Oxygen Meter | Microelectrodes Inc. | OM-4 | meter for sampling the oxygen content of gasses or the disolved oxygen content of liquid perfusates |
| Oxygen Electrode | Microelectrodes Inc. | MI-730 | microprobe for the oxygen meter |
| Scale | Denver Instrument Co. | A-160 | microscale for weighing chemical components |
| Name | Company | Catalog Number | Comments |
| Slice Preparation | |||
| Lancer Vibratome | Ted Pella Inc. | Series 1000 | vibratory tissue slicer |
| Disecting Microscope | Carl Zeiss Inc. | OPMI 1-FC | tabletop, binocular disecting microscope |
| Name | Company | Catalog Number | Comments |
| Perfusion System | |||
| Masterflex L/S | Cole-Parmer | 7523-50 | peristaltic micro perfusion pump |
| Oxygen Regulators x 2 | Victor Medical | VMG-05LY | device for regulating gas flow |
| e-sized carbogen cylinders x 2 | Airgas | gas tanks containing carbogen gas | |
| in-bore oxygenator | developed in house | device responsible for pH and oxygen regulation in the perfusate | |
| Name | Company | Catalog Number | Comments |
| MR Imaging Hardware | |||
| Micro Surface Coil (200mm dia., modified) | Bruker Biospin | B6371/0001 | four-turn micro (200mm dia) surface-style radiofrequency coil |
| Micro 5 probe body | Bruker Biospin | Z3395 | microimaging probe used in the 600 MHz spectrometer |
| Micro 5 gradient coils | Bruker Biospin | M81111 | gradient coil stack used with micro 5 probe body |
| 600 MHz Spectrometer | Oxford Instruments | superconducting magnet (14.1T) used for MR image generation | |
| Imaging Console | Bruker Biospin | Avance III | support and control hardware including gradient amplifiers, preamps, & workstation used for MR image generation |
| Air Blower | Bruker Biospin | BCU-II, -80/60 | Air chiller unit used in conjunction with the probe's heating coil to regulate temperature inside the magnet bore |
| Gradient Chiller | Thermo Scientific | Neslab Merlin M33 | Water chiller used to disipate heat generated by the gradient coils |
参考文献
- Aguayo, J. B., Blackband, S. J., Schoeniger, J., Mattingly, M. A., Hintermann, M. Nuclear magnetic resonance imaging of a single cell. Nature. 322, 190-191 (1986).
- Schoeniger, J. S., Aiken, N., Hsu, E., Blackband, S. J. Relaxation-time and diffusion NMR microscopy of single neurons. J. Magn. Reson. B. 103, 261-273 (1994).
- Flint, J. J., et al. Magnetic resonance microscopy of mammalian neurons. Neuroimage. 46, 1037-1040 (2009).
- Flint, J. J., et al. Magnetic resonance microscopy of human and porcine neurons and cellular processes. Neuroimage. 60, 1404-1411 (2012).
- Kamman, R. L., Go, K. G., Stomp, G. P., Hulstaert, C. E., Berendsen, H. J. C. Changes of Relaxation times T1 and T2 in rat tissues after biopsy and fixation. Magn. Reson. Imag. 3, 245-250 (1985).
- Shepherd, T. M., Thelwall, P. E., Stanisz, G. J., Blackband, S. J. Aldehyde fixative solutions alter the water relaxation and diffusion properties of nervous tissue. Magn. Reson. Med. 62, 26-34 (2009).
- Massin, C., Boero, G., Vincent, F., Abenhaim, J., Besse, P. -. A., Popovic, R. S. High-Q factor RF planar microcoils for micro-scale NMR spectroscopy. Sensor. Actuat. A-Phys. 97, 280-288 (2002).
- Flint, J., Menon, K., Hansen, B., Forder, J., Blackband, S. J. A microperfusion and in-bore oxygenator system designed for magnetic resonance microscopy studies on living tissue explants. Sci. Rep. 5, 18095 (2015).
- Khong, Y. M., et al. Novel intra-tissue perfusion system for culturing thick liver tissue. Tissue Eng. 13 (9), 2345-2356 (2007).
- Schumacher, K., Khong, Y. -. M., Chang, S., Ni, J., Sun, W., Yu, H. Perfusion culture improves the maintenance of cultured liver tissue slices. Tissue Eng. 13 (1), 197-205 (2007).
- Shepherd, T. M., Blackband, S. J., Wirth, E. D. Simultaneous diffusion MRI measurements from multiple perfused rat hippocampal slices. Magn. Reson. Med. 48, 565-569 (2002).
- Henry, W. Experiments on the quantity of gases absorbed by water, at different temperatures, and under different pressures. Phil. Trans. R. Soc. Lond. 93, (1803).
- Bui, J. D., Buckley, D. L., Phillips, M. I., Blackband, S. J., Blümler, P., Blümich, B., Botto, R., Fukushima, E. Studies of perfused brain slices with MR microscopy. Spatially Resolved Magnetic Resonance. , 337-343 (1998).
- Moseley, M. E., et al. Early detection of regional cerebral ischemia in cats: Comparison of diffusion- and T2-weighted MRI and spectroscopy. Magn. Reson. Med. 14 (2), 330-346 (1990).
- Moseley, M. E., et al. Diffusion-weighted MR imaging of acute stroke: Correlation with T2-weighted and magnetic susceptibility-enhanced MR imaging in cats. Am. J. Neuroradiol. 11, 423-429 (1990).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved