Method Article
Suporte metabólico de extirpado, tecidos de cérebro vivos durante a aquisição de microscopia de ressonância magnética
Neste Artigo
Resumo
O atual protocolo descreve um método pelo qual os usuários podem manter viabilidade de preparações de fatias hippocampal e cortical aguda durante a coleta de dados de microscopia de ressonância magnética.
Resumo
Este protocolo descreve os procedimentos necessários para apoiar as funções metabólicas normais das preparações de fatia cerebral aguda durante a coleta de dados de microscopia de ressonância magnética (RM). Embora seja possível executar o senhor coleções em tecidos de mamíferos vivos, extirpado, tais experiências têm sido tradicionalmente restrita pelos limites de resolução e, portanto, são incapazes de visualizar a microestrutura de tecido. Por outro lado, protocolos de deputado que uma resolução imagem microscópica exigido o uso de amostras fixas para acomodar a necessidade de condições estáticas, imutáveis dos tempos de varredura longo. O atual protocolo descreve a primeira técnica de senhor disponível que permite que a imagem latente de amostras de tecido vivo e mamíferos em resoluções microscópicas. Tais dados são de grande importância para a compreensão de como patologia com base em alterações de contraste ocorrendo a influência nível microscópico o conteúdo de macroscópica senhor exames, tais como aqueles usados na clínica. Uma vez que tal entendimento é realizado, métodos de diagnóstico com maior sensibilidade e precisão podem ser desenvolvidos, o que irá traduzir diretamente para o tratamento de doenças anterior, mais acurada monitoramento da terapia e melhorou os resultados dos pacientes.
Enquanto a metodologia descrita centra-se sobre os preparativos de fatia do cérebro, o protocolo é adaptável a qualquer pedaço de tecido excisado, dado que as alterações sejam feitas preparações de gás e o perfusato para acomodar necessidades metabólicas específicas do tecido. Execução bem sucedida do protocolo deve resultar em preparações de fatia de vida, aguda que apresentam estabilidade de sinal do senhor difusão por períodos até 15.5 h. As principais vantagens do sistema atual sobre outros aparelhos de perfusão compatível do senhor são sua compatibilidade com o hardware de microscopia do senhor necessária para alcançar maior imagens de resolução e capacidade de oferecer fluxo constante, ininterrupto com cuidadosamente condições de perfusato regulamentado. Taxa de transferência de amostra reduzida é uma consideração com este projeto como fatia de apenas um tecido pode ser fotografada em um momento.
Introdução
Como sistemas de ressonância magnética (MRI) progrediram constantemente para a intensidade de campo cada vez maiores, mais detalhes sobre a composição e estatuto dos tecidos vivos tornaram-se perceptíveis. Apesar de tais avanços de hardware, Sr. imagem latente em resolução suficiente para visualizar as estruturas celulares dos tecidos ainda não está disponível na clínica. Como resultado, a nível celular características dos tecidos devem ser inferidas quando se considera o conteúdo dos exames clínicos. Tal inferência requer conhecimento de processos equivalentes inferida a partir de dados obtidos em sistemas modelo que podem ser observados diretamente. Tradicionalmente, estes modelos incluíam células de organismos aquáticos, tais como o oócito Xenopus laevis e Aplysia californica L7 neurônio1,2. Estas estavam entre as primeiras células animais disponíveis para observação com métodos do senhor devido ao seu tamanho anormalmente grande: aproximadamente 1000 μm e 300 μm de diâmetro, respectivamente. Mais recentemente, avanços no design de hardware permitiram que um dos maiores exemplos de pilhas mamíferas — o neurônio motor α — para ser fotografada usando técnicas de microscopia do senhor no tecido fixo3,4. Enquanto estes estudos demonstraram a visualização directa de mamíferos material celular usando o senhor, as fixas amostras empregadas diferem significativamente em suas propriedades de senhor de tecido vivo e, portanto, não podem servir como um modelo representativo equivalente5, 6. Mais importante, observar alterações de contraste do senhor que ocorrem em conjunto com processos biológicos complexos requer exemplos de vida que podem ser perturbados e medidos ao longo da experiência de imagem.
Para facilitar estudos de microscopia do senhor sobre tecidos vivos, um protocolo é apresentado que inclui microfilmagem comercial ferragem7 interfaceado com um purpose-built, senhor compatível, no furo oxigenador e dispositivo de perfusão descritas anteriormente8 . Vantagens exclusivas deste projeto incluem capacidades de resolução de nível celular em tecidos de mamíferos e precisão controle sobre conteúdo de gás dissolvido e pH no local da perfusão do tecido. Além disso, ao contrário da maioria dos estudos de senhor de explant que interrompem a perfusão durante a aquisição de imagem para evitar artefatos de fluxo, este projeto suporta o uso de perfusão contínua durante a coleta de dados que foi mostrada para melhorar a condição fisiológica de isolado de tecidos9,10. Por último, sua gravação fechado câmara de retenção de fatia ferragem ajuda e reduzindo a probabilidade de artefatos de movimento que caso contrário poderia ocorrer durante prolongadas coleção de imagens.
Enquanto o atual protocolo descreve procedimentos apropriados para o uso com fatias hippocampal e corticais agudas, controle preciso sobre o perfusato metabolitos permite que este sistema acomodar uma ampla gama de tecidos de diversos tipos e condições experimentais. Limitações deste projeto incluem uma redução na taxa de transferência de amostra em comparação com uma perfusão de multi-slice câmara11; no entanto, esta limitação pode ser superada no futuro usando bobina multi matrizes.
Também, enquanto o sistema pode ser empregado em configurações horizontais ou verticais, o atual protocolo apresenta seu uso em um espectrômetro orientado verticalmente, de 600 MHz. Qualquer sistema capaz de estudos senhor microfilmagem — normalmente estreita-furo (≤6 cm), espectrómetros de alto campo (≥500 MHz) — acomodará o oxigenador e perfusão equipamentos descritos. No entanto, as alterações para a bobina de imagem, gradiente, sistema de sonda ou outro hardware de imagem essencial empregado podem necessitar de alterações para o equipamento de perfusão e parâmetros de verificação do senhor.
Protocolo
todas as experiências com animais descritas seguem as diretrizes estabelecidas em academias nacionais de Ciências ' guia para o cuidado e o uso de animais de laboratório e foram revistos e aprovados pela Universidade da Flórida ' s Comitê de uso (IACUC) e institucional cuidados com animais. Siga os regulamentos e normas aplicáveis ao engajar-se em pesquisa de assunto animal.
1. preparação de perfusato para a manutenção dos tecidos do sistema nervoso Central
- fazer fresco artificial líquido cefalorraquidiano (aCSF).
- Para gerar 2 L de tampão bicarbonato aCSF perfusato, medir 1.500 mL de água purificada por dupla destilação ou osmose reversa para um balão de 4 L. Coloque uma barra de agitação magnética no frasco e agitar o líquido usando uma placa de agitação.
- Para a água purificada, dissolver as seguintes quantidades de sais: cloreto de sódio 14,03 g (120 mM) 4,37 g (26 mM) de bicarbonato de sódio, fosfato de potássio monobásico 0,41 g (1,5 mM), 0,69 g (1,4 mM) sulfato de magnésio hepta-hidratado, cálcio 0,59 g (2 mM) carbónico, 0,45 g (3 mM) de cloreto de potássio e glicose (10 mM) de 3,6 g.
Nota: O conteúdo químico do perfusato diferirão dependendo das exigências metabólicas específicas de tecido e as condições desejadas do experimento. - Homogeneizar essa solução até que todos os sais dissolvido. Ajustar o volume de 2 L com água purificada adicional.
- Testar a osmolalidade da aCSF usando um aparelhos de depressão do ponto de congelamento. Ajustar a 300 mOsm/kg usando o sorbitol. Adição de sorbitol 324 mg para 2 L de 299 mOsm/kg aCSF perfusato irá aumentar a pressão osmótica de 300 mOsm/kg (aproximadamente 1 mOsm por 324mg).
Nota: A aCSF pode ser armazenada a 4 ° C, em um frasco hermético, selado por um período não deve exceder 24 h.
2. Definir se o sistema de perfusão
- preparar o perfusato aCSF.
- ACSF equilíbrio à temperatura ambiente (~ 23 ° C) enquanto gaseamento com 95% carbogênio (95% O 2, 5% CO 2; 1/16 L/min) através de subida direto para não menos de 1 h.
Nota: Tipos de tecido diferentes ou condições experimentais desejadas podem requerer ajustes do perfusato temperatura ou gás conteúdo. As condições desejadas para o conteúdo de gás dissolvido no perfusato podem ser controladas precisamente variando as concentrações de porcentagem de componentes individuais do abastecimento de gás ( Figura 1). - , Uma vez que o aCSF atinge a temperatura desejada e a saturação de carbogênio, confirmam que o pH na faixa fisiológica (7.3-7.4). Continuar a gás bolha diretamente dentro do reservatório de perfusato (1/16 L/min) no decorrer do experimento a fim de manter a adequada dissolveu o conteúdo de oxigênio e pH condições conducentes ao metabolismo do tecido saudável.
- ACSF equilíbrio à temperatura ambiente (~ 23 ° C) enquanto gaseamento com 95% carbogênio (95% O 2, 5% CO 2; 1/16 L/min) através de subida direto para não menos de 1 h.
- Prime as linhas de perfusão.
- Submergir o tubo de entrada conectado à microbomba peristáltica na aCSF preparado (300 mOsm, pH 7.3-7.4, continuamente gaseados).
- Pass o oxigenador dispositivo ( Figura 2) e linhas de perfusão através de ambos o ímã do furo e bobina de gradiente stack (de cima para baixo) e definir as bobinas lado até montagem de sonda. Pendurar o oxigenador acima num copo para apanhar qualquer efluente aCSF.
Nota: Dependendo do design do sistema MRI, linhas de perfusão podem precisar ser passado através do furo do ímã e bobinas de gradientes ou sonda corpo base antes de encher o sistema com aCSF. Confirmar essa colocação de linha de perfusão não irá interferir com a montagem do corpo da sonda ou inserção da sonda na perfuração antes de iniciar o procedimento. - Confirmar a vazão pretendida (2 mL/min) é selecionada e começar a encher as linhas de perfusão por ligar a bomba.
- Inverter o borbulhador vazio, em linha para que aCSF deslocarão o ar contido dentro.
- Conectar o oxigenador ' s gás porto para uma segunda fonte de carbogênio (um distribuidor ou um cilindro carbogen secundário) e definir uma vazão de 1 / 16L/min.
- Confirmar essa carbogen está fluindo sobre o oxigenador ' membrana de troca gasosa s por mergulhando a porta de exaustão em cima o oxigenador água.
- Uma vez aCSF é detectado pingando da câmara de perfusão, purgar as bolhas de gás visível a partir das linhas de entrada pela agitação manual.
- Confirmar o oxigenador está operando corretamente, submergindo o eletrodo de oxigênio na aCSF flui da câmara de perfusão.
Nota: A leitura do medidor de oxigênio deve aproximar-se a porcentagem de oxigênio contido dentro do gás fornecido.
3. Preparação do tecido
- eutanásia
- lugar um rato (125-150 g) na câmara de indução de uma máquina de anestesia e expor a 4% de isoflurano em uma transportadora de oxigênio do gás à taxa de 1 L/min durante 4 min.
- Remover o rato inconsciente da câmara anestesia.
- Realizar um teste de reflexo braço endireitante, colocando o rato na posição supina. Verificar se há quaisquer movimentos — cabeça virada, levantamento de perna, coluna, dobramento, etc — indicativo de que o animal está girando sobre seu estômago.
- Realizar um teste de reflexiva de piscar de olhos ao tocar o olho aberto do animal usando um cotonete. Verificar se há alguma resposta — tampa de fechamento, espasmos musculares, etc. — a esta entrada sensorial.
- Por fim, realizar um membro-retirar o teste de reflexo por beliscar a pele entre os dedos do rato ' s estendidos usando uma pinça ou hemostatos perna de trás. Verificar se há flexão da perna do
Nota: no caso de um resultado positivo de teste reflexiva, não prossiga com a eutanásia. - No caso em que qualquer um dos três testes reflexos provoca uma resposta, retornar o rato imediatamente para a câmara de anestesia e permitir um adicional 2 min de exposição de 4% de isoflurano.
- Realizar os três testes reflexivos sobre em sua totalidade. Repita a exposição de anestesia de 2 min, se necessário e só avançar uma vez observou-se uma completa falta de resposta a todos os três testes reflexivos.
- Eutanásia o rato através de decapitação de guilhotina.
- Ressecção do cérebro
- remover o cérebro de rato por dissecação bruta. Comece com a cabeça na posição de bruços. Usando a tesoura, corte rostral através da pele na parte de trás do pescoço para o nariz e expor o crânio.
- Remover os tecidos moles da superfície do crânio com uma ponta de prova contundente.
- Trabalhando da extremidade caudal, remover o occipital, parietal e frontal ossos do crânio usando ruginas.
- Retrair a dura-máter cortando ao longo da fissura longitudinal com micro tesouras e descascando volta a camada de ambos os hemisférios.
- Remover o cérebro do crânio rodando a cabeça para a posição supina e cortar os nervos cranianos no lado ventral.
- Fatia isolamento
- retornar o cérebro para a posição prona e isolar a parte central contendo o hipocampo, removendo todos os tecidos do caudais para a fissura transversal e rostrais da fímbria. Fazer dois cortes ao longo do plano transversal (ou seja, fatias coronais) com uma lâmina de borda reta.
- Apor o cérebro ' avião de caudal mais s ao centro de um banho de corte vibratome usando cola de cianoacrilato.
- Adicionar gelada, carbogênio borbulhava aCSF para o banho de corte de vibratome e colocar o hardware de retenção de nylon dentro.
- Cortar 300 μm fatias grossas para obter preparações utilizável fatia de 3 a 4 por hemisfério (total de 6 a 8).
- Isolar um hipocampo ou seção cortical de um hemisfério e aparar a fatia, para que ele caiba dentro do microcoil ' tecido de diâmetro 5mm s bem.
4. Amostra de posicionamento e montagem de sistema de perfusão
- bobina preparação
- preencher o microcoil ' câmara de tecido s com aCSF oxigenado do vibratome ' banho de corte s usando uma pipeta de transferência.
- Levar a amostra do cérebro aparadas e posicionar a região de interesse (por exemplo,. camada de célula piramidal) sobre o microcoil usando um escopo dissecar.
- Inserir o dispositivo de retenção de tecido (malha de nylon líquido afixada à arruela de nylon) para manter a posição de amostra durante todo o experimento de imagem.
Nota: Proceda rapidamente através da amostra posicionando o procedimento para minimizar a exposição à luz intensa. Fornecer aCSF oxigenado adicional conforme necessário usando uma pipeta de transferência.
- Montar o oxigenador no furo, microcoil e sonda
- fixar o conjunto de microcoil modificado ( Figura 3) em um grampo de mesa e apor o dispositivo oxigenador no furo, inserindo o pino de apoio acetal dentro do buraco no topo da bobina.
- Lacrar sistema de perfusão colocando a câmara da perfusão sobre a microcoil ' tecido s bem e cinching os dois juntos usando uma abraçadeira miniatura.
- Aparar o excesso de comprimento do empate de cabo usando alicate.
Nota: Em cima selagem bem sucedida, perfusato deve ser observado saindo através das linhas de escoamento e nenhum escapamento deve ser evidente em torno o vedante em silicone da câmara de perfusão. Confirmar essas condições antes da montagem de sonda pode resultar em sérios danos ao hardware de imagem. - Uma vez aCSF pode ser visto a pingar no reservatório de resíduos, pegue o microcoil e oxigenador e prender o conjunto ao topo do corpo sonda imagem.
- Deslize a pilha de gradiente sobre a montagem e o gradiente no topo da sonda do assento. Fotos detalhando o posicionamento relativo e a conexão correta da bobina, componentes de hardware do oxigenador e sonda são fornecidos ( Figura 4).
5. Realizando a coleção de imagens de Sr
- Inserir a sonda montada no ímã do furo
- lugar o corpo da sonda em estreita proximidade com o espectrômetro deu abertura na parte inferior do íman.
- Retrair o excesso de comprimento das linhas de perfusão através do furo da abertura na parte superior do íman.
- Uma vez que todo o tempo disponível foi tirado as linhas de perfusão, avanço do corpo da sonda para o ímã furo na base enquanto simultaneamente retira mais folga a partir das linhas de perfusão da parte superior do furo da.
- Os dois parafusos de fixação na base da sonda da linha correspondente nas ranhuras da pilha shim.
- Antes de prosseguir, verifique se as linhas de perfusão não foram beliscou ou dobradas durante a inserção da sonda, confirmando aCSF saída para o reservatório de resíduos.
Nota: Falha para confirmar a saída de perfusato pode resultar em danos permanentes para perfusão linhas e riscos catastróficos danos ao Sr. imagem latente ferragem. - No caso de não perfusato é visto saindo da linha de retorno para o reservatório de resíduos, remover o corpo da sonda e confirmar que o fluxo de perfusato recomeçou antes de tentar a reinserção. Um layout esquemático do espectrómetro imagem e sistema de perfusão montado tem sido descrito anteriormente 8.
- Conectando o corpo de sonda
- anexar as linhas de água de entrada e saída do refrigerador gradiente.
- Ligue a bomba para refrigerador gradiente e confirmar a configuração de temperatura de água (19 ° C).
- Anexar a mangueira de ar da unidade de refrigerador de ar para o corpo de sonda usando uma braçadeira.
- Rode o botão de fluxo na unidade de refrigerador de ar para o " 1 " posição.
- Conecte o cabo do termopar ao organismo sonda.
- Prenda o cabo coaxial do pré-amplificador a radiofrequência (RF) entrada/saída do corpo da sonda ' canal de protões (H) s.
- Conectar o cabo de alimentação dos amplificadores gradientes para o corpo da sonda.
- Dentro do RF do gabinete, ligue a alimentação para a unidade de compensação B0, todos os três amplificadores gradientes (x, y, z) e a unidade mestre
- Preparando o espectrômetro
- definir a temperatura pretendida furo usando o módulo de regulação da temperatura no console.
- Corresponder (impedância) e ajustar o circuito (frequência) do RF, ajustando os capacitores variáveis dentro da sonda. Isso é conseguido manipulando as varinhas na base do corpo sonda.
- Ajustar as configurações atuais para o espectrômetro ' bobinas de calço s para maximizar a homogeneidade do campo magnético na amostra.
- Começar a coleção de imagens
- recolher imagens piloto para determinar a posição espacial de sua amostra dentro do ímã do furo. Parâmetros típicos para um dois dimensional gradiente eco são as seguintes (TR/TE = 100/4 ms, médias = 1, ângulo de pulso = 30 ó, tempo = matriz seg, 6 = 64 x 64, campo de visão = 0.3 x 0.3 cm, resolução = 47 x 47 μm).
- Coletar pilotos de difusão-tornada mais pesada a fim de confirmar a posição de geometria e tecido de verificação adequada se for o caso. Parâmetros típicos para um dois dimensional digitalização piloto difusão-tornado mais pesado são as seguintes (TR/TE = 2000/11,6 ms, tempo = 4,3 min, Δ = 6 ms, δ = 1 ms, médias = 1, b = 1200 (1860 eficaz) s/mm 2, matrix = 64 x 64, campo de visão = 0,2 x 0,2 cm resolução = 31 μm).
- Coletar uma série de tempo de difusão-tornada mais pesada para determinar as características de estabilidade da preparação fatia aguda. Parâmetros típicos para uma imagem ponderada de difusão dimensional dois são como segue (TR/TE = 2000/11,6 ms, tempo = 1,5 h, Δ = 6 ms, δ = 1 ms, médias = 42, b = 1200 s/mm 2, matrix = 64 x 64, campo de visão = 0.2 x 0.2 cm, resolução = 31 μm). Nota: Caracterizando estabilidade em um dado sistema pode variar desde o protocolo descrito, dependendo de fatores tais como o contraste do senhor empregado (por exemplo, T1, T2, difusão, susceptibilidade), a perturbação física estudou e a mudança de sinal do Senhor por unidade de tempo resultantes de disse perturbação.
Resultados
Preparação de perfusato
Em cima de emprego bem sucedida do dispositivo no furo oxigenação, gases presentes na carbogen fornecido chegará a condições de saturação 100% dentro o perfusato aCSF. Isto pode ser demonstrado pela variação da concentração de oxigênio do gás fornecido e medir a variação no teor de oxigênio dissolvido no perfusato aCSF dentro da câmara de perfusão usando um oxigênio medidor (Figura 1)8. De acordo com a lei de Henry, a quantidade de gás dissolvido que está em equilíbrio com uma amostra de líquido é diretamente proporcional à pressão parcial do gás, desde que a temperatura permanece constante,12. Usando este conhecimento e precisão padrões de gás, é possível quantificar a quantidade de oxigênio dissolvido contido em uma amostra de aCSF conforme descrito. Isto é conseguido através da calibração do medidor de oxigênio utilizando soluções saturadas (diretamente borbulhava por 1h ou mais) de aCSF sendo exposto a gases de composição conhecida: um gás com concentração elevada de oxigênio como carbogênio (95% O2) e outro com pouco oxigênio concentração como o nitrogênio (0% O2). Depois, podem ser efectuadas medições submergindo a ponta do eletrodo de oxigênio em uma amostra. Confirmação de que o oxigenador no furo está funcionando corretamente pode ser conseguida o efluentes da perfusão de medição bem. O oxigênio dissolvido por cento como medido pelo medidor de oxigênio deve corresponder a concentração percentual de oxigénio fornecido no abastecimento de gás. Se os valores medidos são inferiores do fornecimento de gás, isto sugere uma falha de hardware que pode levar a insuficiência metabólica na fatia do tecido.
Comportamento e aparência de amostra
Preparações de fatia aguda que recebem perfusão suficiente o bastante para fornecer o necessários metabolitos e levar resíduos metabólicos em breve chegar a um estado de estabilidade relativa. A partir daí, fatias agudas podem ser submetidas a perturbações externas e suas respostas a essas mudanças podem ser medidas para estudo científico. Para experiências do senhor, a seguir o sinal de interesse ao longo do tempo é uma prática comumente usada para demonstrar a relativa estabilidade da fatia aguda preparações13. O sinal de difusão-tornado mais pesado é especialmente sensível a mudanças em de um tecido água mobilidade, conteúdo e distribuição, como pode ser apreciado pela utilização deste mecanismo de contraste para detectar infartos em acidente vascular cerebral isquêmico14,15. Traçar o sinal da difusão normalizado ao longo do tempo em fatias corticais agudas, mantida sob uma variedade de condições de perfusão relativamente demonstra estabilidade (2 ± 3% mais 15.5 h) após o isolamento do tecido é alcançado (Figura 5). Estabilidade do sinal de difusão foi mantida independentemente de condições de perfusão (intermitentes ou contínuas) ou comprimento de varredura de MRI (curto [4 min] ou long [1,5 h])8. Se fatias não apresentam estabilidade de sinal ao longo do tempo, tais como o aumento do sinal de difusão afiada observado no córtex de vida que não receberam da perfusão, é sugestivo de condições experimentais de qualidade inferior. Experimentos de perturbação não devem ser tentados antes da confirmação das condições de sinal estável em preparações de fatia.
Além de estabilidade de sinal, sample correto posicionamento deve ser confirmado no momento da coleção de imagens. Mesmo que a posição da amostra é controlada durante a colocação do tecido no microscópio a dissecação, mudanças na posição da amostra podem ocorrer durante a montagem do aparato de perfusão, ou devido ao manuseio da bobina ou sonda antes da inserção para o ímã. Confirmação do posicionamento adequado do hipocampo pode ser conseguida através da recolha de suma (2 min), o piloto faz a varredura com contraste de difusão (Figura 6). Porque a camada de célula piramidal é mais sensível à ponderação de difusão que as lâminas hippocampal adjacentes, esta estrutura irá aparecer como uma banda mais escura nas imagens ponderadas em difusão. Configurações que não exibem esta característica contenham amostras descentralizado e provavelmente precisará ser repetido.
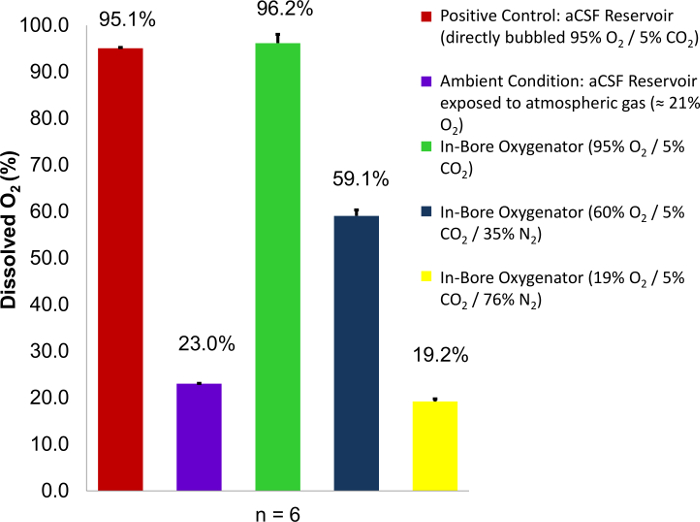
Figura 1: Dissolvido o teor de oxigénio de perfusato aCSF em função da % de conteúdo de2 O gás fornecido. Carbogen misturas que contêm concentrações variáveis de oxigênio (95%, 60% e 19%) são empregadas como um gás de alimentação. Leituras por cento de oxigénio dissolvido são então retiradas a perfusão bem e em comparação com dois controles conhecidos: um reservatório de perfusato borbulhava diretamente com carbogênio (95% O2) e um reservatório de perfusato expostos às condições atmosféricas (23% O2 ). Em cada caso, a saturação de oxigênio por cento no local de tecido perfusão abordagens 100% da concentração O2 dentro da carbogênio mistura usada. Barras de erro são iguais para o desvio-padrão dos meios amostra. Figura reproduzida com a permissão do original do artigo8. Clique aqui para ver uma versão maior desta figura.
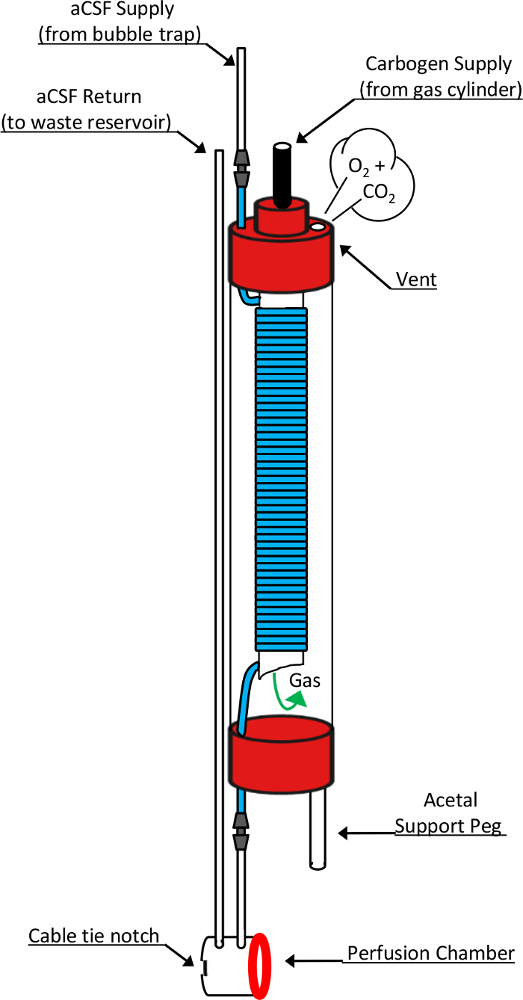
Figura 2: esquemático desenho da câmara no furo oxigenador e perfusão. Este diagrama mostra os elementos de projeto detalhado responsável pela função destes dispositivos críticos. Perfusato fresco que tem sido bombeado através um borbulhador entra o oxigenador através do topo de um tubo de NMR de 10 mm. Ao fazê-lo, ele faz a transição para um gás altamente tubulação do silicone permeável (segmento azul) que é enrolada ao redor de um tubo de 5mm NMR Open-ended, aninhada dentro. Carbogênio gás fornecido através do topo do tubo 5mm incorpora a câmara através do fundo em aberto e passa sobre o tubo do silicone enrolado antes de sair o oxigenador através de um orifício na tampa tubo 10mm. Durante essa exposição, o perfusato flui através do tubo de silicone se torna saturado com os componentes químicos da mistura de gás fornecido. Ao sair o oxigenador, perfusato passa diretamente para a câmara de perfusão antes de entrar a linha de retorno, levando a um reservatório de recolha de resíduos. Outros componentes críticos a este projeto incluem o pino de suporte de acetal que permite o oxigenador repousar verticalmente no topo o modificado microcoil RF, uma arruela de silicone (anel vermelho) que constitui o selo estanque entre câmara de perfusão do oxigenador e tecido do microcoil bem e o empate de cabo entalhe que acomoda a colocação de um empate de cabo, usado para formar este selo reversível. Esta figura foi modificada e reproduzida com a permissão do original do artigo8. Clique aqui para ver uma versão maior desta figura.

Figura 3: modificações para o assembly microcoil que permitem a interface para o oxigenador em calibre. Dois sulcos 3,0 x 1,5 mm (setas pretas) foram corte a parte do assembly que acomodar a largura de uma abraçadeira usada para selar a câmara de perfusão. Um canal (15 x 3 x 4 mm) conecta os bosques em toda a face traseira da bobina. Dois espaços de nylon colocadas nas laterais do acto de canal (setas vermelhas) como um bom partido para a cabeça de gravata de cabo que facilita o processo de selagem. Um furo (2 x 14 mm) na parte superior da Assembleia bobina (arr amareloUXO) junta-se para o acetal suporte pino para fixar o oxigenador. Esta figura foi modificada e reproduzida com a permissão do original do artigo8. Clique aqui para ver uma versão maior desta figura.

Figura 4: foto montagem detalhando o posicionamento relativo e adequada montagem de componentes de sonda, oxigenador e microcoil. Estas imagens apresentam componentes de chave de hardware do dispositivo oxigenador e microperfusion no furo e ilustram como as partes separadas de interface com o outro. Foto de vista explodida do (A) mostrando o posicionamento relativo de todos os componentes antes da selagem do tecido bem ou montagem do corpo da sonda. Cuidado foi tomado para exibir a localização relativa de peças com precisão; no entanto, uma seção das linhas de perfusão foi duplicada a volta desta série para que todos os componentes se encaixam dentro do quadro da imagem. (1 = cabeça de sonda, 2 = microcoil montagem, 3 = anel de retenção de tecido nylon, 4 = perfusão, 5 = a abraçadeira, 6 = oxigenador no furo, 7 = bobinas de gradientes, 8 = borbulhador). (B) componentes após a montagem da bobina e oxigenador. Nesta imagem, o anel de retenção de nylon foi colocado dentro tecido, bem do microcoil para garantir uma amostra. O pino de suporte de acetal na base do oxigenador foi assegurado no seu furo correspondente no topo do microcoil. A junta de silicone na extremidade aberta da perfusão bem foi colocada sobre o poço de tecido, e uma gravata de cabo foi apertada em torno desses componentes para selar a câmara de perfusão. Por último, a base do microcoil foi conectada à parte superior da cabeça do sonda. (C) componentes seguindo a montagem de sonda. No último painel, excesso de comprimento da gravata cabo tiver sido aparado flush com o microcoil. A pilha de bobina gradiente é então deslizou em posição, avançando-se cuidadosamente o cilindro em direção a sonda ao passar as linhas de perfusão em excesso, oxigenador e microcoil através de seu centro oco. Uma vez que os gradientes são conectados na cabeça da sonda, estão guardadas em lugar apertando o colarinho de fixação da sonda sobre a base de rosca dos gradientes. Clique aqui para ver uma versão maior desta figura.

Figura 5: estabilidade de sinal de difusão em fatias corticais agudas superfused. (A) valores de sinal de difusão Normalized em quatro fatias agudas submetidas a diferentes paradigmas superfusion são plotados ao longo do tempo por um período de até 21,5 h após a eutanásia. Fatias permanecem dentro de ± 5% de sua medição de sinal de difusão inicial por um período de 15,5 h após eutanásia independentemente de se superfusion é contínua ou intermitente e independente da duração de varredura do senhor (1,5 h ou 4 min). Gravações de sinal tiradas de córtex de formaldeído-fixo servem como controle positivo (n = 1) para a estabilidade devido à natureza das amostras de tecido fixo estática, imutável. Por outro lado, a difusão sinal medido numa fatia ao vivo ausente de apoio superfusion (n = 1) serve como um controle para deficiência metabólica. Parâmetros do experimento dos diferentes ensaios superfusion são os seguintes: contínuo (superfusion sempre pontual, por exame = 1,5 h), intermitente (superfusion no intervalo de 10 min entre as varreduras, tempo por varredura = 1,5 h), longo intervalo de varredura longo (superfusion na durante a varredura, mas pausado por 10 min entre as varreduras, o tempo por varredura = 1,5 h), intervalo de tempo, curta a varredura (superfusion no intervalo de 1,5 h entre as varreduras, tempo por varredura = 4 min). (B) grupo de apresentando dados Analyzed significa das quatro fatias viver experiências superfusion do painel (A). A difusão do sinal perfil de agrupadas, superfused fatias corticais apresenta pouca variação ao longo do tempo (2 ± 3% mais de 15,5 h) Considerando que o controle não perfundidos (n = 1) apresenta instabilidade de sinal dramático cedo no experimento (15% por 6,5 h). Esta figura foi modificada e reproduzida com a permissão do original do artigo8. Clique aqui para ver uma versão maior desta figura.
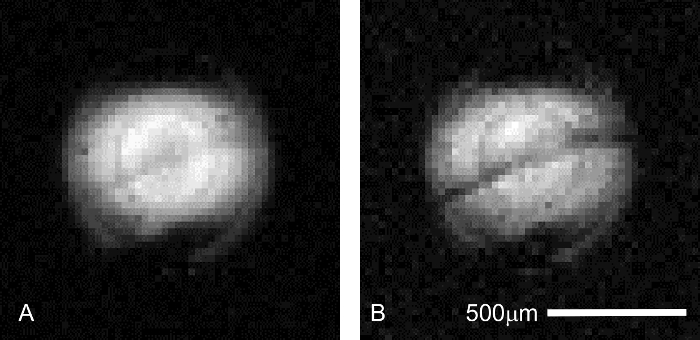
Figura 6: confirmação de colocação de fatias hippocampal durante a imagem latente piloto. Antes da execução de um senhor prolongada sessão de microscopia, correta colocação da amostra é fundamental para garantir recursos como tempo de varredor e caro perfusato aditivos não sejam desperdiçados. A camada de células piramidais na região CA1 do hipocampo podem ser visualizadas em mais rápido (4,3 min), baixa scans piloto de resolução (μm 31 x 31 μm no plano) para garantir que o tecido de interesse é colocado corretamente em relação a microbobina. Varredura de parâmetros comuns a ambas as imagens é os seguintes: TR/TE = 2000/11,6 ms, Δ = 6 ms, δ = 1 ms, médias = 1. (A) b = 0 (227 eficaz) s/mm2. Esta verificação preliminar, o estrato pyramidale é visível apenas como um cinza, banda diagonal centrada no perfil de excitação da bobina. (B) b = 1.200 (1.860 eficaz) s/mm2. Na difusão maior ponderação, interlamellar contraste aumenta à medida que a camada de célula piramidal torna-se mais escura do que os tecidos nas lâminas adjacentes (acima: estrato oriens; abaixo: estrato radiatum). Clique aqui para ver uma versão maior desta figura.
Discussão
O atual protocolo descreve procedimentos necessários para a manutenção metabólica padrão de preparações de fatia cerebral aguda submetidos à microscopia de ressonância magnética. Este procedimento é o único método disponível que permite a visualização de tecidos de mamíferos vivos com o Sr em resoluções capaz de resolver as células. Enquanto as condições de perfusato descritas são adaptadas especificamente para os tecidos do sistema nervoso central, o protocolo é amplamente adaptável a qualquer modo de viver em preparação do tecido por meio de ajustes de constituintes de perfusato e gás, bem como a taxa de fluxo de perfusão e a temperatura.
Os problemas mais comuns susceptíveis de serem encontradas durante os procedimentos descritos incluem aqueles relacionados a falhas no fornecimento de metabólito. Precipitação de sais de cálcio pode ocorrer dentro da aCSF durante insuficiência gasosa como resultado de falhas em sistema de armazenamento em buffer o bicarbonato. Tais precipitados podem entupir as linhas de perfusão e resultar em danos ao hardware grave. Se sal precipitados são observados o perfusato após montagem de sonda, cessar o fluxo de perfusão imediatamente, desligando a bomba peristáltica. Confirme a presença de níveis suficientes de bicarbonato de sódio (4,37 g/2 L) no perfusato, CO2 níveis (5,0%) no abastecimento de gás e o fluxo de gás de carbogênio (1/16 L/min) no reservatório e oxigenador. Finalmente, confirme os níveis de pH são estabilizados no intervalo fisiológico (7.3-7.4). No caso em que os níveis de oxigênio gás e pH ainda não são regulados adequadamente, a membrana de troca de gás deve ser substituída.
Se fatias não apresentam estabilidade de sinal no tempo-curso experimental pretendido, confirme que o corretos constituintes químicos estão presentes na mistura aCSF e que a osmolalidade correta (300 mOsm) e pH (7.3-7.4) são mantidos. Também, certifique-se de carbogênio gás está a ser fornecida para o reservatório de perfusato e oxigenador em 1/16 L/min. Se estes passos não corrigir condições de perfusato, aconselha-se substituição da membrana de troca gasosa. Se a estabilidade do tecido não é alcançada após a solução de problemas nas condições de perfusato, considere refinamento do protocolo cirúrgico com foco em minimizar o intervalo de tempo entre a aplicação de colheita e perfusão do tecido.
Divulgações
Os autores têm sem conflitos de interesse a divulgar.
Agradecimentos
Este trabalho foi apoiado por concessões do National Institutes of Health (NIH 1R01EB012874-01) (1R21NS094061-01A1) (S10RR031637) e o National Science Foundation (acordo de cooperação n º DMR-1157490) através do mecanismo de imagens avançado laboratório nacional de campo magnético elevado (NHMFL) de ressonância magnética e espectroscopia (AMRIS) em UF e o estado da Flórida.
Materiais
| Name | Company | Catalog Number | Comments |
| Perfusate Preparation | |||
| Osmette A | Precision Systems Inc. | 5002 | freezing point depression osmometer |
| Stir Plate Type 1000 | Barnstead/Thermodyne | SPA1025B | magnetic stir plate with heating element |
| Accumet Basic pH Meter | Fisher Scientific | AB15 | pH Meter |
| pH Probe | Fisher Scientific | 13-620-AP61 | probe for pH measurement |
| Oxygen Meter | Microelectrodes Inc. | OM-4 | meter for sampling the oxygen content of gasses or the disolved oxygen content of liquid perfusates |
| Oxygen Electrode | Microelectrodes Inc. | MI-730 | microprobe for the oxygen meter |
| Scale | Denver Instrument Co. | A-160 | microscale for weighing chemical components |
| Name | Company | Catalog Number | Comments |
| Slice Preparation | |||
| Lancer Vibratome | Ted Pella Inc. | Series 1000 | vibratory tissue slicer |
| Disecting Microscope | Carl Zeiss Inc. | OPMI 1-FC | tabletop, binocular disecting microscope |
| Name | Company | Catalog Number | Comments |
| Perfusion System | |||
| Masterflex L/S | Cole-Parmer | 7523-50 | peristaltic micro perfusion pump |
| Oxygen Regulators x 2 | Victor Medical | VMG-05LY | device for regulating gas flow |
| e-sized carbogen cylinders x 2 | Airgas | gas tanks containing carbogen gas | |
| in-bore oxygenator | developed in house | device responsible for pH and oxygen regulation in the perfusate | |
| Name | Company | Catalog Number | Comments |
| MR Imaging Hardware | |||
| Micro Surface Coil (200mm dia., modified) | Bruker Biospin | B6371/0001 | four-turn micro (200mm dia) surface-style radiofrequency coil |
| Micro 5 probe body | Bruker Biospin | Z3395 | microimaging probe used in the 600 MHz spectrometer |
| Micro 5 gradient coils | Bruker Biospin | M81111 | gradient coil stack used with micro 5 probe body |
| 600 MHz Spectrometer | Oxford Instruments | superconducting magnet (14.1T) used for MR image generation | |
| Imaging Console | Bruker Biospin | Avance III | support and control hardware including gradient amplifiers, preamps, & workstation used for MR image generation |
| Air Blower | Bruker Biospin | BCU-II, -80/60 | Air chiller unit used in conjunction with the probe's heating coil to regulate temperature inside the magnet bore |
| Gradient Chiller | Thermo Scientific | Neslab Merlin M33 | Water chiller used to disipate heat generated by the gradient coils |
Referências
- Aguayo, J. B., Blackband, S. J., Schoeniger, J., Mattingly, M. A., Hintermann, M. Nuclear magnetic resonance imaging of a single cell. Nature. 322, 190-191 (1986).
- Schoeniger, J. S., Aiken, N., Hsu, E., Blackband, S. J. Relaxation-time and diffusion NMR microscopy of single neurons. J. Magn. Reson. B. 103, 261-273 (1994).
- Flint, J. J., et al. Magnetic resonance microscopy of mammalian neurons. Neuroimage. 46, 1037-1040 (2009).
- Flint, J. J., et al. Magnetic resonance microscopy of human and porcine neurons and cellular processes. Neuroimage. 60, 1404-1411 (2012).
- Kamman, R. L., Go, K. G., Stomp, G. P., Hulstaert, C. E., Berendsen, H. J. C. Changes of Relaxation times T1 and T2 in rat tissues after biopsy and fixation. Magn. Reson. Imag. 3, 245-250 (1985).
- Shepherd, T. M., Thelwall, P. E., Stanisz, G. J., Blackband, S. J. Aldehyde fixative solutions alter the water relaxation and diffusion properties of nervous tissue. Magn. Reson. Med. 62, 26-34 (2009).
- Massin, C., Boero, G., Vincent, F., Abenhaim, J., Besse, P. -. A., Popovic, R. S. High-Q factor RF planar microcoils for micro-scale NMR spectroscopy. Sensor. Actuat. A-Phys. 97, 280-288 (2002).
- Flint, J., Menon, K., Hansen, B., Forder, J., Blackband, S. J. A microperfusion and in-bore oxygenator system designed for magnetic resonance microscopy studies on living tissue explants. Sci. Rep. 5, 18095 (2015).
- Khong, Y. M., et al. Novel intra-tissue perfusion system for culturing thick liver tissue. Tissue Eng. 13 (9), 2345-2356 (2007).
- Schumacher, K., Khong, Y. -. M., Chang, S., Ni, J., Sun, W., Yu, H. Perfusion culture improves the maintenance of cultured liver tissue slices. Tissue Eng. 13 (1), 197-205 (2007).
- Shepherd, T. M., Blackband, S. J., Wirth, E. D. Simultaneous diffusion MRI measurements from multiple perfused rat hippocampal slices. Magn. Reson. Med. 48, 565-569 (2002).
- Henry, W. Experiments on the quantity of gases absorbed by water, at different temperatures, and under different pressures. Phil. Trans. R. Soc. Lond. 93, (1803).
- Bui, J. D., Buckley, D. L., Phillips, M. I., Blackband, S. J., Blümler, P., Blümich, B., Botto, R., Fukushima, E. Studies of perfused brain slices with MR microscopy. Spatially Resolved Magnetic Resonance. , 337-343 (1998).
- Moseley, M. E., et al. Early detection of regional cerebral ischemia in cats: Comparison of diffusion- and T2-weighted MRI and spectroscopy. Magn. Reson. Med. 14 (2), 330-346 (1990).
- Moseley, M. E., et al. Diffusion-weighted MR imaging of acute stroke: Correlation with T2-weighted and magnetic susceptibility-enhanced MR imaging in cats. Am. J. Neuroradiol. 11, 423-429 (1990).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados