Method Article
Soutien métabolique des excisées, les tissus de cerveau vivants lors de l’Acquisition de la microscopie par résonance magnétique
Dans cet article
Résumé
Le protocole actuel décrit une méthode par laquelle utilisateurs peuvent maintenir la viabilité des préparations de tranches de hippocampe et cortex aiguë lors de la collecte des données de la microscopie par résonance magnétique.
Résumé
Ce protocole décrit les procédures nécessaires à l’appui des fonctions métaboliques normales des préparations de tranches cérébrale aiguë lors de la collecte des données de la microscopie par résonance magnétique (RM). Bien qu’il soit possible d’exécuter des collections de Monsieur sur les tissus de mammifères vivants, excisées, de telles expériences ont traditionnellement été contraint par les limites de la résolution et sont donc incapables de visualiser la microstructure tissulaire. À l’inverse, les protocoles de Monsieur qui n’a atteint la résolution de l’image microscopique nécessitait l’utilisation d’échantillons fixes pour tenir compte de la nécessité de conditions statiques et immuables au fil de longues durées. Le protocole actuel décrit la première technique de Monsieur disponible qui permet l’imagerie des échantillons de tissu vivant, chez les mammifères avec des résolutions microscopiques. Ces données sont d’une grande importance à la compréhension de comment axée sur la pathologie des changements de contraste se produisant à l’influence de niveau microscopique le contenu de macroscopique Monsieur analyses tels que ceux utilisés dans la clinique. Une fois cette compréhension est réalisée, avec une plus grande sensibilité et précision des méthodes de diagnostic peuvent être développés, ce qui se traduira directement au traitement précoce de la maladie, suivi de thérapie plus précis et amélioration des patients.
Alors que la méthodologie décrite se concentre sur des préparations de tranches de cerveau, le protocole est adaptable à toute tranche de tissus excisés, étant donné que les modifications sont apportées à la préparation de gaz et le perfusat pour répondre aux besoins métaboliques spécifiques du tissu. L’exécution réussie du protocole devrait se traduire par vivante et aiguë des préparations de tranches qui présentent une stabilité de Monsieur diffusion signal pour des périodes allant jusqu'à 15,5 h. Les principaux avantages du système actuel sur les autres appareils de perfusion compatible Monsieur sont sa compatibilité avec le matériel de microscopie de Monsieur requise pour atteindre le plus élevé des images de résolution et capacité à fournir un débit constant et ininterrompu avec soigneusement conditions de perfusat réglementé. Débit de l’échantillon réduit est un examen avec cette conception comme tranche de tissu qu’un seul peut être copié à la fois.
Introduction
Comme les systèmes d’imagerie de résonance magnétique (IRM) ont régulièrement progressé à des intensités de champ toujours plus élevés, plus de détails sur la composition et le statut des tissus vivants sont devenus discernables. Malgré ces progrès matériel, M. formation image à des résolutions permettant de visualiser les structures cellulaires des tissus n’est toujours pas disponible à la clinique. Ainsi, les caractéristiques cellulaires au niveau des tissus doivent être déduits lors de l’examen du contenu des tomographies cliniques. Telle conclusion exige la connaissance des processus équivalents tirées de données prises dans des systèmes modèles qui peuvent être observées directement. Traditionnellement, ces modèles incluent les cellules d’organismes aquatiques comme les ovocytes de Xenopus laevis et Aplysia californica L7 neurone1,2. Ceux-ci ont été parmi les premières cellules animales disponibles pour l’observation avec des méthodes de Monsieur en raison de leur taille anormalement grande : environ 1000 μm et 300 μm de diamètre, respectivement. Plus récemment, les progrès dans la conception de matériel ont permis pour l’un des exemples plus importants des cellules mammifères — le α-motoneurone — à être photographié à l’aide de techniques de microscopie de Monsieur tissu fixe3,4. Alors que ces études ont montré une visualisation directe du matériel cellulaire chez les mammifères, à l’aide de Monsieur, les échantillons fixes utilisées diffèrent considérablement dans leurs propriétés de Monsieur de tissus vivants et ne peuvent donc servir un modèle représentatif équivalent5, 6. Plus important encore, détectant les variations de contraste de Monsieur qui se produisent en concert avec les processus biologiques complexes nécessite des échantillons vivants qui peuvent être perturbées et mesurées au cours de l’expérience d’imagerie.
Pour faciliter les études de microscopie de Monsieur sur les tissus vivants, un protocole est présenté qui comprend microimaging commercial matériel7 couplé à une construite à cet effet, Monsieur compatible, en calibre oxygénateur et dispositif de perfusion décrite précédemment8 . Les avantages uniques de ce design intègre des capacités de résolution au niveau cellulaire dans les tissus des mammifères et de contrôle de la précision sur la teneur en gaz dissous et du pH sur le site de perfusion tissulaire. Aussi, contrairement à la plupart des études de M. explant qui interrompt la perfusion lors de l’acquisition d’image pour éviter les artefacts de flux, cette conception prend en charge l’utilisation de la perfusion continue au cours de la collecte de données qui a été montré pour améliorer la condition physiologique de isolée des tissus9,10. Enfin, son aide enregistrement fermée chambre et tranche-rétention matériel pour réduire la probabilité d’artefacts de mouvement qui pourrait se produire pendant longues collection d’images.
Alors que le protocole actuel décrit les procédures appropriées pour une utilisation avec des tranches de hippocampe et cortex aiguës, un contrôle précis sur les métabolites du perfusat permet à ce système pour accueillir un large éventail de types de tissus différents et des conditions expérimentales. Limites de cette conception incluent une réduction de débit de l’échantillon par rapport à une chambre de perfusion multi-tranche11; Toutefois, cette limitation peut surmonter à l’avenir à l’aide de bobines de multiples baies.
Tandis que le système décrit peut être employé dans des configurations horizontales ou verticales, le protocole actuel comporte également son utilisation dans un spectromètre de 600 MHz orientées verticalement. N’importe quel système capable de Monsieur microimaging études — généralement étroit-alésage (6 cm), spectromètres à haut champ (≥500 MHz) — pourra accueillir l’équipement oxygénateur et une perfusion décrite. Toutefois, modifications apportées à la bobine d’imagerie, gradient, système de sonde ou d’autres matériels d’imagerie essentielles employées peuvent nécessiter des modifications à l’équipement de perfusion et paramètres de balayage de Monsieur.
Protocole
toutes les expériences animales décrits suivent les lignes directrices énoncées dans les académies nationales des Sciences ' Guide pour le soin et l’utilisation des animaux de laboratoire et ont été examinés et approuvés par l’Université de la Floride ' s Institutional Animal Care and Use Committee (IACUC). Suivre toutes les règles et réglementations applicables en s’engageant dans la recherche animale sujet.
1. préparation du milieu de perfusion pour l’entretien des tissus du système nerveux Central
- faire frais liquide céphalo-rachidien artificiel (FSCA).
- Pour générer 2 L du perfusat FSCA tamponnée au bicarbonate, mesurer 1 500 mL d’eau purifiée par double distillation ou l’osmose inverse dans une fiole de 4 L. Placer une barre magnétique remuer dans la fiole et agiter le liquide en utilisant un plat sauté.
- Dans l’eau purifiée, dissoudre les quantités de sels suivantes : 14,03 g (120 mM) de chlorure de sodium, phosphate de potassium monobasique de 0,41 g (1,5 mM), 0,69 g (1,4 mM) sulfate de magnésium heptahydraté, 4,37 g (26 mM) de bicarbonate de sodium, calcium 0,59 g (2 mM) chlorure dihydraté, 0,45 g (3 mM) de chlorure de potassium et glucose 3,6 g (10 mM).
Remarque : Le contenu chimique du perfusat différeront selon les besoins métaboliques spécifiques du tissu et les conditions souhaitées de l’expérience. - Mélanger cette solution jusqu'à ce que tous les sels sont dissous. Régler le volume de 2 L à l’aide de l’eau purifiée supplémentaire.
- Tester l’osmolalité de l’aCSF utilisant un osmomètre de dépression du point de congélation. Ajuster à 300 mOsm/kg, à l’aide de sorbitol. Ajout de sorbitol 324 mg à 2 L de 299 mOsm/kg FSCA perfusat augmentera l’osmolalité de 300 mOsm/kg (environ 1 mOsm par 324mg).
Remarque : Le FSCA peut être stocké à 4 ° C dans une bouteille hermétique, scellée pour une période ne devant ne pas dépasser 24 h.
2. Set Up the System Perfusion
- préparer le perfusat fsca.
- FSCA de stabiliser à la température ambiante (~ 23 ° C) tout en gazage avec carbogen de 95 % (IC95 O 2, 5 % CO 2 ; 1/16 L/min) par barbotage direct pour pas moins de 1 h.
Remarque : Types de tissus différents ou des conditions expérimentales souhaitées peuvent nécessiter ajustement du perfusat température ou gaz contenu. Les conditions souhaitées pour la teneur en gaz dissous dans le milieu de perfusion peuvent être contrôlées avec précision en faisant varier les concentrations en pourcentage des différents composants de l’alimentation en gaz ( Figure 1). - Une fois que le FSCA atteint la température requise et la saturation de la carbogen, confirment que le pH est dans les limites physiologiques (7,3 à 7,4). Continuer à gaz bulle directement dans le réservoir du perfusat (1/16 L/min) tout au long de l’expérience afin de maintenir propre dissous la teneur en oxygène et des conditions de pH propices au métabolisme des tissus sains.
- FSCA de stabiliser à la température ambiante (~ 23 ° C) tout en gazage avec carbogen de 95 % (IC95 O 2, 5 % CO 2 ; 1/16 L/min) par barbotage direct pour pas moins de 1 h.
- Amorcer les lignes de perfusion.
- Submerge le tube d’entrée connecté à la micro pompe péristaltique dans le FSCA préparé (300 mOsm, pH 7,3 à 7,4, continuellement gazés).
- Pass l’oxygénateur périphérique ( Figure 2) et des lignes de perfusion à travers tous les deux l’aimant alésage et bobines de gradient (de haut en bas) de la pile et définissez les bobines côté jusqu’au montage de la sonde. Accrocher l’oxygénateur au-dessus un bécher pour intercepter tout effluent fsca.
Remarque : Selon la conception du système MRI, lignes de perfusion devrez peut-être être passé par le biais de l’alésage de l’aimant et les bobines de gradient ou les corps de sonde base avant l’amorçage du système avec fsca. Confirmer que le placement ligne de perfusion n’interférera pas avec l’ensemble du corps de la sonde ou insertion de la sonde dans le trou avant de commencer la procédure d’amorçage. - Vérifier le débit prévu (2 mL/min) est activée et commencer à remplir les lignes de perfusion en activant la pompe.
- Inverser le barboteur en ligne vide, afin que le FSCA supplantera l’air contenu à l’intérieur de.
- Connecter l’oxygénateur ' s port à une seconde source de carbogen (un collecteur ou un cylindre de carbogen secondaire) de gaz et régler un débit de 1 / 16L/min
- Vérifier que carbogen est le débit au fil de l’oxygénateur ' membrane échanges gazeux s en plongeant l’orifice d’échappement sur le dessus de l’oxygénateur dans l’eau.
- Lorsque le FSCA est détecté dégoulinant de la chambre de perfusion, purger les bulles de gaz visible depuis les lignes de flux entrant par agitation manuelle.
- Confirmer l’oxygénateur fonctionne correctement en immergeant la sonde à oxygène dans le FSCA découlant de la chambre de perfusion.
Remarque : La lecture du compteur d’oxygène doit être proche de la proportion d’oxygène contenue dans le gaz fourni.
3. Préparation du tissu
- euthanasie
- Place un rat (125-150 g) dans la chambre de l’induction d’une machine d’anesthésie et d’exposer à 4 % isoflurane dans un transporteur d’oxygène gaz à raison de 1 L/min pendant 4 min.
- Retirer le rat inconscient de la chambre de l’anesthésie.
- Effectuer un test de réflexe de redressement en plaçant le rat en décubitus dorsal. Recherchez tous les mouvements — tête tournant, jambe levée, colonne vertébrale, flexion, etc. — l’indicatif que l’animal se tourne sur son estomac.
- Effectuer un oeil-blink réflexive en touchant le œil ouvert de l’animal à l’aide d’un coton-tige. Vérifier pour toute réponse — couvercle de fermeture, spasmes musculaires, etc. — à cette entrée sensorielle.
- Enfin, effectuer une branche-test du réflexe à retirer en pinçant la peau entre les orteils du rat ' s tendu jambe arrière à l’aide de la pince à épiler ou une pince hémostatique. Recherchez la flexion de la jambe
Remarque : en cas de résultat positif réflexive, ne passez pas à l’euthanasie. - Dans le cas où un des trois tests réflexes suscite une réaction, restituer le rat à la chambre de l’anesthésie et permettre un supplémentaire 2 min d’exposition à 4 % isoflurane.
- Effectuer tous les tests réflexives trois cours dans leur intégralité. Répétez l’exposition d’anesthésie 2 min si nécessaire et procéder seulement une fois qu’on a observé une absence totale de réponse à tous les trois tests réflexives.
- Euthanasier le rat par décapitation guillotine.
- Résection de cerveau
- enlever le cerveau de rat par la technique brute. Commencez avec la tête en position couchée. À l’aide de ciseaux, couper rostralement à travers la peau de l’arrière du cou au nez et exposer le crâne.
- Enlever les tissus mous de la surface du crâne avec une sonde émoussée.
- Travaillant à partir de l’extrémité caudale, enlever l’occipital, pariétal et les os frontal du crâne à l’aide de pinces-gouges.
- Rentrer le dura en découpant le long de la fissure longitudinale avec des ciseaux micro et peeling retour la couche des deux hémisphères.
- Enlever le cerveau du crâne en tournant la tête à la position en décubitus dorsal et sectionné les nerfs crâniens sur la face ventrale.
- Tranche isolation
- retourner le cerveau de la position couchée et isoler la partie centrale contenant l’hippocampe en supprimant tous les tissus caudales sur la fissure transversale et rostrales de la fimbria. Faire deux incisions le long du plan transversal (c.-à-d. les tranches coronales) avec un rasoir polygonale.
- Fixer le cerveau ' plan caudale plus s au centre d’un bain de coupe vibratome à l’aide de colle cyanoacrylate.
- Ajouter glacee, carbogen barboter FSCA au bain vibratome coupe et placer le matériel de rétention en nylon à l’intérieur de.
- Couper 300 μm tranches épaisses afin d’obtenir des préparations de tranches utilisable de 3 à 4 par hémisphère (total de 6 à 8).
- Isoler un hippocampe ou une section corticale d’un hémisphère et coupez la tranche afin qu’il tienne dans la microcoil ' s 5 mm diamètre des tissus bien.
4. Exemple de positionnement et montage de système de Perfusion
- bobine préparation
- remplir le microcoil ' chambre de tissu s avec FSCA oxygéné de la vibratome ' bain de découpage de s à l’aide d’une pipette en.
- Prendre l’échantillon de cerveau Paré et de positionner la région d’intérêt (par exemple. couche de cellules pyramidales) au cours de la microcoil à l’aide d’une dissection étendue.
- Insérer le dispositif de retenue de tissus (nylon mesh net apposée sur la rondelle en nylon) pour conserver la position d’échantillon pendant toute l’expérience d’imagerie.
Remarque : Passez rapidement à travers l’échantillon procédure pour minimiser l’exposition à une lumière intense de positionnement. Fournir le FSCA oxygéné supplémentaire au besoin à l’aide d’une pipette de transfert.
- Montage de l’oxygénateur en calibre, la microcoil et la sonde
- garantir l’assembly mis à jour le microcoil ( Figure 3) dans une pince de table et d’apposer l’appareil en calibre oxygénateur en insérant le peg soutien acétal dans le trou sur le dessus de la bobine.
- Joint le système de perfusion en plaçant la chambre de perfusion sur le microcoil ' tissus s bien et resserrant les deux ensemble à l’aide d’une attache de câble miniature.
- Couper l’excédent de longueur de l’attache de câble à l’aide de pinces coupantes.
NOTE : Sur étanchéité réussie, perfusat devrait être observé sortant à travers les lignes de sortie et aucune fuite ne doit être évidente autour du joint de silicone de la chambre de perfusion. Pour confirmer ces conditions avant l’assemblage de la sonde peut entraîner de graves dommages au matériel d’imagerie. - Une fois FSCA il ressort dégoulinant dans le réservoir de déchets, prendre la microcoil et oxygénateur et fixez l’ensemble vers le haut du corps de sonde d’imagerie.
- Glisser la pile dégradée sur l’Assemblée et accueillir le dégradé sur le dessus de la sonde. Photographies détaillant le positionnement relatif et le bon raccordement des bobines, des composants matériels oxygénateur et la sonde sont fournis ( Figure 4).
5. Effectuant la Collection d’images de M.
- Insérer la sonde Assemblée dans l’aimant d’alésage
- Placer le corps de la sonde à proximité du spectromètre alésage ouverture au bas de l’aimant.
- Retirer l’excédent de longueur des lignes de perfusion par l’intermédiaire de l’alésage d’ouverture sur le dessus de l’aimant.
- Une fois que tous les attelages disponibles a été repris depuis les lignes de perfusion, avance le corps de la sonde dans l’aimant d’alésage à la base tout en simultanément retirer plus mou et les lignes de perfusion du haut de l’alésage.
- Visser les deux vis de fixation à la base de la sonde dans les fentes correspondantes de la pile de shim.
- Avant de commencer, vérifier que les lignes de perfusion ne étaient pas pincés ou déformés lors de l’insertion de la sonde en confirmant le FSCA écoulement dans le réservoir de déchets.
Remarque : Défaut de confirmer le perfusat sortant peut causer des dommages permanents aux dommages catastrophiques risques et lignes de perfusion à M. formation image matériel. - Dans le cas où aucun perfusat n’est vu sortir le tuyau de retour dans le réservoir de déchets, enlever le corps de la sonde et confirmer que flux perfusat a repris avant de tenter de réinsertion. Une présentation schématique du spectromètre de système et l’imagerie de perfusion assemblé a été décrit plus haut 8.
- Reliant le corps de la sonde
- fixer les canalisations d’eau entrée et sortie du refroidisseur dégradé.
- Mettre en marche la pompe pour gradient refroidisseur et confirmez le réglage de température de l’eau (19 ° C).
- Fixer le tuyau d’air de l’unité de refroidisseur d’air sur le corps de la sonde à l’aide d’un collier de serrage.
- Tourner le bouton de débit sur l’unité de refroidisseur d’air de le " 1 " position.
- Fixer le fil de thermocouple au corps de la sonde.
- Fixer le câble coaxial du préamplificateur à la radiofréquence (RF) d’entrée/sortie sur le corps de la sonde ' canal de proton (H) de s.
- Fixer le câble d’alimentation des amplificateurs dégradés au corps de la sonde.
- À l’intérieur de la RF armoire, allumer le courant à la cellule d’indemnisation B0, tous trois amplificateurs de gradients (x, y, z) et l’unité principale.
- Préparer le spectromètre
- régler la température de l’alésage prévu en utilisant le module de réglage de température variable au niveau de la console.
- Match (impédance) et régler le circuit (fréquence), la Fédération de Russie en ajustant les condensateurs variables au sein de la sonde. Ceci est accompli en manipulant les baguettes à la base du corps de la sonde.
- Ajuster les paramètres actuels pour le spectromètre ' bobines shim s afin d’optimiser l’homogénéité du champ magnétique à l’échantillon.
- Collection d’images de commencer
- collectionnent les images pilotes pour déterminer la position spatiale de votre échantillon dans l’aimant d’alésage. Paramètres typiques pour deux dimension écho de gradient sont comme suit (TR/TE = 100/4 ms, moyennes = 1, angle de l’impulsion = 30 o, temps = matrice s, 6 = 64 x 64, champ de vision = 0,3 x 0,3 cm, résolution = 47 x 47 μm).
- Recueillir diffusion-pesée des pilotes afin de confirmer la position de géométrie et de tissus de balayage appropriée le cas échéant. Les paramètres typiques pour deux dimensionnelle numérisation pilote diffusion-pesée sont comme suit (TR/TE = 2000/11,6 ms, temps = 4,3 min, Δ = 6 ms, δ = 1 ms, moyennes = 1, b = 1200 (en vigueur depuis 1860) s/mm 2, matrix = 64 x 64, champ de vision = 0,2 x 0,2 cm résolution = 31 μm).
- Recueillir une série de temps de diffusion-pesée afin de déterminer les caractéristiques de stabilité de la préparation de tranche aiguë. Voici les paramètres typiques pour une image pondérée de deux dimensions diffusion (TR/TE = 2000/11,6 ms, temps = 1,5 h, Δ = 6 ms, δ = 1 ms, moyennes = 42, b = 1200 s/mm 2, matrix = 64 x 64, champ de vision = 0,2 x 0,2 cm, résolution = 31 μm). Remarque : Caractérisation de stabilité dans un système donné varie du protocole décrit selon des facteurs tels que le contraste de Monsieur employées (T1, T2, diffusion, sensibilité), la perturbation physique étudié et le changement de signal de Monsieur par unité de temps résultant dit perturbation.
Résultats
Préparation du perfusat
En emploi réussie de l’appareil d’oxygénation dans Canon, gaz présents dans le carbogen fourni atteindra 100 % des conditions de saturation dans le perfusat fsca. Ceci peut être démontré en variant la concentration en oxygène du gaz fourni et en mesurant le changement de teneur en oxygène dissous dans le perfusat FSCA au sein de la chambre de perfusion à l’aide d’un oxygène mètre (Figure 1)8. Selon la Loi de Henry, la quantité de gaz dissous qui est en équilibre avec un échantillon de liquide est directement proportionnelle à la pression partielle de ce gaz, pourvu que la température reste constante12. À l’aide de cette connaissance et la précision des normes de gaz, il est possible de quantifier la quantité d’oxygène dissous contenus dans un échantillon de l’aCSF, tel que décrit. Ce résultat est obtenu par étalonnage du compteur de l’oxygène à l’aide de solutions saturées (directement barboter pendant 1 h ou plus) de FSCA étant exposés aux gaz de composition connue : un gaz dont la concentration d’oxygène élevée tels que carbogen (95 % O2) et l’autre avec faible teneur en oxygène concentration, tel que l’azote (0 % O2). Par la suite, des mesures peuvent être prises en immergeant la pointe de la sonde à oxygène dans un échantillon. Confirmation que l’oxygénateur à Canon fonctionne correctement est possible en mesurant l’effluent de la perfusion bien. Le pourcentage d’oxygène dissous tels que mesurés par le compteur de l’oxygène doit correspondre à la concentration en pourcentage d’oxygène dans les gaz d’alimentation. Si les valeurs mesurées sont inférieures à celles de l’approvisionnement en gaz, cela laisse supposer une défaillance matérielle qui pourrait conduire à une insuffisance métabolique dans la tranche de tissu.
Comportement et l’apparence de l’échantillon
Des préparations de tranches aiguë qui reçoivent une perfusion suffisante pour fournir les métabolites nécessaires et emporter les déchets métaboliques bientôt atteint un état de stabilité relative. Dès lors, tranches aiguës peuvent être soumis à des perturbations externes et leurs réactions à ces changements peuvent être mesurées pour l’étude scientifique. Pour M. expériences, suivi du signal d’intérêt au fil du temps est une pratique couramment utilisée pour démontrer la stabilité relative de la tranche aiguë préparations13. Le signal de diffusion-pesée est particulièrement sensible aux changements dans d’un mouchoir mobilité de l’eau, le contenu et distribution, comme peut être apprécié par l’utilisation de ce mécanisme de contraste pour détecter les infarctus ischémique14,15. Tracer le signal de diffusion normalisée au fil du temps dans des tranches de cortex aiguës maintenue sous une variété de conditions de perfusion montre relativement stabilité (2 ± 3 % plus de 15,5 h) après l’isolation tissulaire est obtenue (Figure 5). Stabilité de signal de diffusion a été conservée indépendamment des conditions de perfusion (intermittentes ou continues) ou la longueur de balayage de MRI (court [4 min] ou long [1,5 h])8. Si les tranches ne présentent pas de signal de stabilité au fil du temps, tels que l’augmentation de signal de diffusion forte observée dans le cortex de vie n’ayant pas reçu une perfusion, c’est suggestif des conditions expérimentales sous-optimale. Expériences de perturbation ne doivent pas être tentées avant la confirmation de l’état du signal stable dans les préparations de tranches.
En plus de la stabilité du signal, l’échantillon correct positionnement doit être confirmé au moment de la collecte de l’image. Même si la position de l’échantillon est contrôlée pendant la pose de tissu sur le microscope à dissection, changements dans la position de l’échantillon peuvent se produire lors de l’assemblage de l’appareil de perfusion ou une manipulation brutale de la bobine ou la sonde avant insertion dans l’aimant. Confirmation de positionner correctement le hippocampe est possible en collectant bref (2 min), pilote scanne avec contraste de diffusion (Figure 6). La couche de cellules pyramidales étant plus sensible à la pondération de diffusion que les limbes hippocampe adjacents, cette structure apparaît comme une bande plus sombre dans les images pondérées en diffusion. Configurations qui n’affichent pas cette caractéristique contiennent des échantillons décentré et devront probablement être répétée.
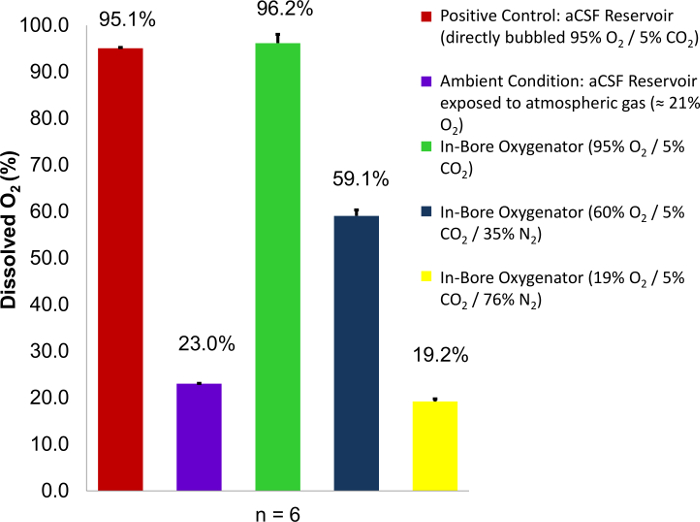
Figure 1 : Dissous la teneur en oxygène du perfusat FSCA en fonction de p O2 contenu dans le gaz fourni. Carbogen mélanges contenant des concentrations variables de l’oxygène (95 %, 60 % et 19 %) sont utilisés comme gaz d’alimentation. Le pourcentage d’oxygène dissous lectures sont alors bien pris de la perfusion et par rapport aux deux témoins connus : un réservoir de perfusat directement barboter avec carbogen (95 % O2) et un réservoir de perfusat exposé aux intempéries (23 % O2 ). Dans chaque cas, la saturation en oxygène pour cent sur le site de tissu perfusion approches 100 % de la concentration d’O2 dans le mélange de carbogen utilisé. Barres d’erreur correspondent à l’écart de la moyenne de l’échantillon. Figure reproduite avec la permission de l' original de l’article8. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
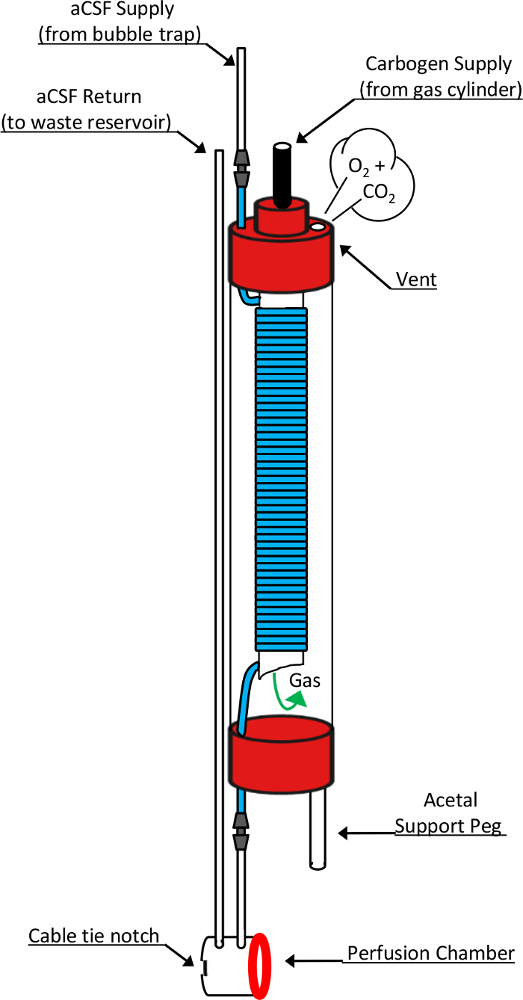
Figure 2 : schéma de la chambre d’oxygénateur et une perfusion en calibre. Ce diagramme montre les éléments de conception détaillée chargé de la fonction de ces dispositifs critiques. Perfusat fraîche qui a été pompée à travers un barboteur pénètre l’oxygénateur à travers la partie supérieure d’un tube de NMR de 10 mm. Ce faisant, il passe en un gaz hautement tube en silicone perméable (segment bleu) qui est enroulé autour d’un tube de 5 mm NMR à composition non limitée, imbriqué à l’intérieur. Carbogen gaz fourni par le haut du tube de 5mm entre dans la chambre à travers le fond ouvertes à tous et passe sur le tube en silicone lové avant de quitter l’oxygénateur à travers un trou d’aération dans le bouchon de tube de 10 mm. Au cours de cette exposition, le perfusat qui coule à travers le tube de silicone devient saturé avec les composants chimiques du mélange gaz fourni. En sortant de l’oxygénateur, perfusat passe directement dans la chambre de perfusion avant d’entrer dans la conduite de retour conduisant à un réservoir de collecte des déchets. Autres composants essentiels à cette conception incluent la cheville de soutien d’acétal permettant l’oxygénateur de se tenir verticalement au sommet de la mis à jour le microcoil RF, une rondelle de silicone (cercle rouge) qui constitue le joint étanche entre la chambre de perfusion de l’oxygénateur et tissus de la microcoil bien et le collier de serrage encoche qui accueille le placement d’une attache de câble utilisée pour former ce sceau réversible. Ce chiffre a été modifié et reproduit avec la permission de l' original de l’article8. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 3 : Modifications à l’Assemblée microcoil permettant l’interface de l’oxygénateur en calibre. Deux rainures 3,0 mm x 1,5 mm (flèches noires) ont été coupés dans le côté de l’Assemblée qui s’adapter à la largeur d’une attache de câble utilisée pour sceller la chambre de perfusion. Une chaîne (15 x 3 x 4 mm) relie les bosquets sur la face arrière de la bobine. Deux espaces en nylon placées sur les côtés de la Loi sur le canal (flèches rouges) comme une prise accessoire pour la tête de cravate câble qui facilite la procédure d’étanchéité. Percer un trou (2 x 14 mm) dans la partie supérieure de l’ensemble de la bobine (jaune arromment) rejoint l’acétal soutenir peg pour sécuriser l’oxygénateur. Ce chiffre a été modifié et reproduit avec la permission de l' original de l’article8. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 4 : Photo montage détaillant le positionnement relatif et le montage des composants de la sonde, oxygénateur et microcoil. Ces images comportent des composants clés du dispositif oxygénateur et microperfusion en Canon et illustrent comment les parties séparées de l’interface avec l’autre. (A) photo de vue éclatée montrant le positionnement relatif de tous les composants avant le scellage du tissu bien ou l’assemblage du corps de la sonde. On a pris soin d’afficher l’emplacement relatif des pièces avec précision ; Toutefois, une partie des lignes de perfusion a été doublée en retour de cette série afin que toutes les composantes s’inscrivent dans le cadre de l’image. (1 = tête de sonde, 2 = microcoil montage, 3 = bague de rétention de tissu en nylon, 4 = perfusion bien, 5 = serre-câble, 6 = en-alésage oxygénateur, 7 = bobines de gradient, 8 = barboteur). Composantes (B) après le montage bobine et oxygénateur. Dans cette image, l’anneau de rétention en nylon a été placé dans le puits de tissus de la microcoil pour garantir un échantillon. La cheville de soutien acétal sur la base de l’oxygénateur est bloquée dans le trou correspondant sur le dessus de la microcoil. Le joint de silicone sur l’extrémité ouverte de la perfusion bien a été placé sur le puits de tissus, et une attache de câble a été renforcée autour de ces composants pour sceller la chambre de perfusion. Enfin, la base de la microcoil a été connectée au haut de la tête de sonde. (C) composants après le montage de la sonde. Dans le dernier panneau, longueur excessive de l’attache de câble ont été allégé, chasse d’eau avec le microcoil. La pile de bobines de gradient est ensuite glissée en position en avançant avec précaution le cylindre vers la sonde en traversant les lignes de perfusion excessive et oxygénateur microcoil son centre creux. Une fois que les gradients sont connectés à la tête de sonde, ils sont maintenus en place en serrant le collier de fixation sur la sonde au-dessus de la base filetée des gradients. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 5 : stabilité de signal de Diffusion dans des tranches de cortex aiguës superfusées. (A) les valeurs de signal de diffusion normalisée en quatre tranches aiguës soumis à différents paradigmes superfusion sont tracés au fil du temps pour une période de jusqu'à 21,5 h suite à l’euthanasie. Tranches de restent à ± 5 % de leurs mesures de signal de diffusion initiale pour une période de 15,5 h après euthanasie indépendamment de si superfusion est continu ou intermittent et indépendant de la durée de scan de Monsieur (1,5 h ou 4 min). Enregistrements de signaux provenant du cortex formaldéhyde-correction servent de contrôle positif (n = 1) pour la stabilité en raison de la nature statique et immuable des échantillons de tissu fixe. À l’inverse, le signal de diffusion mesurés dans une tranche direct en l’absence de soutien superfusion (n = 1) agit comme un contrôle pour insuffisance métabolique. Voici les paramètres de l’expérience des différents essais superfusion : continu (superfusion toujours ponctuellement, par balayage = 1,5 h), intermittent (superfusion sur pour l’intervalle de 10 minutes entre les balayages, fois par scan = 1,5 h), Long intervalle, long scan (superfusion sur au cours de l’analyse, mais en pause pendant 10 min entre les balayages, période par balayage = 1,5 h), Long intervalle, court scan (superfusion sur intervalle de 1,5 h entre les balayages, fois par scan = 4 min). (B) analyse de données montrant groupe signifie des quatre expériences superfusion live-tranche du panneau (A). La diffusion du signal profil de groupés, des tranches de cortex superfusées présente peu de variation dans le temps (2 ± 3 % sur une période de 15,5 h) alors que le contrôle non perfusés (n = 1) montre l’instabilité de signal dramatique au début de l’expérimentation (15 % de 6,5 h). Ce chiffre a été modifié et reproduit avec la permission de l' original de l’article8. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
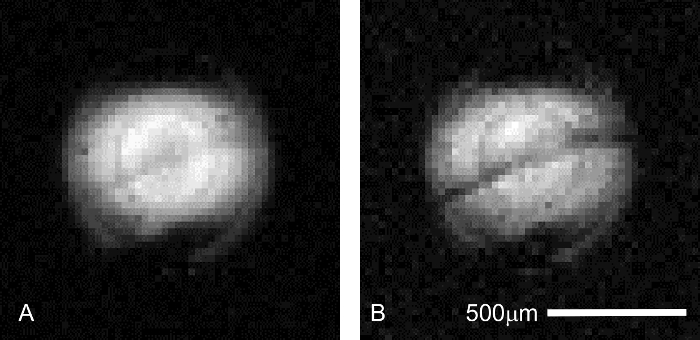
Figure 6 : Confirmation du placement de l’hippocampe tranche en imagerie pilote. Avant d’exécuter un MR long session de microscopie, bon placement de l’échantillon est essentielle pour assurer des ressources telles que le temps de scanner et coûteux additifs perfusat ne sont pas gaspillées. La couche de cellules pyramidales de la région CA1 de l’hippocampe peut être visualisée en plus rapide (4,3 min), un taux inférieur de scans pilote résolution (μm 31 x 31 μm dans le plan) pour s’assurer que le tissu d’intérêt est correctement positionné par rapport à la micro-bobine. Paramètres d’analyse commun à ces deux images sont les suivantes : TR/TE = 2000/11,6 ms, Δ = 6 ms, δ = 1 ms, moyennes = 1. B (A) = 0 (227 efficace) s/mm2. Dans cette analyse préliminaire, la strate pyramidale est à peine visible comme un gris, bande diagonale centré dans le profil d’excitation de la bobine. (B) b = 1 200 (1 860 efficace) s/mm2. À diffusion plus élevée contraste pondération, interlamellaire augmente à mesure que la couche de cellules pyramidales devient plus sombre que les tissus dans les limbes adjacentes (ci-dessus : stratum oriens ; ci-dessous : stratum radiatum). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Le protocole actuel décrit les procédures nécessaires à la maintenance métabolique standard des préparations de tranches de cerveau aiguë subissant la microscopie par résonance magnétique. Cette procédure est la seule méthode actuellement disponible qui permet la visualisation des tissus de mammifères vivants avec Monsieur à des résolutions permettant de résoudre des cellules. Alors que les conditions du perfusat décrites sont adaptées spécifiquement à des tissus du système nerveux central, le protocole est largement adaptable à n’importe quel mode de vie préparation du tissu grâce à des ajustements de constituants perfusat et gaz ainsi que le débit de perfusion et la température.
Les problèmes les plus courants susceptibles d’être rencontrées pendant les procédures décrites comprennent celles qui sont liées à des défaillances dans l’approvisionnement en métabolites. Précipitation des sels de calcium peut se produire à l’intérieur de l’aCSF pendant insuffisance gazeux à la suite de défaillances dans le bicarbonate mise en mémoire tampon de système. Ces précipités peuvent obstruer les lignes de perfusion et causer des dommages matériels graves. Si sels précipités sont observées dans le perfusat après le montage de la sonde, cesser immédiatement les débit de perfusion en désactivant la pompe péristaltique. Confirmer la présence des niveaux suffisants de bicarbonate de sodium (4,37 g/2 L) dans le milieu de perfusion, CO2 niveaux (5,0 %) dans l’approvisionnement en gaz et le débit de gaz de carbogen (1/16 L/min) dans les réservoirs et oxygénateur. Enfin, confirmer les niveaux de pH sont stabilisées dans les limites physiologiques (7,3 à 7,4). Dans le cas où les niveaux de pH et de gaz d’oxygène ne sont toujours pas réglementés convenablement, la membrane d’échanges gazeux doit être remplacée.
Si les tranches ne présentent pas de signal de stabilité au cours de l’évolution temporelle expérimentale prévue, confirment que les constituants chimiques correctes sont présents dans le mélange de l’aCSF et que l’osmolalité correcte (300 mOsm) et pH (7,3 à 7,4) sont maintenues. En outre, assurer carbogen gaz est fourni au réservoir du perfusat et oxygénateur à 1/16 L/min. Si ces étapes ne corrigent pas les conditions du perfusat, remplacement de la membrane des échanges gazeux est conseillé. Si la stabilité du tissu n’est pas atteint après un dépannage les conditions du perfusat, envisager de raffinement du protocole chirurgical en mettant l’accent sur la réduction de l’intervalle de temps entre la demande de récolte et de la perfusion tissulaire.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêt à divulguer.
Remerciements
Ce travail a été soutenu par des subventions de la National Institutes of Health (1R21NS094061 01 a-1) (NIH 1R01EB012874-01) (S10RR031637) et la National Science Foundation (accord de coopération no DMR-1157490) par l’intermédiaire du Laboratoire National de champ magnétique élevé (NHMFL) Advanced Magnetic Resonance Imaging et spectroscopie (AMRIS) UF et l’état de Floride.
matériels
| Name | Company | Catalog Number | Comments |
| Perfusate Preparation | |||
| Osmette A | Precision Systems Inc. | 5002 | freezing point depression osmometer |
| Stir Plate Type 1000 | Barnstead/Thermodyne | SPA1025B | magnetic stir plate with heating element |
| Accumet Basic pH Meter | Fisher Scientific | AB15 | pH Meter |
| pH Probe | Fisher Scientific | 13-620-AP61 | probe for pH measurement |
| Oxygen Meter | Microelectrodes Inc. | OM-4 | meter for sampling the oxygen content of gasses or the disolved oxygen content of liquid perfusates |
| Oxygen Electrode | Microelectrodes Inc. | MI-730 | microprobe for the oxygen meter |
| Scale | Denver Instrument Co. | A-160 | microscale for weighing chemical components |
| Name | Company | Catalog Number | Comments |
| Slice Preparation | |||
| Lancer Vibratome | Ted Pella Inc. | Series 1000 | vibratory tissue slicer |
| Disecting Microscope | Carl Zeiss Inc. | OPMI 1-FC | tabletop, binocular disecting microscope |
| Name | Company | Catalog Number | Comments |
| Perfusion System | |||
| Masterflex L/S | Cole-Parmer | 7523-50 | peristaltic micro perfusion pump |
| Oxygen Regulators x 2 | Victor Medical | VMG-05LY | device for regulating gas flow |
| e-sized carbogen cylinders x 2 | Airgas | gas tanks containing carbogen gas | |
| in-bore oxygenator | developed in house | device responsible for pH and oxygen regulation in the perfusate | |
| Name | Company | Catalog Number | Comments |
| MR Imaging Hardware | |||
| Micro Surface Coil (200mm dia., modified) | Bruker Biospin | B6371/0001 | four-turn micro (200mm dia) surface-style radiofrequency coil |
| Micro 5 probe body | Bruker Biospin | Z3395 | microimaging probe used in the 600 MHz spectrometer |
| Micro 5 gradient coils | Bruker Biospin | M81111 | gradient coil stack used with micro 5 probe body |
| 600 MHz Spectrometer | Oxford Instruments | superconducting magnet (14.1T) used for MR image generation | |
| Imaging Console | Bruker Biospin | Avance III | support and control hardware including gradient amplifiers, preamps, & workstation used for MR image generation |
| Air Blower | Bruker Biospin | BCU-II, -80/60 | Air chiller unit used in conjunction with the probe's heating coil to regulate temperature inside the magnet bore |
| Gradient Chiller | Thermo Scientific | Neslab Merlin M33 | Water chiller used to disipate heat generated by the gradient coils |
Références
- Aguayo, J. B., Blackband, S. J., Schoeniger, J., Mattingly, M. A., Hintermann, M. Nuclear magnetic resonance imaging of a single cell. Nature. 322, 190-191 (1986).
- Schoeniger, J. S., Aiken, N., Hsu, E., Blackband, S. J. Relaxation-time and diffusion NMR microscopy of single neurons. J. Magn. Reson. B. 103, 261-273 (1994).
- Flint, J. J., et al. Magnetic resonance microscopy of mammalian neurons. Neuroimage. 46, 1037-1040 (2009).
- Flint, J. J., et al. Magnetic resonance microscopy of human and porcine neurons and cellular processes. Neuroimage. 60, 1404-1411 (2012).
- Kamman, R. L., Go, K. G., Stomp, G. P., Hulstaert, C. E., Berendsen, H. J. C. Changes of Relaxation times T1 and T2 in rat tissues after biopsy and fixation. Magn. Reson. Imag. 3, 245-250 (1985).
- Shepherd, T. M., Thelwall, P. E., Stanisz, G. J., Blackband, S. J. Aldehyde fixative solutions alter the water relaxation and diffusion properties of nervous tissue. Magn. Reson. Med. 62, 26-34 (2009).
- Massin, C., Boero, G., Vincent, F., Abenhaim, J., Besse, P. -. A., Popovic, R. S. High-Q factor RF planar microcoils for micro-scale NMR spectroscopy. Sensor. Actuat. A-Phys. 97, 280-288 (2002).
- Flint, J., Menon, K., Hansen, B., Forder, J., Blackband, S. J. A microperfusion and in-bore oxygenator system designed for magnetic resonance microscopy studies on living tissue explants. Sci. Rep. 5, 18095 (2015).
- Khong, Y. M., et al. Novel intra-tissue perfusion system for culturing thick liver tissue. Tissue Eng. 13 (9), 2345-2356 (2007).
- Schumacher, K., Khong, Y. -. M., Chang, S., Ni, J., Sun, W., Yu, H. Perfusion culture improves the maintenance of cultured liver tissue slices. Tissue Eng. 13 (1), 197-205 (2007).
- Shepherd, T. M., Blackband, S. J., Wirth, E. D. Simultaneous diffusion MRI measurements from multiple perfused rat hippocampal slices. Magn. Reson. Med. 48, 565-569 (2002).
- Henry, W. Experiments on the quantity of gases absorbed by water, at different temperatures, and under different pressures. Phil. Trans. R. Soc. Lond. 93, (1803).
- Bui, J. D., Buckley, D. L., Phillips, M. I., Blackband, S. J., Blümler, P., Blümich, B., Botto, R., Fukushima, E. Studies of perfused brain slices with MR microscopy. Spatially Resolved Magnetic Resonance. , 337-343 (1998).
- Moseley, M. E., et al. Early detection of regional cerebral ischemia in cats: Comparison of diffusion- and T2-weighted MRI and spectroscopy. Magn. Reson. Med. 14 (2), 330-346 (1990).
- Moseley, M. E., et al. Diffusion-weighted MR imaging of acute stroke: Correlation with T2-weighted and magnetic susceptibility-enhanced MR imaging in cats. Am. J. Neuroradiol. 11, 423-429 (1990).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon