Method Article
否定的な変奏曲染色電子顕微鏡検査方法: システムに挑戦に取り組むためのツール
Erratum Notice
要約
EM のネガティブ染色は高分子構造を可視化するための強力な技術が、さまざまな染色技術サンプル依存方法でさまざまな結果が生じます。ここでいくつかの否定的な染色方法、挑戦的なシステムの可視化に取り組むため初期ワークフローを提供するために詳しく説明します。
要約
ネガティブ染色電子顕微鏡検査 (EM) は、高分子及び高分子錯体の染色試薬を高めるコントラストを使用して比較的簡単かつ迅速な観察を可能します。18 〜 20 の最大解像度で限られている Å、ネガティブ染色 EM は、さまざまな生物学的問題に役立ち、クライオ電子顕微鏡法 (Cryoem) のサンプルを評価するための迅速な手段ともなります。ネガティブ染色ワークフローは直接的な方法;サンプルは、基板上に吸着し、汚れを適用、ブロット、乾燥粒子が埋め込まれた電子密度の高い染色の薄い層を生成します。個々 のサンプルはできます、しかし、変化する染色条件下で著しく異なる方法で動作します。これは多種多様な基板前処理技術、染色試薬、洗浄及びブロッディング ・ テクニック グリッド負の開発につながっています。それぞれの個々 のサンプルの最も適切な手法を決定するは、ケースバイ ケースに基づいて行う必要があります、顕微鏡使用の最高品質否定的な汚れの結果を達成するためにさまざまな技術のさまざまなアクセス必要があります。2 つ別下地調整方法の異なる 3 つのしみが付く技術詳細なプロトコルが提供され、使用方法によって著しく異なる結果を示すサンプルの例です。さらに、それぞれの使用に関する議論といくつかの共通の否定的な染色試薬と 2 つの新規ランタニド ベースの汚れの準備を説明します。
概要
解像度に最近注意にもかかわらず強力な手法と電子とツールボックスの重要なコンポーネントに EM ままに染色クライオ電子顕微鏡1 (Cryoem)、負の著しい進歩がもたらす革命。クライオ グリッド条件2を最適化する前に、サンプルの迅速な評価に最適な方法はまだ否定的な汚損します。高コントラストと負のステンド グラス サンプル調製されたグリッドの速度はそれにサンプル純度、濃度、コンフォーメーション柔軟性3の不均一性を評価するための理想。多くの有益な生物学的構造に起因したテクニックの解像度 〜 18 Å 分解能4,5,6に限定されているにもかかわらず、否定的な汚れの再建といくつかのサンプルは、良い結果をもたらすさまざまな理由から7の Cryoem より染色で
EM のネガティブ染色に興味の粒子は EM グリッドの表面に吸着、電子密度の高い染色化合物の非晶質マトリックスに包まれています。背景とされて周囲の汚れ8よりも少ないの電子密な粒子、興味の粒子の相対的なハイコントラストが生成されます。粒子より多くの電子を散乱し、暗く密な周囲の汚れを基準にして低電子散乱力のため明るい領域として表示されます。粒子の微視的組織の機能は、汚れは任意の隙間に浸透し、不規則なコントラスト詳細9を生成結果画像の詳細な検討から推測することができます。
否定的な汚損プロセス サンプル粒子をキャプチャがサポート基板の作製とサポートされている乾燥汚れの層から始まります。最も一般的に使用される支持基板は、時々 ポリ (例えばホルムバール) または硝酸セルロース (例えばコロジオン) ポリマーの薄い層によって支持された、非晶質炭素の層です。これらの基板は、市販または社内以下のプロトコルを使用して準備できます。
支持基板を準備した後サンプルを適用することができますと余分なソリューションを消されました。サンプルは、ネガティブ染色法の適切なバッファーで中断する必要があります。リン酸バッファーおよび供試体を隠すことが結晶の析出物を生じさせることができる高い塩の集中の使用を回避することをお勧めします。還元剤や洗剤、スクロース、グリセリン、ヌクレオチドの高濃度も避けなければならない汚れ品質4にも影響を与える。水と EM グリッドの表面を洗浄バッファー組成を変更ことはできませんまたは吸着後と前の染色により適切なバッファーを削減可能性がありますバッファーの形成関連する成果物と一般に染色背景を改善します。場合はバッファーのアーティファクトが疑われ、染色バッファー成分観測成果物のソースであるかを決定するためのバッファー専用グリッドを形成できます。
サンプルは、吸着し消され、必要ならば洗浄、染色試薬が適用されます。効果的な否定的な汚れ (表 1) であること様々 な試薬が発見されているが、サンプルに合わせて汚れを選択する必要があります。「ハロー」汚れ形態の粒子の周辺汚れ分子変位による疎水性領域でタンパク質として反発のグループの追加料金。したがって、染色は、蛋白質の潜在的な請求グループのプロトン化状態が同じ作業 ph 染色するように選ばれなければなりません。反対の蛋白質の表面の電荷は肯定的な染色に貢献できる効果は、独自の右の10の有用なテクニックで本稿の範囲ではありませんが。最も一般的に使用される否定的な染色試薬は、酢酸ウランとウラニル ギ酸です。これらの汚れがある比較的微細結晶粒 (4-5 Å)9リン酸化タングステン (8-9 Å 粒)9,11、アンモニウム モリブデン酸11、いくつかなどの他の汚れをより高い解像度の画像を提供してランタン ベース12 をを汚れ。ミリ秒時間スケール13日に多くのタンパク質間相互作用を維持する染色とその傾向に生理的 pH で沈殿するの pH が低い可能性がありますいくつかのサンプル14 にとって有害であるが、定着剤として酢酸ウランとギ酸も行為します。.そのユーティリティにもかかわらずウラニル塩も課題が物流として彼らは有毒と軽度放射性必要になる特別な取扱い、保管、および処分の要件は、非放射性の選択肢を求めるいくつかのユーザーをリードします。
多種多様な基板作製、サンプル アプリケーションの説明し、EM グリッドの染色方法があります。使用する最も適切な方法は、サンプル依存で新しいシステムに取り組む場合に確認することは困難。この原稿は、基板の準備の 2 つの方法と 3 つのしみが付く方法について説明します。側にしみが付くこと、打つ5、および急速な15のフラッシュします。側しみが付くことは、説明する方法の最も簡単です。打つ方法と急速なフラッシュ メソッドは実装しますが、固定する前にフィルムをサンプルの接触時間を制限し、いくつかのサンプル5の染色アイテムの形成を改善するために示されているより難しい。本稿の目的は、否定的な汚れの EM による挑戦的なシステムの可視化に取り組むため初期ワークフローを提供します。
プロトコル
1. EM グリッドの準備
- 炭素シート法
- 新たに裂かれた雲母シートを準備します。
- 優しく雲母シート、層の間に数 mm の一角に精度注射針またはかみそりの刃を挿入します。2 枚の約等しい厚さを生成することが可能としてシートの縦方向の中央に近いとしてツールを挿入します。
- 慎重に叫ぶ離れて雲母シートの 2 つの半分。目、または解剖顕微鏡の下で、このことができますを行います。
- 新しく劈開雲母シートのそれぞれのコーナーの 1 つを切った。シートは、真空のリリース時にカーボン蒸発器で引っくり返る、イベントでシートの被覆炭素側が識別できます。
- 新鮮な切断面でカーボン蒸発の部屋に劈開雲母シート/s を配置します。
- カーボン蒸発器適切に準備の炭素電極を正しくセットアップされていることを確認します。
注: 炭素棒の準備の方法はカーボン蒸発器の仕様によって異なります。1.1.5 のステップまで 1 つの楽器のためのプロトコルのとおりです。- 鋭い先端を持っていると、任意の大まかなバリを除去する紙タオルで磨いて削りで炭素棒を削る。
- 細かいサンドペーパーを使用して 2 番目のロッドの端を平らにし、再びそれを滑らかな紙タオルで磨きます。
- 製造元の指示に従って蒸発器に 2 つの炭素棒を配置します。最初のロッドの削られた端になります 2 番目のロッドの平面的な顔をして会社に連絡を確認します。
- カーボン膜厚は視覚的に判断するつもりなら、雲母の下で部分的にきれいな、乾燥のフィルター紙の小片を置きます。また、炭素の膜厚を測定するマイカと一緒に真空グリースの小さな軽打と白い霜で覆われた顕微鏡スライドを配置します。
- 製造元の指示に従って雲母上への炭素を入金します。
- 真空をポンプダウンし、それは 10-5 mbar まで待ちます。電極の電圧 4.0 V を設定 (5 V まで炭素棒ソースによって必要があります)。
- 約 3.5 の複数の短いパルスを実行マイカ表面の炭素の 1-2 nm 厚い蒸発を入金する電極を通じて期間で s。
: 注それは赤く、白いの炭素棒に電流を流します。あなたの目が損傷する恐れが、明るい光でたりしないでください。 - カーボン蒸発器の厚さ計またはフィルター ペーパーまたは顕微鏡スライド上に堆積カーボン目視による測定を所望の厚さに達するまでマイカに入金する炭素を許可します。最終的な炭素層が 5-10 nm の厚さであることを確認します。
- カーボンの厚みは視覚的に正確に測る場合露出部に真空グリースをコーティングした顕微鏡スライドのつや消し部分を比較、多くの炭素を蒸着すると暗くなります。
注: このメソッドを使用する場合、カーボンの厚さを決定する定量的な方法はありません。
- カーボンの厚みは視覚的に正確に測る場合露出部に真空グリースをコーティングした顕微鏡スライドのつや消し部分を比較、多くの炭素を蒸着すると暗くなります。
- 真空チャンバーを発散し、カーボン蒸発器から炭素被覆雲母を削除します。
注: 以降の手順に進む前に一晩を解決する炭素被覆雲母を残すことができます。 - EM グリッド上にカーボン フィルムをフロートを使って、2 つの水の容器の 1 つ: 底水が流出することができますので、カーボン層の排水弁が付いている容器を待っているグリッドまたはグリッドは、水の下に設定できるリフティング リグに下げた表面は、水の表面に炭素膜までグリッドをその後に発生することができます。
- 純水蒸留して水の表面が約 5 mm 上からコンテナーを埋めます。任意の浮遊粒子状物質を除去するサーフェス上のシートまたは 2 つのレンズの組織をドラッグして水の表面をきれいにします。
- きれいなステンレス メッシュの部分を配置 (2.5 インチで 1 インチは適切なサイズ) 水の表面の下。
- 高級ピンセットのペアを使用して、清潔で乾燥した EM グリッドに表向きに (メーカーの説明) によるとステンレス製メッシュが横たわっていた。一緒に、できるだけしっかりとグリッドをパックが重なり合うことはありません。
- グリッドを配置すると、一度は、ピンセットやトングを開発するフィルムのペアの炭素被覆雲母シートをしっかりとつかみます。
- 水の中に雲母シートをご紹介します。これは非常に浅い角度 (~ 10 度) で行われますを確認します。
注: マイカが水面を突破し、水没、炭素膜が、雲母から分離し、水面に浮くしながら。損傷や汚染を防止し、グリッド上に直接この手順を実行できませんする必要があります。- 雲母シートから分離しないカーボン フィルム意志の可能性を最小限に抑えるためにかみそりの刃で雲母シートの端のまわりのスコア、または水の中にそれを導入する前に小さなはさみで 1 つの角を切断します。
- 炭素膜が切り離されると、一度雲母シートを削除するか、容器の底に落ちること。
- 微細先端ピンセットを使用して、非常に穏やかな圧力を適用し、ゆっくりとした動きで、グリッドの上にカーボン フィルムをガイドします。
- ゆっくりと水を排水や使用器具の種類によって、リフティングのリングを引き上げによるグリッドのいずれかの表面と接触してカーボン シートを持参します。
- いくつかの余分な水をろ紙の部分を使用して装置と芯先から (今のカーボン被覆グリッド) ステンレス製メッシュを持ち上げ。これは、ステンレス スチールのメッシュの非常に端に濾紙に触れるが、グリッドまたは炭素膜と接触して来ていないによってを確認します。
- 乾燥ろ紙片を含むペトリ皿内グリッドのメッシュを置き、それを完全に乾燥できます。
注: これは最高室温で一晩乾燥によって影響を受けるが、約 60 ° C のオーブンでグリッドを配置することによって、ステップを繰り上げることができます。
- 新たに裂かれた雲母シートを準備します。
- フロート コート (直接炭素析出)。このメソッドは、以前詳細に記載されている16
- メニスカスを上部に形成するので、蒸留水であふれんばかりにきれいな大きなガラスのボウルがいっぱい。
- きれいなパスツール ピペットを使用して水の表面にコロジオン液 (酢酸アミル、硝酸セルロース) の一滴を適用、広げるし、完全に乾燥する液滴を許可します。一度乾燥、水面上に浮いてコロジオンの薄層が表示されます。
- そっとつまようじを使用して水の表面からほこりや他の汚染を削除するコロジオン ・ レイヤーを削除します。
- 水に 2 番目のコロジオン ・液滴を適用し、2 〜 3 分乾燥で広がることができます。
メモ: は、コロジオンのフラットやしわ無料シートが得られるまで、手順 1.2.3-1.2.4 を繰り返します。 - フローティング コロジオン ・ シートに高級ピンセット場所 EM グリッドを (製造業者の記述) によると下向きのペアを使用してください。六角形の配列でグリッドをしっかりと一緒にパックしますが、重なり合うことはありません。
注: グリッドを紛失、または逆さまに配置する場合、一般的に最高の場所ではなく、それを移動しようとしたときコロジオン ・ シートの損傷リスクのそれを残してです。 - すべてのグリッドが配置される、優しく上にろ紙のシートを置きます。毛管作用によって飽和状態になるように、用紙を許可します。
注: 任意のサイズや紙の厚さ、グリッドに完全に対応する場合に適しています。 - つまようじを使用すると、フィルター ペーパーを超えたコロジオン ・ フィルムを削除できます。
- グリップの端にろ紙と水面から皮をむきます。
注: グリッドが紙に付着にとどまるべきであります。 - ペトリ皿の上フラット紙とコロジオン ・顔に置き、完全に乾くことができます。
- 1.1.2 に示すとおり適切に準備炭素電極と炭素の蒸発器の部屋でグリッドをフィルター ペーパーの場所。
- 炭素シート法のとおり炭素蒸着手順に従います
- 過熱し、硝酸セルロース シートの損傷を避けるためにパルス間数秒を待ちます。
注: この手順はほとんど必要ありませんが、グリッドはコーティング、カーボンにした後ポリマー層を削除することができます希望する場合。新鮮なフィルター紙に上グリッド炭素側に置き、近く、紙の上ではなく、グリッドにアセトンを数滴を置きます。グリッドの下に広がる、溶解し、吸収ポリマー層にアセトンを許可します。
2. 否定的な汚損試薬の調製
-
酢酸ウランの準備
- 少量の純水を沸騰させるが、徹底的にドガを 10 分間沸騰させるようにし、なさい。わずかに冷却するそれを許可し、005. (UA) 1-2% (w/v) を溶解する使用します。
注: シリカフューム戸棚に、適切な個人用保護具とは、この手順を実行します。 - ソリューションが冷却した後は、0.2 μ m シリンジ フィルター、フィルター ペーパー フィルターします。
- 4 ° C、光から保護されている UA を格納します。ソリューションは、1 年間安定です。
- 少量の純水を沸騰させるが、徹底的にドガを 10 分間沸騰させるようにし、なさい。わずかに冷却するそれを許可し、005. (UA) 1-2% (w/v) を溶解する使用します。
-
粉からウラニル ギ酸の準備。このメソッドは、以前に詳細に記載されている8
- 攪拌による (ステップ 2.1.1) のようにゆで脱純水 2 mL に 20 mg ウラニル ギ酸 (UF) 粉を溶解します。
- かき混ぜ、5 M NaOH の 8 μ L を追加しながら、ソリューションを暗い黄色に変更する必要がありますが、沈殿物を形成する必要があります。
- 0.2 μ m のシリンジ フィルターを通してソリューションをフィルターします。
- ストア UF 汚れを光から保護します。汚れが沈殿物または茶色の変色場合破棄が観察されます。ソリューションは 1-2 日のみ安定です。
-
酢酸ウランからウラン ギ酸の準備
- 1 M NaOH の 100 μ L を追加することで 1 mL の 1% (w/v) UA 汚れを沈殿させます。
- ベンチトップ遠心分離機で最大速度で 2 分間混合物を遠心分離機します。
- 任意の上澄みを廃棄し、積極的なボルテックス沈殿物の 5% (v/v) ギ酸の 100 μ L に溶解しにくい。
- 0.5% (v/v) ギ酸の UF 汚れを屈する 900 μ L 純水を 1 mL の最終巻に希釈します。
- ストア UF 汚れを光から保護します。任意の沈殿物または茶色の変色を観察する場合は、汚れを破棄します。
-
その他の染色試薬の調製
-
ランタノイド酢酸汚れの準備
- エルビウム酢酸 (ErAc) ツリウム (TmAc)、酢酸や酢酸ガドリニウム (GdAc) 酢酸サマリウム (SmAc) を純水で 1-2% (w/v) で溶解します。
注: サンプルは、これらの汚れを使用すると、肯定的な汚れるか、またはグリッドは服薬アドヒアランス不良を表示する場合、彼らできることで酸性化した 0.5% (v/v) ギ酸。白のハローに囲まれて暗いオブジェクトとして表示されるサンプルの結果陽性。服薬アドヒアランス不良グリッドは、グリッドに観察される期待されるよりも少ない分子になります。
- エルビウム酢酸 (ErAc) ツリウム (TmAc)、酢酸や酢酸ガドリニウム (GdAc) 酢酸サマリウム (SmAc) を純水で 1-2% (w/v) で溶解します。
-
モリブデン酸アンモニウム、ナトリウムりんタングステン酸の調製
- 純水で 1-3% (w/v) で汚れを溶解します。必要な場合、5 M NaOH を使用して 7.0 に pH を調整します。
-
ランタノイド酢酸汚れの準備
3. 吸着炭素サンプル基板と染色
-
親水性にレンダリングしてサンプル アプリケーション グリッド表面の創製
- グロー放電ユニットの顕微鏡スライドの上を向いてグリッドを配置します。
- 30 の最小値のためのグリッドを扱う s 10 mA。
注: 正確なグロー放電法が使用される機器の特定の部分の仕様によって異なります。 - またこれは卓上型 UV ランプ4を使用して 10 分間 UV 照射によって達成することがあります。
-
サイドしみが付く方法。このメソッドは、以前に詳細に記載されている8
- 負圧ピンセットのペアを持つグリッドの端を握り、3-5 μ L のサンプルを支持面に適用します。
- 10 グリッド表面に吸着するサンプルを許可する 1 分最適化に s 吸着時間は、個々 のサンプルの必要があります。
- フィルター紙のシートにグリッドの端に触れるし、毛細管液体をオフをプルするを許可します。
- 省略可能: グリッドを洗います。純水または実験フィルムのシートに適切な揮発性緩衝液の場所 50 μ L が値下がりしました。優しくドロップ、グリッドの炭素表面に触れるし、グリッドの表面に小さな液滴を持ち上げます。フィルター紙のシートにグリッドの端に触れるし、毛細管液体をオフをプルするを許可します。
- 必要な回数だけこのステップを繰り返します。
- 染色試薬研究所フィルムのシート上の場所 2 つの 50 μ L が値下がりしました。
- 優しくドロップ、グリッドの炭素表面に触れるし、グリッドの上面に小さな液滴を持ち上げます。
注: 染色に移行した場合は、グリッド、グリッドの背面を破棄しなければなりません。 - 毛細管液体をオフに描画ができ、フィルター紙のシートにグリッドの端をタッチします。この染色の手順を 2 回実行します。
- 乾燥や白熱灯の下で乾燥空気にグリッドを許可します。
-
打つ方法
- 負圧ピンセットのペアを持つグリッドの端を握り、3-5 μ L のサンプルを支持面に適用します。
- グリッドの角度を約 45 ° の向こう向きで、片方の手でピンセットを持ち、急速に 'を弾き飛ばす' グリッドの上には、液滴の大半その手の手首をフリックします。
- オプション: ガラス パスツール ピペットを使用して支持面に洗浄溶液の一滴を適用し、'' 3.2.2 のようにフリックをオフ。必要に応じて繰り返します。
- ガラス パスツール ピペットを使用して染色試薬の支持面の適用ドロップと '映画オフ' 3.2.2 のように。供試体の可視化に必要な染色深さに依存して 1 〜 3 回繰り返します。
注: これは最終的な汚れの深さに属性唯一の要因ではない (ディスカッションを参照してください)。 - 余分な汚れを削除するには、グリッドの端にフィルター紙の破れたエッジに触れます。
- 乾燥や白熱灯の下で乾燥空気にグリッドを許可します。
-
急速なフラッシュ法
- 汚れの 30-70 μ L を描画 (1% 通常の UA を使用) 200 μ L ピペットの先端に空気の 5 μ L を描画し、必要な別の小さな空隙が続くし、5 μ L のサンプルを描画する場合の洗浄/混合試薬 (5-30 μ L)、策定するボリューム ダイヤルを回します。
- グリップ、グリッドの研究から離れて直面して約 45 ° で角度がピンセットを持って負圧ピンセットのペアを持つグリッドの端は、炭素コーティング EM グリッドの顔にピペット チップの全体の内容を取り出します。
- 余分な汚れを削除するには、グリッドの端にフィルター紙の破れたエッジに触れます。
- 乾燥や白熱灯の下で乾燥空気にグリッドを許可します。
注意: すべてのメソッドに対して勧め鉗子、鉗子の顎に乾燥したグリッドを引くことができますがの 2 つの側面間に閉じ込められたソリューションを削除このグリッドに到達するまで引き裂かれたエッジに沿って鉗子フィルター紙のシートをスライドするには 開設。ピンセットでグリッドは、乾燥するヒューム フードの端にも配置できます。一定の空気の流れは、生産量を増やす助けることができる染色も。
結果
最大コントラストとシャープな最も詳細な粒子でサンプルを産するフロリダ大学をある程度否定的な汚損はすべてテスト染色試薬の製造。深く埋め込まれたサンプル (図 1) によるランタノイド汚れは選句と TmAc 生産 UA 知覚対比とステンド グラスの粒子の鋭さによって判断されるように同等の品質の否定的な汚損、TmAc 生産明確より鮮明な画像選句よりします。17はまだの子午面層ラインと目がはっきりと見える TmAc の大きな粒が高倍率で明らかになるタバコ モザイク ウイルス (TMV) 粒子は、TmAc 〜 23 Å 繰り返す TMV 粒子の 1% で染色したときが、Raw 画像のフーリエ変換。他ランタノイドの汚れのテスト、選句、SmAc、または GdAc、どれもはこの機能を解決することができた。クラス平均は、ヘリカルの繰り返しが見えて TMV 粒子から重複する線分を抽出して生成しました。抽出されたセグメントは、一直線に並んだし、カラードプラ18を使用して定期的な機能 (図 2) を見やすく分類します。
いくつかのサンプルは、筋肉派生 C 蛋白など染色法に特に敏感です。Ig と Fn のようなドメインのある柔軟な文字列で構成され、C-蛋白質は負染色 EM 染色に使用される (図 3) のメソッドに依存して大幅に異なる画像を生成します。崩壊側しみが付くメソッドを使用して文字列にビーズのようなドメインのシリーズとして C 蛋白を認めに急速なフラッシュまたはメソッドにフリックによって汚されたとき、リングのような構造が観察されます。
| 試薬 | 濃度 | pH | タイプ |
| モリブデン酸アンモニウム | 1-2% | 5-7 | アニオン性 |
| エルビウム酢酸 (ErAc) | 1-2% | 6 | カチオン性 |
| 酢酸ガドリニウム (GdAc) | 1-2% | 6 | カチオン性 |
| メチルアミン タングステン酸 | 2% | 6-7 | アニオン性 |
| 酢酸サマリウム (農水省) | 1% | 6 | カチオン性 |
| ナトリウム silicotungstate | 1-5% | 5-8 | アニオン性 |
| りんタングステン酸ナトリウム | 1-3% | 5-8 | アニオン性 |
| ツリウム酢酸 (TmAc) | 1-2% | 6 | カチオン性 |
| 酢酸ウラニル (UA) | 1-3% | 3-4 | カチオン性 |
| ギ酸ウラニル (UF) | 0.75-1% | 3-4 | カチオン性 |
表 1: 一般的な負染色試薬です。

図 1: タバコ モザイク ウイルスの例顕微鏡様々 なネガティブ染色試薬で染色(A) 1 %uf (B) 2.5 %tmac (C) 2.5% 選句。(D) 1 %ua (E) 2.5% (F)と GdAc 2.5 %smac。スケール バーは、100 nm。あたりをイメージの複数の領域と複数の複製から代表的なイメージ。この図の拡大版を表示するのにはここをクリックしてください。

図 2: ツリウム アセテート染色タバコ モザイク ウイルス(A) TMV の顕微鏡写真からの高倍率に染まった 1 %tmac。スケール バーは 20 nm。(B)は、抽出された TMV セグメントの平均をクラスします。(C) 〜 23 でパネルを示す層線反射で画像のフーリエ Åこの図の拡大版を表示するにはここをクリックしてください。 。
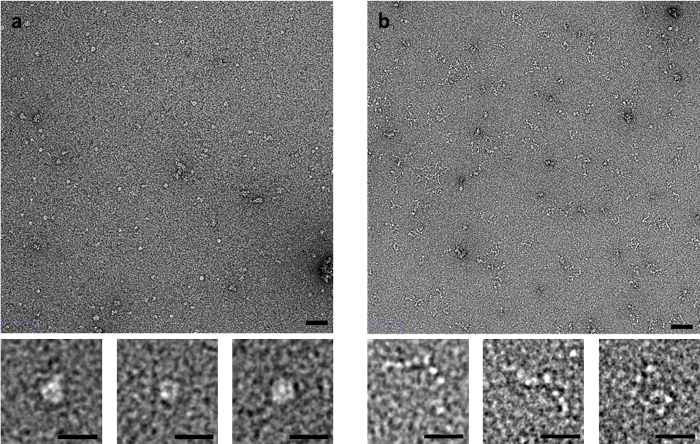
図 3: C 蛋白質のコンフォメーションにメソッドにしみが付く効果。(A) C 蛋白染色 UA 側のしみ方法と(B)打つ法を用いたします。上側のパネルをスケール バーは 50 nm、下部パネル スケール バーは 20 nm。あたりをイメージの複数の領域と複数の複製から代表的なイメージ。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
本稿では、染色試薬、2 つの新規ランタニド試薬 (TmAc と ErAc) を含むさまざまな電子顕微鏡観察用試料の否定的な汚損のための複数の方法について説明します。否定的な汚損プロセスの手順の多くは、汚れ、量の場合は、必要な洗浄としみが付く技術の選択を含む個々 のサンプルの最適化されなければなりません。この原稿は、したがってと挑戦的なシステムの否定的な汚損に対処するため、独自のワークフローを開発するための基礎を提供します。
染色の選択は、高い依存のサンプルです。特に低 pH に敏感なサンプルは、これらの汚れ19の定着性の性質にもかかわらず UA および/または UF、低下可能性があります。これらのケースでは、ランタノイドは、TmAc や選句をより適切かもしれないが、準備の全体の pH は肯定的な染色を防ぐためにサンプルの蛋白質の等電点以下にしなければなりませんように汚れをベースしました。これは、必要に応じて酢酸で汚れを酸性化によって実現できます。特に低 pH 敏感なサンプル、アニオン性のタングステンやモリブデン酸の汚れがより効果的な場合があります。ただし、これらの汚れは、いくつかのケースで成果物の形成を誘導するために発見されている、ようリポタンパク質の連銭形成は20をサンプリングします。もう一度、汚れの pH は、肯定的な汚損を防ぐために、サンプルの等電ポイントの上にこの時間を調整する必要があります。
汚れる前にサンプルの洗浄に高い塩やリン酸部分がバッファーが標本は維持される場合は必要があります。多くの場合、超純水で洗浄を実行できるが低下または単独で水に露出されたとき、構造変化より敏感なサンプル洗浄低イオン強度8の揮発性バッファーを使用して実行する必要があります。慎重に制御条件下でも洗濯は炭素表面21のいくつかの構造の転位で起因できます。
グリッドはしみが付くことおよび染色サンプル吸着面で準備する方法にも大きく影響が観察されるものです。最も適切な方法は、したがって、再度、高いサンプル依存。C-蛋白質などが次側しみ染色、球状リングのような構造として観察されるが、明らかに打つメソッド (または急速なフラッシュ メソッドによって)、グリッドが準備されるとき、これは染色プロセスの成果物に表示されます (図 3).素早く動かすと急速なフラッシュ メソッドで、サンプルが、炭素との対話時間固定の前に、の支持面は、最小15です。サンプルはまた固定前にしみが付くことによって後退メニスカスからより少ない力を経験します。これは長時間吸収時にカーボン フィルムまたは毛管作用によって発生する供試体の構造変化が最小化されたことを意味します。急速なフラッシュ法は試料の時間分解解析の使用もできます。サンプルはリガンドまたは一連のピペット チップ内の添加剤と混合することができます固定のミリ秒以内前に、グリッド表面にアプリケーションをグリッドまたは一瞬前に、の時間の期間。
特定の試験片の最適な画像は再度サンプル依存2を提供するために必要な染色の深さ。電子ビームによる汚れがあまりにも浅い場合、分子を損なうことができるが、汚れがあまりにも厚い構造の機能が失われる場合します。汚れの深さは ta グリッド、汚れはしみ、しみが付くことの程度と時間前にグリッドとの接触時間の長さに適用される汚れの量、カーボン層の均一性グリッドの表面の親水性など複数の要因によって影響を受けるkes グリッドを完全に乾燥。グリッドは、その全体にわたって染色の均一な配分を必要がない、したがってイメージングに適したグリッドの領域を慎重に選択する必要があります。確かに、グリッドは、しばしば同じ条件下で同じ日に準備も品質が異なります。バージェスによるイメージングを提供するために染色の深さの変化が分子と適切な染色深さの外観に影響の良い例ら5 。
にもかかわらず否定的な汚損されて非常に汎用性の高い、迅速、かつ簡単な方法、すべての生物学的標本はこのメソッドの可視化に適しています。壊れやすいアセンブリは崩壊したり、汚れるか、または EM グリッド22乾燥を吸着、分解します。否定的な汚損を行うと、分子の平坦化につながる、そのカーボン サポート フィルム7分子の配向を誘発することができますも。
否定的な汚れは低温電子顕微鏡解析の前にも独自の権利で標本の評価のための貴重なツールが、サンプルは、プロセス中に発生した物理的な力の多くは不完全に理解されます。したがって、使用する最善の方法高依存のサンプルは、固定のプロトコルに従って教えではなく、試行錯誤で決定する必要があります。
開示事項
著者は競合する金銭的な利益を宣言しません。
謝辞
有用な議論と原稿の批判的検討のためのピーターの騎士に非常に感謝しております。ニール ・ ランソン、スティーブン Muench のラボと役に立つ議論のためアストベリー Biostructure 研究室のスタッフのメンバーのすべてに感謝したいと思います。この仕事欧州研究評議会 (FP7/2007-2013) によって資金が供給された ERC 許諾契約 322408/。C 蛋白は、英国心臓財団助成 (BHF PG/13/83/30485) によって提供されるリソースを使用して製作されました。また、リーズ (090932/Z/09/Z と 094232/Z/10/Z) の電子顕微鏡観察をサポートするための資金調達用 Wellcome の信頼を感謝いたします。CS は Wellcome の信頼 ISSF 助成金によって資金を供給します。
資料
| Name | Company | Catalog Number | Comments |
| 200 mesh copper EM grids | Sigma-Aldrich | G4776-1VL | Other materials and/or mesh sizes can also be used |
| Ammonium Molybdate | Sigma-Aldrich | 277908 | |
| Carbon evaporator | Ted Pella Inc. | 9620 | Cressington 208 or equivalent |
| Collodion solution 2% in amyl acetate | Sigma-Aldrich | 9817 | |
| Dumont #5 negative pressure tweezers | World Precision Instruments | 501202 | Or other tweezers as preferred |
| Erbium Acetate | Sigma-Aldrich | 325570 | |
| Gadolinium Acetate | Sigma-Aldrich | 325678 | |
| Mica Sheets. 75x25x0.15mm. | AGAR Scientific | AGG250-1 | |
| Microscope slides, white frosted | Fisher Scientific | 12607976 | Or equivalent |
| Parafilm | Fisher Scientific | 10018130 | Or equivalent |
| Pasteur pipette (glass) | Fisher Scientific | 10343663 | Or equivalent |
| Razor blade | Fisher Scientific | 11904325 | Or equivalent |
| Sandpaper | Hardware store | Wet and dry sandpaper with grit finer that 200 (600 suggested) | |
| Samarium Acetate | Sigma-Aldrich | 325872 | |
| Sodium Hydroxide | Sigma-Aldrich | 1.06462 | |
| Sodium Phosphotungstate | Sigma-Aldrich | P6395 | |
| Stainless Steel Mesh, 150x150 mm (cut to size). | AGAR Scientific | AGG252 | |
| Thulium Acetate | Sigma-Aldrich | 367702 | |
| Two Step Carbon Rod Sharper, for 1/4" rods | Ted Pella Inc. | 57-10 | Or equivalent for carbon evaporator used |
| Ultra pure water | |||
| Uranyl Acetate | Electron Microscopy Sciences | 22400 | |
| Uranyl Formate | Electron Microscopy Sciences | 22450 | |
| Vacuum grease | Fisher Scientific | 12719406 | Or equivalent |
| Whatman #1 Filter paper. | Fisher Scientific | 1001 090 | Or equivalent |
| Whatman #40 filter paper | Fisher Scientific | 10674122 | Or equivalent |
参考文献
- Merk, A., et al. Breaking Cryo-EM Resolution Barriers to Facilitate Drug Discovery. Cell. 165 (7), 1698-1707 (2016).
- De Carlo, S., Harris, J. R. Negative staining and cryo-negative staining of macromolecules and viruses for TEM. Micron. 42 (2), 117-131 (2011).
- Thompson, R. F., Walker, M., Siebert, C. A., Muench, S. P., Ranson, N. A. An introduction to sample preparation and imaging by cryo-electron microscopy for structural biology. Methods. 100, 3-15 (2016).
- Ha, J. Y., et al. Molecular architecture of the complete COG tethering complex. Nat Struct Mol Biol. 23 (8), 758-760 (2016).
- Burgess, S. A., Walker, M. L., Thirumurugan, K., Trinick, J., Knight, P. J. Use of negative stain and single-particle image processing to explore dynamic properties of flexible macromolecules. J Struct Biol. 147 (3), 247-258 (2004).
- Fabre, L., Bao, H., Innes, J., Duong, F., Rouiller, I. Negative-stain single particle EM of the maltose transporter in nanodiscs reveals asymmetric closure of MalK2 and catalytic roles of ATP, MalE and maltose. J Biol Chem. , (2017).
- Zhang, L., et al. An optimized negative-staining protocol of electron microscopy for apoE4 POPC lipoprotein. J Lipid Res. 51 (5), 1228-1236 (2010).
- Ohi, M., Li, Y., Cheng, Y., Walz, T. Negative Staining and Image Classification - Powerful Tools in Modern Electron Microscopy. Biol Proced Online. 6 (1), 23-34 (2004).
- Haschemeyer, R. H., Myers, R. J. . Negative Staining in Principles and Techniques of Electron Microscopy. 2, 101-147 (1972).
- Massover, W. H. Positive staining of protein molecules for electron microscopy: polyiodination of the apoferritin shell in ferritin. Ultramicroscopy. 52, 383-387 (1993).
- Harris, J. R., Bhella, D., Adrian, M. Recent Developments in Negative Staining for Transmission Electron Microscopy. Microsc Microanal. 20, 17-21 (2006).
- Hosogi, N., Nishioka, H., Nakakoshi, M. Evaluation of lanthanide salts as alternative stains to uranyl acetate. Microscopy (Oxf). 64 (6), 429-435 (2015).
- Zhao, F., Craig, R. Capturing time-resolved changes in molecular structure by negative staining. J Struct Biol. 141, 43-52 (2003).
- Cao, B., Xu, H., Mao, C. Transmission electron microscopy as a tool to image bioinorganic nanohybrids: the case of phage-gold nanocomposites. Microsc Res Tech. 74 (7), 627-635 (2011).
- Imai, H., et al. Direct observation shows superposition and large scale flexibility within cytoplasmic dynein motors moving along microtubules. Nat Commun. 6, 8179 (2015).
- Booth, D. S., Avila-Sakar, A., Cheng, Y. Visualizing proteins and macromolecular complexes by negative stain EM: from grid preparation to image acquisition. J Vis Exp. (58), (2011).
- Kendall, A., McDonald, M., Stubbs, G. Precise determination of the helical repeat of tobacco mosaic virus. Virology. 369 (1), 226-227 (2007).
- Scheres, S. H. A Bayesian view on cryo-EM structure determination. J. Mol. Bio. 415 (2), 406-418 (2012).
- Bremer, A., Henn, C., Engel, A., Baumeister, W., Aebi, U. Has negative staining still a place in biomacromolecular electron microscopy?. Ultramicroscopy. 46, 85-111 (1992).
- Garewal, M., Zhang, L., Ren, G., Kleinschmidt, J. . Lipid-Protein Interactions. Methods Mol Biol (Methods and Protocols). 974, 111-118 (2012).
- Walker, M. L., et al. Two-headed binding of a processive myosin to F-actin. Nature. 405 (6788), 804-807 (2000).
- Orlova, E. V., Saibil, H. R. Structural Analysis of Macromolecular Assemblies by Electron Microscopy. Chem Rev. 111 (12), 7710-7748 (2011).
Erratum
Formal Correction: Erratum: Variations on Negative Stain Electron Microscopy Methods: Tools for Tackling Challenging Systems
Posted by JoVE Editors on 1/30/2020. Citeable Link.
An erratum was issued for: Variations on Negative Stain Electron Microscopy Methods: Tools for Tackling Challenging Systems. An author name was updated.
One of the authors' names was corrected from:
Matthew G. Iadaza
to:
Matthew G. Iadanza
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved