Method Article
Вариации на отрицательной пятно методы электронной микроскопии: инструменты для решения сложных систем
В этой статье
Erratum Notice
Резюме
Отрицательный пятно EM – это мощный метод для визуализации макромолекулярной структуры, но различные методы окраски может производить различные результаты образца зависимым образом. Здесь несколько негативных подходов окрашивание подробно описаны в предоставить первоначальный рабочий процесс для решения визуализации сложных систем.
Аннотация
Отрицательный пятно электронной микроскопии (EM) позволяет относительно простой и быстрый наблюдения макромолекул и макромолекулярных комплексов с помощью контраста, повышение пятно реагента. Хотя в резолюции максимум ~ 18-20 Å, отрицательные пятно EM является полезным для целого ряда биологических проблем и также обеспечивает быстрое средством оценки образцов для крио электронной микроскопии (крио EM). Отрицательный пятно рабочий процесс является простым способом; Образец адсорбированные на подложке, а затем применяется, смыл и сушеные производить тонкий слой электронно плотной пятно, в котором частицы внедряются пятно. Отдельные образцы могут однако, ведут себя заметно различными способами в различных условиях окрашивание. Это привело к развитию большое разнообразие методов подготовки субстрата, отрицательные окрашивание реагентов и сетка стиральная и blotting методы. Определение наиболее подходящего метода для каждого индивидуального образца должно быть сделано на основе case-by-case и микроскописта должны иметь доступ к целому ряду различных методов для достижения высочайшего качества негативные пятно результатов. Предоставляются подробные протоколы для двух методов подготовки различных субстрата и три различных blotting методы, и приведен пример пример, который показывает заметно разные результаты в зависимости от используемого метода. Кроме того подготовка некоторых общих негативных окрашивание реагентов и два Роман на основе лантаноиды пятна, описан с обсуждения относительно использования каждого из них.
Введение
Несмотря на недавние внимание к резолюции революция, в результате значительных достижений в крио электронная микроскопия1 (крио ЭМ), отрицательные пятно EM остается мощной техникой и важнейшим компонентом электрон microscopists элементов. Отрицательный окрашивание по-прежнему лучший метод для быстрой оценки до оптимизации условий крио сетка2образца. Высокая контрастность и скорость подготовки сетки негативное витражные образцов делает его идеальным для оценки чистоты образца, концентрации, неоднородность и конформационные гибкость3. Многие биологически информационные структуры привели от негативных пятно реконструкций, несмотря на резолюции технику, ограничиваясь ~ 18 Е резолюции4,5,6, и некоторые образцы дают лучшие результаты в пятно чем крио EM для целого ряда причин7.
В отрицательных пятно EM частица интерес адсорбироваться на поверхности сетки EM и окутан аморфного матрицы электронно плотной пятно составные. Высокий относительный контраст производится между фоном и частица интерес, с частицы в меньше электрона плотной, чем окружающие пятно8. Частицы отображаются в виде светлых областях из-за их низкой электрона рассеяния мощности относительно плотной окружающие пятно, которое рассеивает больше электронов и появляется темнее. Substructural особенности частиц можно дедуцировать от подробного рассмотрения результирующего изображения, как пятно будет проникать в любую щель и производить нерегулярных контрастность деталей9.
Отрицательный окрашивание процесс начинается с подготовки поддержки субстрата, на котором образец частицы захватываются и слой сухих пятен поддерживается. Наиболее часто используемые поддержки субстрата представляет собой слой аморфного углерода, иногда поддерживается тонким слоем поливинилхлорида (например Formvar) или нитроцеллюлозы (например коллодий) полимер. Эти субстраты можно приобрести коммерчески или собственными силами с использованием протоколов, описанные ниже.
После подготовки субстрата поддержки, образец может быть применен, и избыток раствора смыты покинуть. Образцы должны быть приостановлены в подходит буфер для отрицательных окрашивание. Лучше всего избежать использования фосфатного буфера и высокая концентрация соли, что может породить кристаллического осадка, которые могут скрывать образца. Восстановителями, моющие средства, сахароза, глицерин и высокие концентрации нуклеотидов также следует избегать как они также влияют на качество пятно4. Когда нельзя изменять состав буфера, мытье поверхности ет сетки с водой или более подходящих буфера после адсорбции и до окрашивания может уменьшить образование буфера артефактов, связанных с и в целом улучшить пятен фоновый. Если буфер артефакты подозреваются, это может быть информативным, чтобы пятно буфера только сетки, чтобы определить если буфер компоненты являются источником наблюдаемого артефактов.
После того, как образец адсорбированные и смыл и промыть в случае необходимости, применяется окрашивание реактива. Различные реагенты были найдены быть эффективной негативные пятна (Таблица 1), но пятно должно выбираться с учетом образца. «Halo» пятно форм вокруг частицы из-за перемещение молекул пятно гидрофобные регионов белка и отталкивания, взимается групп. Таким образом пятно должно выбираться таким образом, что протонирование состояние любых потенциальных заряженных групп на белок является таким же, как пятно на рабочей рН. Напротив обвинения на поверхности белка может способствовать положительный пятнать эффект, который, хотя полезной техникой в свой правый10 находится не в рамках настоящего документа. Наиболее часто используемые негативные окрашивание реагенты являются уранила ацетат и уранила формате. Эти пятна имеют размер относительно мелкое зерно (4-5 Å)9 и обеспечивают изображения более высокого разрешения через другие пятна фосфо вольфрамат (8-9 Å размер зерна)9,11, аммония молибдата11и некоторые на основе лантаноиды пятна12. Уранила ацетат и формате также выступать в качестве фиксатором, сохраняя много белок белковых взаимодействий на миллисекунду времени шкала13, хотя низкий рН пятно и ее склонность к осадок при физиологическом рН может быть пагубным для некоторых образцов14 . Несмотря на их полезность уранила соли также представляют материально-технические проблемы, поскольку они являются токсичными и мягко радиоактивный, которые могут потребовать специальной обработки, хранения, и распоряжении требования, которые приводит некоторые пользователи искать нерадиоактивные альтернатив.
Существует большое разнообразие методов описано для подготовки субстрата, образец приложения и окрашивание ет сетки. Наиболее подходящий метод, чтобы использовать пример зависимых и может быть трудно определить при решении новой системы. Эта рукопись описываются два метода подготовки субстрата и три blotting методы; стороне промокательной, flicking5и быстрой промывки15. Сторона промокательной является самым простым из описанных методов. Более сложным для реализации, но ограничить время контакта образца с фильма поддержки до фиксации и было показано, улучшить образование пятен артефактов для некоторых образцов5flicking метод и метод быстрого списания. Цель этой рукописи состоит таким образом обеспечить первоначальный рабочий процесс для решения визуализации сложных систем, отрицательные пятно EM.
протокол
1. Подготовка EM сетки
- Лист метод углерода
- Подготовьте лист свежей рассеченного слюды.
- Аккуратно вставьте иглу шприца точности или лезвием бритвы в одном углу листа слюды, несколько мм между слоями. Вставьте инструмент как близко к центру вертикального листа можно производить два куска приблизительно равной толщины.
- Тщательно, закрывающее друг от друга две половинки листовой слюды. Сделать это можно, глаз, или под микроскопом рассечения.
- Отрежьте один из углов каждого из листов недавно рассеченного слюды. В случае, если лист кантует в испарителе углерода во время вакуума релиз, углерода покрытием стороне листа могут быть определены.
- Место рассеченного слюда лист/s в камере испарителя углерода, с свежезаваренным расщепляется поверхностью вверх.
- Убедитесь, что углерода испарителе set-up правильно с электродом должным образом подготовлена углерода.
Примечание: Метод подготовки стержней углерода будет варьироваться в зависимости от характеристики испарителя углерода. Протокол для одного инструмента является следующим до шага 1.1.5.- Точить планку углерода с точилкой иметь острый кончик и затем отполировать салфеткой для удаления заусениц грубый.
- С помощью тонкой наждачной бумагой свести к концу второй стержня и снова отполировать поверхность гладкая с бумажным полотенцем.
- Поместите два углерода стержней в испаритель согласно инструкциям производителя. Убедитесь, что заостренный конец на первый стержень делает фирма контакт с плоский лицом второй стержня.
- Если толщина углерода будет оцениваться визуально место небольшой кусок чистой, сухой фильтр-бумаги частично под слюдой. Кроме того место белый матовый микроскопа с небольшой каплю вакуумных смазка наряду с слюда оценить толщину углерода.
- Хранение углерода на слюда согласно инструкциям производителя.
- Насос вакуумный вниз и ждать до тех пор, пока он находится в 10-5 мбар. Установите напряжение электрода для 4.0 V (до 5 V может потребоваться в зависимости от источника углерода rod).
- Запуск нескольких коротких импульсов приблизительно 3,5 s в продолжительности через электрод сдать 1-2 Нм толщиной испарений углерода на поверхности слюды.
Примечание: Как тока применяется к стержню углерода будет гореть красным и затем белый. Не смотреть на яркий свет, как это может повредить ваши глаза. - Разрешить углерода для депозита на слюды до достижения требуемой толщины, как измеряется углерода испарителя толщиномер или визуального наблюдения углерода, хранение на фильтровальной бумаги или микроскопа. Убедитесь, что конечный угольный слой толщиной 5-10 Нм.
- Если толщина углерода судить визуально сравнить матовое частью микроскопа, покрыты смазкой вакуума в пораженном участке, он станет темнее, как хранение больше углерода.
Примечание: Существует не количественный метод для определения толщины углерода, при использовании этого метода.
- Если толщина углерода судить визуально сравнить матовое частью микроскопа, покрыты смазкой вакуума в пораженном участке, он станет темнее, как хранение больше углерода.
- Вент вакуумной камеры и удалить слюды углерода покрытием из испарителя углерода.
Примечание: Углерод покрытием слюда можно оставить поселиться на ночь перед выполнением последующих шагов - Используйте один из двух емкостей с водой до плавать углеродной пленки на ет сетки: контейнер с сливной клапан на дне так, что вода может быть вытекла и углеродного слоя опустил на ожидании сетки или подъема буровых установок, что сетки можно задать под водой поверхность, которая впоследствии может поднять сетки до углеродной пленки на поверхности воды.
- Заполните контейнер с ультрачистая вода дистиллированная, так что поверхность воды находится примерно в 5 мм от верхней. Очистите поверхность от воды, перетащив лист или два объектива ткани на поверхности, чтобы удалить любые плавающие частицы.
- Поместите кусок чистой нержавеющей стали сетка (1 дюйм 2,5 дюйма является соответствующий размер) под поверхностью воды.
- С помощью тонкой пинцет, лежал чистый, сухой ет сетки лицом вверх (согласно описанию производителя) на сетке из нержавеющей стали. Pack сетки вместе максимально плотно, но не позволяют им перекрываются.
- После того, как устроены сетки, твердо сцепление лист с покрытием слюда углерода в паре пинцетом или фильм развивающихся щипцами.
- Ввести листовой слюды в воду. Убедитесь, что это делается на очень мелкие угол (~ 10 градусов).
Примечание: Слюда должна прорваться сквозь поверхность воды и погружаться, хотя фильм углерода следует отделить от слюды и плавают на поверхности воды. Этот шаг не должен выполняться непосредственно над сеток, чтобы избежать повреждения или загрязнения.- Чтобы свести к минимуму возможность будет фильм углерода, не отделяя от листовой слюды, оценка вокруг края листовой слюды с лезвием бритвы, или отрезать один угол с небольшой ножницами до введения его в воду.
- После того, как фильм углерода отдельный, удалите листовой слюды или дайте ему упасть на дно контейнера.
- С помощью тонкой наконечником пинцеты, применить очень мягкое давление и с медленными движениями руководство фильм углерода над верхней части сетки.
- Принесите углерода листовой поверхности сетки либо медленно слива воды или повышение подъемное кольцо, в зависимости от типа аппарата используется.
- Осторожно снять сетку из нержавеющей стали (теперь с углерода покрытием сетки) от аппарата и фитиль от некоторых из избыток воды, используя кусок фильтровальной бумаги. Убедитесь, что это делается путем прикосновения фильтровальной бумаги на самом краю стальной сетки, но не контактирующих сетки или углеродной пленки.
- Место сетки сетки в чашке Петри, содержащие сухой кусок фильтровальной бумаги и позволяют ей сухой полностью.
Примечание: Это наиболее пострадавших от высыхания на ночь при комнатной температуре, но шаг можно ускорить путем размещения сетки в духовке при температуре около 60 ° C.
- Подготовьте лист свежей рассеченного слюды.
- Поплавок и пальто (прямой углерода осаждения). Этот метод был описан подробно ранее16
- Полностью заполните чистой большой стеклянной чаши до краев с дистиллированной водой, поэтому мениске формы в верхней.
- Применить капли раствора коллодия (нитроцеллюлозы в амила ацетат) к поверхности воды, с использованием чистого пипетка Пастера, позволяют капли для распространения и полностью высушите. После высыхания тонкий слой коллодий, плавающей на поверхности воды будет видимым.
- Аккуратно удалите коллодий слой с помощью зубочистки для удаления пыли и других загрязнений с поверхности воды.
- Применить второй коллодий капли воды и дайте ему распространилась и на 2-3 минут.
Примечание: Повторите шаги 1.2.3-1.2.4 до тех пор, пока получается плоским и морщин бесплатно лист коллодия. - Используя пару тонкой пинцет место ет сетки лицом вниз (согласно описанию производителя) на плавающей коллодий листе. Pack сетки вместе плотно в массив гексагональной, но не позволяют им перекрываются.
Примечание: Если в сетке неправильно или помещены в перевернутом это как правило, лучше оставить его в место, вместо того, чтобы риск повреждения коллодий лист при попытке переместить его. - После того, как все из сетки размещены, аккуратно лежали лист бумаги фильтр над ними. Разрешить бумаги, чтобы стать насыщенные действием капилляров.
Примечание: Любой размер или Толщина фильтровальной бумаги является подходящим, если она полностью покрывает сетки. - Используйте зубочистку для удаления любой коллодий фильм, который выходит за рамки фильтровальной бумаги.
- Ручка фильтра бумаги на краю и очистить его от поверхности воды.
Примечание: Сеток должен оставаться придерживался на бумаге. - Место бумаги плоский и коллодия лицом вверх в чашку Петри и дайте ему высохнуть полностью.
- Место фильтр бумага с сетки в камере испарителя углерода с электродом должным образом подготовлена углерода как подробно указано в 1.1.2.
- Следуйте процедуре испарения углерода, как описано для метода лист углерода в
- Разрешить несколько секунд между импульсами во избежание перегрева и повреждения листе нитроцеллюлозы.
Примечание: При желании полимерный слой может быть удален после сетки были углерода с покрытием, хотя этот шаг требуется редко. Установите в сторону углерода сетки вверх на свежий кусок фильтровальной бумаги и положить несколько капель ацетона на бумаге рядом, но не на сетках. Разрешить ацетона разложить под сетки и распустить и поглощать полимерный слой.
2. Подготовка негативных пятнать реагентов
-
Подготовка уранила ацетат
- Принесите небольшой объем сверхчистой воды до кипения и дайте ей варить 10 минут тщательно Дега. Дайте ему немного остыть, а затем использовать его для растворения уранила ацетат (UA) на 1-2% (w/v).
Примечание: Эта процедура, вытяжной шкаф и надлежащие средства личной защиты. - После охлаждения решения, процеживают через 0,2 мкм шприц фильтр или фильтр-бумаги.
- Храните UA, защищенный от света и 4 градусов. Решение является стабильным на срок до 1 года.
- Принесите небольшой объем сверхчистой воды до кипения и дайте ей варить 10 минут тщательно Дега. Дайте ему немного остыть, а затем использовать его для растворения уранила ацетат (UA) на 1-2% (w/v).
-
Подготовка уранила формате из порошка. Этот метод был описан в деталях ранее8
- Растворите порошок формате (UF) уранила 20 мг 2 мл кипятка дегазацию сверхчистого (как в шаге 2.1.1) путем перемешивания.
- Продолжая размешивать, 8 мкл 5 M NaOH, решение должно измениться на более темный желтый цвет, но не осадок должен сформировать.
- Фильтр решение через фильтр шприц 0,2 мкм.
- Магазин, UF пятно, защищенном от света. Наблюдается отменить, что пятно следует если осадок или коричневого цвета. Решение стабилен только для 1-2 дней.
-
Подготовка уранила формате от уранила ацетат
- Осадок 1 мл 1% (w/v) UA пятно, добавив 100 мкл 1 M NaOH.
- Центрифуга смесь для 2 мин на максимальной скорости в центрифуге benchtop.
- Отменить любые супернатант и растворить осадок в 100 мкл муравьиной кислоты 5% (v/v) путем энергичных vortexing.
- Разбавляют до окончательного объема 1 мл с 900 мкл ультрачистая вода приносить UF пятно в 0,5% (v/v) муравьиной кислоты.
- Магазин, UF пятно, защищенном от света. Отбросить пятно, если наблюдается любой осадок или коричневого цвета.
-
Подготовка других реагентов пятнать
-
Подготовка лантаноиды ацетат пятна
- Растворите Самарий ацетат (SmAc), гадолиний ацетат (ГДАК), тулия ацетат (ТЦПМД) или эрбия ацетат (ErAc) на 1-2% (w/v) в ультрачистая вода.
Примечание: Если образцы Показать положительный пятнать или низкой приверженности к сетке при использовании этих пятен, они могут быть подкислена с до 0,5% (v/v) муравьиной кислоты. Положительный пятнать результаты в образце, появляясь как темный объект, окруженный Белый гало. Низкой приверженности к сетке приведет к меньше молекул, чем ожидаемый соблюдается на сетке.
- Растворите Самарий ацетат (SmAc), гадолиний ацетат (ГДАК), тулия ацетат (ТЦПМД) или эрбия ацетат (ErAc) на 1-2% (w/v) в ультрачистая вода.
-
Подготовка Молибдат аммония и Phosphotungstate натрия
- Растворите пятно на 1-3% (w/v) в ультрачистая вода. Отрегулируйте пэ-аш до 7.0 с помощью 5 M NaOH, при желании.
-
Подготовка лантаноиды ацетат пятна
3. поглощения образцов углеродных субстрата и окрашивания
-
Подготовка поверхности сетки для образца приложения путем оказания Гидрофильное
- Установите решетку вверх на микроскопа в бункер свечения.
- Лечить сетки для минимум 30 s 10 мА.
Примечание: Точный метод тлеющего разряда будет зависеть от характеристик конкретной части оборудования. - Кроме того, это может быть достигнуто путем УФ облучения УФ лампа настольная4на 10 минут.
-
Стороне Blotting метод. Этот метод был описан в деталях ранее8
- Захват край сетки с отрицательным давлением пинцет и применить 3-5 мкл пример к опорной поверхности.
- Разрешить образец адсорбироваться на поверхности сетки для 10 s 1 мин оптимизировать время адсорбции необходимо для отдельных образцов.
- Коснуться края сетки на лист бумаги и позволяют капиллярность стащить жидкости.
- Дополнительно: Промойте сетку. Место 50 мкл капли ультрачистая вода или соответствующие летучих буферного раствора на листе лаборатории фильма. Аккуратно коснитесь углерода поверхности сетки на падение и снять небольшой капли на поверхность сетки. Коснуться края сетки на лист бумаги и позволяют капиллярность стащить жидкости.
- Повторите этот шаг мыть, как столько раз, сколько желаемого.
- Место два 50 мкл капли пятнать реагента на листе лаборатории фильма.
- Аккуратно коснитесь углерода поверхности сетки на падение и снять небольшой капли на верхней поверхности сетки.
Примечание: Если пятно мигрирует в задней части сетки, а затем сетки должен быть уничтожен. - Коснуться края сетки на лист бумаги и позволяют капиллярность рисовать жидкости. Выполните это окрашивание дважды.
- Разрешайте сетке воздух сухой или сухой под лампу накаливания.
-
Стряхивая метод
- Захват край сетки с отрицательным давлением пинцет и применить 3-5 мкл пример к опорной поверхности.
- Проведение пинцет в одной руке, так что сетка под углом примерно 45 ° перед прочь, быстро проведите запястья, руки «Флик» большинство капли, что поверх сетки.
- Дополнительно: Использование стеклянной пипетки Пастера наносить каплю промывочного раствора к опорной поверхности и «Флик от» как в 3.2.2. При необходимости повторите.
- С помощью стеклянной пипетки Пастера наносить каплю окрашивание реактива на опорной поверхности и «Флик от» как в 3.2.2. Повторите 1 - 3 раза зависит глубина пятно, необходимые для визуализации образца.
Примечание: Это не единственный фактор, который атрибуты окончательное пятно глубину (см. обсуждение). - Удалите избыток пятно, рваные края кусок фильтровальной бумаги до края сетки.
- Разрешайте сетке воздух сухой или сухой под лампу накаливания.
-
Метод быстрого промывка
- Сделать 30-70 мкл пятно (1% UA обычно используется) в наконечник пипетки 200 мкл, поверните регулятор громкости составить 5 мкл воздуха, а затем составить мыть/перемешивание реагентов (5-30 мкл), если требуется, последовал еще один небольшой воздушный зазор и затем составить 5 мкл пример.
- Сцепление края сетки с отрицательным давлением пинцет, держа пинцет, так что сетка под углом примерно 45 °, стоящие вдали от исследователя, извлечь все содержимое кончика пипетки по лицу углерода покрытием ет сетки.
- Удалите избыток пятно, рваные края кусок фильтровальной бумаги до края сетки.
- Разрешайте сетке воздух сухой или сухой под лампу накаливания.
Примечание: Для всех методов целесообразно слайд рваные края листа бумаги вдоль щипцы, пока он не достигнет сетки как это удаляет решение в ловушке между двумя сторонами щипцы, которые могут тянуть сушеные сетки в пасть щипцы, после того, как они открыт. Сетка в пинцет могут также размещены на краю зонт для просушки. Постоянный поток воздуха может помочь произвести больше даже пятнать.
Результаты
Все окрашивание реагентов испытания производится негативные пятнать в некоторой степени, с оф, уступая образцов с наибольшей контрастностью и острым, самые подробные частиц. Для глубоко укоренились образцы (рис. 1) лантаноиды основе пятна ErAc и TmAc произведены отрицательные пятнать эквивалентного качества UA как судить по очевидным контраст и резкость окрашенных частиц с TmAc производит более четкие, более четкие изображения чем консоли ERA. Хотя размер зерна TmAc становится очевидным при большом увеличении, когда вирус мозаики табака (ПДЦ) частицы были окрашенных с 1% TmAc ~ 23 Å повторить частиц ВТМ17 по-прежнему ясно видимы глазом и как линия меридиональных слоя в Фурье преобразование raw изображений. Ни один из других лантаноиды пятна испытания, ErAc, SmAc или ГДАК, смогли решить эту функцию. Класс средние показатели были получены путем извлечения перекрывающихся сегментов от частиц ВТМ, где винтовой повторить было видно. Извлечения сегментов затем были согласованы и классифицированы с использованием RELION18 лучше визуализировать периодических функций (рис. 2).
Некоторые образцы особенно чувствительны к метод окрашивания, такие как мышцы производные C-белок. C-белка, который состоит из гибкого строки Ig и Fn как домены, производит значительно различные изображения, отрицательные пятно EM зависит от метода используется окрашивание (рис. 3). Когда с помощью метода промокательной сторона рухнула наблюдаются кольцо как структуры, тогда как когда запятнана быстрой промывки или стряхивая методы, C-белок наблюдается как набор доменов, которые напоминают бусы на строку.
| Реагент | Концентрация | pH | Тип |
| Аммоний молибденовокислый | 1 - 2% | 5 – 7 | Анионные |
| Эрбий ацетат (ErAc) | 1 – 2% | 6 | Катионные |
| Гадолиний ацетат (ГДАК) | 1 – 2% | 6 | Катионные |
| Вольфрамат метиламин | 2% | 6 – 7 | Анионные |
| Самарий ацетат (SmAC) | 1% | 6 | Катионные |
| Натрия silicotungstate | 1 – 5% | 5 – 8 | Анионные |
| Натрия phosphotungstate | 1 -3% | 5 – 8 | Анионные |
| Тулия ацетат (ТЦПМД) | 1 – 2% | 6 | Катионные |
| Уранила ацетат (UA) | 1 – 3% | 3 – 4 | Катионные |
| Уранила формате (UF) | 0,75-1% | 3 – 4 | Катионные |
Таблица 1: Некоторые общие негативные окрашивание реагентов.

Рисунок 1: пример микроскопии вирус табачной мозаики витражи с различных негативных пятно реагентов (A) 1% UF (B) 2,5% TmAc (C) 2,5% консоли ERA. (D) 1% UA (E) 2,5% ГДАК и (F) 2,5% Смак. Масштаб гистограммы являются 100 Нм. Представитель изображения из нескольких реплицирует с несколькими областями, отображаемого на репликацию. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 2: пятнать вирус табачной мозаики с тулия ацетат (A) высокое увеличение площади от Микрофотография TMV витражи с 1% TmAc. Линейки-20 Нм. (B) класса среднем извлеченные TMV сегментов. (C) Фурье преобразование изображения в панели A показаны слой линия размышления ~ 23 Å. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
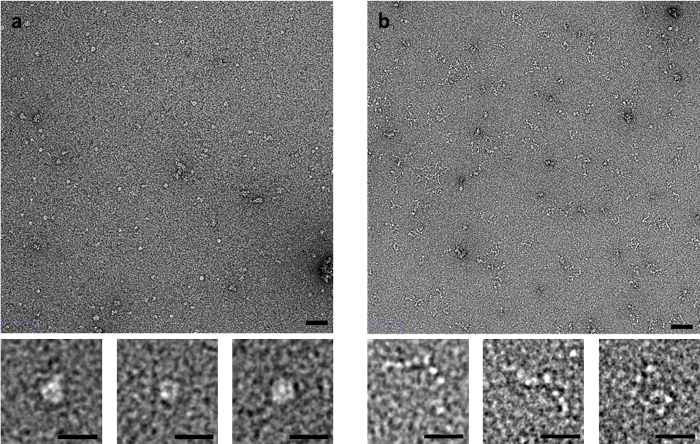
Рисунок 3: последствия blotting метод на конформацию C-белка. (A) C-белка витражи с UA, с помощью метода помаркой на стороне и (B) flicking метод. Верхней панели шкалы составляет 50 Нм, нижней шкалы панели составляет 20 Нм. Представитель изображения из нескольких реплицирует с несколькими областями, отображаемого на репликацию. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Эта рукопись описывает несколько методов для отрицательных окрашивания образцов для электронной микроскопии с помощью различных пятнать реагентов, включая два романа лантаноиды реагентов (ТЦПМД и консоли ERA). Многие из шагов, негативные окрашивание процесса должны быть оптимизированы для отдельных образцов, включая выбор пятно, мытье требуется, если таковые имеются, и blotting метод. Эта рукопись, таким образом, обеспечивает основу для microscopists развивать свои собственные рабочие процессы для решения отрицательной окрашивание сложных систем.
Выбор пятно является весьма образец зависимых. Образцы, которые особенно чувствительны к низким рН может снизиться UA и/или UF, несмотря на фиксирующие свойства этих пятен19. В этих случаях лантаноиды основана пятен, таких как TmAc или ErAc может быть более подходящим, хотя общая pH подготовки должны храниться ниже изоэлектрической точки образца белка, чтобы помочь предотвратить положительный пятнать. Для этого подкисляющих пятно с уксусной кислоты при необходимости. Особенно низкий рН чувствительных образцы анионные вольфрамат или Молибдат пятна может быть более эффективным. Хотя эти пятна были найдены для стимулирования формирования артефактов в некоторых случаях, таких как формирование стружки в липопротеинов образцов20. Опять же pH пятно может потребоваться скорректировать этот раз выше изоэлектрической точки образца, чтобы предотвратить положительный пятнать.
Стиральная образца до окраски может быть необходимо, если буфер, в котором поддерживается образца имеет высокий компонент соли или фосфата. Во многих случаях Стиральная может быть выполнена с ультрачистая вода, но для более чувствительных проб, которые могут ухудшить или претерпевают структурные изменения при контакте с водой в одиночку, Стиральная может потребоваться выполнить с буфером летучих низкой ионной силы8. Даже в тщательно контролируемых условиях Стиральная может привести некоторые структурной перестройки на поверхности углеродных21.
Метод, по которому сетка готовится с точки зрения образца адсорбции, blotting и пятнать может также существенно повлиять на то, что наблюдается. Наиболее подходящим методом является таким образом, опять же, весьма образец зависимых. C-белка, например, наблюдается как шаровидных кольцо как структура после окрашивания стороне блот, но это, кажется, быть артефактом процесса окрашивания, как показали, когда сетки готовятся методом flicking (или метод быстрого списания) (рис. 3 ). Flicking и быстрых методов списания время образца должна взаимодействовать с углеродом опорной поверхности до фиксации в свернутом15. Образец также испытывает меньше сил с отступающей мениска на промокательной до фиксации. Это означает, что структурные изменения в образец, которые могут произойти после продолжительной абсорбции время на углеродной пленки или через капиллярность минимизированы. Метод быстрого списания может также использоваться для раз решить анализа образцов. Образец можно смешивать с лигандом или добавка в наконечник пипетки для набора период времени перед применением к сетке или только однократно на поверхности сетки до фиксации в течение миллисекунд.
Глубина пятно, необходимых для обеспечения оптимального изображения определенного образца снова образца зависит от2. Если пятно слишком мелкой, молекулы могут быть повреждены электронного луча, но если слишком густой пятно структурные особенности могут быть потеряны. Пятно глубина зависит от нескольких факторов, таких как гидрофильность поверхности сетки, равномерность слоя углерода, количество пятен, применяется к сетке, продолжительность времени, что пятно находится в контакте с сетки до промокательной, степень промокательной и время это та KES на сетку, чтобы полностью сухой. Сетка будет никогда не имеют равномерное распределение пятна во всей его полноте и поэтому области сетки для изображений должны быть выбраны тщательно. Действительно сетки часто различаются по качеству даже когда подготовлен в тот же день в тех же условиях. Хороший пример того, как изменения в глубине пятно влияет на внешний вид молекул и глубина соответствующие пятно для изображений обеспечивается Берджесс et al5.
Несмотря на негативные окрашивание очень разносторонний, быстрый и простой метод, не все биологические образцы поддаются визуализации этим методом. Хрупкие сборки можно свернуть или разбирать при адсорбции, пятнать или сушки на ет сетки22. Отрицательный окрашивания также может привести к сплющивать молекул и побудить предпочтительным ориентаций молекул углерода поддержки фильм7.
Отрицательный пятно является ценным инструментом для оценки образцов в своем собственном праве, а также перед крио EM анализ, но многие из физических сил, которыми образца сталкивается в процессе плохо понимают. Таким образом наилучший подход является весьма образец зависимых и должен быть определен путем проб и ошибок, а не учил после фиксированного протокол.
Раскрытие информации
Авторы заявляют не конкурирующих финансовых интересов.
Благодарности
Мы чрезвычайно признательны рыцаря Петра за полезные обсуждения и критический обзор рукописи. Мы хотели бы поблагодарить всех членов Нил Ranson и Стивен Мюнх labs и сотрудники Astbury Biostructure лаборатории для полезной дискуссии. Эта работа финансировалась Европейским Советом исследований (FP7/2007-2013) / ERC грантовое соглашение 322408. C-белка был подготовлен с использованием ресурсов, предоставляемых на Британский фонд сердца Грант (BHF PG/13/83/30485). Мы также благодарим Уэллком траст для оборудования, финансирование для поддержки электронной микроскопии в Лидсе (090932/Z/09/Z и 094232/Z/10/Z). CS финансируется Уэллком доверять ИССФ Грант.
Материалы
| Name | Company | Catalog Number | Comments |
| 200 mesh copper EM grids | Sigma-Aldrich | G4776-1VL | Other materials and/or mesh sizes can also be used |
| Ammonium Molybdate | Sigma-Aldrich | 277908 | |
| Carbon evaporator | Ted Pella Inc. | 9620 | Cressington 208 or equivalent |
| Collodion solution 2% in amyl acetate | Sigma-Aldrich | 9817 | |
| Dumont #5 negative pressure tweezers | World Precision Instruments | 501202 | Or other tweezers as preferred |
| Erbium Acetate | Sigma-Aldrich | 325570 | |
| Gadolinium Acetate | Sigma-Aldrich | 325678 | |
| Mica Sheets. 75x25x0.15mm. | AGAR Scientific | AGG250-1 | |
| Microscope slides, white frosted | Fisher Scientific | 12607976 | Or equivalent |
| Parafilm | Fisher Scientific | 10018130 | Or equivalent |
| Pasteur pipette (glass) | Fisher Scientific | 10343663 | Or equivalent |
| Razor blade | Fisher Scientific | 11904325 | Or equivalent |
| Sandpaper | Hardware store | Wet and dry sandpaper with grit finer that 200 (600 suggested) | |
| Samarium Acetate | Sigma-Aldrich | 325872 | |
| Sodium Hydroxide | Sigma-Aldrich | 1.06462 | |
| Sodium Phosphotungstate | Sigma-Aldrich | P6395 | |
| Stainless Steel Mesh, 150x150 mm (cut to size). | AGAR Scientific | AGG252 | |
| Thulium Acetate | Sigma-Aldrich | 367702 | |
| Two Step Carbon Rod Sharper, for 1/4" rods | Ted Pella Inc. | 57-10 | Or equivalent for carbon evaporator used |
| Ultra pure water | |||
| Uranyl Acetate | Electron Microscopy Sciences | 22400 | |
| Uranyl Formate | Electron Microscopy Sciences | 22450 | |
| Vacuum grease | Fisher Scientific | 12719406 | Or equivalent |
| Whatman #1 Filter paper. | Fisher Scientific | 1001 090 | Or equivalent |
| Whatman #40 filter paper | Fisher Scientific | 10674122 | Or equivalent |
Ссылки
- Merk, A., et al. Breaking Cryo-EM Resolution Barriers to Facilitate Drug Discovery. Cell. 165 (7), 1698-1707 (2016).
- De Carlo, S., Harris, J. R. Negative staining and cryo-negative staining of macromolecules and viruses for TEM. Micron. 42 (2), 117-131 (2011).
- Thompson, R. F., Walker, M., Siebert, C. A., Muench, S. P., Ranson, N. A. An introduction to sample preparation and imaging by cryo-electron microscopy for structural biology. Methods. 100, 3-15 (2016).
- Ha, J. Y., et al. Molecular architecture of the complete COG tethering complex. Nat Struct Mol Biol. 23 (8), 758-760 (2016).
- Burgess, S. A., Walker, M. L., Thirumurugan, K., Trinick, J., Knight, P. J. Use of negative stain and single-particle image processing to explore dynamic properties of flexible macromolecules. J Struct Biol. 147 (3), 247-258 (2004).
- Fabre, L., Bao, H., Innes, J., Duong, F., Rouiller, I. Negative-stain single particle EM of the maltose transporter in nanodiscs reveals asymmetric closure of MalK2 and catalytic roles of ATP, MalE and maltose. J Biol Chem. , (2017).
- Zhang, L., et al. An optimized negative-staining protocol of electron microscopy for apoE4 POPC lipoprotein. J Lipid Res. 51 (5), 1228-1236 (2010).
- Ohi, M., Li, Y., Cheng, Y., Walz, T. Negative Staining and Image Classification - Powerful Tools in Modern Electron Microscopy. Biol Proced Online. 6 (1), 23-34 (2004).
- Haschemeyer, R. H., Myers, R. J. . Negative Staining in Principles and Techniques of Electron Microscopy. 2, 101-147 (1972).
- Massover, W. H. Positive staining of protein molecules for electron microscopy: polyiodination of the apoferritin shell in ferritin. Ultramicroscopy. 52, 383-387 (1993).
- Harris, J. R., Bhella, D., Adrian, M. Recent Developments in Negative Staining for Transmission Electron Microscopy. Microsc Microanal. 20, 17-21 (2006).
- Hosogi, N., Nishioka, H., Nakakoshi, M. Evaluation of lanthanide salts as alternative stains to uranyl acetate. Microscopy (Oxf). 64 (6), 429-435 (2015).
- Zhao, F., Craig, R. Capturing time-resolved changes in molecular structure by negative staining. J Struct Biol. 141, 43-52 (2003).
- Cao, B., Xu, H., Mao, C. Transmission electron microscopy as a tool to image bioinorganic nanohybrids: the case of phage-gold nanocomposites. Microsc Res Tech. 74 (7), 627-635 (2011).
- Imai, H., et al. Direct observation shows superposition and large scale flexibility within cytoplasmic dynein motors moving along microtubules. Nat Commun. 6, 8179 (2015).
- Booth, D. S., Avila-Sakar, A., Cheng, Y. Visualizing proteins and macromolecular complexes by negative stain EM: from grid preparation to image acquisition. J Vis Exp. (58), (2011).
- Kendall, A., McDonald, M., Stubbs, G. Precise determination of the helical repeat of tobacco mosaic virus. Virology. 369 (1), 226-227 (2007).
- Scheres, S. H. A Bayesian view on cryo-EM structure determination. J. Mol. Bio. 415 (2), 406-418 (2012).
- Bremer, A., Henn, C., Engel, A., Baumeister, W., Aebi, U. Has negative staining still a place in biomacromolecular electron microscopy?. Ultramicroscopy. 46, 85-111 (1992).
- Garewal, M., Zhang, L., Ren, G., Kleinschmidt, J. . Lipid-Protein Interactions. Methods Mol Biol (Methods and Protocols). 974, 111-118 (2012).
- Walker, M. L., et al. Two-headed binding of a processive myosin to F-actin. Nature. 405 (6788), 804-807 (2000).
- Orlova, E. V., Saibil, H. R. Structural Analysis of Macromolecular Assemblies by Electron Microscopy. Chem Rev. 111 (12), 7710-7748 (2011).
Erratum
Formal Correction: Erratum: Variations on Negative Stain Electron Microscopy Methods: Tools for Tackling Challenging Systems
Posted by JoVE Editors on 1/30/2020. Citeable Link.
An erratum was issued for: Variations on Negative Stain Electron Microscopy Methods: Tools for Tackling Challenging Systems. An author name was updated.
One of the authors' names was corrected from:
Matthew G. Iadaza
to:
Matthew G. Iadanza
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены