Method Article
Variationen auf negativ Färben Elektronenmikroskopie Methoden: Werkzeuge für die Bekämpfung der anspruchsvolle Systeme
In diesem Artikel
Erratum Notice
Zusammenfassung
Negativen Fleck EM ist eine kraftvolle Methode zur Visualisierung von makromolekularen Struktur, aber verschiedenen befleckenden Techniken können unterschiedliche Ergebnisse in eine Probe Weise produzieren. Hier sind mehrere negative Färbung Ansätze zu einer anfänglichen Workflow zur Bewältigung der Visualisierung der anspruchsvolle Systeme ausführlich beschrieben.
Zusammenfassung
Negativen Fleck Elektronenmikroskopie (EM) ermöglicht relativ einfach und schnell Beobachtung von Makromolekülen und makromolekulare komplexe durch den Einsatz von Kontrast Verbesserung Fleck Reagenz. Obwohl in Auflösung bis zu ~ 18-20 begrenzt Å, negative Fleck EM eignet sich für eine Vielzahl von biologischen Problemen und bietet auch ein schnelles Mittel zur Bewertung der Proben für Kryo-Elektronenmikroskopie (Cryo-EM). Der negative Fleck-Workflow ist einfache Methode; die Probe wird auf einem Substrat adsorbiert, dann ein Fleck aufgetragen, ausgelöscht und getrocknet, um eine dünne Schicht von Elektron Dichte Flecken zu produzieren, in denen die Partikel eingebettet sind. Einzelproben können, jedoch deutlich unterschiedlich unter unterschiedlichen befleckenden Bedingungen Verhalten. Dies führte zur Entwicklung einer Vielzahl von Substrat Präparationstechniken, negative Färbung Reagenzien und Raster waschen und beflecken Techniken. Ermittlung der am besten geeignete Technik für jede einzelne Probe muss auf einer Schachtel-durchschachtel Grundlage erfolgen und einem Mikroskopiker müssen Zugang zu einer Vielzahl von verschiedenen Techniken, um die qualitativ hochwertigsten negative Fleck-Ergebnisse zu erzielen. Detaillierte Protokolle für zwei verschiedene Substrat Zubereitungsmethoden und drei verschiedenen befleckenden Techniken werden zur Verfügung gestellt, und ein Beispiel für ein Beispiel, das zeigt deutlich unterschiedliche Ergebnisse abhängig von der verwendeten Methode. Darüber hinaus ist die Herstellung von einigen gemeinsamen negative Färbung Reagenzien und zwei neuartige Lanthanid-basierte Flecken, mit Diskussion über die Verwendung der einzelnen beschrieben.
Einleitung
Trotz der jüngsten Aufmerksamkeit auf die Auflösung Fleck Revolution durch bedeutende Fortschritte in der Cryo-Elektron Mikroskopie1 (Cryo-EM), negative EM bleibt eine leistungsfähige Technik und ein entscheidender Bestandteil des Elektrons Mikroskopiker Toolbox. Negative Färbung bleibt immer noch die beste Methode für schnelle Bewertung einer Probe vor der Optimierung Cryo-Grid Bedingungen2. Die kontrastreiche und Geschwindigkeit der Raster Vorbereitung der negativ gefärbten Proben macht es ideal für die Beurteilung der Probe Reinheit, Konzentration, Heterogenität und Konformationsänderungen Flexibilität3. Viele biologisch informative Strukturen haben ergab sich aus negativen Fleck Rekonstruktionen, trotz der Technik Auflösung bis ~ 18 Å Auflösung4,5,6, beschränkt und einige Beispiele liefern bessere Ergebnisse in Fleck als Cryo-EM für eine Vielzahl von Gründen7.
In negativen Fleck EM ist das Teilchen des Interesses auf die Oberfläche eines EM-Netzes adsorbiert und umhüllt von einer amorphen Matrix von Elektron Dichte Fleck zusammengesetzte. Ein hohe relative Kontrast entsteht zwischen dem Hintergrund und der Partikel von Interesse, mit dem Teilchen wird weniger Elektron Dichte als die umliegenden Fleck-8. Die Partikel erscheinen als helle Bereiche aufgrund ihrer niedrigen Elektron Streuung macht im Vergleich zu den dichten umliegenden Fleck, streut die Elektronen mehr und erscheint dunkler. Substructural Eigenschaften der Partikel können die eingehende Prüfung der resultierenden Bilder abgeleitet werden, da Fleck in jede Ritze dringt und unregelmäßige Kontrast Detail9produzieren wird.
Der negative Färbung Prozess beginnt mit der Vorbereitung eines Support-Substrats auf denen die Teilchen der Probe erfasst werden und die Schicht der getrockneten Fleck unterstützt. Die am häufigsten verwendeten Unterstützung Substrat ist eine Schicht aus amorphem Kohlenstoff, manchmal unterstützt durch eine dünne Schicht aus Polyvinylchlorid (z.B. Formvar) oder Nitrozellulose (z.B. Kollodium) Polymer. Diese Substrate können kommerziell erworben oder im Haus mit der unten beschriebenen Protokolle zubereitet.
Nach der Vorbereitung der Unterstützung Substrat die Probe aufgebracht werden, und die überschüssige Lösung ausgelöscht aus. Proben sollten in einem geeigneten Puffer für Negative Färbung ausgesetzt werden. Es empfiehlt sich, vermeiden die Verwendung der Phosphatpuffer und hohe Salzkonzentrationen, die kristalline Ausscheidungen hervorrufen können, die die Probe verdunkeln können. Reduktionsmittel, Reinigungsmittel, Saccharose, Glycerin und hohe Konzentrationen von Nukleotid sollte auch vermieden werden, da sie auch Fleck Qualität4betreffen. Wenn die Puffer Zusammensetzung kann nicht geändert werden, die Oberfläche des Rasters EM mit Wasser waschen oder ein passender Puffer nach Adsorption und vor der Färbung kann verringern die Bildung des Puffers im Zusammenhang mit Artefakten und im Allgemeinen verbessern Fleck Hintergrund. Wenn Puffer Artefakte im Verdacht stehen, kann es sein, informativ, ein Puffer nur Raster, um festzustellen, ob der Puffer-Komponenten die Quelle der beobachteten Artefakte sind zu beflecken.
Nachdem die Probe adsorbiert, und ausgelöscht und gewaschen, wenn nötig, wird eine Färbung Reagenz angewendet. Eine Vielzahl von Reagenzien sind gefunden worden, um effektive negative Flecken (Tabelle 1) werden, aber der Fleck muss die Probe entsprechend gewählt werden. Ein 'Halo' Fleck Formen um das Teilchen durch beide die Verschiebung der Fleck Moleküle durch die hydrophoben Regionen des Proteins und Abstoßung von Gruppen in Rechnung gestellt. Daher muss der Fleck gewählt werden, so dass der Protonierung Zustand der potenziellen geladenen Gruppen auf das Protein identisch mit den Fleck bei der Arbeit-pH ist. Gegenüber Ladungen auf der Oberfläche des Proteins kann dazu beitragen, eine positive Färbung bewirken, die zwar eine nützliche Technik in eigenen Rechten10 nicht in den Anwendungsbereich dieses Papier. Die am häufigsten verwendeten negative Färbung Reagenzien sind Uranyl Acetat und Uranyl Formiat. Diese Flecken haben eine relativ feine Körnung (4-5 Å)9 und höher aufgelöste Bilder über andere Flecken wie Phospho-Wolframaten (8-9 Å Korngröße)9,11, Ammonium Molybdat11und einige Lanthanid-basierte 12Flecken. Uranyl Acetat und Formiat fungieren auch als ein Fixiermittel, erhalten viele Protein-Protein-Wechselwirkungen eine Millisekunde pünktlich Maßstab13, obwohl der niedrige pH-Wert den Fleck und seiner Neigung zu Ausfällen bei physiologischen pH möglicherweise nachteilig auf einige Proben14 . Trotz ihres Nutzens stellen die Uranyl-Salze auch logistische Herausforderungen wie sie sind giftig und leicht radioaktiv, die erfordern kann spezielle Handhabung, Lagerung, und Entsorgung Anforderungen, führt einige Benutzer nicht radioaktiv Alternativen zu suchen.
Es gibt eine Vielzahl von Methoden für die Substrataufbereitung, Beispielanwendung beschrieben und Färbung des EM-Raster. Die am besten geeignete Methode zu verwenden ist Probe abhängig und kann schwierig sein, festzustellen, wenn ein neues System anpackt. Dieses Manuskript beschreibt zwei Methoden der Substrataufbereitung und drei befleckende Methoden; Seite zu beflecken, zwischen5und schnelle Spülung15. Seite-beflecken ist die einfachste der beschriebenen Methoden. Die flinken Methode und die schnelle Buchungsmethode sind viel schwieriger zu implementieren, aber begrenzen die Kontaktzeit der Probe mit der Trägerfolie vor Fixierung und haben gezeigt, dass Bildung von Fleck Artefakte für einige Proben5zu verbessern. Das Ziel dieses Manuskriptes ist somit einen erste Workflow bieten für die Bewältigung der Visualisierung der anspruchsvolle Systeme von negativ-Fleck EM.
Protokoll
1. Vorbereitung der EM Grids
- Carbon-Blatt-Methode
- Bereiten Sie eine frisch gespalten Glimmer.
- Sanft fügen Sie eine Präzision Spritzennadel oder einer Rasierklinge an einer Ecke des Blattes Glimmer, ein paar mm zwischen den Schichten. Setzen Sie das Werkzeug so nah an der vertikalen Mitte des Blattes als möglich, zwei Stücke von etwa gleicher Dicke herzustellen.
- Vorsichtig auseinander Preis die beiden Hälften des Blattes Glimmer. Kann dies zu tun, mit dem Auge oder unter dem sezierenden Mikroskop.
- Einer der Ecken von jedem der neu gespalten Glimmer Blätter abgeschnitten. Den Fall, dass das Blatt in den Kohlenstoff-Verdampfer während Vakuum Version dreht, kann die Kohlenstoff beschichtete Seite des Blattes identifiziert werden.
- Platzieren Sie gespalten Glimmer Blatt/s in der Kammer von einem Kohlenstoff-Verdampfer, mit der frisch gespalten-Oberfläche nach oben.
- Sicherstellen Sie, dass der Kohlenstoff-Verdampfer Set-up mit einem entsprechend vorbereiteten Kohlenstoffelektrode richtig ist.
Hinweis: Die Methode des Vorbereitens der Kohlestäbe variieren je nach den Spezifikationen des Verdampfers Kohlenstoff. Ein Protokoll für ein Instrument ist wie folgt erst Schritt 1.1.5.- Schärfen Sie ein Kohlestab mit einem Anspitzer haben eine scharfe Spitze und Polieren Sie es mit einem Papiertuch, grobe Grate zu entfernen.
- Mit feinem Sandpapier glätten Sie das Ende eines zweiten Stabes und wieder Polieren Sie glatt mit einem Papiertuch zu.
- Legen Sie die zwei Kohlestäbe in den Verdampfer gemäß Anweisungen des Herstellers. Sicherstellen Sie, dass die geschärfte Ende auf dem ersten Stab festen Kontakt mit dem abgeflachten Gesicht des zweiten Stabes macht.
- Legen Sie ein kleines Stück von sauberen, trockenen Filterpapier teilweise unter dem Glimmer, wenn die Kohlenstoff-Dicke optisch gemessen werden soll. Alternativ legen Sie einen weiße mattierte Mikroskop-Objektträger mit einem kleinen Klecks Vakuum Fett neben dem Glimmer, Kohlenstoff-Dicke zu messen.
- Kohlenstoff auf der Glimmer gemäß Anweisungen des Herstellers zu hinterlegen.
- Pumpen Sie das Vakuum ab und warten Sie, bis es 10-5 Mbar ist. Stellen Sie die Spannung der Elektrode auf 4.0 V (bis zu 5 V kann je nach die Kohlenstoffquelle Stab erforderlich sein).
- Führen Sie mehrere kurze Pulse von ca. 3,5 s Dauer durch die Elektrode ca. 1-2 nm dicken Verdampfungen von Kohlenstoff auf der Glimmer-Oberfläche zu hinterlegen.
Hinweis: Als aktuell gilt für die Carbonstange wird es rot leuchten und dann weiß. Seht sie nicht an das helle Licht, da dies Ihre Augen beschädigen könnte. - Den Kohlenstoff auf die Glimmer zu hinterlegen, bis die gewünschte Dicke erreicht ist, gemessen durch den Kohlenstoff Verdampfer Dickenmesser oder durch visuelle Beobachtung des Kohlenstoffs lagern sich auf dem Filterpapier oder Mikroskop-Objektträger zu ermöglichen. Sicherstellen Sie, dass die endgültige Kohlenstoffschicht 5-10 nm dick ist.
- Wenn die Kohlenstoff-Dicke optisch gemessen ist wird gefrostete Bestandteil der Mikroskop-Objektträger beschichtet mit Vakuum Fett in den sichtbaren Bereich zu vergleichen, es dunkler, da mehr Kohlenstoff hinterlegt ist.
Hinweis: Es gibt keine quantitative Methode zum Kohlenstoff Dicke zu bestimmen, wenn Sie diese Methode verwenden.
- Wenn die Kohlenstoff-Dicke optisch gemessen ist wird gefrostete Bestandteil der Mikroskop-Objektträger beschichtet mit Vakuum Fett in den sichtbaren Bereich zu vergleichen, es dunkler, da mehr Kohlenstoff hinterlegt ist.
- Entlüften der Vakuumkammer und dem Kohlenstoff-beschichtete Glimmer aus dem Kohlenstoff-Verdampfer zu entfernen.
Hinweis: Der Kohlenstoff-beschichtete Glimmer kann bleiben über Nacht bevor Sie mit weiteren Schritten zu begleichen - Verwenden Sie eine der zwei Wasser-Container die Carbon Folie auf die EM-Raster zu schweben: ein Behälter mit einem Ablassventil an der Unterseite, so dass Wasser abgelassen werden kann und die Kohleschicht gesenkt auf die wartet auf Gitter oder eine anhebende Rig, das die Netze auf unter Wasser gesetzt werden können Oberfläche, die später die Netze bis zu den Kohlenstoff-Film auf der Oberfläche des Wassers erhöhen kann.
- Füllen Sie den Behälter mit hochreinem destilliertem Wasser, so dass die Oberfläche des Wassers ca. 5 mm von der Spitze ist. Reinigen Sie die Oberfläche des Wassers, indem man ein Blatt oder zwei Linsenpapier über die Oberfläche, schwebende Partikel zu entfernen.
- Legen Sie ein Stück sauber Edelstahl-Filtergewebe (1 Zoll von 2,5 Zoll ist eine geeignete Größe) unter der Oberfläche des Wassers.
- Legen Sie mit einer feinen Pinzette, sauberen, trockenen EM Gitter offen (laut Herstellerbeschreibung) auf die Edelstahl Filtergewebe. Packen Sie die Netze so dicht wie möglich zusammen, aber nicht lassen Sie zu, dass sie überlappen.
- Sobald die Raster angeordnet sind, greifen Sie fest die Kohlenstoff-beschichtete Glimmer Blatt in ein paar Pinzette oder Zange zur Filmentwicklung.
- Einführen der Glimmervorlage ins Wasser. Stellen Sie sicher, dass dies in einem sehr flachen Winkel (~ 10 Grad).
Hinweis: Sollte der Glimmer durchbrechen der Wasseroberfläche und Tauchen, während der Carbon Film sollte von dem Glimmer getrennt und auf der Wasseroberfläche schwimmen. Dieser Schritt sollte nicht direkt über die Netze, um Beschädigung und Verschmutzung zu vermeiden durchgeführt werden.- Um die Möglichkeit der Carbon Film wird nicht von der Glimmervorlage trennen zu minimieren, um den Rand des Blattes mit einer Rasierklinge Glimmer Punktzahl oder Abschneiden einer Ecke mit einer kleinen Schere vor der Einführung ins Wasser.
- Sobald der Carbon Film gelöst hat, entfernen Sie die Folie Glimmer oder ließ ihn auf den Boden des Containers fallen.
- Feine Spitzen Pinzette, drücken Sie sehr sanft an und mit langsamen Bewegungen führen Sie die Kohlenstoff-Film über die Oberseite der Netze.
- Bringen Sie die Carbon-Blatt in Kontakt mit der Oberfläche der Netze entweder durch langsam ablassen des Wassers oder die Erhöhung der anhebenden Rings, je nach dem Typ des Geräts verwendet.
- Heben Sie vorsichtig die Edelstahl-Filtergewebe (jetzt mit Carbon-beschichtete Grids) aus dem Apparat und Docht entfernt überschüssiges Wasser mit einem Stück Filterpapier. Stellen Sie sicher, dass dies durch das Filterpapier an den Rand des die Stahlgitter berühren aber kommen nicht in Kontakt mit Gittern oder Carbon Film.
- Legen Sie das Netz der Netze in einer Petrischale mit einem trockenen Stück Filterpapier und lassen Sie es trocknen völlig.
Hinweis: Dies wird am besten durch Trocknung über Nacht bei Raumtemperatur beeinflusst, aber der Schritt kann beschleunigt werden, indem man die Netze in einem Ofen bei etwa 60 ° C.
- Bereiten Sie eine frisch gespalten Glimmer.
- Schwimmer und Mantel (direkte CO2-Abscheidung). Diese Methode wurde zuvor ausführlich beschrieben16
- Füllen Sie vollständig eine saubere große Glasschüssel bis zum Rand mit destilliertem Wasser aus, so dass ein Meniskus an der Spitze bildet.
- Wenden Sie einen einzigen Tropfen Kollodium-Lösung (Nitrozellulose in Amyl Acetat) an die Oberfläche des Wassers mit einer sauberen Pasteurpipette, lassen Sie das Tröpfchen verteilt und vollständig trocknen. Nach dem Trocknen wird eine dünne Schicht aus Kollodium schwimmend auf der Wasseroberfläche sichtbar.
- Entfernen Sie vorsichtig die Kollodium-Schicht mit einem Zahnstocher, um Staub oder andere Verunreinigungen von der Oberfläche des Wassers zu entfernen.
- Wenden Sie eine zweite Kollodium-Tröpfchen auf das Wasser an und lassen Sie es sich ausbreiten und ca. 2-3 Minuten trocknen.
Hinweis: Wiederholen Sie Schritte 1.2.3-1.2.4, bis man eine Wohnung und Falten frei Blatt Kollodium erhält. - Verwenden ein paar feine Pinzette Platz EM Gitter verdeckt (laut Herstellerbeschreibung) auf dem schwimmenden Kollodium-Blatt. Packen Sie die Netze zusammen fest in einer hexagonalen Anordnung, aber nicht lassen Sie zu, dass sie überlappen.
Hinweis: Wenn ein Raster ist fehl am Platz oder auf den Kopf gestellt, ist es in der Regel am besten, lassen Sie es im Ort als zu riskieren, das Kollodium-Blatt zu beschädigen, wenn Sie versuchen, es zu bewegen. - Sobald alle Raster platziert sind, legen Sie vorsichtig ein Blatt Filterpapier über sie. Lassen Sie das Papier durch Kapillarwirkung gesättigt werden.
Hinweis: Jeder möglicher Größe oder Dicke des Filterpapiers ist geeignet, wenn es die Gitter vollständig abdeckt. - Verwenden Sie einen Zahnstocher, um Kollodium-Film zu entfernen, der über das Filterpapier hinausgeht.
- Greifen Sie das Filterpapier am Rand und ziehen Sie es von der Wasseroberfläche.
Hinweis: Die Netze sollte auf dem Papier haften bleiben. - Legen Sie das Papier flach und Kollodium-Gesicht nach oben in eine Petrischale und lassen Sie vollständig trocknen.
- Platzieren Sie das Filterpapier mit dem Gitter in der Kammer von einem Kohlenstoff-Verdampfer mit einem entsprechend vorbereiteten Kohlenstoffelektrode wie in 1.1.2.
- Folgen Sie dem Kohlenstoff Verdunstung Verfahren, wie die Carbon-Blatt-Methode in
- Warten Sie einige Sekunden zwischen Impulsen zur Vermeidung von Überhitzung und Beschädigung der Nitrozellulose-Blatt.
Hinweis: Falls gewünscht, die Polymerschicht kann entfernt werden, nachdem die Gitter Kohlenstoff beschichtet, wurden, obwohl dieser Schritt nur selten notwendig ist. Stellen Sie die Gitter Kohlenstoff Seite nach oben auf ein frisches Stück Filterpapier und mehrere Tropfen Aceton auf dem Papier in der Nähe, aber nicht auf den Gittern. Das Aceton, verteilt unter den Gittern und löst und absorbiert die Polymerschicht zu ermöglichen.
2. Vorbereitung der Reagenzien Negative Färbung
-
Vorbereitung von Uranyl Acetat
- Ein kleines Volumen von ultrareinem Wasser zum Kochen bringen und 10 min zu entgasen gründlich kochen lassen. Lassen Sie etwas abkühlen, und dann verwenden Sie, um Uranyl Acetat (UA) bei 1-2 % (w/V) auflösen.
Hinweis: Führen Sie diesen Vorgang in einem Laborabzug und mit geeigneter persönlicher Schutzausrüstung. - Nachdem die Lösung abgekühlt ist, durch einen 0,2 µm Spritze Filter oder Filterpapier filtern.
- Speichern Sie die UA geschützt vor Licht und bei 4 ° c. Die Lösung ist für bis zu 1 Jahr stabil.
- Ein kleines Volumen von ultrareinem Wasser zum Kochen bringen und 10 min zu entgasen gründlich kochen lassen. Lassen Sie etwas abkühlen, und dann verwenden Sie, um Uranyl Acetat (UA) bei 1-2 % (w/V) auflösen.
-
Vorbereitung der Uranyl Formiat aus Pulver. Diese Methode ist im Detail vorher beschrieben worden8
- 20 mg Uranyl Formiat (UF) Pulver in 2 mL abgekochtes entgast Reinstwasser (wie in Schritt 2.1.1) durch Rühren auflösen.
- Weiterhin rühren, 8 µL 5 M NaOH hinzufügen, die Lösung sollte eine dunklere Farbe ändern, aber kein Niederschlag bilden sollte.
- Filtern Sie die Lösung durch einen 0,2 µm Spritze Filter.
- Der UF-Fleck vor Licht geschützt lagern. Verwerfen, die der Fleck sollte wenn Niederschlag oder braune Verfärbung wird beobachtet. Die Lösung ist nur für 1-2 Tage stabil.
-
Vorbereitung der Uranyl Formiat von Uranyl Acetat
- Auszufällen Sie 1 mL 1 % (w/V) UA Fleck durch Zugabe von 100 µL 1 M NaOH.
- Zentrifugieren Sie die Mischung für 2 min bei maximaler Geschwindigkeit in einer Zentrifuge Benchtop.
- Verwerfen Sie alle überstand und lösen Sie des Niederschlags in 100 µL 5 % (V/V) Ameisensäure durch kräftig aufschütteln auf.
- Verdünnen Sie zu einem Endvolumen von 1 mL mit 900 µL Reinstwasser UF Fleck in 0,5 % (V/V) Ameisensäure zu liefern.
- Der UF-Fleck vor Licht geschützt lagern. Verwerfen Sie den Fleck, wenn übereilte oder braune Verfärbungen beobachtet wird.
-
Vorbereitung der anderen Färbung Reagenzien
-
Vorbereitung der Lanthanid Acetat Flecken
- Lösen Sie auf, Samarium Acetat (SmAc), Gadolinium Acetat (GdAc), Thulium Acetat (TmAc) oder Erbium Acetat (ErAc) bei 1-2 % (w/V) in Reinstwasser.
Hinweis: Wenn Proben positive Färbung oder schlechte Einhaltung der Raster zeigen, wenn diese Flecken zu verwenden, sie können sein angesäuert mit bis zu 0,5 % (V/V) Ameisensäure. Positive Färbung ergibt sich in der Probe erscheinen als dunkle Objekt von einem weißen Halo umgeben. Armen festhalten an das Netz führt zu weniger Moleküle als erwartet beobachtet in der Startaufstellung.
- Lösen Sie auf, Samarium Acetat (SmAc), Gadolinium Acetat (GdAc), Thulium Acetat (TmAc) oder Erbium Acetat (ErAc) bei 1-2 % (w/V) in Reinstwasser.
-
Vorbereitung von Ammonium Molybdat und Natrium Phosphotungstate
- Lösen Sie den Fleck mit 1-3 % (w/V) in Reinstwasser. Stellen Sie den pH-Wert auf 7,0 mit 5 M NaOH, falls gewünscht.
-
Vorbereitung der Lanthanid Acetat Flecken
(3) Proben zu den Kohlenstoff adsorbierenden Substrat und Färbung
-
Vorbereitung der Grid Oberfläche für die Beispielanwendung von hydrophil zu rendern
- Legen Sie das Gitter nach oben auf einen Objektträger in einer Schein-Entlastung-Einheit.
- Behandeln Sie das Raster für ein Minimum von 30 s bei 10 mA.
Hinweis: Die genaue Methode der Glimmentladung hängt von den Vorgaben der das besondere Stück der Ausrüstung verwendet. - Alternativ kann dies durch UV-Bestrahlung für 10 Minuten mit einem Benchtop UV Lampe4erreicht werden.
-
Seite Blot-Methode. Diese Methode ist im Detail vorher beschrieben worden8
- Greifen Sie den Rand des Rasters mit Unterdruck Pinzette und wenden Sie 3 bis 5 µL der Probe auf die Auflagefläche.
- Ermöglichen die Probe zu adsorbieren an die Rasteroberfläche für 10 s, 1 min. optimieren die Adsorption Zeit muss für Einzelproben.
- Tippen Sie auf den Rand des Rasters, um ein Blatt Filterpapier und ermöglichen Sie Kapillarwirkung zu ziehen aus der Flüssigkeit zu.
- Optional: Waschen Sie das Raster. Platz 50 µL Tropfen Reinstwasser oder geeignete flüchtige Pufferlösung auf einem Blatt Labor Film. Sanft berühren Sie die Carbon-Oberfläche des Gitters bis zum Tropfen und einen kleinen Tropfen auf der Oberfläche des Gitters abheben. Tippen Sie auf den Rand des Rasters, um ein Blatt Filterpapier und ermöglichen Sie Kapillarwirkung zu ziehen aus der Flüssigkeit zu.
- Wiederholen Sie dies waschen so oft wie gewünscht.
- Platz zwei 50 µL Tropfen Reagenz auf einem Blatt Labor Film Färbung.
- Sanft berühren Sie die Carbon-Oberfläche des Gitters bis zum Tropfen und einen kleinen Tropfen auf der Oberseite des Gitters abheben.
Hinweis: Wenn der Fleck, wandert sollte die Rückseite des das Raster und das Netz dann verworfen werden. - Tippen Sie auf den Rand des Rasters, um ein Blatt Filterpapier und lassen Sie Kapillarwirkung die Flüssigkeit ziehen. Durchführen Sie diese Färbung Schritt zweimal.
- Lassen Sie das Gitter an der Luft trocken oder trocken unter einer Glühlampe.
-
Flicking Methode
- Greifen Sie den Rand des Rasters mit Unterdruck Pinzette und wenden Sie 3 bis 5 µL der Probe auf die Auflagefläche.
- Halten Sie die Pinzette in der Hand, so dass das Raster bei etwa 45 ° abgewandten abgewinkelt ist, schnell streichen Sie das Handgelenk, Hand, "aus den Großteil der Tropfen, der auf den Rost ist flick".
- Optional: Mit einem Glas Pasteurpipette geben Sie einen Tropfen der Waschlösung, die Auflagefläche und "flick off" wie in 3.2.2. Wiederholen Sie bei Bedarf.
- Mit einem Glas Pasteurpipette einen Tropfen Reagenz auf der Auflagefläche Färbung und "flick aus" wie in 3.2.2. Wiederholen Sie die 1-3 Mal Fleck Tiefe erforderlich für die Visualisierung der Probe abhängig.
Hinweis: Dies ist nicht der einzige Faktor, der letzte Fleck Tiefe zuschreibt (siehe Diskussion). - Entfernen Sie überschüssige Fleck durch Berühren der zerrissenen Rand ein Stück Filterpapier an den Rand des Rasters.
- Lassen Sie das Gitter an der Luft trocken oder trocken unter einer Glühlampe.
-
Rasche Buchungsmethode
- 30-70 µL des Flecks zu zeichnen (1 % UA in der Regel verwendet) in der Spitze einer 200 µL Pipette, drehen Sie den Lautstärkeregler bis 5 µL der Luft ziehen, dann waschen/mischen Reagenz (5-30 µL) aufzustellen, wenn erforderlich, von einem anderen kleinen Luftspalt gefolgt und dann bis 5 µL der Probe.
- Halt den Rand eines Rasters mit einem Unterdruck Pinzette, die Pinzette halten, so dass das Raster bei etwa 45 ° abgewandten der Forschers, abgewinkelt Auswerfen der gesamte Inhalt der Pipettenspitze über das Gesicht des Rasters Kohlenstoff-beschichtete EM.
- Entfernen Sie überschüssige Fleck durch Berühren der zerrissenen Rand ein Stück Filterpapier an den Rand des Rasters.
- Lassen Sie das Gitter an der Luft trocken oder trocken unter einer Glühlampe.
Hinweis: Bei allen Methoden ist es ratsam, den zerrissenen Rand aus einem Blatt Filterpapier entlang der Zange schieben, bis sie das Raster erreicht, wie dies Lösung zwischen den beiden Seiten der Zange, die das getrocknete Raster in die Backen der Zange ziehen können entfernt, sobald sie sind gefangen geöffnet. Das Raster in der Pinzette kann auch am Rande einer Abzugshaube zum Trocknen platziert werden. Die konstanten Luftstrom kann helfen, mehr zu produzieren sogar Färbung.
Ergebnisse
Die Färbung Reagenzien getestet produziert negative Färbung zu einem gewissen Grad mit UF Gewinnung der Proben mit dem größten Kontrast und schärfsten, detailliertesten Partikel. Für tief eingebettete Proben (Abbildung 1) Lanthanid-basierte Flecken ErAc und TmAc negative Färbung von gleichwertiger Qualität ua produziert wie beurteilt die scheinbare Kontrast und Schärfe der gefärbten Partikel, produzieren TmAc mit klarer, mehr gestochen scharfe Bilder als ErAc. Obwohl die größeren Korngröße des TmAc zeigt sich bei hoher Vergrößerung, Tabakmosaikvirus (TMV) Partikel mit 1 % TmAc ~ 23 Å wiederholen des TMV Teilchens befleckt waren17 war immer noch deutlich sichtbar mit dem Auge und als a meridionale Schichtanlage in der Fourier-Transformation der raw-Bild. Keiner der anderen Lanthanid Flecken getestet, ErAc, SmAc oder GdAc, waren in der Lage, diese Funktion zu beheben. Klasse Durchschnittswerte wurden erzeugt, durch die Gewinnung von überlappenden Segmente von TMV Partikel wo die spiralförmige Wiederholung sichtbar war. Die extrahierten Segmente wurden dann ausgerichtet und klassifiziert mit RELION18 besser visualisieren die periodische Funktion (Abbildung 2).
Einige Beispiele sind besonders empfindlich auf die Methode der Färbung, wie der Muskel C-Protein abgeleitet. C-Protein, bestehend aus einer flexiblen Reihe von Ig und Fn-ähnlichen Domänen, produziert deutlich unterschiedliche Bilder von negativ-Fleck EM abhängig von der Methode der Färbung verwendet (Abbildung 3). Mit der Seite-Blot-Methode, zusammengefaltet sind ringartige Strukturen beobachtet, während beim von der schnelle Spülung oder streichen Methoden befleckt, C-Protein als eine Reihe von Domänen beobachtet wird, die wie Perlen auf einer Schnur aussehen.
| Reagenz | Konzentration | pH | Typ |
| Ammonium-Molybdat | 1 - 2 % | 5 – 7 | Anionischen |
| Erbium-Acetat (ErAc) | 1 – 2 % | 6 | Kationischen |
| Gadolinium-Acetat (GdAc) | 1 – 2 % | 6 | Kationischen |
| Methylamin Wolframat | 2 % | 6 – 7 | Anionischen |
| Samarium-Acetat (SmAC) | 1 % | 6 | Kationischen |
| Natrium silicotungstate | 1 – 5 % | 5 – 8 | Anionischen |
| Natrium phosphotungstate | 1-3 % | 5 – 8 | Anionischen |
| Thulium Acetat (TmAc) | 1 – 2 % | 6 | Kationischen |
| Uranyl Acetat (UA) | 1 – 3 % | 3 – 4 | Kationischen |
| Uranyl Formiat (UF) | 0,75 – 1 % | 3 – 4 | Kationischen |
Tabelle 1: Einige gemeinsame negative Färbung Reagenzien.

Abbildung 1: Beispiel Mikrographen des Tabak-Mosaik-Virus mit verschiedenen negativen Fleck Reagenzien befleckt (A) 1 % UF (B) 2,5 % TmAc (C) 2,5 % ErAc. (D) 1 % UA (E) 2,5 % GdAc und (F) 2,5 % SmAc. Maßstabsleisten sind 100 nm. Repräsentative Bilder aus mehreren Wiederholungen mit mehreren Bereichen abgebildet pro replizieren. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2: Färbung Tabakmosaikvirus mit Thulium Acetat (A) hoher Vergrößerung des Bereiches von einem Schliffbild des TMV gebeizt mit 1 % TmAc. Maßstabsleiste beträgt 20 nm. (B) Klasse Durchschnitt der extrahierten TMV Segmente. (C) Fourier-Transformation des Bildes in zentrale A zeigt Layer Linie Reflexionen bei ~ 23 Å. Bitte klicken Sie hier für eine größere Version dieser Figur.
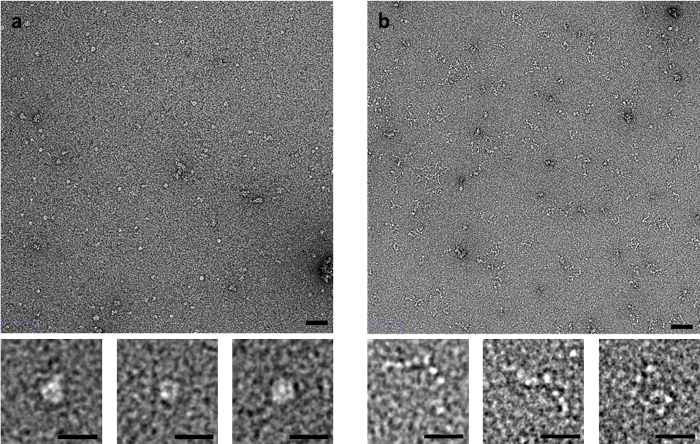
Abbildung 3: Auswirkungen der Blot-Methode auf die Konformation der C-Protein. (A) C-Protein mit UA mit der Seite-Blot-Methode und (B) flinken befleckt. Oberen Bereich Maßstabsleiste beträgt 50 nm, untere Schaltflächenleiste Skala beträgt 20 nm. Repräsentative Bilder aus mehreren Wiederholungen mit mehreren Bereichen abgebildet pro replizieren. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Dieses Manuskript beschreibt mehrere Methoden für die negative Färbung von Proben für Elektronenmikroskopie mit einer Vielzahl von Reagenzien, einschließlich zwei neuartige Lanthanid-Reagenzien (TmAc und ErAc) Färbung. Viele der Schritte des negativen Färbung Prozesses müssen für einzelne Proben, einschließlich der Auswahl der Fleck, waschen erforderlich, falls vorhanden, und die blotting-Technik optimiert werden. Diese Handschrift bietet damit eine Grundlage für Mikroskopiker, eigene Workflows für die Bewältigung der negativ-Färbung der anspruchsvolle Systeme zu entwickeln.
Die Wahl der Fleck ist stark abhängigen probieren. Proben, die besonders empfindlich auf niedrige pH-Wert können durch UA und/oder UF, trotz der Fixativ Eigenschaften von diesen Flecken19beeinträchtigt werden. In diesen Fällen basiert Lanthanid Flecken wie TmAc oder ErAc besser geeignet sein kann, obwohl der allgemeine pH-Wert der Zubereitung unterhalb des isoelektrischen Punktes des Proteins Probe um zu verhindern, positive Färbung gehalten werden muss. Dies kann erreicht werden durch den Fleck mit Essigsäure Ansäuern, falls erforderlich. Für besonders niedrige pH empfindlichen Proben können anionische Wolframat oder Molybdat Flecken effektiver sein. Obwohl diese Flecken induzieren die Bildung von Artefakten in einigen Fällen gefunden wurden, wie z. B. die Bildung von Rouleaux in Lipoprotein Proben20. Wiederum kann der pH-Wert des Flecks müssen angepasst werden, diese Zeit, um über dem isoelektrischen Punkt der Probe, um positive Verfärbung zu verhindern.
Waschen der Probe vor der Färbung kann notwendig sein, wenn der Puffer, in dem die Probe gehalten wird, eine hohe Salz oder Phosphat-Komponente hat. In vielen Fällen waschen mit Reinstwasser durchgeführt werden kann, aber für empfindlicher Proben, die verschlechtern oder strukturelle Veränderungen bei Wasser allein, waschen kann mit einem flüchtigen Puffer geringer Ionenstärke8durchgeführt werden müssen. Auch unter streng kontrollierten Bedingungen kann waschen einige strukturelle Neuordnung auf Carbon Oberfläche21führen.
Die Methode, durch die ein Raster in Bezug auf Probe Adsorption, beflecken und Färbung bereit ist, kann auch erheblich beeinflussen, was beobachtet wird. Die geeignetste Methode ist somit wiederum sehr probieren angewiesen. C-Protein, wird z. B. als kugelige ringartige Struktur nach Seite-Blot Färbung beobachtet, aber dies scheint ein Artefakt des Prozesses Färbung, wie offenbart, wenn Netze durch die flimmernden Methode (oder die schnelle Buchungsmethode) zubereitet werden (Abbildung 3 ). In der flinken und schnellen Buchungsmethoden ist die Zeit, die die Probe zur Interaktion mit der Carbon Auflagefläche vor Fixierung minimierte15. Die Probe erlebt auch weniger Kräfte von der zurückweichenden Meniskus auf Löschpapier vor Fixierung. Dies bedeutet, dass strukturelle Veränderungen in der Probe, die nach längerer Absorptionszeit auf dem Carbon-Film oder durch Kapillarwirkung auftreten konnten minimiert werden. Die schnelle Buchungsmethode kann auch für zeitaufgelöste Analyse der Proben verwendet werden. Die Probe mit einem Liganden oder Additiv innerhalb einer Pipettenspitze für einen Satz mischbar Zeitraum vor der Anwendung an einem Raster oder nur kurz auf der Rasteroberfläche vor Fixierung innerhalb von Millisekunden.
Die Tiefe der Fleck bieten optimale Bilder einer bestimmten Probe ist wieder Probe je2verpflichtet. Wenn der Fleck zu flach ist, können die Moleküle durch den Elektronenstrahl beschädigt werden können wenn der Fleck zu dick Strukturmerkmale jedoch verloren. Fleck-Tiefe wird durch mehrere Faktoren wie Hydrophilie der Rasteroberfläche, Ebenheit des Kohlenstoff-Schicht, die Höhe der Fleck auf das Raster, die Länge der Zeit, den Fleck in Kontakt mit dem Raster vor dem Beflecken, das Ausmaß der beflecken und die Zeit es ist ta angewendet beeinflusst KEs für das Raster zu trocken. Ein Raster haben nie eine gleichmäßige Verteilung der Fleck in seiner Gesamtheit und Bereiche des Rasters geeignet für Bildgebung müssen daher sorgfältig ausgewählt werden. In der Tat unterscheiden sich Netze oft in Qualität, auch wenn Sie am selben Tag unter den gleichen Bedingungen vorbereitet. Ein gutes Beispiel dafür, wie Variation in der Tiefe der Fleck beeinflusst das Aussehen der Moleküle und die entsprechenden Fleck Tiefe für Bildgebung von Burgess vorgesehen ist Et al.5.
Trotz negativer Färbung ein sehr vielseitiges, schnelle und einfache Methode, sind nicht alle biologische Proben Visualisierung von dieser Methode zugänglich. Fragile Baugruppen können zusammenbrechen oder zerlegen auf Adsorption, Färbung oder Trocknung auf die EM Raster22. Negative Färbung kann auch zu einer Abflachung der Moleküle und bevorzugte Orientierung der Moleküle auf dem Kohlenstoff Unterstützung Film7induzieren.
Negativen Fleck ist ein wertvolles Werkzeug für die Beurteilung der Proben aus eigenem Recht und auch vor der Cryo-EM-Analyse, aber viele der physikalischen Kräfte, die die Probe während des Prozesses Begegnungen sind schlecht verstanden. Daher der beste Ansatz zu verwenden ist sehr abhängigen probieren und muss durch Versuch und Irrtum als Autodidakt nach einem festen Protokoll ermittelt werden.
Offenlegungen
Die Autoren erklären keine konkurrierenden finanziellen Interessen.
Danksagungen
Wir sind sehr dankbar, Peter Ritter für hilfreiche Diskussionen und kritische Durchsicht des Manuskripts. Wir möchten alle Mitglieder Neil Ransons und des Stephen Muench Labors und Astbury Biostructure Laborpersonal für hilfreiche Gespräche danken. Diese Arbeit wurde finanziert durch den Europäischen Forschungsrat (RP7/2007-2013) / ERC-Grant Agreement 322408. C-Protein wurde mit Mitteln, die durch einen Zuschuss der British Heart Foundation (BHF PG/13/83/30485) hergestellt. Wir danken auch dem Wellcome Trust für Geräte, Mittel zur Unterstützung der Elektronenmikroskopie in Leeds (090932/Z/09/Z und 094232/Z/10/Z). CS ist durch ein Wellcome Trust ISSF finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| 200 mesh copper EM grids | Sigma-Aldrich | G4776-1VL | Other materials and/or mesh sizes can also be used |
| Ammonium Molybdate | Sigma-Aldrich | 277908 | |
| Carbon evaporator | Ted Pella Inc. | 9620 | Cressington 208 or equivalent |
| Collodion solution 2% in amyl acetate | Sigma-Aldrich | 9817 | |
| Dumont #5 negative pressure tweezers | World Precision Instruments | 501202 | Or other tweezers as preferred |
| Erbium Acetate | Sigma-Aldrich | 325570 | |
| Gadolinium Acetate | Sigma-Aldrich | 325678 | |
| Mica Sheets. 75x25x0.15mm. | AGAR Scientific | AGG250-1 | |
| Microscope slides, white frosted | Fisher Scientific | 12607976 | Or equivalent |
| Parafilm | Fisher Scientific | 10018130 | Or equivalent |
| Pasteur pipette (glass) | Fisher Scientific | 10343663 | Or equivalent |
| Razor blade | Fisher Scientific | 11904325 | Or equivalent |
| Sandpaper | Hardware store | Wet and dry sandpaper with grit finer that 200 (600 suggested) | |
| Samarium Acetate | Sigma-Aldrich | 325872 | |
| Sodium Hydroxide | Sigma-Aldrich | 1.06462 | |
| Sodium Phosphotungstate | Sigma-Aldrich | P6395 | |
| Stainless Steel Mesh, 150x150 mm (cut to size). | AGAR Scientific | AGG252 | |
| Thulium Acetate | Sigma-Aldrich | 367702 | |
| Two Step Carbon Rod Sharper, for 1/4" rods | Ted Pella Inc. | 57-10 | Or equivalent for carbon evaporator used |
| Ultra pure water | |||
| Uranyl Acetate | Electron Microscopy Sciences | 22400 | |
| Uranyl Formate | Electron Microscopy Sciences | 22450 | |
| Vacuum grease | Fisher Scientific | 12719406 | Or equivalent |
| Whatman #1 Filter paper. | Fisher Scientific | 1001 090 | Or equivalent |
| Whatman #40 filter paper | Fisher Scientific | 10674122 | Or equivalent |
Referenzen
- Merk, A., et al. Breaking Cryo-EM Resolution Barriers to Facilitate Drug Discovery. Cell. 165 (7), 1698-1707 (2016).
- De Carlo, S., Harris, J. R. Negative staining and cryo-negative staining of macromolecules and viruses for TEM. Micron. 42 (2), 117-131 (2011).
- Thompson, R. F., Walker, M., Siebert, C. A., Muench, S. P., Ranson, N. A. An introduction to sample preparation and imaging by cryo-electron microscopy for structural biology. Methods. 100, 3-15 (2016).
- Ha, J. Y., et al. Molecular architecture of the complete COG tethering complex. Nat Struct Mol Biol. 23 (8), 758-760 (2016).
- Burgess, S. A., Walker, M. L., Thirumurugan, K., Trinick, J., Knight, P. J. Use of negative stain and single-particle image processing to explore dynamic properties of flexible macromolecules. J Struct Biol. 147 (3), 247-258 (2004).
- Fabre, L., Bao, H., Innes, J., Duong, F., Rouiller, I. Negative-stain single particle EM of the maltose transporter in nanodiscs reveals asymmetric closure of MalK2 and catalytic roles of ATP, MalE and maltose. J Biol Chem. , (2017).
- Zhang, L., et al. An optimized negative-staining protocol of electron microscopy for apoE4 POPC lipoprotein. J Lipid Res. 51 (5), 1228-1236 (2010).
- Ohi, M., Li, Y., Cheng, Y., Walz, T. Negative Staining and Image Classification - Powerful Tools in Modern Electron Microscopy. Biol Proced Online. 6 (1), 23-34 (2004).
- Haschemeyer, R. H., Myers, R. J. . Negative Staining in Principles and Techniques of Electron Microscopy. 2, 101-147 (1972).
- Massover, W. H. Positive staining of protein molecules for electron microscopy: polyiodination of the apoferritin shell in ferritin. Ultramicroscopy. 52, 383-387 (1993).
- Harris, J. R., Bhella, D., Adrian, M. Recent Developments in Negative Staining for Transmission Electron Microscopy. Microsc Microanal. 20, 17-21 (2006).
- Hosogi, N., Nishioka, H., Nakakoshi, M. Evaluation of lanthanide salts as alternative stains to uranyl acetate. Microscopy (Oxf). 64 (6), 429-435 (2015).
- Zhao, F., Craig, R. Capturing time-resolved changes in molecular structure by negative staining. J Struct Biol. 141, 43-52 (2003).
- Cao, B., Xu, H., Mao, C. Transmission electron microscopy as a tool to image bioinorganic nanohybrids: the case of phage-gold nanocomposites. Microsc Res Tech. 74 (7), 627-635 (2011).
- Imai, H., et al. Direct observation shows superposition and large scale flexibility within cytoplasmic dynein motors moving along microtubules. Nat Commun. 6, 8179 (2015).
- Booth, D. S., Avila-Sakar, A., Cheng, Y. Visualizing proteins and macromolecular complexes by negative stain EM: from grid preparation to image acquisition. J Vis Exp. (58), (2011).
- Kendall, A., McDonald, M., Stubbs, G. Precise determination of the helical repeat of tobacco mosaic virus. Virology. 369 (1), 226-227 (2007).
- Scheres, S. H. A Bayesian view on cryo-EM structure determination. J. Mol. Bio. 415 (2), 406-418 (2012).
- Bremer, A., Henn, C., Engel, A., Baumeister, W., Aebi, U. Has negative staining still a place in biomacromolecular electron microscopy?. Ultramicroscopy. 46, 85-111 (1992).
- Garewal, M., Zhang, L., Ren, G., Kleinschmidt, J. . Lipid-Protein Interactions. Methods Mol Biol (Methods and Protocols). 974, 111-118 (2012).
- Walker, M. L., et al. Two-headed binding of a processive myosin to F-actin. Nature. 405 (6788), 804-807 (2000).
- Orlova, E. V., Saibil, H. R. Structural Analysis of Macromolecular Assemblies by Electron Microscopy. Chem Rev. 111 (12), 7710-7748 (2011).
Erratum
Formal Correction: Erratum: Variations on Negative Stain Electron Microscopy Methods: Tools for Tackling Challenging Systems
Posted by JoVE Editors on 1/30/2020. Citeable Link.
An erratum was issued for: Variations on Negative Stain Electron Microscopy Methods: Tools for Tackling Challenging Systems. An author name was updated.
One of the authors' names was corrected from:
Matthew G. Iadaza
to:
Matthew G. Iadanza
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten