Method Article
Variações na negativa mancham métodos de microscopia eletrônica: ferramentas para enfrentar o desafio sistemas
Neste Artigo
Erratum Notice
Resumo
Mancha negativa EM é uma técnica poderosa para a visualização de estrutura macromolecular, mas diferentes técnicas de coloração podem produzir resultados diferentes de forma dependente de amostra. Aqui, várias abordagens de coloração negativas são descritas em detalhes para fornecer um fluxo de trabalho inicial para combater a visualização dos sistemas desafiadoras.
Resumo
Microscopia eletrônica de mancha negativa (EM) permite observação relativamente simples e rápida de macromoléculas e macromoleculares complexos através da utilização de contraste, realçando a mancha reagente. Embora limitado na resolução a um máximo de ~ 18-20 Å, mancha negativa EM é útil para uma variedade de problemas biológicos e também fornece um meio rápido de avaliar amostras para microscopia cryo-elétron (cryo-EM). O fluxo de trabalho mancha negativa é método simples; a amostra é adsorvida sobre um substrato e, em seguida, uma mancha é aplicada, apagada e secos para produzir uma camada fina de mancha densa elétron, no qual as partículas são incorporadas. Amostras individuais podem, no entanto, se comportar de forma marcadamente diferente sob diferentes condições de coloração. Isto levou ao desenvolvimento de uma grande variedade de técnicas de preparação do substrato, negativas de reagentes e grade de lavagem e mancha as técnicas de coloração. Determinar a técnica mais adequada para cada amostra individual deve ser feito em uma base caso-a-caso e microscopista deve ter acesso a uma variedade de técnicas diferentes para alcançar os resultados da mais alta qualidade mancha negativa. Protocolos detalhados para três diferentes técnicas de mancha e dois métodos de preparação de substrato diferentes são fornecidos, e é mostrado um exemplo de uma amostra que mostra resultados marcadamente diferentes dependendo do método utilizado. Além disso, a preparação de alguns reagentes comuns de coloração negativas e dois novas manchas Lanthanide-based, é descrita com a discussão sobre o uso de cada um.
Introdução
Apesar da recente atenção à resolução revolução resultante de avanços significativos no cryo-elétron microscopia1 (cryo-EM), negativo mancha permanece EM uma técnica poderosa e um componente crucial da caixa de ferramentas dos elétrons microscopistas. Coloração negativa continua a ser o melhor método de avaliação rápida de uma amostra antes de otimizar as condições de cryo-grade2. O alto contraste e velocidade de preparação de grade de amostras negativas manchadas é ideal para avaliar a pureza da amostra, concentração, heterogeneidade e flexibilidade conformacional3. Muitas estruturas biologicamente informativas resultaram de reconstruções mancha negativa, apesar de resolução da técnica, limitando-se a 18 ~ Å resolução4,5,6, e algumas amostras produzem melhores resultados na mancha do que cryo-EM para uma variedade de razões,7.
Na mancha negativa EM, a partícula de interesse é adsorvida sobre a superfície de uma grade EM e envolto por uma matriz amorfa de mancha de elétron denso composta. Um alto contraste relativo é produzido entre o fundo e a partícula de interesse, com a partícula sendo menos elétron denso do que o circundante mancha8. As partículas aparecem como áreas claras por causa de seu poder de espalhamento de elétrons de baixa em relação a densa mancha circundante, que dispersa os elétrons mais e aparece mais escura. Subestruturais características de partículas podem ser deduzidas o exame pormenorizado de imagens resultantes como mancha irá penetrar qualquer fenda e produzir contraste irregular detalhe9.
O processo de coloração negativo começa com a preparação de um substrato de apoio, no qual as partículas da amostra são capturadas e a camada da mancha seca com suporte. O substrato de apoio mais comumente usado é uma camada de carbono amorfo, às vezes apoiado por uma fina camada de polivinil (por exemplo, Formvar) ou nitrocelulose (por exemplo, colódio) polímero. Estes substratos podem ser adquiridos comercialmente ou preparados em casa usando os protocolos descritos abaixo.
Depois que o substrato de apoio é preparado, a amostra pode ser aplicada, e a solução em excesso destruídos fora. As amostras devem ser suspensas em um buffer apropriado para coloração de negativo. É melhor evitar o uso de tampão fosfato e altas concentrações de sal, que podem dar origem a precipitados cristalinos que podem obscurecer o espécime. Agentes redutores, detergentes, sacarose, glicerol e altas concentrações de nucleótidos também devem ser evitadas, como eles afetam também mancha qualidade4. Quando a composição do tampão não pode ser alterada, a superfície da grelha EM com água de lavagem ou um buffer mais adequado após adsorção e antes da coloração pode reduzir a formação de buffer de artefatos relacionados e geralmente melhorar o plano de fundo da mancha. Se artefatos de reserva são suspeitos, pode ser informativo para manchar uma grade somente buffer para determinar se os componentes da reserva são a fonte dos artefatos observados.
Depois que a amostra é adsorvida e destruída e lavada, se necessário, é aplicado um reagente de coloração. Uma variedade de reagentes foram encontrados para ser eficazes manchas negativas (tabela 1), mas a mancha deve ser escolhida de acordo com a amostra. Um 'halo' mancha formas em torno da partícula devido a ambos o deslocamento das moléculas mancha pelas regiões hidrofóbicas da proteína e repulsão pelo acusado grupos. Portanto, a mancha deve ser escolhida de modo que o estado de protonação de quaisquer potenciais grupos carregados na proteína é o mesmo que a mancha com o pH de trabalho. Em frente de cargas na superfície da proteína pode contribuir para uma coloração positiva efeito, que, embora uma técnica útil em sua própria direita10 não está no escopo deste trabalho. Os reagentes de coloração negativos mais comumente usados são acetato de uranilo e formiato de uranilo. Estas manchas têm um tamanho de grão relativamente fino (4-5 Å)9 e fornecer imagens de alta resolução sobre outras manchas como phospho-volframos (Å tamanho de grão de 8-9)9,11, de molibdato de amónio11e alguns baseados em lantanídeos manchas de12. Formiato e acetato de uranilo também agem como um fixador, preservando muitas interações da proteína-proteína em um milésimo de segundo tempo escala13, embora o baixo pH da mancha e sua propensão para precipitar em pH fisiológico pode ser prejudicial para algumas amostras14 . Apesar de sua utilidade, os sais de uranilo também apresentam desafios logísticos como eles são tóxico e levemente radioativo, o que pode exigir tratamento especial, armazenamento, e requisitos de eliminação, o que leva alguns usuários a procurar alternativas não-radioativo.
Há uma grande variedade de métodos descritos para o preparo do substrato, o aplicativo de exemplo e a coloração das grades EM. O método mais apropriado a utilizar é dependente de amostra e pode ser difícil verificar ao abordar um novo sistema. Este manuscrito descreve dois métodos de preparo do substrato e três métodos de mancha; lado borrando flicking5e rápida descarga15. Lado-a mancha é o mais simples dos métodos descritos. O método flicking e o método de lavagem rápido são mais difíceis de implementar, mas limitar o tempo de contato da amostra com o filme de suporte antes de fixação e têm sido mostrados para melhorar a formação de mancha artefatos para algumas amostras de5. O objetivo deste manuscrito é, portanto, para fornecer um fluxo de trabalho inicial para combater a visualização dos sistemas desafiadoras por negativo-mancha EM.
Protocolo
1. preparação de grades EM
- Método de folha de carbono
- Prepare uma folha de mica clivada recentemente.
- Insira cuidadosamente a agulha de uma seringa de precisão ou uma lâmina de barbear em um canto da folha de mica, alguns milímetros entre as camadas. Inserir a ferramenta como perto do centro vertical da folha como possível produzir dois pedaços de aproximadamente a mesma espessura.
- Cuidadosamente abrir as duas metades da folha de mica. Fazer isso pode pelo olho, ou sob um microscópio de dissecação.
- Corte um dos cantos de cada uma das folhas de mica clivada recentemente. No caso em que a folha se virar no evaporador carbono durante lançamento de vácuo, o lado de carbono revestido da folha pode ser identificado.
- Coloque a folha de mica clivada/s na câmara de um evaporador de carbono, com a superfície recém-clivada virada para cima.
- Certifique-se que o evaporador de carbono é o set-up corretamente com um eletrodo de carbono devidamente preparados.
Nota: O método de preparar as barras de carbono pode variar dependendo das especificações do evaporador de carbono. Um protocolo para um instrumento é como segue até o passo 1.1.5.- Sharpen uma vareta de carbono com um apontador para ter uma ponta afiada e depois lustrá-la com uma toalha de papel para remover quaisquer rebarbas ásperas.
- Usando uma lixa fina achatar o fim de uma segunda vara e lustrá-la novamente suave com uma toalha de papel.
- Coloque as barras de duas carbono dentro do evaporador de acordo com as instruções do fabricante. Certifique-se de que extremidade afiada na haste do primeira faz contato firme com a face achatada da segunda haste.
- Coloque um pequeno pedaço de papel de filtro limpo e seco, parcialmente sob a mica se a espessura de carbono vai ser avaliados visualmente. Como alternativa, coloque uma lâmina de microscópio fosco branco com uma pequena bagatela de vácuo graxa juntamente com a mica para medir a espessura de carbono.
- Depósito de carbono para a mica de acordo com as instruções do fabricante.
- Bomba o vácuo para baixo e espere até que esteja a 10-5 mbar. Definir a tensão do eletrodo para 4.0 V (até 5 V pode ser necessária, dependendo da fonte de haste de carbono).
- Executar vários pulsos curtos de aproximadamente 3.5 s em duração através do eletrodo para depositar evaporações espessura de 1-2 nm de carbono na superfície de mica.
Nota: Como corrente é aplicada à haste do carbono que irá brilhar em vermelho e branco em seguida. Não olhe para a luz brilhante como isso poderia danificar os olhos. - Permitir que o carbono depositar sobre a mica até a espessura desejada é atingida, como medido pelo medidor de espessura do evaporador carbono ou pela observação visual do carbono depositado no papel de filtro ou de microscópio. Certifique-se de que a camada de carbono final é 5-10 nm de espessura.
- Se a espessura de carbono é avaliada visualmente comparar a parte geada do microscópio slide revestido com graxa de vácuo para a área exposta, ele se tornará mais escuro como mais carbono é depositado.
Nota: Não há nenhum método quantitativo para determinar a espessura de carbono quando usando este método.
- Se a espessura de carbono é avaliada visualmente comparar a parte geada do microscópio slide revestido com graxa de vácuo para a área exposta, ele se tornará mais escuro como mais carbono é depositado.
- Ventilar a câmara de vácuo e retire o mica carbono revestido do evaporador de carbono.
Nota: A mica revestida de carbono pode ser assente a noite antes de prosseguir com as etapas subsequentes - Use um dos dois recipientes de água para flutuar o filme de carbono para as grades EM: um recipiente com uma válvula de drenagem na parte inferior, então a água pode ser drenada para fora e a camada de carbono reduzido para as grades aguardando ou um equipamento de levantamento que as grades podem ser definidas na debaixo d'água superfície, que posteriormente pode elevar as grades até o filme de carbono na superfície da água.
- Encha o recipiente com água ultrapura água destilada para que a superfície da água é de aproximadamente 5 mm do topo. Limpe a superfície da água, arrastando uma folha ou duas de tecido lente sobre a superfície para remover quaisquer partículas flutuantes.
- Coloque um pedaço de malha de aço inoxidável limpo (1 polegada por 2,5 polegadas é um tamanho adequado) sob a superfície da água.
- Usando um par de pinças bem, estava limpa e seca EM grades viradas para cima (de acordo com a descrição do fabricante) sobre a malha de aço inoxidável. Embalamos as grades juntos tão firmemente quanto possível, mas não permitir que se sobrepõem.
- Uma vez que as redes são organizadas, segure firmemente a folha de mica revestida de carbono em um par de pinças ou filme desenvolvendo tenaz.
- Apresente a folha de mica para a água. Certifique-se de que isto é feito em um ângulo muito raso (~ 10 graus).
Nota: A mica deve quebrar a superfície da água e mergulhe, enquanto o filme de carbono deve separar a mica e flutuam na superfície da água. Esta etapa não deve ser realizada diretamente sobre as grades, para evitar danos e/ou contaminação.- Para minimizar a possibilidade da vontade de filme de carbono não se separa da folha de mica, marcar ao redor da borda da folha de mica com uma lâmina de barbear ou cortar um canto com uma pequena tesoura antes de introduzi-lo na água.
- Uma vez que o filme de carbono desencaixada, remova a folha de mica ou deixá-lo cair para o fundo do recipiente.
- Usando uma pinça com ponta fina, aplique uma pressão muito suave e com movimentos lentos, guia o filme de carbono por cima das grades.
- Trazer a folha de carbono em contacto com a superfície das grades ou por lentamente drenando a água ou levantar o anel de levantamento, dependendo do tipo de aparelho utilizado.
- Levante com cuidado a malha de aço inoxidável (agora com grades de carbono revestido) do aparelho e pavio fora alguns do excesso de água usando um pedaço de papel de filtro. Certifique-se de que isto é feito por tocar o papel de filtro à beira da malha aço mas não entrar em contato com as grades ou filme de carbono.
- Coloque a malha das redes em uma placa de Petri contendo um pedaço seco de papel de filtro e deixe a ele secar completamente.
Nota: Isto melhor é afetado por secagem durante a noite em temperatura ambiente, mas o passo pode ser acelerado pela colocação das grelhas em estufa a aproximadamente 60 ° C.
- Prepare uma folha de mica clivada recentemente.
- Float e casaco (deposição de carbono direto). Esse método foi descrito em detalhe anteriormente16
- Completamente, encha uma tigela de vidro limpo grande até a borda com água destilada para que um menisco constitui-se no topo.
- Aplique uma gota de solução de Colódio (nitrocelulose em acetato de amila) à superfície da água com uma pipeta pasteur limpo, permitir que a gota espalhar e secar completamente. Depois de seco uma camada fina de colódio flutuando sobre a superfície da água será visível.
- Remova suavemente a camada de colódio usando um palito de dentes para remover poeira ou outra contaminação da superfície da água.
- Aplicar uma segunda gota de colódio para a água e deixe-a espalhar-se e secar durante 2-3 minutos.
Nota: Repita os passos 1.2.3-1.2.4 até obter uma folha livre plana e enrugamento de colódio. - Usando um par de pinças bem lugar EM grades de bruços (de acordo com a descrição do fabricante) na folha de colódio flutuante. Embale as grades juntos firmemente em uma matriz hexagonal, mas não permitir que se sobrepõem.
Nota: Se uma grade é extraviada ou colocada de cabeça para baixo é geralmente melhor para deixá-lo no lugar, ao invés de risco de danificar a folha de colódio ao tentar movê-lo. - Uma vez que todas as redes são colocadas, delicadamente, coloque uma folha de papel de filtro sobre eles. Permitir que o papel tornar-se saturado por ação capilar.
Nota: Qualquer tamanho ou espessura de papel de filtro é adequada se cobre completamente as grades. - Use um palito para remover qualquer filme de colódio que ultrapassa o papel de filtro.
- Segure o papel de filtro na borda e descascá-lo da superfície da água.
Nota: As grades devem ficar aderidas ao jornal. - Coloque o papel liso e colódio-rosto em uma placa de Petri e deixe-o secar completamente.
- Coloque o papel de filtro com as grades na câmara de um evaporador de carbono com um eletrodo de carbono devidamente preparados conforme detalhado em 1.1.2.
- Siga o procedimento de evaporação de carbono conforme descrito para o método de folha de carbono na
- Permita vários segundos entre pulsos para evitar sobreaquecimento e danificar a folha de nitrocelulose.
Nota: Se desejar que a camada de polímero pode ser removida após as grades têm sido carbono revestido, embora esta etapa é raramente necessária. Coloque o lado de carbono de grades acima em uma folha de papel de filtro e colocar algumas gotas de acetona no papel perto, mas não, as grades. Permitir que a acetona espalhar-se sob as grelhas e dissolver e absorver a camada de polímero.
2. preparação dos reagentes de coloração negativa
-
Preparação do acetato de uranilo
- Leve um pequeno volume de água ultrapura para ferver e deixe-a ferver durante 10 min desgaseificar completamente. Deixe-o esfriar um pouco e então usá-lo para dissolver o acetato de uranilo (UA) em 1-2% (p/v).
Nota: Execute esse procedimento em uma hotte e com equipamento de protecção adequado. - Após a solução esfriar, filtre através de um filtro de seringa 0,2 µm ou papel de filtro.
- Armazene protegido da luz e no 4 ˚ c a UA. A solução é estável por até 1 ano.
- Leve um pequeno volume de água ultrapura para ferver e deixe-a ferver durante 10 min desgaseificar completamente. Deixe-o esfriar um pouco e então usá-lo para dissolver o acetato de uranilo (UA) em 1-2% (p/v).
-
Preparação de uranilo formiato de pó. Este método tem sido descrito em detalhe anteriormente8
- Dissolva o pó de formiato (UF) de uranilo 20 mg em 2 mL de água ultrapura desgaseificada fervida (como na etapa 2.1.1) por agitação.
- Continuando a mexer, adicionar 8 µ l de 5 M de NaOH, a solução deve mudar para uma cor amarela mais escura, mas não precipitado deve formar.
- Filtre a solução através de um filtro de seringa 0,2 µm.
- Loja a mancha UF protegida da luz. Descarte que a mancha deve se precipitar ou marrom descoloração é observado. A solução só é estável durante 1-2 dias.
-
Preparação de uranilo formiato de acetato de uranilo
- Precipitar a 1 mL de 1% (p/v) mancha UA adicionando-se 100 µ l de 1 M de NaOH.
- Centrifugue a mistura por 2 min na velocidade máxima em uma centrífuga de bancada.
- Descarte qualquer sobrenadante e dissolver o precipitado em 100 µ l de 5% (v/v) de ácido fórmico vortexing vigorosa.
- Dilua até um volume final de 1 mL com 900 µ l de água ultrapura para produzir a mancha UF em 0,5% (v/v) de ácido fórmico.
- Loja a mancha UF protegida da luz. Descarte a mancha se for observada qualquer descoloração precipitada ou marrom.
-
Preparação de reagentes de coloração
-
Preparação do acetato de Lanthanide manchas
- Dissolva o acetato de samário (SmAc), acetato de gadolínio (GdAc), acetato de Túlio (TmAc) ou acetato de érbio (ErAc) no 1-2% (p/v) em água ultrapura.
Nota: Se amostras mostram coloração positiva ou pobre aderência à grade quando usando estas manchas, eles podem ser acidificados com até 0,5% (v/v) de ácido fórmico. Coloração positiva resulta na amostra aparecendo como um objeto escuro, rodeado por um halo branco. Pobre aderência à grade irá resultar em moléculas menos do que o esperado sendo observada na grelha.
- Dissolva o acetato de samário (SmAc), acetato de gadolínio (GdAc), acetato de Túlio (TmAc) ou acetato de érbio (ErAc) no 1-2% (p/v) em água ultrapura.
-
Preparação de molibdato de amónio e Phosphotungstate de sódio
- Dissolva a mancha em 1-3% (p/v) em água ultrapura. Ajuste o pH a 7,0 usando 5 M de NaOH, se desejado.
-
Preparação do acetato de Lanthanide manchas
3. as amostras para o carbono absorver muito substrato e coloração
-
Preparação da superfície da grade para o aplicativo de exemplo pelo processamento-lo hidrofílico
- Coloque a grade virada para cima em uma corrediça do microscópio em uma unidade de descarga do fulgor.
- Tratar a grade durante um período mínimo de 30 s a 10 mA.
Nota: O método exato de brilho da descarga dependerá das especificações da peça do equipamento utilizado. - Alternativamente, este pode ser realizada por irradiação UV durante 10 minutos, usando uma bancada UV lâmpada4.
-
Lado mancha método. Este método tem sido descrito em detalhe anteriormente8
- Agarre na extremidade da grade com um par de pinças de pressão negativa e aplicar 3 a 5 µ l de amostra para a superfície de apoio.
- Permitir que a amostra de adsorção para a superfície de grade 10 s a 1 min. otimizar o tempo de adsorção deve para amostras individuais.
- Tocar a borda da grade para uma folha de papel de filtro e permitem a ação capilar retirar o líquido.
- Opcional: Lave a grelha. Colocar 50 µ l gotas de água ultrapura ou solução de amortecedor apropriado volátil em uma folha de filme de laboratório. Delicadamente toque na superfície do carbono da grade para o soltar e retire uma pequena gota sobre a superfície da grade. Tocar a borda da grade para uma folha de papel de filtro e permitem a ação capilar retirar o líquido.
- Repita esta etapa de lavagem, como muitas vezes como desejado.
- Lugar dois 50 µ l gotas do reagente em uma folha de filme de laboratório de coloração.
- Delicadamente toque na superfície do carbono da grade para o soltar e retire uma pequena gota sobre a superfície superior da grade.
Nota: Se a mancha migra para parte de trás da grade, em seguida, a grade deve ser descartada. - Tocar a borda da grade para uma folha de papel de filtro e permitem a ação capilar retirar o líquido. Execute esta etapa coloração duas vezes.
- Permitir que a grade de ar seco ou seco sob uma lâmpada de incandescência.
-
Flicking método
- Agarre na extremidade da grade com um par de pinças de pressão negativa e aplicar 3 a 5 µ l de amostra para a superfície de apoio.
- Segurando uma pinça em uma mão, para que a grade tem um ângulo de aproximadamente 45° virada para fora, rapidamente vire o punho da mão para 'filme' fora a maior parte da gota que está em cima da grade.
- Opcional: Usando um pipeta Pasteur de vidro aplicar uma gota de solução de lavagem para a superfície de apoio e 'flick fora', como em 3.2.2. Repita, se necessário.
- Usando um pipeta Pasteur de vidro aplicar uma gota de reagente para a superfície de apoio de coloração e 'flick fora', como em 3.2.2. Repita 1 - 3 vezes dependente mancha profundidade necessária para a visualização da amostra.
Nota: Este não é o único fator que atribui à profundidade final mancha (ver discussão). - Remova a mancha excesso ao tocar a borda rasgada de um pedaço de papel de filtro para a borda da grade.
- Permitir que a grade de ar seco ou seco sob uma lâmpada de incandescência.
-
Método rápido de Flushing
- Desenhar 30-70 µ l da mancha (1% UA geralmente usado) na ponta de uma pipeta de 200 µ l, gire o botão de volume para elaborar 5 µ l de ar e, em seguida, elaborar lavagem/mistura reagente (5-30 µ l), se necessário, seguido por outra abertura de ar pequena e então elaborar 5 µ l de amostra.
- A borda de uma grade com um par de pinças de pressão negativa, para que a grade tem um ângulo de aproximadamente 45° de costas para o pesquisador, a segurar a pinça de aperto ejetar todo o conteúdo da ponta da pipeta no rosto da grade EM carbono revestido.
- Remova a mancha excesso ao tocar a borda rasgada de um pedaço de papel de filtro para a borda da grade.
- Permitir que a grade de ar seco ou seco sob uma lâmpada de incandescência.
Nota: Para todos os métodos é aconselhável deslize a borda rasgada de uma folha de papel de filtro junto a pinça até atingir a grade como isso remove a solução presa entre os dois lados da pinça, que pode puxar a grade seca para as garras da pinça uma vez que eles são abriu. A grade em uma pinça também pode ser colocada na borda de uma coifa para secar. O constante fluxo de ar pode ajudar a produzir mais nem coloração.
Resultados
Todos os reagentes coloração testados produziram coloração negativa em algum grau, com UF rendendo as amostras com o maior contraste e partículas mais nítidas, mais detalhadas. Para manchas de lantanídeos com base em amostras profundamente incorporado (Figura 1) ErAc e TmAc produziram coloração negativa de qualidade equivalente a UA como julgados pela aparente contraste e nitidez das partículas manchadas, com TmAc mais clara, produzindo imagens mais nítidas do que ErAc. Embora o maior tamanho de grão da TmAc torna-se aparente na alta ampliação, quando as partículas do vírus do mosaico do tabaco (TMV) foram coradas com 1% TmAc o Å ~ 23 repita da partícula TMV17 ainda era claramente visível a olho nu e como a linha de camada meridional na Transformada de Fourier da imagem raw. Nenhuma das outras lantanídeos manchas testadas, ErAc, SmAc ou GdAc, era capaz de resolver esse recurso. Classe médias foram geradas extraindo segmentos sobrepostos de partículas TMV, onde a repetição helicoidal foi visível. Os segmentos extraídos então estavam alinhados e classificados usando RELION18 para visualizar melhor a característica periódica (Figura 2).
Algumas amostras são especialmente sensíveis para o método de coloração, tais como o músculo derivado da proteína C. C-proteína, que consiste de uma sequência flexível de Ig e Fn-como domínios, produz imagens significativamente diferentes por negativo-mancha EM dependente do método de coloração usado (Figura 3). Quando usando o método de lado-mancha, desabou anel-como estruturas são observadas, Considerando que quando manchado pela lavagem rápida ou passar rapidamente métodos, C-proteína é observada como uma série de domínios que se assemelham a grânulos em uma sequência de caracteres.
| Reagente | Concentração | pH | Tipo |
| Molibdato de amónio | 1 - 2% | 5 – 7 | Aniônicos |
| Acetato de érbio (ErAc) | 1 – 2% | 6 | Catiônica |
| Acetato de gadolínio (GdAc) | 1 – 2% | 6 | Catiônica |
| Tungstato de metilamina | 2% | 6 – 7 | Aniônicos |
| Acetato de samário (SmAC) | 1% | 6 | Catiônica |
| Silicotungstate de sódio | 1 – 5% | 5 – 8 | Aniônicos |
| Phosphotungstate de sódio | 1 -3% | 5 – 8 | Aniônicos |
| Acetato de Túlio (TmAc) | 1 – 2% | 6 | Catiônica |
| Acetato de uranilo (UA) | 1 – 3% | 3 – 4 | Catiônica |
| Formiato de uranilo (UF) | 0,75 – 1% | 3 – 4 | Catiônica |
Tabela 1: Alguns comuns negativos coloração reagentes.

Figura 1: micrografias de exemplo do vírus do mosaico do tabaco manchado com vários reagentes mancha negativa (A) 1% UF (B) 2,5% TmAc (C) 2,5% ErAc. (D) 1% UA (E) 2,5% GdAc e (F) 2,5% SmAc. Barras de escala são 100 nm. Imagens representativas de várias repetições com múltiplas áreas fotografadas por replicar. Clique aqui para ver uma versão maior desta figura.

Figura 2: coloração do vírus do mosaico do tabaco com acetato de Túlio (A) alta ampliação da área de uma micrografia de TMV coradas com 1% TmAc. Barra de escala é de 20 nm. (B) de classe média de segmentos extraídos do TMV. Transformada de Fourier (C) da imagem em reflexões de linha de camada painel A apresentando em 23 ~ Å. clique aqui para ver uma versão maior desta figura.
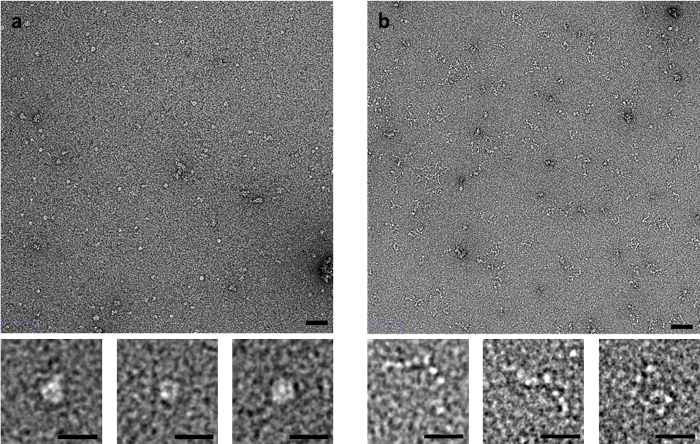
Figura 3: efeitos da mancha método sobre a conformação da proteína-C. (A) C-proteína manchado com UA usando o método do lado do Borrão e flicking método (B) . Barra de escala superior do painel é 50 nm, barra de escala inferior do painel é de 20 nm. Imagens representativas de várias repetições com múltiplas áreas fotografadas por replicar. Clique aqui para ver uma versão maior desta figura.
Discussão
Este manuscrito descreve vários métodos para a coloração negativa de amostras para microscopia eletrônica usando uma variedade de reagentes, incluindo dois reagentes romance lantanídeos (TmAc e ErAc) de coloração. Muitas das etapas do processo de coloração negativa devem ser otimizadas para amostras individuais, incluindo a escolha de mancha, a quantidade de lavagem necessária, se houver e a técnica da mancha. Este manuscrito, portanto, fornece uma base para microscopistas desenvolver seus próprios fluxos de trabalho para combater o negativo de coloração dos sistemas desafiadoras.
A escolha da mancha é altamente dependente da amostra. Amostras que são especialmente sensíveis ao pH baixo podem ser degradadas pela UA e/ou UF, apesar das propriedades fixador destas manchas19. Nestes casos, lantanídeos baseados em manchas como TmAc ou ErAc pode ser mais apropriado, embora o pH geral da preparação deve ser mantido abaixo do ponto isoelétrico da proteína para ajudar a prevenir a coloração positiva amostra. Isso pode ser feito por acidificantes a mancha com ácido acético, se necessário. Para amostras sensíveis especialmente baixo pH, aniônicas manchas tungstato ou molibdato podem ser mais eficazes. Embora estas manchas foram encontradas para induzir a formação de artefatos em alguns casos, tais como a formação de rouleaux em lipoproteína amostras de20. Novamente, o pH da mancha pode precisar ser ajustada, neste momento, acima do ponto isoelétrico da amostra, para evitar coloração positiva.
Lavagem da amostra antes da coloração pode ser necessária se o buffer no qual a amostra é mantida tem uma elevada componente de sal ou fosfato. Em muitos casos, lavagem pode ser realizada com água ultrapura mas para amostras mais sensíveis, o que podem degradar ou sofrer mudanças estruturais quando exposto a água sozinho, lavagem pode precisar ser executada com um buffer volátil de baixa força iônica8. Mesmo sob condições cuidadosamente controladas, a lavagem pode resultar em um rearranjo estrutural sobre a superfície do carbono21.
O método pelo qual uma grade está preparada em termos de adsorção de amostra, mancha e mancha pode afetar também significativamente o que é observado. O método mais apropriado é assim, mais uma vez, altamente amostra dependente. Proteína-C, por exemplo, é observada como uma estrutura globular em anel após coloração de lado-blot, mas este parece ser um artefato do processo de coloração, como revelado quando grades são preparados pelo método flicking (ou pelo método de liberação rápido) (Figura 3 ). Os métodos de irrigação flicking e rápidos, o tempo que a amostra deve interagir com o carbono apoio superfície antes de fixação é minimizado15. A amostra também experiências menos forças de menisco recuo sobre a mancha antes da fixação. Isto significa que mudanças estruturais na amostra que poderia ocorrer após o tempo de absorção prolongada sobre o filme de carbono ou através de ação capilar são minimizadas. O método de nivelamento rápido também pode ser usado para análise de tempo-resolvido de espécimes. A amostra pode ser misturada com um ligante ou aditivo dentro de uma ponta de pipeta para um conjunto de período de tempo antes da aplicação de uma grade ou momentaneamente sobre a superfície da grade antes de fixação dentro milissegundos.
A profundidade da mancha necessária para fornecer imagens ideais de um determinado espécime novo é dependente de amostra2. Se a mancha é muito rasa, moléculas podem ser danificadas pelo feixe de elétron, mas se a mancha é grossa demais características estruturais podem ser perdidas. Profundidade da mancha é influenciada por vários fatores, tais como Hidrofilia da superfície da grelha, uniformidade da camada de carbono, a quantidade de mancha aplicada à grade, o comprimento de tempo a mancha está em contato com a grade antes da mancha, a extensão da mancha e o tempo ta Kes para a grade para secar completamente. Uma grade nunca terá uma distribuição uniforme da mancha em sua totalidade e, portanto, áreas da grade apropriada para a imagem latente precisam ser selecionados cuidadosamente. Com efeito, grades muitas vezes variam em qualidade, mesmo quando preparados no mesmo dia nas mesmas condições. Um bom exemplo de como a variação na profundidade da mancha afeta o aparecimento de moléculas e a profundidade da mancha apropriado para geração de imagens é fornecida por Burgess et al5.
Apesar de negativo coloração ser um método muito versátil, rápido e simples, nem todos os espécimes biológicos são passíveis de visualização por esse método. Assemblies frágil podem recolher ou desmontar a adsorção, coloração ou secagem no grade EM22. Coloração negativa pode também levar a achatamento das moléculas e induzir orientações preferenciais de moléculas sobre o suporte de carbono filme7.
Mancha negativa é uma ferramenta valiosa para avaliação de espécimes em sua própria direita e também antes da análise de cryo-EM... mas muitas das forças físicas, que a amostra encontra-se durante o processo são mal compreendidas. Portanto, a melhor abordagem para usar é altamente dependente da amostra e deve ser determinada por tentativa e erro ao invés de ensinadas na sequência de um protocolo fixo.
Divulgações
Os autores declaram não concorrentes interesses financeiros.
Agradecimentos
Somos extremamente gratos ao Peter Knight para discussões úteis e revisão crítica do manuscrito. Gostaríamos de agradecer a todos os membros dos laboratórios de Neil Ranson e de Stephen Muench e o pessoal de Astbury Biostructure laboratório para debates úteis. Este trabalho foi financiado pelo Conselho Europeu de investigação (FP7/2007-2013) / ERC concessão acordo 322408. Proteína-C foi produzida usando recursos fornecidos por uma concessão da British Heart Foundation (BHF PG/13/83/30485). Agradecemos também a confiança de Wellcome para equipamentos de financiamento para apoiar a microscopia eletrônica em Leeds (090932/Z/09/Z e 094232/Z/10/Z). CS é financiado por um subsídio de ISSF Wellcome Trust.
Materiais
| Name | Company | Catalog Number | Comments |
| 200 mesh copper EM grids | Sigma-Aldrich | G4776-1VL | Other materials and/or mesh sizes can also be used |
| Ammonium Molybdate | Sigma-Aldrich | 277908 | |
| Carbon evaporator | Ted Pella Inc. | 9620 | Cressington 208 or equivalent |
| Collodion solution 2% in amyl acetate | Sigma-Aldrich | 9817 | |
| Dumont #5 negative pressure tweezers | World Precision Instruments | 501202 | Or other tweezers as preferred |
| Erbium Acetate | Sigma-Aldrich | 325570 | |
| Gadolinium Acetate | Sigma-Aldrich | 325678 | |
| Mica Sheets. 75x25x0.15mm. | AGAR Scientific | AGG250-1 | |
| Microscope slides, white frosted | Fisher Scientific | 12607976 | Or equivalent |
| Parafilm | Fisher Scientific | 10018130 | Or equivalent |
| Pasteur pipette (glass) | Fisher Scientific | 10343663 | Or equivalent |
| Razor blade | Fisher Scientific | 11904325 | Or equivalent |
| Sandpaper | Hardware store | Wet and dry sandpaper with grit finer that 200 (600 suggested) | |
| Samarium Acetate | Sigma-Aldrich | 325872 | |
| Sodium Hydroxide | Sigma-Aldrich | 1.06462 | |
| Sodium Phosphotungstate | Sigma-Aldrich | P6395 | |
| Stainless Steel Mesh, 150x150 mm (cut to size). | AGAR Scientific | AGG252 | |
| Thulium Acetate | Sigma-Aldrich | 367702 | |
| Two Step Carbon Rod Sharper, for 1/4" rods | Ted Pella Inc. | 57-10 | Or equivalent for carbon evaporator used |
| Ultra pure water | |||
| Uranyl Acetate | Electron Microscopy Sciences | 22400 | |
| Uranyl Formate | Electron Microscopy Sciences | 22450 | |
| Vacuum grease | Fisher Scientific | 12719406 | Or equivalent |
| Whatman #1 Filter paper. | Fisher Scientific | 1001 090 | Or equivalent |
| Whatman #40 filter paper | Fisher Scientific | 10674122 | Or equivalent |
Referências
- Merk, A., et al. Breaking Cryo-EM Resolution Barriers to Facilitate Drug Discovery. Cell. 165 (7), 1698-1707 (2016).
- De Carlo, S., Harris, J. R. Negative staining and cryo-negative staining of macromolecules and viruses for TEM. Micron. 42 (2), 117-131 (2011).
- Thompson, R. F., Walker, M., Siebert, C. A., Muench, S. P., Ranson, N. A. An introduction to sample preparation and imaging by cryo-electron microscopy for structural biology. Methods. 100, 3-15 (2016).
- Ha, J. Y., et al. Molecular architecture of the complete COG tethering complex. Nat Struct Mol Biol. 23 (8), 758-760 (2016).
- Burgess, S. A., Walker, M. L., Thirumurugan, K., Trinick, J., Knight, P. J. Use of negative stain and single-particle image processing to explore dynamic properties of flexible macromolecules. J Struct Biol. 147 (3), 247-258 (2004).
- Fabre, L., Bao, H., Innes, J., Duong, F., Rouiller, I. Negative-stain single particle EM of the maltose transporter in nanodiscs reveals asymmetric closure of MalK2 and catalytic roles of ATP, MalE and maltose. J Biol Chem. , (2017).
- Zhang, L., et al. An optimized negative-staining protocol of electron microscopy for apoE4 POPC lipoprotein. J Lipid Res. 51 (5), 1228-1236 (2010).
- Ohi, M., Li, Y., Cheng, Y., Walz, T. Negative Staining and Image Classification - Powerful Tools in Modern Electron Microscopy. Biol Proced Online. 6 (1), 23-34 (2004).
- Haschemeyer, R. H., Myers, R. J. . Negative Staining in Principles and Techniques of Electron Microscopy. 2, 101-147 (1972).
- Massover, W. H. Positive staining of protein molecules for electron microscopy: polyiodination of the apoferritin shell in ferritin. Ultramicroscopy. 52, 383-387 (1993).
- Harris, J. R., Bhella, D., Adrian, M. Recent Developments in Negative Staining for Transmission Electron Microscopy. Microsc Microanal. 20, 17-21 (2006).
- Hosogi, N., Nishioka, H., Nakakoshi, M. Evaluation of lanthanide salts as alternative stains to uranyl acetate. Microscopy (Oxf). 64 (6), 429-435 (2015).
- Zhao, F., Craig, R. Capturing time-resolved changes in molecular structure by negative staining. J Struct Biol. 141, 43-52 (2003).
- Cao, B., Xu, H., Mao, C. Transmission electron microscopy as a tool to image bioinorganic nanohybrids: the case of phage-gold nanocomposites. Microsc Res Tech. 74 (7), 627-635 (2011).
- Imai, H., et al. Direct observation shows superposition and large scale flexibility within cytoplasmic dynein motors moving along microtubules. Nat Commun. 6, 8179 (2015).
- Booth, D. S., Avila-Sakar, A., Cheng, Y. Visualizing proteins and macromolecular complexes by negative stain EM: from grid preparation to image acquisition. J Vis Exp. (58), (2011).
- Kendall, A., McDonald, M., Stubbs, G. Precise determination of the helical repeat of tobacco mosaic virus. Virology. 369 (1), 226-227 (2007).
- Scheres, S. H. A Bayesian view on cryo-EM structure determination. J. Mol. Bio. 415 (2), 406-418 (2012).
- Bremer, A., Henn, C., Engel, A., Baumeister, W., Aebi, U. Has negative staining still a place in biomacromolecular electron microscopy?. Ultramicroscopy. 46, 85-111 (1992).
- Garewal, M., Zhang, L., Ren, G., Kleinschmidt, J. . Lipid-Protein Interactions. Methods Mol Biol (Methods and Protocols). 974, 111-118 (2012).
- Walker, M. L., et al. Two-headed binding of a processive myosin to F-actin. Nature. 405 (6788), 804-807 (2000).
- Orlova, E. V., Saibil, H. R. Structural Analysis of Macromolecular Assemblies by Electron Microscopy. Chem Rev. 111 (12), 7710-7748 (2011).
Erratum
Formal Correction: Erratum: Variations on Negative Stain Electron Microscopy Methods: Tools for Tackling Challenging Systems
Posted by JoVE Editors on 1/30/2020. Citeable Link.
An erratum was issued for: Variations on Negative Stain Electron Microscopy Methods: Tools for Tackling Challenging Systems. An author name was updated.
One of the authors' names was corrected from:
Matthew G. Iadaza
to:
Matthew G. Iadanza
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados