Method Article
Variazioni in negativo macchia metodi di microscopia elettronica: strumenti per affrontare impegnativi sistemi
In questo articolo
Erratum Notice
Riepilogo
Macchia negativa EM è una potente tecnica per la visualizzazione struttura macromolecolare, ma diverse tecniche di colorazione possono produrre risultati diversi in un modo dipendente di esempio. Qui diversi approcci di macchiatura negativi sono descritte in dettaglio per fornire un flusso di lavoro iniziale per affrontare la visualizzazione di sistemi impegnativi.
Abstract
Macchia negativa la microscopia elettronica (EM) permette l'osservazione relativamente semplice e veloce di macromolecole e complessi macromolecolari attraverso l'uso di contrasto macchia reagente. Anche se limitata nella risoluzione a un massimo di ~ 18-20 Å, macchia negativa EM è utile per una varietà di problemi biologici e fornisce anche un mezzo rapido per valutare campioni di cRIO-microscopia elettronica (cryo-EM). Il flusso di lavoro di macchia negativa è il metodo diretto; il campione è adsorbito su un substrato, poi una macchia è applicata, cancellata ed essiccata per produrre un sottile strato di macchia fitta di elettrone in cui le particelle sono incorporate. Campioni individuali possono, tuttavia, comportarsi in modi nettamente diversi sotto diverse condizioni di colorazione. Questo ha portato allo sviluppo di una grande varietà di tecniche di preparazione di substrato, dei reagenti e dalla griglia di lavaggio e macchiare le tecniche di colorazione negative. Determinare la tecnica più appropriata per ogni singolo campione deve essere fatto su una base del contenitore-da-contenitore e un microscopista dovrà avere accesso a una varietà di tecniche differenti per raggiungere i risultati di altissima qualità macchia negativa. Protocolli dettagliati per due metodi di preparazione del substrato differenti e tre diverse tecniche macchiantesi sono forniti, e viene illustrato un esempio di un campione che Mostra risultati nettamente diversi a seconda del metodo utilizzato. Inoltre, la preparazione di alcuni comuni reagenti di colorazione negative e due macchie romanzo basato su lantanidi, è descritto con discussione per quanto riguarda l'uso di ciascuno.
Introduzione
Nonostante la recente attenzione sulla risoluzione rivoluzione conseguenti progressi significativi nel cryo-elettrone microscopia1 (cryo-EM), negativo macchia EM rimane una tecnica potente e una componente cruciale della casella degli strumenti degli elettroni microscopisti. Macchiatura negativa rimane ancora il metodo migliore per la valutazione rapida di un campione prima di ottimizzare cryo-griglia condizioni2. L'elevato contrasto e velocità di preparazione griglia dei campioni negativi macchiati lo rende ideale per valutare la purezza del campione, la concentrazione, eterogeneità e flessibilità conformazionale3. Molte strutture biologicamente informativi hanno portato dalle ricostruzioni di macchia negativa, nonostante la risoluzione della metodica si limita a ~ 18 Å risoluzione4,5,6, e alcuni campioni di ottenere risultati migliori nella macchia di cryo-EM per una varietà di motivi7.
Nella macchia negativa EM, la particella di interesse è adsorbita sulla superficie di una griglia di EM e avvolto da una matrice amorfa di macchia fitta di elettrone composto. Un elevato contrasto relativo viene prodotto tra lo sfondo e la particella di interesse, con la particella essendo meno densi dell'elettrone rispetto al circostante macchia8. Le particelle appaiono come zone chiare a causa del loro potere di scattering elettrone bassa rispetto la fitta macchia circostante, che disperde gli elettroni più e appare più scura. Caratteristiche strutturali delle particelle possono essere dedotto dall'esame dettagliato delle immagini risultanti come macchia penetrerà in qualsiasi fessura e produrre irregolare contrast dettaglio9.
Il processo di colorazione negativo inizia con la preparazione di un substrato di supporto su cui vengono acquisite le particelle del campione e lo strato di macchia secca supportato. Il substrato di supporto più comunemente usato è uno strato di carbonio amorfo, talvolta supportato da un sottile strato di polivinile (ad es. Formvar) o polimeri di nitrocellulosa (ad es. collodio). Questi substrati possono essere acquistati in commercio o preparati in casa utilizzando i protocolli descritti di seguito.
Dopo aver preparato il substrato di supporto, il campione può essere applicato, e la soluzione in eccesso cancellati fuori. I campioni dovrebbero essere sospesi in un tampone idoneo per la colorazione del negativo. Si consiglia di evitare l'utilizzo di tampone fosfato e alte concentrazioni di sale, che possono dar luogo a precipitati cristallini che possono oscurare il campione. Agenti riducenti, detergenti, saccarosio, glicerolo e alte concentrazioni di nucleotide dovrebbero anche essere evitate come colpiscono anche macchia qualità4. Quando la composizione di buffer non può essere modificata, la superficie della griglia EM con acqua di lavaggio o un tampone più idoneo dopo adsorbimento e prima della colorazione può ridurre la formazione del buffer di elementi correlati e in generale migliorare lo sfondo di macchia. Se gli artefatti buffer sono sospettati, può essere informativo a macchiare una griglia di sola buffer per determinare se i componenti del tampone sono la fonte degli elementi osservati.
Dopo il campione è adsorbito e cancellato e lavato se necessario, viene applicato un colorazione reagente. Una varietà di reagenti sono stati trovati per essere efficace macchie negative (tabella 1), ma la macchia deve essere scelto per soddisfare il campione. Un 'halo' delle forme di macchia intorno la particella a causa sia dello spostamento delle molecole macchia dalle regioni idrofobiche della proteina e repulsione di carica gruppi. Pertanto, la macchia deve essere scelto in modo che lo stato di protonazione di qualsiasi potenziali gruppi carichi sulla proteina è lo stesso come la macchia al pH di lavoro. Fronte a oneri sulla superficie della proteina può contribuire a una macchiatura positiva effetto, che anche se una tecnica utile nella propria destra10 non è nell'ambito di questa carta. I reagenti di colorazione negativi più comunemente usati sono acetato di uranile e formiato di uranile. Queste macchie hanno una granulometria relativamente fine (4-5 Å)9 e fornire immagini ad alta risoluzione sopra altre macchie come fosfo-wolframati (8-9 Å granulometria)9,11, Ammonio molibdato11e alcuni basati su lantanidi macchie di12. Formiato e acetato di uranile anche agire come un fissativo, conservando molte interazioni proteina-proteina su un millisecondo tempo scala13, anche se il basso pH della macchia e la sua propensione a precipitare a pH fisiologico può essere dannoso per alcuni campioni14 . Nonostante la loro utilità, i sali di uranile presentano anche le sfide logistiche come essi sono entrambi tossico e leggermente radioattiva, che possa richiedere speciali di movimentazione, stoccaggio, e requisiti di smaltimento, che porta alcuni utenti a cercare alternative non radioattivo.
Ci sono una grande varietà di metodi descritti per la preparazione del substrato, applicazione di esempio e colorazione delle griglie di EM. Il metodo più appropriato da utilizzare è campione dipendente e può essere difficile da accertare quando si affronta un nuovo sistema. Questo manoscritto descrive due metodi di preparazione del substrato e tre metodi macchiantesi; lato macchiare, flicking5e rapid15vampate di calore. Lato-blotting è il più semplice dei metodi descritti. Il metodo passa rapidamente e il metodo di consuntivazione rapido sono più difficili da implementare, ma limitare il tempo di contatto del campione con il film di supporto prima della fissazione e hanno dimostrato di migliorare la formazione di artefatti di macchia per alcuni campioni5. L'obiettivo di questo manoscritto è così di fornire un flusso di lavoro iniziale per affrontare la visualizzazione di sistemi difficili da negativo-macchia EM.
Protocollo
1. preparazione di griglie di EM
- Metodo del foglio di carbonio
- Preparare un foglio di mica appena spaccati.
- Inserire delicatamente un ago di siringa di precisione o una lama di rasoio in un angolo del foglio di mica, pochi mm tra gli strati. Inserire l'utensile come vicino al centro verticale del foglio come possibile produrre due pezzi circa dello stesso spessore.
- Attentamente prise apart le due metà del foglio mica. Fare questo può dall'occhio, o sotto un microscopio per dissezione.
- Tagliare uno degli angoli di ciascuno dei fogli appena fenduti mica. Nel caso in cui il foglio gira nell'evaporatore carbonio durante il rilascio del vuoto, il lato di carbonio rivestito del foglio può essere identificato.
- Posizionare il foglio mica spaccati/s nella camera di un evaporatore di carbonio, con la superficie appena spaccati rivolto verso l'alto.
- Assicurarsi che l'evaporatore di carbonio è set-up correttamente con un elettrodo di carbonio adeguatamente preparati.
Nota: Il metodo di preparazione le barre di carbonio variano a seconda delle specifiche dell'evaporatore di carbonio. Un protocollo per uno strumento è come segue fino al passo 1.1.5.- Affilare una canna in carbonio con un temperino per avere una punta affilata e quindi lucidare con un tovagliolo di carta per rimuovere eventuali sbavature ruvido.
- Utilizzando carta vetrata fine appiattire la fine di una seconda canna e nuovo polacco liscia con un tovagliolo di carta.
- Posizionare le barre di due carbonio nell'evaporatore secondo le istruzioni del produttore. Garantire che l'estremità affilata sull'asta prima è la costante contatto con il viso appiattito della seconda canna.
- Posto un piccolo pezzo di carta da filtro pulito e asciutto parzialmente sotto la mica se lo spessore di carbonio sta per essere valutata visivamente. In alternativa, posizionare un vetrino da microscopio satinato bianco con un piccolo tocco di grasso per vuoto a fianco la mica per misuratore di spessore di carbonio.
- Deposito di carbonio sulla mica secondo le istruzioni del produttore.
- Il vuoto della pompa verso il basso e attendere fino a quando è a 10-5 mbar. Impostare la tensione dell'elettrodo di 4.0 V (fino a 5 V può essere richiesto a seconda della fonte di carbonio rod).
- Eseguire più brevi impulsi di circa 3.5 s in durata attraverso l'elettrodo a depositare evaporazioni spessore di 1-2 nm di carbonio sulla superficie di mica.
Nota: Come viene applicata la corrente per la canna in carbonio si illuminerà di rosso e poi bianco. Non guardare la luce luminosa quanto ciò potrebbe danneggiare gli occhi. - Consentire il carbonio per depositare sulla mica fino a quando viene raggiunto lo spessore desiderato, misurata mediante il misuratore di spessore di evaporatore di carbonio o di osservazione visiva del carbonio depositato sulla carta da filtro o vetrino da microscopio. Assicurarsi che lo strato di carbonio finale è 5-10 nm di spessore.
- Se lo spessore del carbonio è calibrato visivamente confrontare la parte smerigliata del vetrino microscopio rivestito con grasso per vuoto per l'area esposta, diventerà più scura, come più carbonio è depositato.
Nota: Non c'è nessun metodo quantitativo per determinare lo spessore di carbonio quando si utilizza questo metodo.
- Se lo spessore del carbonio è calibrato visivamente confrontare la parte smerigliata del vetrino microscopio rivestito con grasso per vuoto per l'area esposta, diventerà più scura, come più carbonio è depositato.
- Sfiatare la camera a vuoto e rimuovere la mica rivestita di carbonio dall'evaporatore al carbonio.
Nota: La mica rivestita di carbonio può essere lasciata decantare una notte prima di procedere con i passaggi successivi - Utilizzare uno dei due contenitori di acqua a galleggiare il film di carbonio sulle griglie di EM: un contenitore con una valvola di scarico nella parte inferiore in modo da far defluire l'acqua e lo strato di carbonio abbassato verso le griglie in attesa o un impianto di sollevamento che le griglie possono essere impostate su sotto l'acqua superficie, che può successivamente alzare le griglie fino a film di carbonio presso la superficie dell'acqua.
- Riempire il contenitore con acqua distillata ultrapura in modo che la superficie dell'acqua è di circa 5 mm dalla parte superiore. Pulire la superficie dell'acqua trascinando un foglio o due di tessuto lente sopra la superficie per rimuovere eventuali particelle di galleggiante.
- Posizionare un pezzo di maglia di acciaio inox pulito (1 pollice da 2,5 pollici è una dimensione appropriata) sotto la superficie dell'acqua.
- Utilizzando un paio di pinzette bene, laici pulito e asciutto EM griglie a faccia in su (secondo la descrizione del produttore) sulla mesh in acciaio inox. Imballare le griglie insieme più strettamente possibile, ma non permettere loro di sovrapporsi.
- Una volta che le griglie sono disposti, afferrare saldamente il foglio di mica rivestita di carbonio in un paio di pinzette o pinze di sviluppo di pellicole.
- Introdurre il foglio di mica in acqua. Garantire che ciò avvenga con un'angolazione molto bassa (~ 10 gradi).
Nota: La mica deve attraversare la superficie dell'acqua e immergere, mentre il film di carbonio dovrebbe separare dalla mica e galleggiare sulla superficie dell'acqua. Questo passaggio non deve essere eseguito direttamente sopra le griglie, per evitare danni e/o contaminazione.- Per ridurre al minimo la possibilità di non separare dal foglio mica la volontà del pellicola carbonio, Punteggio ottenuto intorno al bordo del foglio mica con una lama di rasoio o tagliare un angolo con piccole forbici prima di introdurlo in acqua.
- Una volta che la pellicola di carbonio è scollegato, rimuovere il foglio di mica o lasciarlo cadere sul fondo del contenitore.
- Usando la pinzetta punta fine, applicare una pressione molto delicata e con movimenti lenti e guidare la pellicola di carbonio sopra la parte superiore delle griglie.
- Portare il foglio di carbonio a contatto con la superficie delle griglie o lentamente lo scarico dell'acqua o alzando l'anello di sollevamento, a seconda del tipo di apparecchio utilizzato.
- Sollevare con cautela la mesh in acciaio inox (ora con griglie rivestite di carbonio) dall'apparecchio e stoppino via l'acqua in eccesso utilizzando un pezzo di carta da filtro. Assicurarsi che questo è fatto da toccare il filtro di carta fino al bordo della maglia d'acciaio, ma non entrano in contatto con le griglie o pellicola di carbonio.
- Posizionare la mesh di griglie in una capsula di Petri contenente un pezzo di carta da filtro secco e lasciare ad esso asciugare completamente.
Nota: Questo è meglio influenzata da essiccamento durante la notte a temperatura ambiente, ma il passo può essere accelerato mettendo le griglie in un forno a circa 60 ° C.
- Preparare un foglio di mica appena spaccati.
- Galleggiante e cappotto (deposizione di carbonio diretto). Questo metodo è stato descritto in dettaglio in precedenza16
- Così un menisco forma nella parte superiore, completamente di riempire una ciotola di vetro grande e pulita fino all'orlo con acqua distillata.
- Applicare una goccia di soluzione di collodio (nitrocellulosa in acetato di amile) sulla superficie dell'acqua utilizzando una pipetta pasteur pulito, permettono la goccia stendere e asciugare completamente. Una volta asciutto un sottile strato di collodio che galleggia sulla superficie dell'acqua sarà visibile.
- Rimuovere delicatamente lo strato di collodio utilizzando uno stuzzicadenti per rimuovere polvere o altri contaminanti dalla superficie dell'acqua.
- Applicare una goccia di collodio seconda all'acqua e lasciarlo stendere e asciugare per 2-3 minuti.
Nota: Ripetere i passaggi 1.2.3-1.2.4 fino ad ottenuta un foglio piatto e ruga libero di collodio. - Usando un paio di pinzette bene posto a faccia in griglie EM giù (secondo la descrizione del produttore) sul foglio di collodio galleggiante. Imballare le griglie insieme strettamente in una matrice esagonale, ma non permettere loro di sovrapporsi.
Nota: Se una griglia è smarrita o messo a testa in giù è generalmente migliore di lasciare in posto, piuttosto che rischiare di danneggiare il foglio di collodio quando si cerca di spostarlo. - Una volta che tutte le griglie vengono inserite, appoggialo delicatamente con un foglio di carta da filtro su di loro. Consentire la carta si impregni per azione capillare.
Nota: Qualsiasi dimensione o spessore di carta da filtro è appropriato se copre completamente le griglie. - Utilizzare uno stuzzicadenti per rimuovere qualsiasi pellicola di collodio che si estende oltre la carta da filtro.
- Afferrare la carta da filtro al bordo e staccarla dalla superficie dell'acqua.
Nota: Le griglie dovrebbero stare aderite alla carta. - Posizionare il piatto di carta e collodio-viso fino in una capsula di Petri e lasciare asciugare completamente.
- Porre la carta da filtro con le griglie nella camera di un evaporatore di carbonio con un elettrodo di carbonio opportunamente preparati come dettagliato al punto 1.1.2.
- Seguire la procedura di evaporazione di carbonio come descritto per il metodo del foglio di carbonio in
- Consentire diversi secondi tra impulsi per evitare surriscaldamento e danneggiare il foglio di nitrocellulosa.
Nota: Se si desidera lo strato di polimero possa essere rimossi dopo le griglie sono state carbonio rivestito, anche se questo passaggio è raramente necessario. Posizionare le griglie laterali carbonio alto su un pezzo di carta da filtro fresca e mettere alcune gocce di acetone sul libro vicino, ma non su, le griglie. Consentire l'acetone stendere sotto le griglie e sciogliere e assorbire lo strato di polimero.
2. preparazione dei reagenti di colorazione negativa
-
Preparazione di acetato di uranile
- Portare un piccolo volume di acqua ultrapura a ebollizione e lasciare bollire per 10 min degassificare completamente. Lasciar raffreddare leggermente e quindi utilizzarlo per sciogliere acetato di uranile (UA) a 1-2% (p/v).
Nota: Eseguire questa procedura in una cappa e con opportuni dispositivi di protezione personali. - Dopo che la soluzione è raffreddata, filtrare attraverso un filtro da 0,2 µm siringa o carta da filtro.
- Memorizzare la UA protetto dalla luce e a 4 ˚ c. La soluzione è stabile per 1 anno.
- Portare un piccolo volume di acqua ultrapura a ebollizione e lasciare bollire per 10 min degassificare completamente. Lasciar raffreddare leggermente e quindi utilizzarlo per sciogliere acetato di uranile (UA) a 1-2% (p/v).
-
Preparazione di formiato di uranile da polvere. Questo metodo è stato descritto in dettaglio in precedenza8
- Sciogliere la polvere di formiato (UF) di uranile 20 mg in 2 mL di acqua ultrapura degassato bollita (come descritto al punto 2.1.1) mediante agitazione.
- Pur continuando a mescolare, aggiungere 8 µ l di 5 M NaOH, la soluzione dovrebbe cambiare in un colore giallo più scuro, ma nessun precipitato dovrebbe formare.
- Filtrare la soluzione attraverso un filtro per siringa 0,2 µm.
- Archivio la macchia UF al riparo dalla luce. Scartare che la macchia dovrebbe se qualunque precipitare o marrone scolorimento è osservato. La soluzione è stabile solo per 1-2 giorni.
-
Preparazione di formiato di uranile da acetato di uranile
- Precipitare 1 mL di 1% (p/v) macchia UA aggiungendo 100 µ l di 1 M NaOH.
- Centrifugare la miscela per 2 min alla massima velocità in una centrifuga da banco.
- Eliminare qualsiasi supernatante e vigoroso nel Vortex per sciogliere il precipitato in 100 µ l di acido formico al 5% (v/v).
- Diluire a un volume finale di 1 mL con 900 µ l di acqua ultrapura per produrre la macchia UF in acido formico 0.5% (v/v).
- Archivio la macchia UF al riparo dalla luce. Scartare la macchia se non si osserva alcuna decolorazione precipitato o marrone.
-
Preparazione di altri reagenti di colorazione
-
Preparazione di lantanidi acetato macchie
- Sciogliere il samario acetato (SmAc), acetato di gadolinio (GdAc), acetato di Tulio (TmAc) o acetato di erbio (CSER) a 1-2% (p/v) in acqua ultrapura.
Nota: Se i campioni mostrano la macchiatura positiva o scarsa aderenza alla griglia quando si utilizzano queste macchie, essi possono essere acidificate con fino allo 0,5% (v/v) acido formico. La macchiatura positiva comporta il campione che appare come un oggetto scuro circondato da un alone bianco. Scarsa aderenza alla griglia si tradurrà in poche molecole rispetto previsto essere osservato sulla griglia di partenza.
- Sciogliere il samario acetato (SmAc), acetato di gadolinio (GdAc), acetato di Tulio (TmAc) o acetato di erbio (CSER) a 1-2% (p/v) in acqua ultrapura.
-
Preparazione di molibdato di ammonio e di sodio Phosphotungstate
- Sciogliere la macchia all'1-3% (p/v) in acqua ultrapura. Regolare il pH a 7.0 utilizzando 5 M NaOH se desiderato.
-
Preparazione di lantanidi acetato macchie
3. campioni al carbonio adsorbente substrato e colorazione
-
Preparazione della superficie griglia per applicazione di esempio di eseguirne il Rendering idrofila
- Posizionare la griglia rivolto verso l'alto su un vetrino da microscopio in un'unità di scarico di incandescenza.
- Trattare la griglia per un minimo di 30 s a 10 mA.
Nota: Il metodo esatto di effluvio dipenderà le specifiche del particolare pezzo di attrezzature utilizzate. - In alternativa, ciò può essere compiuta da irradiazione UV per 10 minuti utilizzando una lampada UV di benchtop4.
-
Metodo di macchiare lato. Questo metodo è stato descritto in dettaglio in precedenza8
- Afferrare il bordo della griglia con un paio di pinzette di pressione negativa e applicare 3-5 µ l di campione alla superficie di appoggio.
- Lasciare il campione di adsorbire alla superficie della griglia per 10 s per 1 min. ottimizza il tempo di adsorbimento deve per singoli campioni.
- Toccare il bordo della griglia in un foglio di carta da filtro e permettere un'azione capillare tirare fuori il liquido.
- Optional: Lavare la griglia. Mettere 50 µ l gocce di acqua distillata o soluzione appropriato tampone volatili su un foglio di pellicola di laboratorio. Delicatamente toccare la superficie di carbonio della griglia per la discesa e sollevare una piccola goccia sulla superficie della griglia. Toccare il bordo della griglia in un foglio di carta da filtro e permettere un'azione capillare tirare fuori il liquido.
- Ripetere questo passaggio di lavare tante volte quanto desiderato.
- Posto due 50 µ l gocce di reagente su un foglio di pellicola di laboratorio di colorazione.
- Delicatamente toccare la superficie di carbonio della griglia per la discesa e sollevare una piccola goccia sulla superficie superiore della griglia.
Nota: Se la macchia migra verso il retro della griglia quindi la griglia deve essere eliminato. - Toccare il bordo della griglia in un foglio di carta da filtro e permettere un'azione capillare disegnare il liquido. Eseguire questo passaggio colorazione due volte.
- Consentire la griglia all'aria secca o secca sotto una lampada ad incandescenza.
-
Sfogliando il metodo.
- Afferrare il bordo della griglia con un paio di pinzette di pressione negativa e applicare 3-5 µ l di campione alla superficie di appoggio.
- Tenendo le pinzette in una mano, in modo che la griglia è inclinata di circa 45° rivolto, scorri rapidamente il polso della mano a 'flick fuori' la maggior parte della goccia che si trova sopra la griglia.
- Opzionale: Utilizzando un pipetta Pasteur di vetro applicare una goccia di soluzione di lavaggio alla superficie di appoggio e 'flick fuori' come 3.2.2. Ripetere se necessario.
- Utilizzando un pipetta Pasteur di vetro applicare una goccia di reagente alla superficie di appoggio di colorazione e 'flick fuori' come 3.2.2. Ripetere 1 - 3 volte dipende dalla macchia profondità necessaria per la visualizzazione dell'esemplare.
Nota: Questo non è l'unico fattore che attribuisce alla profondità finale macchia (vedi discussione). - Rimuovere l'eccesso macchia toccando il bordo strappato un pezzo di carta da filtro al bordo della griglia.
- Consentire la griglia all'aria secca o secca sotto una lampada ad incandescenza.
-
Metodo rapido consuntivazione
- Disegnare il 30-70 µ l di macchia (1% UA solitamente usata) nella punta di una pipetta 200 µ l, girare la manopola del volume per redigere 5 µ l di aria, quindi redigere reagente di lavaggio/miscelazione (5-30 µ l), se necessario, seguito da un altro piccolo traferro e quindi elaborare 5 µ l di campione.
- Presa il bordo di una griglia con un paio di pinzette di pressione negativa, tenendo le pinzette, in modo che la griglia è inclinata di circa 45° dalla parte opposta il ricercatore, espellere l'intero contenuto della punta della pipetta in tutta la faccia della griglia EM rivestita di carbonio.
- Rimuovere l'eccesso macchia toccando il bordo strappato un pezzo di carta da filtro al bordo della griglia.
- Consentire la griglia all'aria secca o secca sotto una lampada ad incandescenza.
Nota: Per tutti i metodi è opportuno far scorrere il bordo strappato di un foglio di carta da filtro lungo il forcipe finché raggiunge la griglia come questo rimuove soluzione intrappolato tra i due lati della pinza, che può tirare la griglia secca nelle fauci delle pinze, una volta che sono aperto. La griglia nelle pinzette è posizionabile anche sul bordo di una cappa aspirante ad asciugare. Il costante flusso d'aria può aiutare a produrre di più anche di colorazione.
Risultati
Tutti i reagenti di colorazione testati hanno prodotto la macchiatura negativa in una certa misura, con UF producendo i campioni con le particelle più nitide, più dettagliate e più grande contrasto. Per le macchie di lantanidi basato campioni profondamente incorporato (Figura 1) ErAc e TmAc hanno prodotto la macchiatura negativa di qualità equivalente a UA come giudicato dall'apparente contrasto e nitidezza delle particelle macchiate, con TmAc producendo più chiara, immagini più nitide di ErAc. Anche se il più grande formato di grano di TmAc diventa evidente a forte ingrandimento, quando particelle di Virus del mosaico del tabacco (TMV) erano macchiate con 1% TmAc ~ 23 Å ripetere della particella TMV17 era ancora chiaramente visibile dall'occhio e come linea meridional strato nella Trasformata di Fourier dell'immagine raw. Nessuno di altre lantanidi macchie testate, ErAc, SmAc o GdAc, erano in grado di risolvere questa funzionalità. Classe medie sono state generate da estrarre segmenti sovrapposti da particelle TMV dove la ripetizione elicoidale era visibile. I segmenti estratti erano poi allineati e classificati utilizzando RELION18 per visualizzare meglio la funzione periodica (Figura 2).
Alcuni esempi sono particolarmente sensibili al metodo di macchiatura, come il muscolo derivato proteina C. Proteina C, che è costituito da una stringa flessibile di Ig e Fn-come i dominii, produce immagini significativamente diverse da negativo-macchia EM dipende il metodo di colorazione usato (Figura 3). Quando utilizzando il metodo lato-blotting, compresso anello-come le strutture sono osservate, mentre quando macchiato da vampate di calore rapido o sfogliando metodi, proteina C è osservata come una serie di domini simili a perle su una stringa.
| Reagente | Concentrazione | pH | Tipo |
| Ammonio molibdato | 1 - 2% | 5 – 7 | Anionici |
| Acetato di erbio (CSER) | 1 – 2% | 6 | Cationici |
| Acetato di gadolinio (GdAc) | 1 – 2% | 6 | Cationici |
| Tungstato di metilammina | 2% | 6 – 7 | Anionici |
| Acetato di samario (SmAC) | 1% | 6 | Cationici |
| Sodio silicotungstate | 1 – 5% | 5 – 8 | Anionici |
| Sodio phosphotungstate | 1 -3% | 5 – 8 | Anionici |
| Tulio acetato (TmAc) | 1 – 2% | 6 | Cationici |
| Acetato di uranile (UA) | 1 – 3% | 3 – 4 | Cationici |
| Formiato di uranile (UF) | 0,75-1% | 3 – 4 | Cationici |
Tabella 1: Alcuni comuni colorazione reagenti negativi.

Figura 1: micrografie esempio del Virus del mosaico del tabacco macchiato con vari macchia negativa reagenti (A) 1% UF (B) 2,5% TmAc (C) 2,5% ErAc. (D) 1% UA (E) 2,5% GdAc e (F) 2,5% SmAc. Barre della scala sono 100 nm. Immagini rappresentative da repliche multiple con più aree imaged per replica. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: colorazione Virus del mosaico del tabacco con acetato di Tulio (A) ad alto ingrandimento dell'area da una microfotografia di TMV macchiato con 1% TmAc. Barra della scala è di 20 nm. (B) di classe media di segmenti di TMV estratti. (C) trasformata di Fourier dell'immagine nel pannello A visualizzando strato line riflessioni ~ 23 Å. Clicca qui per visualizzare una versione più grande di questa figura.
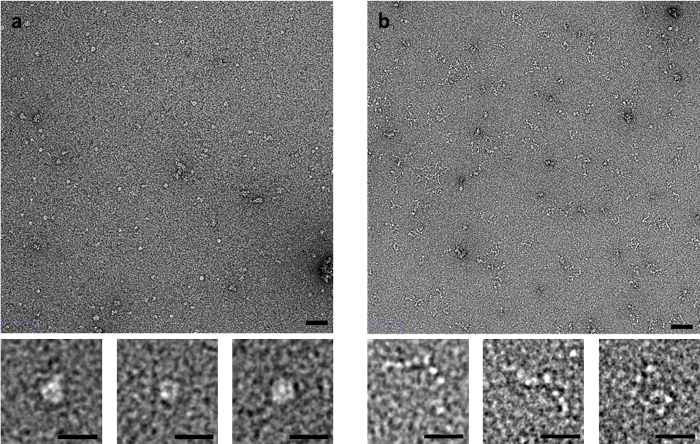
Figura 3: effetti di blotting metodo sulla conformazione della proteina-C. (A) proteina C macchiato con UA utilizzando il metodo della macchia sul lato e metodo flicking (B) . Barra della scala pannello superiore è di 50 nm, barra di scala inferiore del pannello è di 20 nm. Immagini rappresentative da repliche multiple con più aree imaged per replica. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Questo manoscritto descrive diversi metodi per la macchiatura negativa di campioni per microscopia elettronica utilizzando una varietà di reagenti, compresi due reagenti romanzo lantanidi (TmAc ed ErAc) di colorazione. Molti dei passaggi del processo di colorazione negativo deve essere ottimizzati per singoli campioni, compresa la scelta della macchia, quantità di lavaggio richiesto se qualsiasi e la tecnica blotting. Questo manoscritto fornisce così una base per microscopisti sviluppare flussi di lavoro personalizzati per affrontare il negativo-macchiatura dei sistemi impegnativi.
La scelta di macchia è altamente dipendente di esempio. Campioni che sono particolarmente sensibili al pH basso possono essere degradati da UA e/o UF, nonostante le proprietà fissativa di queste macchie19. In questi casi, lantanidi basano macchie quali TmAc o ErAc potrebbe essere più appropriato, anche se il pH complessivo del preparato dovrà essere tenuto sotto il punto isoelettrico della proteina campione per aiutare a prevenire la macchiatura positiva. Questo può essere realizzato acidificando la macchia con acido acetico, se necessario. Per i campioni sensibili soprattutto basso pH, anionici tungstato o molibdato macchie possono essere più efficace. Anche se queste macchie sono state trovate per indurre la formazione di artefatti in alcuni casi, come la formazione di rouleaux in lipoproteina campioni20. Ancora una volta, il pH della macchia potrebbe essere necessario essere regolato, stavolta a sopra il punto isoelettrico del campione, per evitare la macchiatura positiva.
Lavaggio del campione prima della colorazione può essere necessaria se il buffer in cui viene mantenuta l'esemplare ha un'alta componente di sale o fosfato. In molti casi, il lavaggio può essere eseguito con acqua ultrapura ma per campioni più sensibili, che possono degradare o subire modifiche strutturali quando esposti ad acqua da solo, lavaggio potrebbe essere necessario essere eseguita con un buffer di volatile di bassa forza ionica8. Anche in condizioni rigorosamente controllate, lavaggio può provocare alcuni riorganizzazione strutturale sulla superficie di carbonio21.
Il metodo mediante il quale una griglia viene preparata in termini di adsorbimento di campione, macchiare e colorazione può anche significativamente influenzare ciò che osserva. Il metodo più appropriato è così, ancora una volta, altamente di esempio dipendenti. Proteina C, ad esempio, si osserva come una globulare struttura anulare seguendo il lato-macchia di colorazione, ma questo sembra essere un artefatto del processo di colorazione, come ha rivelato quando griglie sono preparati dal metodo flicking (o il metodo di consuntivazione rapido) (Figura 3 ). Nei metodi di consuntivazione flicking e rapidi, il tempo che il campione deve interagire con il carbonio superficie di appoggio prima della fissazione è ridotto al minimo15. Il campione anche esperienze meno forze da menisco retrocedere su macchiare prima della fissazione. Questo significa che cambiamenti strutturali nell'esemplare che potrebbe verificarsi su tempo di assorbimento prolungato sul film di carbonio o attraverso l'azione capillare sono ridotti al minimo. Il metodo di consuntivazione rapido è utilizzabile anche per tempo-risolta l'analisi degli esemplari. Il campione può essere mescolato con un legante o additivo all'interno di un puntale per un set di periodo di tempo prima dell'applicazione di una griglia o solo momentaneamente sulla superficie della griglia prima della fissazione in pochi millisecondi.
La profondità della macchia deve fornire immagini ottimali di un esemplare particolare è nuovamente campione dipendente2. Se la macchia è troppo superficiale, molecole possono essere danneggiati dal fascio di elettroni, ma se la macchia è troppo spessa caratteristiche strutturali possono essere perse. Profondità di macchia è influenzata da diversi fattori quali idrofilia della superficie della griglia, uniformità dello strato di carbonio, la quantità di macchia applicata alla griglia, la lunghezza di tempo macchia è a contatto con la griglia prima di macchiare, nella misura di macchiare e il tempo si ta KES per la griglia a completamente asciutto. Una griglia non avrà mai una distribuzione uniforme della macchia tutta la sua interezza e quindi aree della griglia appropriata per l'imaging devono essere selezionati con attenzione. Infatti, griglie spesso variano in qualità anche quando preparate il giorno stesso alle stesse condizioni. Un buon esempio di come variazione in profondità macchia influisce sull'aspetto delle molecole e la profondità di macchia appropriato per imaging è fornito da Burgess et al.5.
Nonostante negativo colorazione sia un metodo molto versatile, veloce e semplice, non tutti i campioni biologici sono suscettibili di visualizzazione da questo metodo. Fragile assembly può comprimere o smontare all'adsorbimento, macchiatura o essiccazione EM griglia22. Macchiatura negativa può anche condurre all'appiattimento delle molecole ed indurre preferiti orientamenti delle molecole del carbonio supporto pellicola7.
Macchia negativa è un prezioso strumento per la valutazione degli esemplari a sé stante e anche prima dell'analisi cryo-EM, ma molte delle forze fisiche il campione rileva durante il processo sono capiti male. Pertanto, l'approccio migliore da utilizzare è altamente dipendente di esempio e deve essere determinata dal trial-and-error piuttosto che ha insegnato a seguito di un protocollo fisso.
Divulgazioni
Gli autori non dichiarano concorrenti interessi finanziari.
Riconoscimenti
Siamo estremamente grati a Peter Knight per utili discussioni e revisione critica del manoscritto. Vorremmo ringraziare tutti i membri dei laboratori di Neil Ranson e di Stephen Muench e il personale di laboratorio Biostructure Astbury per utili discussioni. Questo lavoro è stato finanziato dal Consiglio europeo della ricerca (FP7/2007-2013) / ERC Grant accordo 322408. Proteina C è stata prodotta utilizzando le risorse fornite da una sovvenzione di British Heart Foundation (BHF PG/13/83/30485). Ringraziamo anche il Wellcome Trust per attrezzature fondi per sostenere la microscopia elettronica a Leeds (090932/Z/09/Z e 094232/Z/10/Z). CS è finanziata da una sovvenzione di ISSF Wellcome Trust.
Materiali
| Name | Company | Catalog Number | Comments |
| 200 mesh copper EM grids | Sigma-Aldrich | G4776-1VL | Other materials and/or mesh sizes can also be used |
| Ammonium Molybdate | Sigma-Aldrich | 277908 | |
| Carbon evaporator | Ted Pella Inc. | 9620 | Cressington 208 or equivalent |
| Collodion solution 2% in amyl acetate | Sigma-Aldrich | 9817 | |
| Dumont #5 negative pressure tweezers | World Precision Instruments | 501202 | Or other tweezers as preferred |
| Erbium Acetate | Sigma-Aldrich | 325570 | |
| Gadolinium Acetate | Sigma-Aldrich | 325678 | |
| Mica Sheets. 75x25x0.15mm. | AGAR Scientific | AGG250-1 | |
| Microscope slides, white frosted | Fisher Scientific | 12607976 | Or equivalent |
| Parafilm | Fisher Scientific | 10018130 | Or equivalent |
| Pasteur pipette (glass) | Fisher Scientific | 10343663 | Or equivalent |
| Razor blade | Fisher Scientific | 11904325 | Or equivalent |
| Sandpaper | Hardware store | Wet and dry sandpaper with grit finer that 200 (600 suggested) | |
| Samarium Acetate | Sigma-Aldrich | 325872 | |
| Sodium Hydroxide | Sigma-Aldrich | 1.06462 | |
| Sodium Phosphotungstate | Sigma-Aldrich | P6395 | |
| Stainless Steel Mesh, 150x150 mm (cut to size). | AGAR Scientific | AGG252 | |
| Thulium Acetate | Sigma-Aldrich | 367702 | |
| Two Step Carbon Rod Sharper, for 1/4" rods | Ted Pella Inc. | 57-10 | Or equivalent for carbon evaporator used |
| Ultra pure water | |||
| Uranyl Acetate | Electron Microscopy Sciences | 22400 | |
| Uranyl Formate | Electron Microscopy Sciences | 22450 | |
| Vacuum grease | Fisher Scientific | 12719406 | Or equivalent |
| Whatman #1 Filter paper. | Fisher Scientific | 1001 090 | Or equivalent |
| Whatman #40 filter paper | Fisher Scientific | 10674122 | Or equivalent |
Riferimenti
- Merk, A., et al. Breaking Cryo-EM Resolution Barriers to Facilitate Drug Discovery. Cell. 165 (7), 1698-1707 (2016).
- De Carlo, S., Harris, J. R. Negative staining and cryo-negative staining of macromolecules and viruses for TEM. Micron. 42 (2), 117-131 (2011).
- Thompson, R. F., Walker, M., Siebert, C. A., Muench, S. P., Ranson, N. A. An introduction to sample preparation and imaging by cryo-electron microscopy for structural biology. Methods. 100, 3-15 (2016).
- Ha, J. Y., et al. Molecular architecture of the complete COG tethering complex. Nat Struct Mol Biol. 23 (8), 758-760 (2016).
- Burgess, S. A., Walker, M. L., Thirumurugan, K., Trinick, J., Knight, P. J. Use of negative stain and single-particle image processing to explore dynamic properties of flexible macromolecules. J Struct Biol. 147 (3), 247-258 (2004).
- Fabre, L., Bao, H., Innes, J., Duong, F., Rouiller, I. Negative-stain single particle EM of the maltose transporter in nanodiscs reveals asymmetric closure of MalK2 and catalytic roles of ATP, MalE and maltose. J Biol Chem. , (2017).
- Zhang, L., et al. An optimized negative-staining protocol of electron microscopy for apoE4 POPC lipoprotein. J Lipid Res. 51 (5), 1228-1236 (2010).
- Ohi, M., Li, Y., Cheng, Y., Walz, T. Negative Staining and Image Classification - Powerful Tools in Modern Electron Microscopy. Biol Proced Online. 6 (1), 23-34 (2004).
- Haschemeyer, R. H., Myers, R. J. . Negative Staining in Principles and Techniques of Electron Microscopy. 2, 101-147 (1972).
- Massover, W. H. Positive staining of protein molecules for electron microscopy: polyiodination of the apoferritin shell in ferritin. Ultramicroscopy. 52, 383-387 (1993).
- Harris, J. R., Bhella, D., Adrian, M. Recent Developments in Negative Staining for Transmission Electron Microscopy. Microsc Microanal. 20, 17-21 (2006).
- Hosogi, N., Nishioka, H., Nakakoshi, M. Evaluation of lanthanide salts as alternative stains to uranyl acetate. Microscopy (Oxf). 64 (6), 429-435 (2015).
- Zhao, F., Craig, R. Capturing time-resolved changes in molecular structure by negative staining. J Struct Biol. 141, 43-52 (2003).
- Cao, B., Xu, H., Mao, C. Transmission electron microscopy as a tool to image bioinorganic nanohybrids: the case of phage-gold nanocomposites. Microsc Res Tech. 74 (7), 627-635 (2011).
- Imai, H., et al. Direct observation shows superposition and large scale flexibility within cytoplasmic dynein motors moving along microtubules. Nat Commun. 6, 8179 (2015).
- Booth, D. S., Avila-Sakar, A., Cheng, Y. Visualizing proteins and macromolecular complexes by negative stain EM: from grid preparation to image acquisition. J Vis Exp. (58), (2011).
- Kendall, A., McDonald, M., Stubbs, G. Precise determination of the helical repeat of tobacco mosaic virus. Virology. 369 (1), 226-227 (2007).
- Scheres, S. H. A Bayesian view on cryo-EM structure determination. J. Mol. Bio. 415 (2), 406-418 (2012).
- Bremer, A., Henn, C., Engel, A., Baumeister, W., Aebi, U. Has negative staining still a place in biomacromolecular electron microscopy?. Ultramicroscopy. 46, 85-111 (1992).
- Garewal, M., Zhang, L., Ren, G., Kleinschmidt, J. . Lipid-Protein Interactions. Methods Mol Biol (Methods and Protocols). 974, 111-118 (2012).
- Walker, M. L., et al. Two-headed binding of a processive myosin to F-actin. Nature. 405 (6788), 804-807 (2000).
- Orlova, E. V., Saibil, H. R. Structural Analysis of Macromolecular Assemblies by Electron Microscopy. Chem Rev. 111 (12), 7710-7748 (2011).
Erratum
Formal Correction: Erratum: Variations on Negative Stain Electron Microscopy Methods: Tools for Tackling Challenging Systems
Posted by JoVE Editors on 1/30/2020. Citeable Link.
An erratum was issued for: Variations on Negative Stain Electron Microscopy Methods: Tools for Tackling Challenging Systems. An author name was updated.
One of the authors' names was corrected from:
Matthew G. Iadaza
to:
Matthew G. Iadanza
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon