Method Article
透過電子顕微鏡用小型サンプル準備
* これらの著者は同等に貢献しました
要約
楽器と透過型電子顕微鏡のためのナノリットル サイズ サンプル ボリュームの準備のためのメソッドが表示されます。これは蛋白質の大幅にサンプルの損失を削減し、単一細胞ライセート visual プロテオミクス解析を有効にするために持つことができます有害な結果を回避するため、必要な紙しみが付くことのステップはありません。
要約
最近の技術の進歩によりクライオ電子顕微鏡 (Cryoem) は急速に原子分解能するタンパク質複合体の構造解析のための標準的な方法となっています。ただし、蛋白質の分離技術と EM 試料作製法ボトルネックのまま。タンパク質の高分解能解析の単一粒子処理手法とマイクロ流体原則小型サンプルを作る EM アプローチでイメージを作成する必要があります個々 のタンパク質粒子の比較的小さい数 (数百万に 100,000)実現可能。
小型化、紙あぶらとり無料 EM グリッド法サンプル前処理、EM グリッド プライミングおよびサンプルのナノリットル ボリュームを消費するだけのポスト処理が表示されます。メソッドが調剤システムを使用して sub ナノリットル精度制御液体吸収と EM グリッド プライミング、プラットフォームと EM グリッドをピックアップ-・-プランジ-機構とサンプルの上の相対湿度を決定グリッド温度を制御します。ガラス化。Cryoem 温度制御ステージ上 EM グリッドに配置し、キャピラリーに試料を吸引します。キャピラリーの先端は、グリッド表面に近接して位置、サンプルにグリッドが読み込まれ、過剰は、マイクロキャピ ラリーに再吸引。その後、サンプル フィルムは安定し、若干結露点基準プラットフォーム温度のオフセットによって規制制御水蒸発による間伐です。特定の時点で急速に液体エタンのサンプル ガラス化のために発動を促された EM グリッドを転送する選択-プランジ機構がトリガーされます。サンプルご利用方法も、否定的な汚れ (NS) EM のナノリットル サイズ サンプル ボリュームを準備する利用できます。
方法論は大きくサンプル消費量を減らすし、従来で使用されるあぶらとり紙など蛋白質、潜在的に有害なアプローチを避けます。さらに、必要なサンプルのほんのわずかな量により高速サンプル エアコン、「visual プロテオミクス、」単一セル換散またはの定量分析のための「ロスレス」総試料との組み合わせなど、新規の実験的戦略複雑なサンプル。
概要
ハードウェアと透過電子顕微鏡 (TEM) によるタンパク質複合体の構造解析のためのソフトウェアは、近年中に進んでいる超。強化した「解像度革命」1,2へ道舗装し、構造研究を根本的に変更します。革命開始クライオ電子顕微鏡 (Cryoem)3,4、放射線感受性を短縮し、予防しながら生理条件に近いの下で生物学的試料の調製を可能の出現で透過電子顕微鏡5の高真空での蒸発をサンプル。次の年では、増分の技術進歩は達成可能な解像度を徐々 に増加。これらの技術革新の間で電界放射銃6、7のアプリケーションより最近では、最尤法8,9などのデータ解析のアルゴリズムを改善します。直接電子検出器カメラ10、11,12,13、ムービー モード イメージングおよびそれに伴うソフトウェアの開発14,15,16,17日 (レビューを参照してくださいチェン、Grigorieff、らの単粒子解析による生体試料の原子分解能を達成するために必要な最終的なブレークスルーを提供18). Cryoem の重要性は最近開拓者の 3 つの化学のノーベル賞の受賞によって認識されました。
電子顕微鏡による生体試料を画像にサンプル (その後「グリッドの準備」と呼ばれる) と EM グリッドを読み込むためのメソッドする必要があります結果サンプル層 (i) 十分に薄いことを確認 (< 100 nm) 散乱弾性によって広範なノイズを避けるため、または乗算するには電子、(ii) 電子顕微鏡の高真空に耐えるし、(iii) が放射線障害から、生体分子を保護します。2 つの主な方法は、これらの条件を満たすために使用される: 否定的な汚れ(NS)19,20プロシージャ (図 1A) 炭素薄膜フィルム サンプルを吸着、非晶質重金属の生体分子を埋め込むし、空気で乾燥するアセンブリを許可します。これはシンプルで簡単なと (その後、「サンプル グリッド」と呼ばれる) 読み込まれている EM グリッド簡単にして保存し時間の長期間にわたって保つことができる (一般に年).TEM、準備 NS による高コントラストを展示し、クライオ準備よりも高い電子線量を容認するが、解像度が約 20 Å。 Cryoem プロシージャ (図 1B) 採用ホーリーファイバー炭素をサポートに限定。試料溶液の薄膜が穴にまたがってスパンされてし、EM グリッドは、寒剤、-150 ° C 以下それを急速に冷却するため、通常液化エタンに陥って結果は非晶質、ビトリファイド、サポートする穴のソリューションの 50 に 100 nm 厚のフィルムです。この薄い非晶質膜は電子顕微鏡で高真空に耐えるし、理想的なケースで、自然な状態での生物学的構造を保持します。プロシージャでは、生体試料の高解像度イメージを作成することができます。ただし、グリッドのサンプル保たれなければならない温度より低い温度で-150 ° C 失透を避けるためにすべての回で。それは低温ですが、コントラストのための比較的高い電子線量を使ってイメージ化されることし、信号対雑音比が低いにもかかわらず。したがって、コントラストを高める平均化技術を採用し、高解像度三次元 (3 D) 地図を再構築できるサンプルは、さまざまな角度からイメージを作成、提供。最もよく使用され、今の三次元再構成のための非常に成功したメソッドは単一の粒子のアプローチ。最近のレビューら18チェンを参照してください。
ネガティブ染色 TEM (NS EM) はスクリーニングと品質管理の重要なコントラストが必要な場合、またはサンプルの限られた量だけ利用可能な場合 (炭素膜への吸着は、一般的にサンプルを集中)。タンパク質立体構造の高解像度の 3 D 復元を目指した場合、単一粒子の低温電子顕微鏡がゴールド スタンダード方法です。
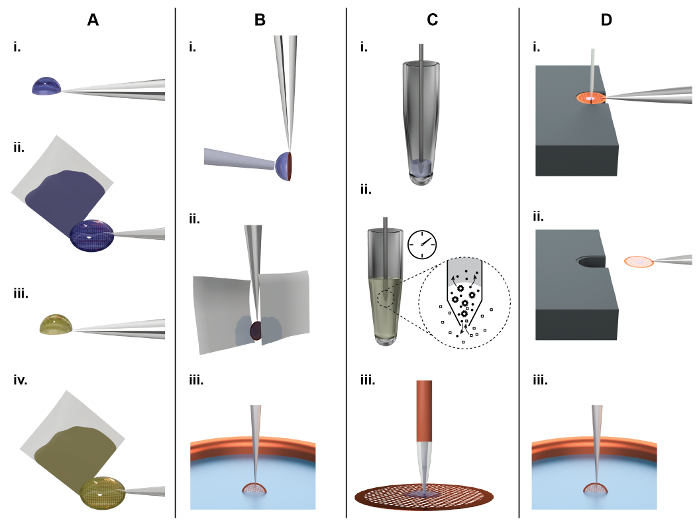
図 1: 原則の TEM グリッド準備とクラシック (パネル A、B) とマイクロ アプローチ (パネル C、D) の比較。A)古典的な NS エマージング グリッド準備: 約 3 μ L のサンプルが (その後、「NS EM グリッド」と呼ばれる) 連続炭素膜で覆われている EM グリッド上に手で戻 (i)。約 10 のためのインキュベーション後離れて薄い水膜に吸着した分子を残して側 (ii) から余分な液体を消し去るため s、ろ紙を使用します。重金属塩溶液、例えば20, 2% の酢酸ウランのタンパク質の培養後、s (iii) と再び液体がろ紙 (iv) を使用する側からしみが付くことによって削除されます。最後に、EM グリッドは、空気の乾燥に残っています。B)クラシック Cryoem グリッド準備: サンプルの約 3 μ L、ホーリーファイバーの炭素膜に手で戻します。薄いサンプル フィルムを形成するには、余分な液体が紙あぶらとり顔の片側または両側 (ii) からによって削除されます。最後に、グリッドが急速に液体エタン ガラス化 (iii) のために急落しました。C) cryoWriter セットアップを使用して NS エマージング グリッド準備: A 5 nL ボリューム (i) マイクロキャピ ラリーを使用してサンプル素材から吸気です。サンプルはエアコン、マイクロキャピ ラリー チップはエアコン解決、例えば2% 酢酸アンモニウムに没頭しています。イオンや小分子拡散 (ii) で交換されます。マイクロキャピ ラリーの寸法は、全体のプロセスが拡散駆動型であることを確認注意してください。タンパク質は塩イオンよりも多くの低い拡散定数し、24が大幅に失われない。最後に、サンプルはグリッド上に分配される、(iii) を乾燥します。D) cryoWriter 法を用いた低温エマージング グリッド準備の原則: ホーリーファイバーの炭素膜で覆われて、EM グリッドを温度制御プラットフォームの表面に置かれ、ピンセットで開催。プラットフォームの温度は、グリッド環境の露点温度からのオフセットで制御されます。サンプルを含むマイクロキャピ ラリー基準グリッドを移動、それはグリッドの上のいくつかのマイクロメートルまでのマイクロキャピ ラリーを下げます。スパイラル パターンでステージを移動しながらその後、サンプルのいくつかの nanoliters を調剤しそれから余分な液体は再吸気 (i)。EM グリッド プライミング後、マイクロキャピ ラリーを撤回、グリッドは、蒸発するためにサンプル量を制御できるように短時間の温度制御プラットフォーム (その後露点 (DP) のステージと呼ばれる)。凍結急落、グリッドは急速にピンセット (ii) を使用して、ステージから撤退、垂直方向の位置に 90 度反転および寒剤お風呂 (iii) (' ピック プランジ ' メカニズムとその後呼ばれる) に突入します。この図の拡大版を表示するのにはここをクリックしてください。
残念なことに、彼らが発明されたので NS と低温電子顕微鏡用グリッドの作製法が大幅に改善しないしています。現在の欠点は、高いサンプル消費量 (1 mg/mL のタンパク質の約 3 μ L) とサンプルの大量 (> 99%) を失った (図 1a, B)。さらに、低温電子顕微鏡用グリッドを準備するための古典的な方法は蛋白質のための過酷な手順: 最初に、それを含む、広範な顔に紙あぶらとりステップ (図 1B、ii) と、第二に、蛋白質は、空気-水界面にさらされています。21時間のかなりの量。ここでは、サンプルの前処理方法、試料グリッドと NS EM (図 1C) または 70S (図 1D) の後処理 (グリッドの乾燥またはガラス) が表示されます。"CryoWriter"と呼ばれる、社内構築されたセットアップ条件を吸引し、サンプル、回避紙完全にしみが付くことおよび薄いサンプルのための代替手段を提供することを分配する小型サンプル処理技術とマイクロ流体の原則を使用してください。CRYOEM。それは大幅サンプル消費を低減し、試料全体としてのユーザー コントロールを向上します。さらに、メソッドにより実験的応用;などの「単一のセルのビジュアル プロテオミクス」22,23,24,25と呼ばれる方法では個々 の細胞の生体成分の分離の準備。
プロトコル
"CryoWriter"(図 2; 詳細は以前仕事24,26,27を参照してください) または同等の計測は以下のプロトコルに必要な。主な部品と消耗品のサプライヤーのリストは、材料の表で与えられます。
1. ネガティブ染色 (NS) グリッドの準備
- 計測器をオンにし、ソフトウェアを起動します。すべての必要なモジュール (シリンジ ポンプ コント ローラー、電動ステージ、監視カメラ、および露点ステージ) を初期化します。
- クールなサンプルのサポートと露点ステージ。必要な場合は、露点段階温度調節されていることを確認、露点より 1-2 ° C。
注意: ステージは PID コント ローラーを持つ商業ペルチェ素子によって冷却されます。 - NS を準備するには、(例えば、タングステン酸 2% メチルアミン市販) NS の 100-150 μ L で、100 または 200 μ L の PCR チューブを充填します。計測器の冷却サンプルのサポートにチューブを置きます。
- サンプルを配置します。
- サンプルを置く (0.5 ~ 1 μ M) を 100 または 200 μ L の PCR チューブ。未満 50 μ L のサンプルが利用可能な場合、かみそりの刃で PCR チューブの下部を切断し、サンプルとしても使用します。これにより、マイクロキャピ ラリーがサンプルを簡単に達することができます。
注: 後でサンプルを吸引に使用マイクロキャピ ラリーが少し傾いている、旅行高さ z 軸方向は限られているので、100 または 200 μ L の PCR チューブからサンプルを吸引する簡単です。 - 蒸発を防ぐために装置で冷却サンプルのサポートに PCR チューブ/コンテナーを配置します。サンプルが吸気して室温; 顕微鏡ステージ トップ インキュベーターでもプレートからまた、冷却は、ウェル プレートには実装されていません。
- サンプルを置く (0.5 ~ 1 μ M) を 100 または 200 μ L の PCR チューブ。未満 50 μ L のサンプルが利用可能な場合、かみそりの刃で PCR チューブの下部を切断し、サンプルとしても使用します。これにより、マイクロキャピ ラリーがサンプルを簡単に達することができます。
- 位置を定義します。電動 xy ステージと直線 x、y、および z 軸ステージ、マイクロキャピ ラリーを配置するためのソフトウェア制御ボタンを制御する cryoWriter ジョイスティックを使用します。カメラを使用すると、毛細血管の位置を確認します。
- サンプル保存容器に、マイクロキャピ ラリーを移動します。サンプル液に先端を浸すし、「サンプル」としてこの位置を保存します。
- NS PCR チューブに、マイクロキャピ ラリーを移動、NS ソリューションに先端を浸すし、「汚れ」としてこの位置を保存します。
- マイクロキャピ ラリー約 100 μ m は、EM グリッドが配置され、"grid_save"としてこの位置を保存するスロットの中央上に配置します。
- サンプルを吸引し、NS EM の状態します。
- インストールされていない場合は、高精度シリンジ ポンプの 10 μ L のシリンジ (0.46 mm 内径) をマウントします。
- 30 cm 長い石英マイクロキャピ ラリー (外径 360 μ m、内径 150 μ m) 注射器のコンセントの片方の端を接着します。
- プレス フィット コネクタ経由での他の短い (5 cm) マイクロキャピ ラリーの末長いテーパー マイクロキャピ ラリーを接続します。短いマイクロキャピ ラリーのテーパーの先端は、調剤の先端を形成します。
- 脱のダブル蒸留水 (ddH2O; システム液体) で注射器を記入し、気泡の形成を避けるため。
- 調剤システムの液体の nanoliters の数十、糸くずティッシュでマイクロキャピ ラリーからの低下を取り外します。
- 保存されたサンプルの位置をダブルクリックします。よく、これはサンプルで、マイクロキャピ ラリーを配置します。毛細血管が動いている間調剤 3 × 0.5 nL マイクロキャピ ラリー チップは、空気の泡が (下記のメモ 2 を参照) が閉じ込められているを防ぐためにサンプルに浸漬する前にちょうどシステムの液体の。
- サンプルの吸引 5 nL。
- 保存されている NS 位置をダブルクリックします。マイクロキャピ ラリー サンプル容器から、NS 貯水池へ自動的に移動します。3 × 0.5 を手動で調剤毛細血管が動いている間先端は空気がないことを確認する貯留層に浸漬する前にちょうどサンプル液の nL の泡 (下記のメモ 2 を参照)。
注:重要: (1) シリンジ ポンプの歯車のバック ラッシュをためピストンのストロークで小さな損失がある吸引したり調剤モードから切り替えたとき。メーカーによると新しいユニットのバック ラッシュは 7 と 12 μ m の間にあります。これは、0.46 mm のバレル径のシリンジ 1 2 nl ということを意味します。そのため、1-2 nL 省くことができる""、サンプルは実際に調剤する前に。通常、小さな液滴に起動 3 0.5 後マイクロキャピ ラリー チップを終了し nL ディスペンス手順。(2) サンプルの上/下に閉じ込められた気泡はより少なく正確な調剤を行うだろうし、拡散によってサンプルをご利用いただけますを防ぐ。 - サンプル バッファーとノズル形状に応じて、3-12 分間浸漬マイクロキャピ ラリーを残します。
注: より高い塩やリン酸塩濃度バッファーに必要な浸漬の時間が長くなります。NS (比較的早く) バッファー塩 (比較的高速) とタンパク質サンプル プラグに拡散する拡散反射光アウト (時間がかかる)。これは、読み込まれたグリッドが乾くときの結晶化を防ぐサンプル バッファー塩の濃度を下げます。さらに、リン酸は、NS との組み合わせで沈殿物を形成する傾向があります。
- グリッドを準備し、エアコンのサンプルのスポットを入金します。
- サンプルは調節されている粘着テープと PDMS ブロックの部分を取り、適用およびほこりがないように粘着テープを削除して、PDMS の上面をきれい。PDMS ブロックをシャーレに入れてください。
注: 新しい PDMS ブロックはクリーン ルームから取得されます。 - 慎重にグリッドを拾う (例えばCu, Parlodion/C 皮膜で被覆された 200 または 400 メッシュ)。ピンセットでグリッドの端のみをタッチしてください。上向きカーボン フィルム クリーン PDMS ブロック上に置きます。
- 場所空気圧グロー放電ユニットと輝きのグリッドと PDMS ブロック放電 20 0.4 mbar で 100 W 電源付き。閉じたペトリ皿にグリッドを格納します。グロー放電時間が長く一般にグリッド上の堆積したサンプル ボリュームの大きい広がりに します。その結果、汚れの層が薄くなる (弱い染色)。
- cryoWriter ピンセットでグロー放電グリッドを把握する前に浸漬時間を 1 分に。電磁石がオンかどうかを確認します。それ以外の場合、ソフトウェアでそれをオンします。電磁石にピンセットをマウントし、露点ステージ、カーボン フィルム側を上にグリッドを配置する手動マイクロマニピュレーター ネジを使用します。露点段階温度調節されていることを確認してください 1-2 ° C の露点上サンプルが読み込まれた後に蒸発の率を減らすため。
- 浸漬時間は場合、は、"grid_save"をダブルクリックします。マイクロキャピ ラリー チップは、グリッド表面上安全に配置されます。手動でグリッドと接触するマイクロキャピ ラリー チップをもたらします。10 μ m でノズルを持ち上げて、中央上に配置。
注意:洗剤を含むいくつかのサンプルは、低い表面張力により液体が分配されるとき、マイクロキャピ ラリーの外側面に沿って上に移動する傾向があります。このような損失を防ぐためにグリッド表面の近くに非常に重要です。 - 5 分配グリッド上にサンプルの nL。1 つはサンプルが非常にヒントになるまでまたゆっくりと分配でき、5 をすばやく分注で乾燥した日、とき急速な蒸発が起こりマイクロキャピ ラリー チップで、nL。
- 露点ステージ (DP ステージ) でゆっくりと乾燥条件のサンプルをマイクロキャピ ラリーを撤回します。
- 一度サンプル スポットが乾燥しているは、グリッドを取り出してグリッド ボックスまたはペトリ皿に室温で保管します。
- 500 を分配、マイクロキャピ ラリーからシステムの液体の nL と糸くずの組織でそれを削除します。エタノール、洗剤や 1 M NaOH で 5 回毛細血管をフラッシュします。これは、別のサンプルで使用することができますマイクロキャピ ラリーをクリーンアップします。
- サンプルは調節されている粘着テープと PDMS ブロックの部分を取り、適用およびほこりがないように粘着テープを削除して、PDMS の上面をきれい。PDMS ブロックをシャーレに入れてください。
2. 低温グリッドの準備
- 装置および試料を準備するには、手順 1.1 から 1.5 上記に従います。NS する必要がない場合は、1.3 と 1.5.2 の手順を省略します。サンプル バッファーを交換または透析による低温電子顕微鏡のサンプルの条件、例えばバッファーの濃度を低減する塩か紹介する添加剤 (例えばトレハロース、洗剤) 目的のバッファー代わりに使用 NS 手順 1.3 と 1.5.2 で。
- 標準的な低温コンテナーにおける液体エタンを準備します。
- エタン カップ、クライオ ボックス ホルダーとクモをアセンブルし、液体窒素であふれんばかりに寒剤容器を満たし通常約 200 mL が必要です。エタン カップ下がったし、は液体窒素の無料まで、数分待ってください。
- エタンのガスボンベを開き、ゆっくりとエタン カップにガスの流れを聞かせてください。レベルがトップ下 2-3 mm になるまで液体エタンを満たしてくれこれは数分かかります、約 5 mL の液体のエタンが必要です。
- クライオ ボックスを取り出して寒剤コンテナーの空きスロットにします。
- クモを削除、上では、ポリスチふたを閉めて、cryoWriter で取り付けの寒剤容器を置きます。
- グロー放電 EM グリッド。
- 粘着テープ、ポリジメチルシロキサン (PDMS) ブロックの部分を取り、適用し (任意のほこりを削除します) 粘着テープの取り外し上面 PDMS をきれい。PDMS ブロックをシャーレに入れてください。
- 慎重にグリッド ボックスからグリッドを選択します。ピンセットでグリッドの端のみをタッチしてください。上向きホーリーファイバー カーボン フィルム クリーン PDMS ブロック上に置きます。
- 場所、PDMS プラズマ クリーナーとプラズマ クリーニングのグリッドとグリッドの表面 (例えば使用 75% Ar/25% H2、パワー 50 W、圧力 25 mTorr) をブロックします。ペトリ皿でグロー放電グリッドと PDMS ブロックを配置します。
- 楽器でグリッドを位置します。
- CryoWriter ピンセットでグロー放電グリッドを把握します。電磁石がオンかどうかを確認します。それ以外の場合、ソフトウェアでそれをオンします。電磁石にピンセットをマウントし、手動マイクロマニピュレーター ネジを使用してステージ、カーボン フィルム側にフラットをグリッドに合わせます。
- "Grid_save"をダブルクリックします。約 10 μ m のグリッド サーフェス上に先端があるのでマイクロキャピ ラリー位置を調整します。マイクロキャピ ラリー自由に移動できるグリッド上で任意の場所、それに触れることがなく必要に応じて撤回のマイクロキャピ ラリー数マイクロ メートル場合ことを確認します。
- グリッドの中心に戻って、「グリッド」として新しい位置を保存します。
注意:正しい名前を付けるマクロ スクリプトを動作するために必須です。
- サンプルとプランジ凍結グリッドを記述します。
- システム液晶の nanoliters の数十のマイクロキャピ ラリーをフラッシュ、糸くずティッシュでマイクロキャピ ラリーからの低下を取り外します。
- マクロ スクリプトを起動します。マクロは、次の手順を行います。
- 5 分配 (先端に空気の泡を削除) する nL サンプル位置に行く。
- サンプルの吸引 65 nL。5 を吹き込む nL サンプル チューブに戻る。このアカウントは、システムのバック ラッシュ、すなわち同期書き込みが許可します。 その調剤を確保して同時に動きの開始をステージに。
- 「グリッド」の位置に移動します。
- '文章のパターン」は、同時に調剤 45 グリッド上で移動するマイクロキャピ ラリーになりますを開始サンプルの nL。
- その後、グリッドの中央に戻って、マイクロキャピ ラリーを移動別 10 μ m、それを下げるし、過剰なサンプル液を撤回します。
- マイクロキャピ ラリーを撤回し、電磁石をオフにします。これは凍結ピンセットや開始のプランジを解放します。
- グリップのピンセットとプランジャーから磁気のアダプターを慎重に取り外します。すぐにクライオ ボックスを含む寒剤容器にエタン カップからグリッドを転送し、空きスロットに、グリッドを配置します。
3. 単一セル Lysate の準備
- エレクトロポレーション用、microcapillaries を準備します。
注: テーパ (レーザー プルと検査) 石英 microcapillaries コーティングが先細りのプロセス中に降りて焼けは、先端を除いて、外側の保護ポリイミド コーティングがあります。- 導電性層で microcapillaries をコートにそれらをマウント 45 ° の角度で金属製のレールに上向きのヒント。ノンコート ポリイミドがプレス フィット コネクタが後で採用されている最高のシールを形成するよう、先端の下端 (2 cm) を盾にアルミ箔を使用します。
- スパッタ預金 20 の粘着層 nm Ti/W と Pt、200 nm 厚の層。
- マイクロキャピ ラリー チップを疎水性にします。
- 1-ドデカンチ エタノールの 1 M 溶液を準備します。
- グロー放電 0.4 mbar で 100 W の電源と 1 分のための空気でマイクロキャピ ラリー。
- 数時間 (理想的には一晩) 1-ドデカンチの 1 M 溶液でマイクロキャピ ラリーの先端を浸します。
注: 使用する前に 1 日新鮮なヒントを準備するお勧めします。
- 新しいマイクロキャピ ラリーをインストールします。
- 1-ドデカンチ ソリューションから、マイクロキャピ ラリーを削除すすいでエタノールと外をエタノール注射器を使用して内側を洗い流します。
注: 機能性 microcapillaries を使用できない場合すぐにグロー放電、マイクロキャピ ラリーの先端と PDMS と硫酸の混合物である商用車の窓辺の演出のドロップに浸し。1-ドデカンチが一般的に十分な結果疎水性官能基化はないも同然です。 - キャピラリー カッターでコーティングされていない端を切断します。
注: クリーン カットはプレス フィット コネクタと良好なシールにとって重要です。 - ポリイミド コーティング レーザーによって、毛細血管を引っ張って中にに焼かれたときガラス、ポリイミド塗膜間に形成されたシャープなボーダーに銀ペーストを適用するのにには、つまようじを使用します。
注: この補強は必要 Pt コーティングはこの地域で非常に弱い、電気伝導を簡単に打破することができます。 - ポリイミド末アセトンでマイクロキャピ ラリーを洗います。最後にアセトンの小さなドロップを残すし、プレス フィット コネクタの開口部に挿入します。良好なシールを形成する光の圧力を適用されます。
- 1-ドデカンチ ソリューションから、マイクロキャピ ラリーを削除すすいでエタノールと外をエタノール注射器を使用して内側を洗い流します。
- マイクロキャピ ラリー位置を調整します。
- 計測器をオンにし、手順 1.1 で説明されているように、ソフトウェアを起動します。さらに、顕微鏡カメラとファンクション ・ ジェネレーターを初期化します。
- 顕微鏡でスライド ホルダーにガラス顕微鏡スライドを配置します。
- スライド ガラスに近いマイクロキャピ ラリーを下げるし、顕微鏡カメラ ビューで表示されるまで対物レンズを中心に。X と y 軸リニア ステージを使用して、画像の中心に、マイクロキャピ ラリーの先端を配置します。それが少しスライド ガラスに触れるまで、徐々 に先端が低きます。
注意:ファイナル アプローチに向けて非常に小さなステップ (5 μ m) を選択します。先端が破損することができます。 - 「ノズルの調整」ボタンをを押します。これは、リトラクト、マイクロキャピ ラリー 40 mm とセットとしてこの位置をホーム ポジション。
- スライドのスタンプの PDMS 作品や伊藤の準備
- ミックス PDMS、10:1 の比率で架橋剤ハイブリダイゼーション インキュベーターまたは同様のデバイスにいくつかの時間の深さの約 2-3 mm。 焼く 60 ° c に大きいペトリ皿に注ぐ。
- ハンマーとスタンプ (直径 12 mm)、PDMS 層の穴をカットします。その後、メスを使って 2 cm 長い正方形または長方形の顕微鏡のスライドに合わせてスタンプの部分を取得する穴を含むをカットします。通常、2 つのスタンプ部分は 1 つの顕微鏡のスライドにマウントされます。
- PDMS 作品と伊藤スライド最初洗剤とし、70% エタノールを洗います。60 ° C のオーブンでそれらをぬれた、ペトリ皿と聞かせて、エタノールで完全に蒸発させる場所
- グロー放電 0.4 mbar で 100 W の電源と 1 分のため伊藤スライドし、コーティング溶液 (例えばポリ-L-リジン (PLL)) 1 mL を適用します。5 分間インキュベート、ピペットとソリューションを削除、ddH2O をわずか 1 ml 1 分の運動を扇動し、ddH2ピペットを使用して O を削除します。60 ° C で乾燥のスライドを聞かせてください。
- 細胞培養を準備します。次の標準的な付着性細胞培養のプロトコル (例えばアーノルド、ら24,25). 通常分割継実行中に伊藤に細胞を播きます。
- 伊東の新鮮な PLL コート スライドを取るし、PDMS の作品を追加します。防水シールを形成するいくつかの圧力を適用されます。これは彼らの基盤としてスライドと小さな井戸を生成します。
- PDMS の井戸に新鮮な媒体中に浮遊細胞の約 300 μ L を追加します。播種密度は、ウェルあたり約 75,000 セルをする必要があります。
- 伊藤スライドを標準的な条件の下で 1-2 日にインキュベートします。
- セル換散の実験の準備を。
- エレクトロポレーション バッファー (例えば、リン酸緩衝生理食塩水 (PBS)) の数ミリリットルをあらかじめ温めます。
- NS EM グリッドの準備のためのセットアップを準備します。
注: 手順 1.1 1.5 (NS) のまたはステップ 2.1 2.4 (低温) のためのセットアップを準備するための詳細のとおりです。ここで我々 は NS 準備の最も重要な手順を説明します。- NS を準備するには、(例えば、タングステン酸 2% メチルアミン市販) NS の 100-150 μ L で、100 または 200 μ L の PCR チューブを充填します。計測器の冷却サンプルのサポートにチューブを置きます。
- NS PCR チューブに、マイクロキャピ ラリーを移動、NS ソリューションに先端を浸すし、「汚れ」としてこの位置を保存します。
- 標準的な溶解パラメーター、例えば、換散電圧をロードします。
- インキュベーターから伊藤スライドを取り出して顕微鏡挿入でそれをマウントします。アルミニウム挿入時のスライドを修正したり、伊東間の電気接触を確保する 2 本のネジを使用して、スライドと電気的に接地されたアルミ フレームの塗装します。
- 細胞培養培地を外し、エレクトロポレーション バッファーの 300 μ L で 2 回洗います。エレクトロポレーション バッファー内の細胞を維持します。
- セットアップの生細胞インキュベータ段階で伊藤スライドを保持アルミニウム挿入を配置します。
- 顕微鏡ビューで細胞培養を検索し、セルがいない領域を選択します。ITO 表面に先端に近づくとそっと触って、ヒント 100 μ m を撤回し、「セル」としての地位を保存します。
- すぐに細胞培養を残すシステム液体の nanoliters の数十でマイクロキャピ ラリー チップをフラッシュし、細胞培養に再びそれを置きます。PDMS もない空気の泡が先端に閉じ込められていることを確認するに浸漬中にいくつかの nanoliters を調剤します。
- ITO 表面にそっと近づく (当初は、すなわち「セル」の位置にする必要があります。、100 μ m 表面上)。時に連絡先、ヒント 10 μ m を撤回します。
- 換散のための近くのセルを選択します。マイクロキャピ ラリー ターゲットのセルの上のヒントの場所。
- 単一のセル換散のためマクロ スクリプトを起動します。
- 名位置、マイクロキャピ ラリーは、セルが正常に分離された後に移動する必要があります。これは NS の貯水池 (NS EM)、脱塩バッファー (Cryoem) または EM グリッド (Cryoem) になります。スペル ミスを回避し、"ok"を押します。
- マクロは、ユーザーの介入なし進みます。
- i) 顕微鏡ステージと細胞文化 100 μ m、左側に標的細胞のスナップショットは、移動、マイクロキャピ ラリーから ddH2O システム液体の撮影、および 50 nL が分配されます。これは転置し高塩バッファーが薄れて、浸透圧をセルに適用します。
- ii) ステージは再び標的細胞上の先端の位置に戻されます。定義済み電圧バーストが適用され、3 を吸引するポンプ システムを開始 500 ms 後 2 μ L/分の流量でサンプルの nL。
- iii) のステージは、検査する再度、左に移動されます。ユーザーの入力を求めるウィンドウが表示されます。
- 散のステップが成功したかどうかと言います。
- 答えは、いいえ、引き継ぐ、フラッシュ、マイクロキャピ ラリーと新しい細胞をターゲットかどうか。
- 答えが yes の場合削除 (分離) セルのスナップショットが作成され、その後、マイクロキャピ ラリーは 3.8.1 で指定された場所に移動します。NS またはバッファー貯水池場合は、3 × 0.5 を分配する標準のユーザー インターフェイスを使用して、気泡がないことを確認する、マイクロキャピ ラリー中の液体の nL を移動します。先端は、マクロによって貯留液中浸漬します。
注: サンプル 1.6.9 - NS EM、セクション 2.2 2.6 Cryoem 1.7.9 のセクションで説明したように、グリッドを準備する続行できます。以下では、NS-グリッドの準備に必要な手順を説明します。
- 浸漬ノズル形状に応じて、8-12 分マイクロキャピ ラリーを残す
注: バッファーの高いリン酸濃度調節のためより長い浸漬時間が必要です。 - 5 分配条件セル グリッド上に lysate の nL。
- マイクロキャピ ラリーを撤回し、露点温度以上 1-2 ° C を規制しましょう露点ステージ (DP ステージ) でゆっくりと乾燥条件のサンプル。
- グリッドを削除し、グリッド ボックスまたはペトリ皿に室温で保存します。
結果
"CryoWriter"セットアップは (図 2で描かれた) 小型 EM グリッド準備手続き図 1C D案をテストするために開発されました。図 2A逆蛍光顕微鏡にマウントされているさまざまなコンポーネントの概要を示しています。顕微鏡; の左側に細胞培養のモジュールをインストールします。EM グリッド準備のためモジュールは右側にあります。細胞培養モジュール (図 2B) は光学顕微鏡により付着性真核生物細胞の増殖および細胞培養の住セルイメージ投射します。個々 の細胞は浸透衝撃、エレクトロポレーションとセルの内容のマイクロキャピ ラリー (図 2B図 6A)24,25に誤嚥の複合作用によって服従に分離します。吸気のライセート サンプルは、NS または低温電子顕微鏡用グリッドの準備に使用できます。また、PCR チューブのストック タンパク質溶液は、サンプル ソースをすることができます。採用マイクロキャピ ラリー (図 2B) は、吸気しサブ nL 精度で調剤サンプル ボリューム高精度ポンプ システムに接続されます。プロトコルの詳細としては、このマイクロキャピ ラリー、重要なサンプル輸送を伴わない EM グリッド自体の上にすべてのサンプル処理が実行されます。たとえば、同じマイクロキャピ ラリーは真核生物細胞の溶解、ライセートを吸引、条件をそれ、最後に EM グリッドに因数を分配するたグリッド準備モジュールは、正確に制御された (図 2C) であることは、EM グリッドの温度を可能にする可動式の DP ステージで構成されます。NS-透過電子顕微鏡用グリッドの準備されたサンプル、単に寒冷期から削除でき室温で空気乾燥します。ただし、ことができますいわゆるコーヒー リング効果は定量的 TEM タンパク質「助詞」カウントは避ける必要があります。これを行うには、グリッド、液体の蒸発を遅く、徐々 に増加する温度勾配を利用した DP-ステージでゆっくりと乾燥させます。Cryoem、グリッドの温度は露点; 保存します。およそ 8 ° C の正のオフセットを選択すると、必要に応じてセンサーによって監視できるサンプル液膜の安定化と間伐の制御の蒸発を許可する26。選択した間伐後、ピックアップ-プランジ機構がアクティブ化され、サンプルはガラス固化体 (図 2C)。NS EM グリッドは、常温保存のこの急落の機構が必要ないことに注意してください。

図 2: cryoWriter セットアップの概要。A) cryoWriter セットアップの概要は逆の光顕微鏡 (1) にマウントされています。B)小型 PDMS による細胞培養プレート (4) の上に位置する操作およびセルの換散をサンプルのマイクロキャピ ラリー (3) で A. 細胞培養室 (2)、パネルの左側にある領域のはめ込みが示されます。C)領域のはめ込みパネル A. 'ピックアップ-と-急落' メカニズムの右側に示されています。ホーリーファイバー カーボン フィルム EM グリッド (5) (6) ピンセットの先端の間にマウントは、メイン テキストで露点ステージ (DP ステージ) と呼ばれる低温ステージ (7) との直接接触で水平方向に配置。ステージ温度は PID のコント ローラーとそれを維持、または露点温度、周囲環境により近くに水冷式ペルチェ素子を介して厳重します。DP ステージ (7) は、マイクロキャピ ラリーを基準にしてグリッドを移動する電動 xy 軸にマウントされています。マイクロキャピ ラリー自体 z ステージにマウントされていると EM グリッドの表面の近くに非常にまで低下して使用できる調剤ナノリットル サイズ ボリューム ボリューム (連続炭素薄膜層 NS em または cr 用ホーリーファイバー カーボン フィルムそれをカバーするサンプルのサポートをするヨ-EM)。高精度ポンプ システム (8) を使用してに、液体吸収および調剤が行われる注意してください。螺旋状に、マイクロキャピ ラリーを基準にしてグリッドを移動することによって、液に分散できます。Cryoem 準備のためピックアップ-プランジ凍結機構 (9) は急速に急速冷却とサンプル ガラスの液体エタン (10) にサンプル読み込みグリッドを転送します。この図の拡大版を表示するのにはここをクリックしてください。
図 3は、NS EM グリッド cryoWriter セットアップを使用した代表的な結果を示しています。マイクロキャピ ラリーの先端が積まれた 5 NS と塩イオンの拡散の交換を許可するように、原液からサンプルと数分間 NS ソリューション (タングステン酸 2% メチルアミン) の貯水池に浸漬の nL (理論的な議論については、アーノルド、 etら24). その後、エアコンのサンプルは NS EM グリッドの炭素薄膜フィルム上に分配され、乾燥します。図 3A定量 TEM に必要な完全な液滴を視覚化する同じ方法でスロット グリッドの使用を示しています。コーヒー リングの効果を避けるためには、新鮮なグロー放電グリッドは当初露点温度 (水の蒸発はない) で開催され DP ステージ上、このゆっくりと温められました。ほとんどのアプリケーション (例えば、サンプルまたは構造解析の品質管理) のこの遅い乾燥の工程が不要に注意してください。高品質の NS-図 3B Cのように、それがなければ、準備を取得します。エアコン低リン酸無料塩バッファー時間は、約 3 分は、例えば、低塩分 Tris バッファー (20 mM トリス塩酸 pH 7.4 50 mm NaCl)、タバコ モザイク ウイルス (TMV) を使用して図 3Bに示すように、サンプルです。図 3Cは、TMV PBS バッファー (2.7 mM KCl、1.5 mM KH2PO4、136.9 mM NaCl、8.9 mM Na2HPO4·7H2O、pH 7.4) にあった、最悪のシナリオを示します。リン酸イオンは重金属イオンの NS (図 5Cを参照してください)、延長に必要なコンディショニング時間 (7 分) 一時的な結晶を形成します。他の重金属の塩は、グリッドの準備モジュール、例えば2% メチルアミン バナジン酸塩やアンモニウム モリブデン酸も使用できます (またアーノルドらを見なさい24). ただし、酢酸ウランは適していません。この汚れの架橋効果は、炭素に吸着フィルム (図 5E参照)23前にソリューションでは、蛋白質のサンプル条件がある場合、集計につながります。

図 3:図 1Cに示すように、cryoWriter セットアップを使用した NS グリッドの典型的な結果。A)タングステン酸 2% メチルアミンとエアコン後スロット グリッドに調剤 3 nL 液滴の概要イメージ。B) 20 mM TRIS バッファーに TMV。はめ込みは、指定された領域の 3 倍の拡大を示しています。アーノルドら24から適応 (抜粋資料に関連するそれ以上の権限は ACS に監督する必要があります)。C)タバコ モザイク ウイルス (TMV) PBS バッファー。はめ込みは、指定された領域の 3 倍の拡大を示しています。アーノルドら24から適応 (抜粋資料に関連するそれ以上の権限は ACS に監督する必要があります)。スケール バー: 100 μ m、B、50 nm;C、80 nm。この図の拡大版を表示するのにはここをクリックしてください。
Cryoem グリッド cryoWriter セットアップを使用した典型的な結果は、図 4に描かれています。パネル 4 a は、ガラス固化体サンプルがカバーする領域のグリッドのアトラスを示しています。パネル 4 b は、選択したグリッドのスロットでガラス質の氷の均一性を示しています。どちらの場合も、サンプルは 25 mM HEPES 島 pH 7.5、0.05% Fos 14 洗剤を含む 50 mM NaCl バッファーにあった。多くのサンプルおよびバッファーされたテストし匹敵する高品質のガラス質の氷が得られたが必要条件がバッファーの依存 (図 5の議論を参照してください)。パネル 4 C は、コントラストを高める高デフォーカスでイメージ トリス塩酸バッファー (20 mM 50 mM NaCl トリス-HCl; pH 7.4) のアポフェリチン粒子とバクテリオファージを示しています。パネル 4 D は、amphipoles によって安定化された 200 kDa の膜蛋白質を示しています。

図 4:図 1Dに示すように、cryoWriter セットアップを使用した低温電子顕微鏡グリッドの典型的な結果。サンプルとバッファーは、例では異なります。すべてのサンプルは、ホーリーファイバーの炭素膜に読み込まれました。A) 150 kDa の膜タンパク質、ガラス質の氷の周辺を含むサンプルの概要画像 (「グリッド アトラス」) コラージュは、白い矢印で示されます。B)ガラス質の氷でホーリーファイバー カーボン フィルムを見せて、同じバッファーを使用したグリッドからグリッドのスロットを拡大。いくつかの穴は、白い矢印で示されるようにないサンプル バッファーで満ちています。C)タンパク質アポフェリチンとバクテリオファージを含んでいるガラス固化体のサンプルの炭素穴。Inset: 二重拡大バクテリオファージの末尾を示します。白の印は、カーボン フィルムです。コントラストを高める高デフォーカスと画像が記録されたことに注意してください。D) A 200 kDa の膜タンパク質 amphipols の再構成します。Inset: 増加コントラストと指定された領域の 2 倍の拡大。スケール バー: 100 μ m、B、10 μ m;C と D は、80 nm。この図の拡大版を表示するのにはここをクリックしてください。
CryoWriter セットアップにより最適な EM グリッドの準備条件のスクリーニングを系統的例は図 5Aに示すように (25 mM HEPES 島 pH 7.5、50 mM NaCl、0.05% のアポフェリチン Fos 14)。この実験では、ガラス質の氷の温度を「間伐」を変化させた、しかし、間伐の時間 (すなわち、サンプル アプリケーションとプランジ凍結時間のずれ) が一定 (1 s)。低温オフセット (例えば、8 K)、サンプルの層が厚すぎていた。オフセット温度が高い、穴にガラス質の氷が薄くなった (10 K、12 K) (18 K) の上のいくつかの段階でグリッドに完全になったまで乾燥 (示されていない)。結果記載されてここでは、ガラス質の氷の大きい均一領域に 12 K 鉛のオフセット黒の矢印で示されるように。このような最適化の実験の内容は (アポフェリチン) などのタンパク質の「テスト」を使用してターゲット サンプルのバッファー。見つけた最高の条件は、対象サンプルに適用されます。さらに、最適パラメーターを持つグリッドの準備手順の間にしばしば認識できるし、大幅な時間の節約、電子顕微鏡で上映される必要はありません。図 5は、また cryoWriter のセットアップに固有の典型的な低温電子顕微鏡 (パネル B) と NS EM (パネル C ~ E) 成果物ギャラリーを示します。0.1% デシル-β-D-maltopyranoside (2.7 mM KCl、1.5 mM KH2PO4136.9 mM NaCl、8.9 mM Na2HPO4·7H2O、pH 7.4 では、0.1%DM) を含む PBS でのパネル 5 b に示す Cryoem グリッドは過度に薄くしました。画像の背景は、塩分濃度が高すぎるようになったので粗いです。一般的には、サンプルの外観は、塩濃度の線形関数思えない薄化プロセス中に濃度の閾値に達したとき、穀物は突然顕著になります。プロトコル セクション 1.6 NS EM の「グリッドの準備の前にエアコンのステップで不要な物質を削除できることに注意してください。NS 他のアーティファクトが発生することができます。パネル 5 C に示す例では、条件 PBS バッファー (2.7 mM KCl、1.5 mM KH2PO4、136.9 mM NaCl、8.9 mM Na2HPO4·7H2O、pH 7.4) サンプルなしでは沈殿物の 3 分の 2% メチルアミン タングステン酸の結晶が、明らかに亀裂につながる炭素表面上の広範な力を発揮します。PBS および NS 濃度で析出物の唯一の形式の範囲し、長い (比較図 3C) のサンプルをコンディショニングすることで避けることができます。パネル 5 D には、「コーヒー リング」を出展、ディスペンサー NS サンプル液滴の周囲が表示されます。これは定量的、総サンプルの分析を妨げるし、サンプル アプリケーションの中に露点温度で EM グリッドを維持し、(それを乾燥する温度を徐々 に増やすことで、すなわち、乾燥プロセスを減速することで回避できます。図 3を参照)。パネル 5E (20 mM HEPES, pH 7.0, エアコン 3 分アポフェリチン) 2% ウラニル酢酸汚れ吸着炭素フィルム サポートする前に、条件の蛋白質のサンプルを使用ことはできませんの架橋アクティビティが表示されます。
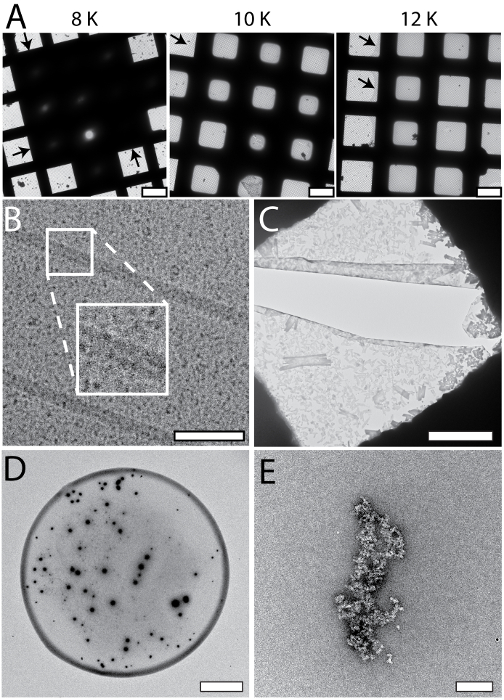
図 5: 体系的な変更および成果物観察 cryoWriter セットアップが NS と低温電子顕微鏡用グリッドの準備に使用されたとき。A)体系的なガラス質の氷厚の変化;Cryoem に備えてグリッドの最適化。DP 段階のオフセットの温度は様々 な (8 K ~ 12 K) 維持間伐時定数 (1 s)。矢印は、サンプルの層の周囲を示します。B)塩の効果;あまりにも高濃度、すなわち、間伐のステップが長すぎます。挿入図は、指定された領域の 2 倍の拡大を示しています。C)塩の沈殿物の重金属塩の存在下で PBS バッファーによって形成されます。PBS バッファーを含むサンプルは、他のバッファーのサンプルより長く調整しなければなりません。ここでは、サンプルなし PBS バッファーは、3 分の 2% メチルアミン タングステン他サンプル バッファーは、一般的にエアコンだった。おそらく薄いサポートに作用する乾燥工程時沈殿物から強い力による炭素膜の亀裂に注意してください。D) 'コーヒー リング」の効果。E) 3 分ウラニル イオンを示す重要な架橋活動と、アポフェリチンの酢酸 2% ウランでエアコン アポフェリチン クラスターの大きな集合体を形成します。スケール バー: A、80 μ m;B、80 nm の C、12 μ m;D、80 μ m;E、200 nm。この図の拡大版を表示するのにはここをクリックしてください。
CryoWriter セットアップを使用して EM グリッド作成に必要なボリュームと少量実験の新しい型ができます。たとえば、単一のセルの全体内容を収集し、NS-70S のために準備することができます。手順は、図 6に示されます。付着性、真核細胞 (HEK 293) 同時エレクトロポレーションとサンプル吸引 (パネル 6 a)25によって分離するか。容量 3 の nL を吸気、細胞ライセートが含まれているし、さらに処理するためマイクロキャピ ラリーに保持されます。-EM パネル 6 b に示すように、NS の細胞培養媒体はセル換散の前に PBS バッファー (2.7 mM KCl、1.5 mM KH2PO4、136.9 mM NaCl、8.9 mM Na2HPO4·7H2O、pH 7.4) と交換されました。セルの内容は、3 で吸気されたバッファーの nL とその後 10 分間図 1Cに記載されている NS の貯留層内エアコン、5 nL ボリュームは NS EM グリッドの連続炭素膜に分配されました。個々 の蛋白質、例えば、アクチン フィラメントと接続された蛋白質の膜パッチは、画像で認識できます。図6 CCryoem の量 3 nL 調剤されたに液体を削除する再吸引せずホーリーファイバー炭素 EM グリッド。試料の比較的厚いフィルムをガラス化する前に薄く広く。これを行うには、DP 段階温度は徐々 に、露点温度から始まります。'ピック プランジ' メカニズムと (細部は見るらアーノルドのサンプル ガラスをトリガー事前に指定したしきい値に到達するまで薄化プロセスを監視するリアルタイムのセンサー システム26). イメージの膜の構造とタンパク質を認識できます。
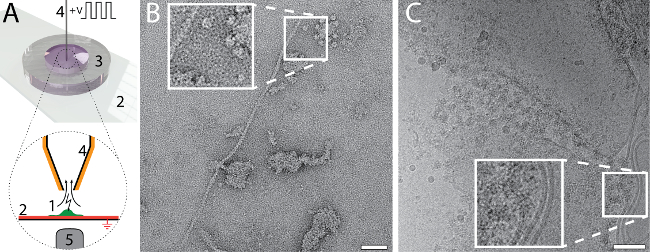
図 6: 単一のセルのビジュアル プロテオミクス cryoWriter 設定を使用します。A)単一付着性真核生物細胞の換散。セルは、官能、ITO (赤) スライド ガラスの (2) の小型シャーレ (3)25(1、緑) を栽培されています。ITO 層を電気的に接地します。セルは、プラチナでコーティングされたマイクロキャピ ラリー (4) によって近づかれます。細胞ライセートの吸引時にせん断力、一連の電気パルスによって行われる溶解を容易にする (示されていない) 初期の高浸透圧刺激が与えられます。光顕微鏡で、プロセスを監視します。顕微鏡の対物レンズは示されている (5) です。詳細については、当社の以前の仕事24,25を参照してください。B)個々 の HEK 293 細胞からライセートの NS EM イメージ。接続された蛋白質と糸状の膜とアクチン パッチが表示されます。アーノルドら24から適応パネル (抜粋資料に関連するそれ以上の権限は ACS に監督する必要があります)。C)個々 の HEK 293 細胞からライセートの Cryoem イメージ。挿入図は、典型的な膜準蛋白質構造が表示されている指定された領域の 2 倍の拡大を示しています。パネル C 適応アーノルドら26からスケール バー: B、50 nm;C、80 nm。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
'CryoWriter' 楽器との NS- と Cryoem nL サイズ総サンプル ボリュームからサンプル グリッドを準備し、完全に古典的な紙しみが付くことのステップを避けるために必要なプロトコルが表示されます。マイクロ流体原理とマイクロ システムはこれを可能にする cryoWriter に結合されます。
我々 の経験では、本稿で提示された小型のメソッドを使用する場合、EM グリッドの準備のためのパラメーター空間が古典的な方法と厳密なユーザー制御の下でより大きいことを示しています。重要なは、増加の再現性の場合、サンプル バッファー システムは、実際の実験を実行する前にパラメーターの最適値を決定するためのすぐに利用できるテスト蛋白質で補完済み画面することが可能になります。これは最低限絶対に目的の標本の消費を保持し、強くお勧め。両方の NS-70S グリッドの準備のための重要なステップは、: (i) プライミング ポンプ システムのサブ ナノリットル ボリューム調剤、システム液体 (水) 脱、バブルの無料。(グロー放電のプラズマ クリーニングのステップ; ii) 正確な制御EM グリッドの表面特性は、再現可能な結果を得るのために重要です。(iii) サンプルをご利用いただけます。、例えば、ns での調節に必要な時間は、バッファーの種類や塩分濃度 (図 3)、およびマイクロキャピ ラリー24のノズル形状によって異なります。(iv) の定量 EM; NS EM 準備蒸発コーヒー リングの効果は、NS EM 製剤の定量分析を禁止することができ、DP ステージによって制御される遅い蒸発によって抑制する必要があります。
提示されたグリッドの準備方法のさまざまな側面は、特定のサンプルの汎用プロトコルの開発をできるように自由に結合できます。典型的な例であるグリッドに向けて Cryoem; 前にエアコン ステップによる高解像度 EM、例えばグリセロールを阻止する物質の除去グリッドを用意する前にエアコンの配位子などのメディエーター分子の導入または単一細胞ライセートで NS- または -70S (図 6) の検討。
マイクロ流体システムと示された方法で最小限のサンプル量の使用は完全に紙しみが付くことのステップの必要性を削除します。これは、タンパク質、可能性のある不要なイオン サンプルの汚染および本質的に大規模なサンプル損失につながる過酷な治療は、あぶらとり紙ため大きな利点です。その一方で、cryoWriter が使用される場合、Cryoem 試料は古典的な方法で準備されるときに、薄いサンプルの膜の気水界面による潜在的影響は避けられない。Cryoem に適したグリッドは、サンプル アプリケーションとガラス化 (データは示されていない) 間未満 0.2 秒待機時間で用意できます。ただし、タンパク質は、拡散によって数ナノ秒でナノメートルの少数の tenths を旅行、あるまだ数回 100 nm 厚のサンプル フィルムの水面に衝突するそれらのための十分な時間。ただし、空気-水界面に付着蛋白質の量これらの短時間ギャップ大幅削減されるだろうし、タンパク質変性を防ぐ可能性がありますまたは粒子の方向を制限します。水空気インターフェイスから機密性の高いタンパク質を保護するかもしれないもう一つの有望なアプローチは、低分子量界面活性物質によるサンプル フィルムをカバーすることです。これらの化合物は、グリッドの準備する前に cryoWriter でご利用いただけますステップによって急速に導入できます。マイクロ流体システムの表面に容積率は、cryoWriter の更なる制限サンプル潜在的マイクロキャピ ラリー表面に非特異的吸着が失われることし、粒子のカウントによって定量分析を妨げます。2 つの方法で問題に対処: 最初に、サンプルは、マイクロキャピ ラリー内で長い距離を移動しません。確かに、処理全体で先端部にキャピラリー ナノリットル サンプル ボリュームのままです。第二に、容積の比率に表面をさらに削減して第三に比較的大きな内径、例えば180 μ m microcapillaries を使用して、必要な場合に、microcapillaries の表面することができます簡単にパッシベーションなど、それらを扱うことによって。市販のポリリジン エタノール グリコール (PLL PEG)。
EM に使用されている単一粒子アプローチによるタンパク質の高分解能解析には、個々 のタンパク質粒子像の数百万に 100,000 だけ必要があります。これは、マイクロ流体技術が構造の調査のための十分な蛋白質の複合体を提供できることを意味します。最小セル量 (約 40,000 セル) からタンパク質複合体 (約 1 時間) の高速分離の小型免疫沈殿法は、以前28を開発されました。このメソッドは今、cryoWriter の小型サンプル準備段階に直接リンクされます。最終的な目標は、すべて 2 時間未満を必要とするタンパク質の超高速分離と Cryoem グリッド準備のための統合されたマイクロ パイプラインを開発します。さらに、図 6分量とサンプルの準備およびほぼ可逆エアコンとグリッドの準備の手順、cryoWriter を使用して達成のために必要な材料の量によって示されるようにそれを可能にする蛋白質を研究するには個々 の細胞の複合体。一緒に、小型免疫沈澱法と、cryoWriter は、我々 が最近熱衝撃実験24よう「単細胞 visual プロテオミクス」と呼ばれる新しいプロテオミクス手法の基盤を築きます。「Visual プロテオミクス」画像の解析に連動データ解析アルゴリズムは現在テスト中です。
開示事項
著者トマス ・ ブラウン、ヘニング スタールバーグ ステファン A. アーノルド宣言次の競合する金利: PCT の特許出願の一部である cryoWriter コンセプト/EP2015/065398 と EP16194230。
謝辞
著者は彼らのサポートは、s. a. ミュラー原稿、A. Fecteau-ルフェーブルの EM、リカルド ・ Adaixo、フランク ・ テクニカル サポートを慎重に読み、重要な議論のためのバーゼル大学の Biozentrum のワーク ショップを感謝したいです。膜タンパク質のレーマンは、彼の刺激的な会話のための名誉の大学バーゼル、A. エンゲル (C チナ、Biozentrum、バーゼル大学からのすべて) のサンプルをテストします。テスト サンプルは、p. Ringler、m. a. によって提供された親切マヒマヒ、t. Schwede (Biozentrum、バーゼルの大学)、P. Leiman (スイス連邦工科大学生物物理学、構造生物学研究室)、r. ディアス アバロス (構造生物学センター、米国ニューヨーク)。プロジェクトは、スイスのナノサイエンスの研究所 (SNI プロジェクト P1401 ARGOVIA プロジェクト MiPIS) とスイスの全米科学財団 (SNF、プロジェクト 200021_162521) によって支持されました。
資料
| Name | Company | Catalog Number | Comments |
| Liquid handling | |||
| Microcapillary tip | New Objective | FS360-100-30-N-20 | SilicaTips 30 µm tip ID, 100 µm ID , pk. 20 |
| FS360-150-30-N-20 | SilicaTips 30 µm tip ID, 150 µm ID , pk. 20 | ||
| Conductive sleeve | New Objective | CONGAS-1 | Conductive Elastomer for HV contact, 12" long |
| Fused silica tubing | BGB-Analytik | TSP-150375 | TSP Standard FS Tubing, 150 µm ID, 363 µm OD, 5 meter |
| PressFit Connector | BGB-Analytik | 2525LD | Deact. PressFit Connector 0.25 to 0.25 mm ID, pk. 25 |
| Syringe 10 µl | BGB-Analytik | HA-80001 | Hamilton 1701 LT - Luer Tip (needle not included) |
| Syringe pump controller | Cetoni | A3921000093 | neMESYS controller |
| Syringe pump dosing unit | Cetoni | A3921000095 | neMESYS dosing unit |
| Temperature control | |||
| Dew point sensor | Meltec | UFT75-AT | Humidity/Temperature sensor, dew point calculation, USB and embedded DLL |
| Temperature sensor | Sensorshop24.ch | LS7-PT1000-1.0-3L | Surface mountable temperature sensor Pt1000 |
| Peltier controller | Cooltronic | TC2812 | PID temperature controller for activation of Peltier driven systems with constant voltage output |
| Peltier element | Distrelec.ch | PE-127-14-15-S | 40x40 mm |
| Water-cooling block | - | - | Water cooling block for 40x40 mm peltier element, copper base |
| Water pump | Digitec.ch | 294877 | XSPC X20 750 Dual 5.25 Bay Reservoir Pump Black V4 |
| Water heat exchanger block | - | - | Water heat exchanger block with 2 fans to cool down circulating water |
| Small water coolers | PCHC.ch | 223050 | Alphacool MCX ram copper edition 2 pcs |
| Small peltier elements | Distrelec.ch | PE-031-10-15-S | Laird 15x15 mm 3.4 A 8.1 W 3.8 V 74 °C, 2 pcs |
| Mechanics | |||
| Linear stage z-axis | Dyneos AG | M-404.2PD | High-load precision translational stage, 50 mm travel range, DC motor |
| Stage controller | Dyneos AG | C-863 | Mercury Servo Controller |
| Microscope xy-axis stage | Prior Scientific | H117EIL5 | Motorized stage for Zeiss Axiovert 200 inverted microscope |
| Small permanent magnets | Supermagnete | S-05-08-N | Rod magnet Ø 5 mm, height 8.47 mm, neodymium, N45, nickel-plated, pk. 10 |
| Small electromagnet | Schramme | EG1025A02/110 | Electromagnet 24V 220 N 150 N 2,5 W |
| Controller electromagnet | Conrad.ch | MST-1630.001 7 | Electromagnet control PCB board |
| Solenoid hub | Distrelec.ch | HD8286-R-F-24V100% | Kuhnke Solenid Hub 30 mm 16 N 2 N 16 W |
| Mini tweezers | Electron Microscopy Sciences | 0302-M5S-PS | Dumont Type 5 mini, super thin tips |
| Various optomechanical parts | Thorlabs | - | - |
| Various mechanical parts | Workshop Biozentrum, University Basel | - | Custom designed adapter plates, holders, etc. see attached CAD files |
| Optics | |||
| Laser diode | Thorlabs | CPS780S | 780 nm laser diode module 2.5 mW |
| Photo detector | Thorlabs | PDA100A-EC | Si Switchable Gain Detector, 320-1100 nm, 2.4 MHz BW, 100 mm2 |
| EM grids | |||
| DURASIN FILM TEM | emsdiasum.com | DTF-03523 | 30 nm DuraSiN™ silicon nitride membranes for TEM, pack of 5 |
| Quantifoil Cu 200 mesh R 2/1 | Quantifoil Micro Tools GmbH | ||
| Quantifoil Cu 200 mesh R 1.2/1.3 | Quantifoil Micro Tools GmbH | ||
| Buffers / Neg. stain | |||
| PBS | Sigma | D8537 SIGMA | Dulbecco’s Phosphate Buffered Saline |
| NanoVan 2% | nanoprobes.com | Negative stain vanadium based | |
| NanoW 2% | nanoprobes.com | Negative stain tungsten based | |
| Software | |||
| openBEB | The openBEB 2 framework is avaible upon request, version 3 will be downloadable | ||
| CryoWriter control software (openBEB plugin) | Avaible upon request, extra fees for 3rd party driver software might apply. |
参考文献
- Kuhlbrandt, W. Biochemistry: The resolution revolution. Science. 343 (6178), 1443-1444 (2014).
- Bai, X. -. c., McMullan, G., Scheres, S. H. W. How cryo-EM is revolutionizing structural biology. Trends Biochem Sci. 40 (1), 49-57 (2015).
- Dubochet, J., Adrian, M., Chang, J. J., Homo, J. C., Lepault, J., McDowall, A. W., Schultz, P. Cryo-electron microscopy of vitrified specimens. Q Rev Biophys. 21 (2), 129-228 (1988).
- Lepault, J., Booy, F. P., Dubochet, J. Electron microscopy of frozen biological suspensions. J Microsc. 129, 89-102 (1983).
- Baker, L. A., Rubinstein, J. L. Radiation damage in electron cryomicroscopy. Methods Enzymol. , (2010).
- Crewe, A. V., Eggenberger, D. N., Wall, J., Welter, L. M. Electron gun using a field emission source. Rev Sci Instrum. , (2003).
- Zemlin, F. Expected contribution of the field-emission gun to high-resolution transmission electron microscopy. Micron. 25 (3), 223-226 (1994).
- Scheres, S. H. RELION: implementation of a Bayesian approach to cryo-EM structure determination. J Struct Biol. 180 (3), 519-530 (2012).
- Grigorieff, N. FREALIGN: high-resolution refinement of single particle structures. J Struct Biol. 157 (1), 117-125 (2007).
- Li, X., Mooney, P., Zheng, S., Booth, C. R., Braunfeld, M. B., Gubbens, S., Agard, D. a., Cheng, Y. Electron counting and beam-induced motion correction enable near-atomic-resolution single-particle cryo-EM. Nat methods. 10, 584-590 (2013).
- Milazzo, A. -. C., Cheng, A., Moeller, A., Lyumkis, D., Jacovetty, E., Polukas, J., Ellisman, M. H., Xuong, N. -. H., Carragher, B., Potter, C. S. Initial evaluation of a direct detection device detector for single particle cryo-electron microscopy. J Struct Biol. 176 (3), 404-408 (2011).
- Ruskin, R. S., Yu, Z., Grigorieff, N. Quantitative characterization of electron detectors for transmission electron microscopy. J Struct Biol. 184 (3), 385-393 (2013).
- Veesler, D., Campbell, M. G., Cheng, A., Fu, C. -. y., Murez, Z., Johnson, J. E., Potter, C. S., Carragher, B. Maximizing the potential of electron cryomicroscopy data collected using direct detectors. J Struct Biol. 184 (2), 193-202 (2013).
- Campbell, M. G., Cheng, A., Brilot, A. F., Moeller, A., Lyumkis, D., Veesler, D., Pan, J., Harrison, S. C., Potter, C. S., Carragher, B., Grigorieff, N. Movies of ice-embedded particles enhance resolution in electron Cryo-microscopy. Structure. 20 (11), 1823-1828 (2012).
- Ripstein, Z. A., Rubinstein, J. L. Processing of Cryo-EM movie data. Methods in Enzymology. 579, 103-124 (2016).
- Li, X., Mooney, P., Zheng, S., Booth, C. R., Braunfeld, M. B., Gubbens, S., Agard, D. A., Cheng, Y. Electron counting and beam-induced motion correction enable near-atomic-resolution single-particle cryo-EM. Nature Methods. 10 (6), 584-590 (2013).
- McLeod, R. A., Kowal, J., Ringler, P., Stahlberg, H. Robust image alignment for cryogenic transmission electron microscopy. J Struct Biol. 197 (3), 279-293 (2017).
- Cheng, Y., Grigorieff, N., Penczek, P. A., Walz, T. A primer to single-particle cryo-electron microscopy. Cell. 161 (3), 438-449 (2015).
- Brenner, S., Horne, R. W. A negative staining method for high resolution electron microscopy of viruses. Biochim Biophys Acta. 34, 103-110 (1959).
- De Carlo, S., Harris, J. R. Negative staining and cryo-negative staining of macromolecules and viruses for TEM. Micron. 42 (2), 117-131 (2011).
- Glaeser, R. M. How good can cryo-EM become. Nat Methods. 13, 28-32 (2016).
- Engel, A., Graslund, A., Rigler, R., Widengren, J. in . Single Molecule Spectroscopy in Chemistry, Physics and Biology. 96, 417-431 (2010).
- Kemmerling, S., Ziegler, J., Schweighauser, G., Arnold, S. A., Giss, D., Müller, S. A., Ringler, P., Goldie, K. N., Goedecke, N., Hierlemann, A., Stahlberg, H., Engel, A., Braun, T. Connecting µ-fluidics to electron microscopy. J Struct Biol. 177 (1), 128-134 (2012).
- Arnold, S. A., Albiez, S., Opara, N., Chami, M., Schmidli, C., Bieri, A., Padeste, C., Stahlberg, H., Braun, T. Total sample conditioning and preparation of nanoliter volumes for electron microscopy. ACS nano. 10 (5), 4981-4988 (2016).
- Kemmerling, S., Arnold, S. A., Bircher, B. A., Sauter, N., Escobedo, C., Dernick, G., Hierlemann, A., Stahlberg, H., Braun, T. Single-cell lysis for visual analysis by electron microscopy. J Struct Biol. 183, 467-473 (2013).
- Arnold, S. A., Albiez, S., Bieri, A., Syntychaki, A., Adaixo, R., McLeod, R. A., Goldie, K. N., Stahlberg, H., Braun, T. Blotting-free and lossless cryo-electron microscopy grid preparation from nanoliter-sized protein samples and single-cell extracts. J Struct Biol. 197 (3), 220-226 (2017).
- Ramakrishnan, C., Bieri, A., Sauter, N., Roizard, S., Ringler, P., Müller, S. A., Goldie, K. N., Enimanev, K., Stahlberg, H., Rinn, B., Braun, T. openBEB: open biological experiment browser for correlative measurements. BMC Bioinformatics. 15, 84 (2014).
- Giss, D., Kemmerling, S., Dandey, V., Stahlberg, H., Braun, T. Exploring the interactome: microfluidic isolation of proteins and interacting partners for quantitative analysis by electron microscopy. Anal Chem. 86, 4680-4687 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved