Method Article
Миниатюрных Пробоподготовка для просвечивающей электронной микроскопии
* Эти авторы внесли равный вклад
В этой статье
Резюме
Представлен документ и методы для подготовки томов nanoliter размера выборки для просвечивающей электронной микроскопии. Требуются шаги не промокательной бумаги, таким образом избежать пагубных последствий, которые это может иметь для белков, значительно снижает потери образца и включение анализа одной ячейки lysate для визуального протеомики.
Аннотация
Из-за недавних технологического прогресса крио электронной микроскопии (крио ЭМ) быстро становится стандартный метод структурного анализа белковых комплексов атомной резолюции. Однако белок изоляции методы и методы подготовки образца для EM оставаться узким местом. Относительно небольшое количество индивидуальных белковых частиц (100 000 до нескольких миллионов) нужно быть imaged для высокого анализа белков одной частицы EM подход, делая миниатюрных выборки, обработки, методы и принципы microfluidic это возможно.
Миниатюрных, бумага blotting свободные ет сетки подготовки для образца предварительного кондиционирования, ет сетки грунтовки и пост-обработки, который потребляет только nanoliter объемы выборки представлен метод. Этот метод использует систему дозирования с точностью суб nanoliter для контроля жидких поглощения и ет сетки грунтовки, платформа для контроля температуры сетки, определяя таким образом относительная влажность выше ет сетки и забрать и падение механизм для образца Витрификация. Крио EM ет сетки помещается на стадии контролируемой температурой и образец наддува в капилляр. Кончик капиллярного позиционируется в близости к поверхности сетки, сетка загружается с образцом и избыток повторно без наддува в микрокапиллярной. Впоследствии фильм образец стабилизировалась и слегка разбавленной испарением контролируемые воды регулируется смещение платформы температуры относительно точки росы. В данный момент забрать и падение механизм срабатывает, быстро передачи загрунтовать ет сетки в жидкий Этан для витрификации образца. Кроме того образец кондиционирования методы доступны для подготовки тома nanoliter размера выборки для отрицательных пятно (NS) EM.
Методологии значительно сократить потребление образца и избежать подходы потенциально вредных белков, таких как промокательной бумаги фильтр используется в обычных методов. Кроме того незначительное количество образца требуется позволяет Роман экспериментальных стратегий, таких как быстрый пример кондиционирования, комбинации с одноклеточных лизиса для «визуальные протеомики», или «без потерь» всего Пробоподготовка для количественного анализа сложные образцы.
Введение
Аппаратное и программное обеспечение для структурного анализа белковых комплексов, просвечивающей электронной микроскопии (ТЕА) массово продвинулось за последние годы. Усовершенствования, внесенные проложили путь к «резолюции революции»1,2 и кардинально изменил структурных исследований. Революция началась с появлением крио электронная микроскопия (крио ЭМ)3,4, позволяя подготовка биологических образцов под рядом физиологических условиях во время уменьшения излучения чувствительность и предотвращения Пример испарения в высоком вакууме передачи электронного микроскопа5. В последующие годы добавочное технологический прогресс постепенно увеличивается резолюции достижимыми. Среди этих нововведений были применение пушки Автоэмиссионные6,7и, более недавно, улучшены алгоритмы анализа данных, например максимального правдоподобия методы8,9. Прямая электронная детектор камер10,11,12,13, кино режим изображения и сопровождающих программного обеспечения события14,15, 16 , 17, представила окончательный прорыв, необходимых для достижения атомной резолюции для биологических образцов, анализ одной частицы (для обзора см. Ченг, Григорьев, et al. 18). Присуждение Нобелевской премии по химии для трех из пионеров недавно признали важность крио EM.
Для биологической пробы по ТЕА, метод, используемый для загрузки ет сетки с образцом (впоследствии именуется как «сетка подготовка») должны обеспечить, что результирующий слой образца (i) является достаточно тонким (< 100 Нм) чтобы избежать обширный шум неэластичный или умножить разбросаны электроны, (ii) выдерживает высокий вакуум Микроскоп электрона, и (iii) защищает биомолекулы от радиационного повреждения. Две основные методы используются для выполнения эти предпосылки: отрицательные пятно(NS)19,20 процедур (рис. 1A) адсорбирует образца на тонких углеродных фильм, внедрить биомолекул в аморфных хэви-метал и затем Позвольте Ассамблее высохнуть на воздухе. Это простой и быстрый, и загружен ет сетки (впоследствии именуется как «образца сетках») легко хранить и может храниться в течение продолжительных периодов времени (как правило лет). В ТЕА подготовке демонстрируют высокую контрастность за счет NS и терпеть более высокие дозы электронов чем крио препараты, но резолюции ограничивается примерно 20 Å. крио-EM процедур, которые поддерживает (рис. 1Б) используют Холи углерода. Тонкая пленка образец решения охватывали через отверстия и сетке EM погружается в криогенное, обычно сжиженных этана, чтобы быстро охладить его ниже-150 ° C. В результате аморфные, керамические, 50-100 Нм толщиной фильм решения в поддержку отверстия. Этот тонкий, аморфные пленки выдерживает высокий вакуум в электронный микроскоп и, в идеальном случае, сохраняет биологические структуры в их родном государстве. Процедура позволяет биологических образцов для отображаемого в с высоким разрешением. Однако сетка образца должны храниться при температуре ниже-150 ° C на все время, чтобы избежать devitrification. Записи образа, используя сравнительно высокой электрона дозы из-за низкой температуры, но контраст и соотношение сигнал шум тем не менее является низким. Таким образом усреднения методы используются для увеличения контрастности и условии образец отображаемого под различными углами, с высоким разрешением трехмерные (3D) карта может быть реконструирован. Наиболее часто используемые и весьма успешный метод для 3D-реконструкции на сегодняшний день является одной частицы подход. Недавний обзор см Чэн al.18.
Отрицательный пятно ТЕА (NS-ЭМ) имеет важное значение для проверки и контроля качества, когда необходима высокая контрастность или доступны только ограниченное количество образцов (адсорбция углерода фильм обычно концентрируется образца). Одна частица крио EM является метод золотой стандарт, если с высоким разрешением 3D реконструкций структуры белков предназначены для.
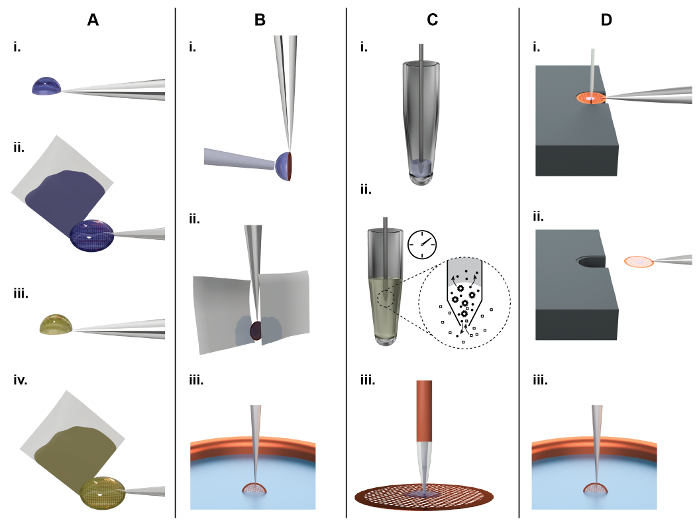
Рисунок 1: подготовка сетки принципы ТЕА и сравнение между классической (Группа A, B) и microfluidic подход (группы C, D). A) классической NS-ет сетки подготовка: около 3 мкл пример накапаны вручную на сетке EM, покрыты пленкой непрерывной углерода (впоследствии именуемой «сетка NS-EM») (i). После инкубации около 10 s, фильтровальная бумага используется для пятно от лишней жидкости со стороны (ii), оставляя адсорбированных биомолекул в фильме тонкой воды. Впоследствии, белок инкубировали в раствор соли тяжелых металлов, например, 2% уранила ацетат, для 20 s (iii) и снова жидкость удаляется промокательной со стороны, с помощью фильтра бумаги (iv). Наконец EM-сетка оставляют сушиться на воздухе. B) классической крио ет сетки подготовка: около 3 мкл пример накапаны рукой на Холи углеродной пленки. Для формирования тонких образцов фильм, излишков жидкости удаляется промокательной бумаге лицо на одной или обеих сторон (ii). Наконец grid является быстро погрузился в жидкий Этан для витрификации (iii). C) NS-ет сетки подготовка с использованием cryoWriter установки: объем 5 nL придыханием из запасов образца с помощью микрокапиллярной (i). Для образца кондиционирования кончик микрокапиллярной погружен в раствор принадлежности, например, 2% Ацетат аммония. Малые молекулы и ионы осуществляется путем диффузии (ii). Обратите внимание, что размеры микрокапиллярной убедитесь, что весь процесс диффузии инициативе. Белки имеют гораздо ниже константы диффузии чем соль ионов и значительно не потеряли24. Наконец образец обойтись на сетке и разрешено сухой (iii). D) принципы подготовки крио ет сетки с помощью метода на основе cryoWriter: EM сетки, покрытой Холи углеродной пленки на поверхности платформы с контролируемой температурой и проведенных пинцетом. Температура платформы контролируется со смещением от температуры точки росы в Грид-среде. Сетке перемещается по отношению к микрокапиллярной, содержащие образец и микрокапиллярной опускается до тех пор, пока это несколько микрометров выше сетки. Впоследствии несколько нанолитров образца обойтись от него в то время как этап переехал в спирали; лишнюю жидкость повторно без наддува (i). После EM сетки грунтовка микрокапиллярной снимается и сетка остается на температуры контролируемых платформе (впоследствии именуются точки росы (DP) стадии) за короткое время, чтобы позволить контролируемых количество образца не испарится. Для ныряния замораживания сетка стремительно выведены от стадии с помощью пинцета (ii), перевернулся на 90° в вертикальной позиции и погрузился в ванну криогенное (iii) (впоследствии именуемой «забрать и погрузиться» механизм). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
К сожалению методы подготовки сетки, используемые для NS и крио ет не имеют значительно улучшилось, так как они были изобретены. Текущие недостатки являются высокий образец потребление (около 3 мкл белка 1 мг/мл) и большое количество образцов (> 99%) потерял (рис. 1А, B). Кроме того, классический метод, используемый для подготовки сетки крио EM это суровые процедуры для белков: во-первых, она включает в себя обширный лицом на промокательной бумаги шаг (рис. 1Б, ii), и, во-вторых, белок подвергается воздух вода интерфейс для значительное количество времени21. Здесь представлен альтернативный метод для образца предварительного кондиционирования, сетки пробоподготовки и пост-обработки (сетка сушки или стеклования) для NS-Эм (рис. 1C) или крио Эм (рис. 1D). Доме построен установки, под названием «cryoWriter», использует миниатюрных образец обработки принципы технологии и microfluidic аспирационная, состояние и отказаться от образца, избегая бумага полностью blotting и предоставляя альтернативные методы для тонких образцов для крио EM. Это значительно сокращает потребление образца и улучшает пользовательский элемент управления над пробоподготовки в целом. Кроме того метод позволяет Роман экспериментальных приложений; таких, как подготовка отдельных биологических компонентов отдельных ячеек в подход под названием «одноклеточного визуальные протеомики»22,23,24,25.
протокол
«cryoWriter» (рис. 2; подробности см. предыдущие работы24,26,-27) или эквивалентной аппаратуры требуется для следующих протоколов. Список поставщиков для основных частей и расходных материалов приводится в Таблице материалов.
1. отрицательные пятно (NS) подготовки сетки
- Включите инструмент и запуск программного обеспечения. Инициализируйте все необходимые модули (контроллер насоса шприца, моторизованных этапов, камер наблюдения и точки росы стадии).
- Прохладно пример поддержки и стадии точки росы. Если требуется, убедитесь, что точка росы стадии температура регулируется 1-2 ° C выше температуры точки росы.
Примечание: Стадии охлаждается коммерческих устройства Пельтье с контроллером PID. - Подготовьте NS, заполнив 100 или 200 мкл ПЦР-пробирку с 100-150 мкл NS (например, коммерчески доступных вольфрамат метиламина 2%). Поместите трубку на поддержку охлаждения образца документа.
- Положение образца.
- Поместить образец (0.5 - 1 мкм) в 100 или 200 мкл ПЦР-пробирку. Если меньше чем 50 мкл пример доступен, отрезать в нижней части ПЦР-пробирку с лезвием бритвы и использовать его как пример хорошо. Это будет гарантировать, что микрокапиллярной можно легко добраться до образца.
Примечание: Это легче аспирационная пробы из 100 или 200 мкл ПЦР трубы, потому что микрокапиллярной, позже используется для аспирационная образец слегка наклонена и направление путешествия высота z-axis ограничен. - Поместите трубки/контейнер ПЦР на поддержку охлаждения образца в инструмент для предотвращения испарения. Кроме того образцы могут быть атмосферный от хорошо пластины в инкубаторе Топ Этап микроскопа при комнатной температуре; охлаждение для хорошо пластины не реализованы.
- Поместить образец (0.5 - 1 мкм) в 100 или 200 мкл ПЦР-пробирку. Если меньше чем 50 мкл пример доступен, отрезать в нижней части ПЦР-пробирку с лезвием бритвы и использовать его как пример хорошо. Это будет гарантировать, что микрокапиллярной можно легко добраться до образца.
- Определение позиции. Используйте джойстик cryoWriter, который управляет моторизованных xy стадии и кнопки управления программного обеспечения для линейной x-, y- и этапов z-axis в положение микрокапиллярной. Используйте камеру для проверки позиции капилляра.
- Переместите микрокапиллярной водохранилище образца. Погрузите кончик в образце жидкость и сохранить эту позицию как «образец».
- Перемещение микрокапиллярной к NS ПЦР-пробирку, погрузите кончик в NS решение и сохранить эту позицию как «пятно».
- Место примерно 100 мкм микрокапиллярной выше центра слот где ет сетки будет располагаться и сохранить эту позицию как «grid_save».
- Аспирационная образца и условием NS-EM.
- Если еще не установлен, установите 10-мкл шприца (0,46 мм внутренний диаметр) на точность шприцевый насос.
- Клей один конец 30 см длиной кварцевое стекло микрокапиллярной (наружный диаметр 360 мкм, внутренний диаметр 150 мкм) на выходе шприца.
- Подключите другой конец микрокапиллярной короткий (5 см) длиной коническая микрокапиллярной через разъем пресс подходят. Конический наконечник короткий микрокапиллярной образует кончик дозирования.
- Заполните шприц дегазацию двойной дистиллированной водой (ddH2O; системы жидкости) и избежать образования воздушных пузырей.
- Обойтись в несколько десятков нанолитров системы жидкости и удалите любые капли из микрокапиллярной безворсовой салфеткой.
- Дважды щелкните сохраненный образец позиции. Это позиции микрокапиллярной в образце хорошо. В то время как капиллярные движется, обойтись 3 x 0.5 nL системы жидкости перед кончик микрокапиллярной погружается в образце для предотвращения пузырьков воздуха от застревания там (см. Примечание 2 ниже).
- Аспирационная 5 nL образца.
- Дважды щелкните на сохраненные позиции NS. Микрокапиллярной выведены из контейнера образца и переехал в водохранилище NS автоматически. В то время как капиллярные движется, вручную обойтись 3 x 0.5 nL образец жидкости перед кончик погружается в водохранилище, чтобы убедиться, что есть нет воздуха пузыри (см. Примечание 2 ниже).
Примечание: Важно: (1) при переключении от аспирации режим дозирования или наоборот, есть небольшая потеря в ход поршня из-за к люфт в gears шприцевой насос. По словам производителя зазор нового подразделения лежит между 7 и 12 мкм. Для наших шприц с ствол диаметром 0,46 мм это переводит на 1-2 nL. Таким образом 1-2 nL может «обойтись», прежде чем образец на самом деле обойтись. Обычно, крошечные капельки начинает выйти из кончик микрокапиллярной после третьего 0.5 nL обойтись шаг. (2) воздушный пузырь ловушку выше/ниже образец будет сделать менее точного дозирования и предотвратить образец принадлежности путем диффузии. - Оставьте микрокапиллярной, погружен на 3-12 минут, в зависимости от буфер образца и сопло геометрии.
Примечание: Выше соли и/или фосфата концентрация в буфере, тем больше время требуется погружения. NS (достаточно быстро) диффундирует в вилку образца при буфера солей (сравнительно быстро) и белок (медленнее) диффузных вне. Это снижает концентрацию солей буфера в образце, помешать им кристаллизации когда высохнет загружены сетки. Кроме того фосфат стремится сформировать преципитат в сочетании с NS.
- Подготовить сетки и хранение место кондиционированного образца.
- В то время как настоящее время обусловлено образца, возьмите кусок клейкой ленты и блок PDMS и очистите верхнюю сторону PDMS путем применения и удаления клейкая лента для обеспечения, что есть нет пыли. Поместите блок PDMS в чашке Петри.
Примечание: Новые блоки PDMS взяты из чистой комнаты. - Тщательно подобрать сетки (например, Cu, 200 или 400 сетка, покрытая пленкой Parlodion/C). Убедитесь в том, чтобы коснуться только край сетки с помощью пинцета. Поместите его на чистые PDMS блок с углеродной пленки вверх.
- Место PDMS блок с сеткой в тлеющего разряда воздуха и свечение выполнять его для 20 s с мощностью 100 Вт на 0,4 мбар. Сохраните сетку в закрытой чашке Петри. Время разряда свечение обычно ведут к более большой распространять объем наплавленного образца на сетке. В результате, пятно слой становится тоньше (слабее пятно).
- 1 мин до времени погружения, понять сетке свечения выписан пинцетом cryoWriter. Убедитесь, что включен электромагнита; в противном случае, включите его в программном обеспечении. Смонтировать пинцет на электромагнит и использовать винт ручной микроманипулятор для выравнивания сетки плашмя на стадии точки росы, углерода фильм стороной вверх. Убедитесь, что точка росы стадии температура регулируется 1-2 ° С выше точки росы для снижения испарения после загрузки образца.
- Когда время погружения, дважды щелкните на «grid_save». Кончик микрокапиллярной будет уделяться безопасно над поверхностью сетки. Вручную привести кончик микрокапиллярной контакт с сетки. Снять сопло 10 мкм и разместите его над центром.
ОСТОРОЖНОСТЬЮ: Некоторые образцы, содержащие моющих средств, как правило, двигаться вверх вдоль наружной поверхности микрокапиллярной когда жидкость отказаться из-за нижней поверхностного натяжения. Важно быть очень близко к поверхности сетки, чтобы предотвратить такие потери. - Распределить 5 nL образца на сетке. На сухой день, когда быстрое испарение происходит на кончик микрокапиллярной, можно обойтись также медленно до тех пор, пока образец находится на самом кончике и затем быстро распределить 5 nL.
- Снять микрокапиллярной и пусть кондиционированного образца медленно высушить на сцене точки росы (DP-этап).
- Как только образец пятно высохнет, снимите решетку и хранить при комнатной температуре в поле Сетка или Петри.
- Отказаться от 500 nL системы жидкости из микрокапиллярной и удалить его с безворсовой ткани. Промойте капилляр 5 раз с этанолом, моющее средство или 1 M NaOH. Это очищает микрокапиллярной, позволяя использовать его с другой образец.
- В то время как настоящее время обусловлено образца, возьмите кусок клейкой ленты и блок PDMS и очистите верхнюю сторону PDMS путем применения и удаления клейкая лента для обеспечения, что есть нет пыли. Поместите блок PDMS в чашке Петри.
2. крио сетки подготовка
- Подготовить документ и образец, выполните описанные выше шаги 1.1-1.5. Если NS не требуется, пропустите шаги 1.3 и 1.5.2. Обмен буфер образца или условие выборки для крио EM методом диализа, например, чтобы снизить концентрацию буфера солей или ввести добавки (например, Трегалоза, моющие средства) вместо нужного буфера NS в шаге 1.3 и 1.5.2.
- Приготовьте жидкий Этан в стандартной крио контейнере.
- Соберите Кубок этана, крио поле держателя и паук и заполнить контейнер Криоген до краев с жидким азотом; обычно требуется около 200 мл. Подождите несколько минут, пока этана Кубок остыл и бесплатно жидкого азота.
- Открыть бутылку газа этана и медленно пусть потока газа в чашке этана. Пусть это заполнить с жидким этаном до тех пор, пока уровень составляет 2-3 мм ниже верхней части; Это занимает всего несколько минут и требует около 5 мл жидкого этана.
- Возьмите крио поле и поместите его в свободный слот в контейнере Криоген.
- Удалите паука, место крышку полистирола на вершине и поместите контейнер Криоген на монтаж в cryoWriter.
- Тлеющий разряд ет сетки.
- Возьмите кусок клейкой ленты и полидиметилсилоксана (PDMS) блок и очистки верхней стороне PDMS путем применения и удаления клейкая лента (удаляет пыль). Поместите блок PDMS в чашке Петри.
- Тщательно выберите сетку из окна сетки. Убедитесь в том, чтобы коснуться только край сетки с помощью пинцета. Поместите его на чистую PDMS блок с Холи углеродной пленки вверх.
- Место PDMS блок с сеткой в плазме более чистых и плазмы чистой поверхности сетки (например использование 75% Ar/25% H2, мощность 50 Вт, давление 25 mTorr). Поместите блок PDMS с сеткой свечения сбрасываются в чашке Петри.
- Поместите сетку в инструмент
- Возьмите сетке свечения выписан пинцетом cryoWriter. Убедитесь, что включен электромагнита; в противном случае, включите его в программном обеспечении. Смонтировать пинцет на электромагнит и использовать винт ручной микроманипулятор для выравнивания сетки плашмя на сцене, углерода фильм стороной вверх.
- Дважды щелкните на «grid_save». Отрегулируйте положение микрокапиллярной так, что кончик 10 мкм на поверхности сетки. Убедитесь, что микрокапиллярной может свободно перемещаться по всей сетке не касаясь его где угодно, если необходимо снять микрокапиллярной несколько микрометров.
- Вернитесь к центру сетки и сохранить новое положение как «сетка».
ОСТОРОЖНОСТЬЮ: Правильное именование является обязательным для работы скрипта макрос.
- Напишите образца и Плунге замораживание сетки.
- Потолочные микрокапиллярной с несколько десятков нанолитров системы жидкости и удалите любые капли из микрокапиллярной безворсовой салфеткой.
- Запустите макрос сценария. Макрос будет выполнять следующие действия:
- Распределить 5 nL (чтобы снять любые воздушные пузыри на кончике) и перейти к позиции образца.
- Аспирационная 65 nL образца. Настаивать 5 nL обратно в пробирку образца. Этот счета для системы зазор и позволить синхронизированный письменной форме, т.е., чтобы обеспечить, что дозирования и стадии начать движение в то же время.
- Перейти к позиции «сетка».
- Инициировать «написание шаблон», которая вызовет микрокапиллярной для перемещения по сетке, одновременно дозирования 45 nL образца.
- Впоследствии переместить микрокапиллярной обратно к центру сетки, опустите его еще 10 мкм и снять излишки образец жидкости.
- Снять микрокапиллярной и выключить электромагнита. Это освобождает пинцета и инициирует окунуться замораживания.
- Сцепление пинцетом и осторожно отпустите магнитный адаптер от поршень. Быстро перевести сетку из Кубка Этан в Криоген контейнер, содержащий поле крио и место сетки в свободный слот.
3. одноклеточных Lysate подготовка
- Подготовьте для электропорации microcapillaries.
Примечание: Коническая (лазер вытащил и инспектируемого) кварцевого microcapillaries имеют защиты водоплавающих покрытие на внешней стороне, за исключением кончика, где покрытие сжигается во время процесса сужающийся.- Чтобы покрыть microcapillaries с проводящий слой, смонтировать их под углом 45 ° на металлической рейке, с советами, указывая вверх. Используйте алюминиевой фольги для щит нижнего конца (2 см) из советов, как немелованной полиимида образует лучшее уплотнение с пресс подходят соединители, занятых позже.
- Распыления депозит липким слоем 20 Нм Ti/W, а затем 200 Нм толстый слой Pt.
- Сделайте микрокапиллярной кончик гидрофобным.
- Подготовьте раствор 1 M 1-dodecanethiol в EtOH.
- Тлеющий разряд микрокапиллярной в воздухе за 1 мин с мощностью 100 Вт на 0,4 мбар.
- Погрузите кончик микрокапиллярной в растворе 1 M 1-dodecanethiol за несколько часов (в идеале на ночь).
Примечание: Это лучше подготовить советы свежезаваренным один день перед использованием.
- Установите новый микрокапиллярной.
- Удалить микрокапиллярной из 1-dodecanethiol раствора, промойте снаружи с этанолом и промойте внутри Этанол, с помощью шприца.
Примечание: Если не функционализированных microcapillaries доступны, быстро свечение выполнять кончик микрокапиллярной и окунуть его в капле коммерческих автомобилей окна лечения, который представляет собой смесь PDMS и серной кислоты. Результате гидрофобные функционализации не так хорошо, как с 1-dodecanethiol, но обычно достаточно. - Рассекающий удар его немелованной конец с капиллярного резцом.
Примечание: Чистый срез имеет важное значение для хорошее уплотнение с разъемом пресс fit. - Используйте зубочистку применять серебряные пасты для резкого границе образуется между стеклом и полиимидные покрытия, когда полиимида покрытие был сожжен лазера при капиллярных потянув.
Примечание: Это укрепление необходимо как Pt покрытие является очень слабым в этом регионе, и электропроводность может легко сломать. - Вымойте полиимида конце микрокапиллярной с помощью ацетона. Оставьте небольшой капли ацетона в конце и вставьте его в отверстие разъема пресс fit. Придайте легкое давление сформировать хорошее уплотнение.
- Удалить микрокапиллярной из 1-dodecanethiol раствора, промойте снаружи с этанолом и промойте внутри Этанол, с помощью шприца.
- Калибровки микрокапиллярной позицию.
- Включите инструмент и запустить программное обеспечение, как описано в шаге 1.1. Кроме того инициализируйте камеры микроскопа и функции генератора.
- Место стекло микроскопа в слайд держатель на микроскопе.
- Нижняя микрокапиллярной недалеко от стеклянное скольжение и его центр через микроскоп цель, до тех пор, пока он появляется в представлении камеры микроскопа. Использование линейных этапах x - и y оси позиционировать кончик микрокапиллярной в центре изображения. Затем медленно опустите кончик, до тех пор, пока она слегка затрагивает стеклянное скольжение.
ОСТОРОЖНОСТЬЮ: Выбор очень маленькими шагами окончательный подход (5 мкм). В противном случае могут быть повреждены кончик. - Нажмите кнопку «Калибровка сопла». Это убирается микрокапиллярной 40 мм и наборы, это положение, как Главная позиция.
- Подготовка штампованные PDMS штук и Ито слайды
- Mix PDMS и сшивателя в соотношении 10:1, налить в большой Петри на глубину от около 2-3 мм. Выпекать при температуре 60° C на несколько часов в гибридизации инкубатора или аналогичное устройство.
- С помощью молотка и штамп (диаметр 12 мм), вырезать отверстия в слое PDMS. После этого используйте скальпель вырезать 2 см длиной квадраты или прямоугольники, включая отверстия, чтобы получить штамп куски, которые приспосабливают на микроскопа. Как правило два штампованных частей смонтированы на одной микроскопа.
- Вымойте PDMS штук и Ито слайды сначала с моющим средством, а затем с 70% этиловом спирте. Место их, влажный, в чашке Петри и пусть этанола полностью испариться в духовке при температуре 60° C.
- Тлеющий разряд Ито слайды за 1 мин с мощностью 100 Вт на 0,4 мбар, а затем применить 1 мл раствора покрытие (например, поли L-лизин (PLL)). Инкубируйте 5 мин, удалить раствор с пипетки и применять 1 мл ddH2O. слегка агитировать за 1 мин, а затем удалить ddH2O, с помощью пипетки. Пусть слайды сушат при температуре 60° C.
- Подготовьте клеточной культуры. Следуйте стандартным культивирования протокол сторонник клетки (например, Арнольд, et al. 24 , 25). семян клетки на Ито во время нормальной расщепления/пассированый работает.
- Возьмите свежезаваренным PLL-покрытая ITO слайд и добавить PDMS кусок. Придайте некоторое давление в форме водонепроницаемые уплотнения. Это производит небольшие скважин с слайд как их базы.
- Около 300 мкл клеток, приостановлено в свежих средних PDMS скважин. Высева плотность должна быть около 75 000 ячеек на хорошо.
- Инкубируйте слайды Ито на 1-2 дня при стандартных условиях.
- Подготовьте для эксперимента лизис клеток:
- Предварительно теплой несколько миллилитров электропорации буфера (например,-фосфатный буфер (PBS)).
- Подготовить настройки для подготовки NS-ет сетки
Примечание: Подробная информация для подготовки установки показаны шаги 1.1-1.5 (для NS) или шаг 2.1-2.4 (для крио). Здесь мы описываем наиболее важные шаги для NS-подготовка.- Подготовьте NS, заполнив 100 или 200 мкл ПЦР-пробирку с 100-150 мкл NS (например, коммерчески доступных вольфрамат метиламина 2%). Поместите трубку на поддержку охлаждения образца документа.
- Перемещение микрокапиллярной к NS ПЦР-пробирку, погрузите кончик в NS решение и сохранить эту позицию как «пятно».
- Загрузите параметры стандартной лизиса, например, лизис напряжения.
- Возьмите Ито слайд из инкубатора и смонтировать его на Микроскоп вставки. Использовать два винта, чтобы исправить слайд на алюминиевые вставки и обеспечить электрического контакта между Ито покрытие слайд и электрически заземленной алюминиевая рама.
- Удалите средство культуры клеток и дважды промыть 300 мкл буфера электропорации. Держите клетки в буфере электропорации.
- Поместите вставку алюминия, холдинг Ито слайд в инкубатор жить клеточной стадии на установку.
- Найдите культуры клеток в Микроскоп Вид и выберите область с клеток не. Подход кончик к поверхности Ито и нежно коснуться его, затем снять наконечник 100 мкм и сохранить положение как «клетки».
- Быстро оставить культуры клеток и потолочные кончик микрокапиллярной с несколько десятков нанолитров системы жидкости, затем снова положить его в культуре клеток. Во время погружения в скважину PDMS для обеспечения того, чтобы не воздушных пузырей попали на кончике отказаться от нескольких нанолитров.
- Осторожно подходить к поверхности Ито (изначально, вы должны быть в позиции «клетки», т.е., 100 мкм над поверхностью). После контакта отзыв чаевые 10 мкм.
- Выберите ячейку рядом для лизиса. Место кончике микрокапиллярной над целевой ячейкой.
- Запустите макрос сценария для одной ячейки лизис.
- Имя позиции микрокапиллярной следует перенести после того, как ячейки были успешно анализироваться. Это будет NS водохранилище (NS-ЭМ), опреснительные буфера (крио ЭМ) или ет сетки (крио EM). Избежать орфографических ошибок и нажмите кнопку «ОК».
- Макрос продолжается без вмешательства пользователя:
- i микроскоп этапа и клетки культуры 100 мкм перемещаются влево, снимок целевой ячейки — это принято и 50 nL ddH2O системы жидкости отказаться от микрокапиллярной. Это смещает и ослабляет высокого соли буфера и применяется к ячейке, осмотическое давление.
- II этап переехал обратно в позицию кончик над целевой ячейкой снова. Стандартные напряжения всплеск применяется, и после 500 мс системе насос начинает аспирационная 3 nL образца при скорости потока 2 мкл/мин.
- III этап перемещается слева снова, позволяя ячейку, чтобы быть проверены. Появится окно, спрашивая для ввода данных пользователем.
- Сказать ли лизис шаг был успешным или нет.
- Если ответ нет, взять на себя, флеш микрокапиллярной и целевых новую ячейку.
- Если ответ Да, снимок удален (лизированных) ячейки, а затем микрокапиллярной переехала в расположении, указанном в 3.8.1. Если это NS или буфер водохранилище, используйте стандартный пользовательский интерфейс отказаться от 3 х 0,5 nL жидкости при микрокапиллярной движется обеспечить, что нет пузырьков воздуха. Кончик погружен в жидкость водохранилище макрос.
Примечание: Вы можете продолжать условие выборки и подготовить сетки, как описано в разделах 1.6.9 - 1.7.9 NS-EM или раздел 2.2-2.6 для крио Эм. Ниже описаны необходимые шаги для подготовки NS-сетки.
- Оставить микрокапиллярной, погружен на 8-12 минут, в зависимости от геометрии сопла
Примечание: Концентрация высокой фосфата в буфере требует более длительного времени погружения для кондиционирования. - Распределить 5 nL кондиционером ячейки lysate на сетке.
- Снять микрокапиллярной и пусть кондиционированного образца сухой медленно на сцене точки росы (DP-стадия) регулируется 1-2° C выше температуры точки росы.
- Снимите решетку и хранить при комнатной температуре в поле Сетка или Петри.
Результаты
Установка «cryoWriter» был разработан (изображены на рис. 2) для того чтобы испытать миниатюрных ет сетки подготовки процедуры, предлагаемые в Рисунок 1C, D. Рисунок 2 A показывает обзор различных компонентов, крепится к обратная флуоресцентным микроскопом. Культивирование клеток модуль установлен на левой стороне микроскопа; модуль для подготовки сетки EM расположен справа. Культивирование клеток модуль (рис. 2B) позволяет рост адэрентных эукариотических клеток и клеток визуализации клеточной культуры в световой микроскоп. Отдельные клетки лизированы комбинированным действием осмотическим шоком, электропорация и аспирации содержимого ячейки в24,микрокапиллярной (рис. 2Б, Рисунок 6A)25. Атмосферный lysate образец затем может использоваться для подготовки сетки для NS - или крио EM. Кроме того решение запасов белка в ПЦР-пробирку может быть источника выборки. Микрокапиллярной (рис. 2B) занятых подключен к системе насос высокой точности, позволяя образца томов будет придыханием и обойтись с суб nL точностью. Как подробно говорится в протоколы все образца обработка выполняется в пределах этой микрокапиллярной или на сетке EM без значительных образца транспорта. К примеру же микрокапиллярной используется для лизируют отдельных эукариотических клеток, аспирационная lysate, состояние его и наконец освободить аликвоты на ет сетки. Модуль подготовки Сетка состоит из подвижных DP-стадии, что позволяет температура ет сетки, размещенных на нем, чтобы быть точно контролируемой (рис. 2C). NS-ТЕА подготовленного образца сетки можно затем просто удалены из стадии холодной и позволило высохнуть на воздухе при комнатной температуре. Однако так называемый кофе кольцо эффекты, которые можно затем привести необходимо избегать количественных ТЕА, где учитываются белка «частицы». Чтобы сделать это, сетки сушатся медленно на DP-сцене с помощью постепенно увеличивая градиента температуры замедлить испарение жидкости. Для крио EM температура сетки держится недалеко от точки росы; выбирается положительное смещение приблизительно 8 ° C, позволяя контролируемых испарение жидкого образца для тонкопленочных стабилизации и истончение, который при необходимости может контролироваться датчиком26. После выбранного истончение время активируется механизм подбора и окунуться и образца является керамические (рис. 2C). Обратите внимание, что этот погружаясь механизм не нужен для NS-ет сетки, которые хранятся при комнатной температуре.

Рисунок 2: обзор настройки cryoWriter. A) обзор cryoWriter установки монтируется на обратное свет микроскоп (1). B) врезные области указано на левой стороне панели A. клеток культивирования отсека (2), с микрокапиллярной (3) для манипуляции и клеток лизис образец позиционируется выше миниатюрных ячеек на основе PDMS культуры пластину (4). C) врезные области указано на правой стороне панели A. «забрать и падение» механизма. Холи углерода фильм ет сетки (5) монтируется между советы пинцет (6) и горизонтальном в непосредственном контакте с контролируемой температурой стадии (7), называют этап точки росы (DP-этап) в основном тексте. Стадии температура строго контролируется через контроллер PID и водяным охлаждением элемент Пельтье, сохраняя его минимальной или близкой к температуре точки росы, в зависимости от окружающей среды. DP-этап (7) установлен на моторизованных xy оси для перемещения сетки по отношению к микрокапиллярной. Микрокапиллярной, сам монтируется на z сцене и могут быть снижены до тех пор, пока это очень близко к поверхности сетки EM и использованы отказаться от nanoliter размера томов на поддержку образца, покрывая его (непрерывной тонкой углеродного слоя для NS-EM или Холи углеродной пленки для cr Эй Эм). Обратите внимание, что жидкость поглощения и дозирования выполняется с помощью высокоточного насос системы (8). Обойтись жидкость может распространяться путем перемещения сетки по отношению к микрокапиллярной в спирали. Для подготовки крио EM забрать и падение механизм замораживания (9) быстро передает образец загружены сетки в жидкий Этан (10) для быстрого охлаждения и образец витрификации. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Рисунок 3 показывает представитель результаты, полученные для сеток NS-EM, подготовлен с использованием cryoWriter установки. Кончик микрокапиллярной был загружен с 5 nL образца от Стоковый раствор и опущенные в водохранилище NS раствора (2% метиламина вольфрамат) на несколько минут чтобы позволить диффузионное обмен ионов соли и NS (для теоретической дискуссии см. Арнольд, et Al. 24). После этого, кондиционированного образца было обойтись на тонких углеродных фильм NS-ет сетки и сушат. Рисунок 3 A показывает использование сетки слот таким же образом визуализировать полный капли, как это требуется для количественных ТЕА. Для того, чтобы избежать эффекта кольцо кофе, свежую свечение выписан сетки первоначально состоялась в температуры точки росы (нет испарения воды) и затем медленно прогревается на DP-сцене. Обратите внимание, что для большинства приложений (например, контроль качества образца или структурный анализ) этот процесс медленного высыхания не требуется. Высокое качество NS-препараты получены без него, как показано на рисунке 3B, C. Раз принадлежности для фосфат свободной низким соли буферов находятся около 3 минут, например, с низким содержанием соли трис буфере (рН 7,4 20 мм трис-HCl 50 мм NaCl), как показано на рисунке 3B с помощью вирус мозаики табака (ПДЦ) как образец. Рисунок 3 C представляет наихудший сценарий как TMV в PBS буфера (2,7 мм KCl, 1,5 мм х2PO4, 136.9 мм NaCl, 8,9 мм Na2HPO4·7H2O, рН 7,4). Фосфат ионы формируют переходных кристаллы с ионами тяжелых металлов NS (см. рис. 5C), удлинение принадлежности сроков (7 мин). Другие соли тяжелых металлов может также использоваться с модуль подготовки сетки, например, 2% метиламина ванадата или аммония молибдата (см. также Арнольд, и др. 24). Однако уранила ацетата не подходит; сшивки эффект это пятно приводит к агрегатов, если образец протеина связано в растворе, прежде чем фильм адсорбция углерода (см. Рисунок 5E)23.

Рисунок 3: типичные результаты для сеток NS, подготовлен с использованием cryoWriter установки, как указано на рисунке 1C. A) обзор изображение 3 капли nL обойтись на сетке слот после кондиционирования с метиламином вольфрамат 2%. B) TMV в буфер TRIS 20 мм. Врезные показывает 3 x расширение указанного региона. Адаптировано из Арнольд, et al.24 (дополнительные разрешения, относящиеся к выдержки материала должны быть направлены в ACS). C) вирус мозаики табака (ПДЦ) в буфере PBS. Врезные показывает 3 x расширение указанного региона. Адаптировано из Арнольд, et al.24 (дополнительные разрешения, относящиеся к выдержки материала должны быть направлены в ACS). Масштаб бары: A, 100 мкм; B, 50 Нм; C, 80 Нм. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
На рисунке 4изображены типичные результаты, полученные для сеток крио EM, подготовлен с использованием cryoWriter установки. Группа 4A показывает сетку Атлас покрытых керамической образца. 4б группа показывает однородности стекловидным льдом в выбранной сетки слот. В обоих случаях образец был в 25 мм HEPES-Кох pH 7.5, 50 мм NaCl буфер, содержащий 0,05% Fos 14 моющего средства. Многие образцы и буферы были протестированы и сопоставимых высокое качество стекловидного тела льда было получено, но необходимые условия буфер зависимых (см. также обсуждение рис. 5). Группа 4C показывает apoferritin частиц и бактериофага в Tris-HCl буфере (20 мм трис-HCl, 50 мм NaCl; рН 7,4), отображаемого на высокой defocus для увеличения контрастности. Группа 4D показывает 200 кДа мембранный белок, стабилизированный amphipoles.

Рисунок 4: типичные результаты для сеток крио EM, подготовлен с использованием cryoWriter установки, как указано на рис. 1D. Образцы и буферы различаются в примерах. Все образцы были загружены на Холи углеродных пленок. A) коллаж изображений («Атлас сетки») Обзор образца, содержащего 150 кДа мембранный белок, периферии стекловидным льдом обозначается белыми стрелками. B) расширенное сетки слот из сетки, приготовленные тот же буфер, показаны Холи углеродной пленки со стекловидным льдом. Некоторые отверстия не заполнены с буфером выборки как обозначается белыми стрелками. C) углерода отверстие с керамические образцы, содержащие apoferritin белковых комплексов и бактериофагов. Вставка: двойная расширения показаны хвост бактериофага. Белая звездочка указывает углеродной пленки. Обратите внимание, что образ был записан с высоким defocus для увеличения контрастности. D) 200 кДа мембранных белков воссоздана в amphipols. Вставка: 2 x расширение указанного региона, показано с повышенной контрастностью. Масштаб бары: A, 100 мкм; B, 10 мкм; C и D, 80 Нм. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Установка cryoWriter позволяет систематического отбора для оптимальных условий приготовления Эм сетки; Пример показан на рис. 5A (apoferritin в 25 мм HEPES-Кох pH 7.5, 50 мм NaCl, 0,05% Fos 14). В этом эксперименте, стекловидным льдом, «истончение» температура была различной, но истончение время (например, разрыв во времени между образца приложения и небольшим замораживания) сохранялась (1 s). При низких температурах смещения (например, 8 K) слой образец был слишком толстая. При более высоких температурах смещения, стекловидным льдом в отверстия была тоньше (10 K, 12 K), до тех пор, пока на определенном этапе (выше 18 K) сетке стала полностью сухой (не показано). В результаты представлены здесь, смещение 12 K приводят к большой однородной области стекловидным льдом как указано черными стрелками. Такие эксперименты оптимизации могут быть выполнены с буфером целевой выборки с использованием «тест» белков (например, apoferritin). Найти лучшие условия применяются к целевой выборки. Кроме того сетки с параметрами далека от оптимальной часто может быть признано во время процедуры подготовки и не нужно будет показан в электронный микроскоп, экономя значительное время. Рисунок 5 также показывает галерею типичных крио Эм (Группа B) и артефакты NS-Эм (панелей C-E) для установки cryoWriter. Крио ет сетки, показаны на панели 5B с TMV в PBS, содержащие 0,1% децил β-D-maltopyranoside (2,7 мм KCl, 1,5 мм х2PO4, 136.9 мм NaCl, 8,9 мм Na2HPO4·7H2O, рН 7,4, 0.1%DM) был чрезмерно разбавлять. Фон изображения зернистым, потому что концентрация соли стали слишком высока. В общем внешний вид образца, кажется, не быть линейная функция концентрации соли; зерна вдруг стали видные когда Пороговая концентрация достигается в процессе прореживания. Обратите внимание, что нежелательные вещества могут быть удалены по принадлежности шаг до подготовки сетки, как описано для NS-ет в протоколе раздел 1.6. NS может вызвать другие артефакты. В примере, показанном в панели 5C PBS буфера (2,7 мм KCl, 1,5 мм х2PO4, 136.9 мм NaCl, 8,9 мм Na2HPO4·7H2O, рН 7,4) без образца было обусловлено в 2% метиламина вольфрамат за 3 мин преципитаты и кристаллы очевидным и оказывают обширные силы на поверхности углерода приводит к трещинам. Единственная форма преципитаты в определенной концентрации PBS и NS диапазон и можно избежать путем кондиционирования образца для дольше (Сравните рис. 3C). Группа 5D показывает на периферии обойтись капли образца NS выставке «кофе кольцо». Это будет мешать анализа количественных, Общая проб и можно избежать путем замедления процесса сушки, т.е., держать ет сетки при температуре точки росы во время образца приложения, а затем постепенно увеличивая температуру сушить) см. рис. 3А). Группа 5E (apoferritin в 20 мм HEPES, pH 7.0, кондиционером 3 мин) показывает активность сшивки уранила 2% ацетат пятно, которое не может использоваться для образцы протеина состояние, прежде чем они адсорбируются к углерода фильм поддерживает.
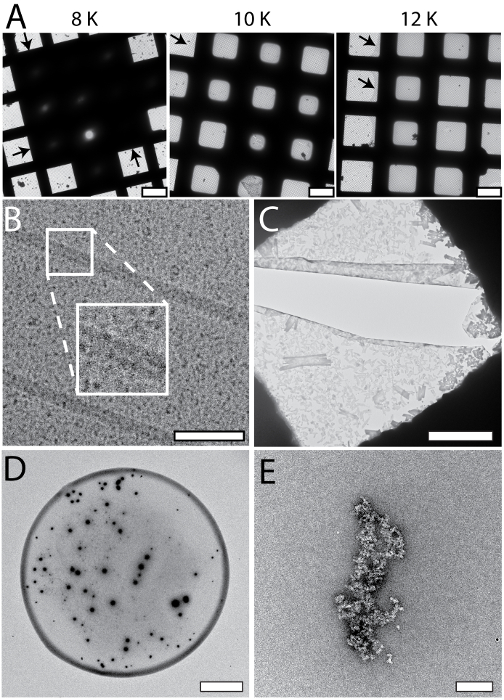
Рисунок 5: систематические изменения и артефакты наблюдается, когда установка cryoWriter был использован для подготовки сетки для NS - и крио EM. A) изменения толщины систематического стекловидным льдом; Оптимизация подготовки сетки для крио EM. Смещения температуры DP-этапа был разнообразный (8 K 12 K) сохраняя истончение постоянная времени (1 s). Стрелки указывают на периферии образец слоя. B) соль эффекты; слишком высоко концентрированный, то есть, истончение шаг был слишком долго. Врезные изображает 2 x расширение указанного региона. C) соль преципитаты, образованный PBS буфера присутствии соли тяжелых металлов. Образцы, содержащие PBS буфера должны выдерживаться больше, чем примеры в других буферов. Здесь PBS буфера без образца было обусловлено в 2% метиламина вольфрамат 3 мин, типичное время для других образцов буферов. Обратите внимание на трещины в фильме углерода наиболее вероятно из-за сильного взаимодействия от осадков, действуя на тонкой поддержку во время процесса сушки. D) «Кофе кольцо» эффект. E) Apoferritin кондиционерами в 2% уранила ацетат за 3 мин уранила ионов демонстрируют значительные сшивки активности и apoferritin кластеры формы крупных агрегатов. Масштаб бары: A, 80 мкм; B, C 80 Нм, 12 мкм; D, 80 мкм; E, 200 Нм. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Небольшое количество и объем, необходимый для ет сетки подготовки с использованием cryoWriter установки позволяет новые типы экспериментов. Например общее содержимое одной ячейки можно собраны и подготовлены для NS - и крио EM. В рисунке 6Aуказывается процедура. Сторонником, эукариотических клеток (ГЭС 293) лизированы одновременных электропорации и образец аспирации (Группа 6A)25. Суммарный объем 3 придыханием nL, который содержит lysate клетки и сохраняется в микрокапиллярной для дальнейшей обработки. Для NS-EM, показан в панели 6B средство культивирования клеток обменивался с PBS буфера (2,7 мм KCl, 1,5 мм х2PO4, 136.9 мм NaCl, 8,9 мм Na2HPO4·7H2O, рН 7,4) до лизис клеток. Содержимое ячейки были наддува в 3 nL буфера и кондиционерами в водохранилище NS, как указано в Рисунок 1C на 10 мин, потом, тома 5 nL было обойтись на непрерывной углеродной пленки NS-ет сетки. Индивидуальных белков, например, нитчатые актина и мембраны патчи с прилагаемой белков может быть признано в изображении. Для крио EM, показано на рисунке6 C, объем 3 nL было обойтись на Холи углерода ет сетки без повторного аспирации для удаления жидкости. Относительно толстые фильм образца формируется был широко разбавлять до витрификации. Чтобы сделать это, DP-стадии температура была постепенно увеличивается, начиная с температуры точки росы. Истончение процесс контролируется датчиком система реального времени до предварительно заданного порога срабатывания механизма «забрать и падение» и образец стеклования (для Подробнее см. Арнольд, et al. 26). мембранных структур и белки могут быть признаны в изображении.
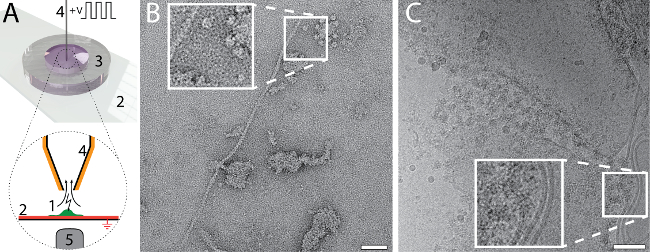
Рисунок 6: единый визуальный протеомики клеток с использованием cryoWriter установки. A) лизис одной адэрентных эукариотической клетки. Клетка выращивается на функционализированных, стеклянное скольжение Ито покрытием (красный) (2) в миниатюрных Петри (3)25(1, зеленый). Ито слой заземлены. Ячейка подошла микрокапиллярной (4), который с платиновым покрытием. Первоначальный шок осмотического (не указано) предоставляется для облегчения лизиса, которая выполняется ряд электрических импульсов и перерезывающих сил во время стремление lysate клетки. Этот процесс можно контролировать с помощью световой микроскопии; объектива микроскопа является указано (5). В разделе наши предыдущие работы24,25. B) NS-EM образ lysate от отдельной ячейки 293 ГЭС. Нитчатые актина и мембраны патчи с прилагаемой белки являются видимыми. Группа, адаптированный Арнольд, et al.24 (дополнительные разрешения, относящиеся к выдержки материала должны быть направлены в ACS). C) крио-EM образ lysate от отдельной ячейки 293 ГЭС. Врезные показывает 2 x расширение указанного региона, где видны типичные мембранных структур с связанных белков. Группа C адаптировано из Арнольд, et al. 26 баров масштаба: B, 50 Нм; C, 80 Нм. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Инструмент «cryoWriter» и протоколы, необходимые для подготовки образца сетках для NS - и крио EM от nL размера общей выборки томов и полностью избежать классической промокательной бумаги шаг представлены. Microfluidic принципы и микромеханические системы объединены в cryoWriter чтобы сделать это возможным.
Наш опыт показывает, что при использовании миниатюрных методы, представленные в этой рукописи, параметр пространство для приготовления Эм сетки больше, чем для классических методов и под более жесткий пользовательский элемент управления. Главное достигнуто увеличение воспроизводимость позволяет предварительно просматривать с системой буфер образца, дополняет с легко доступных тестовых белка, чтобы определить оптимальные параметры перед фактической эксперимент выполняется. Это держит потребления образца интерес к абсолютной минимальной и настоятельно рекомендуется. Важнейшие шаги для подготовки сетки обоих NS - и крио EM являются: (i) Грунтовка насос системы; для суб nanoliter объем дозирования, система жидкости (воды) должен быть дегазации и пузырь бесплатно. (ii) точный контроль тлеющего разряда или плазменной очистки шаг; характеристики поверхности ет сетки имеют решающее значение для воспроизводимых результатов. (iii) образца принадлежности; время, необходимое для кондиционирования, например, с НС, зависит от типа буфера, содержание соли и концентрации (рис. 3), а также сопло геометрии микрокапиллярной24. (iv) испарения для NS-EM подготовки количественных Эм; кофе кольцо эффект может запретить количественный анализ NS-Эм препараты и должно быть подавлено медленно испарения, контролируемых DP-сцене.
Различные аспекты методов подготовки представленных сетки можно было свободно комбинировать, позволяя разработки универсальных протоколов для конкретных образцов. Типичными примерами бы удаления вещество, которое препятствует разрешением EM, например, глицерин, принадлежности шаг до подготовки сетки для крио Эм; Введение посредника молекул, например лигандов, по принадлежности перед готовятся сетки; или изучения одну ячейку lysate, NS - или крио Эм (рис. 6).
Использование микрофлюидика и минимальный пример сумм в представленные методы полностью устраняет необходимость промокательной бумаги шаги. Это большое преимущество, потому что промокательной бумаги жестокого обращения для белков, потенциально загрязнять образца с нежелательные ионы и неизбежно приводит к потере массивные образца. С другой стороны эффекты, потенциально вызванных воздух вода интерфейс тонкий образец пленке, образующейся при крио EM образцы подготавливаются в классической манере не избежать при использовании cryoWriter. Подходит для крио ет сетки может быть подготовлен с менее 0,2 s время ожидания между образца приложения и стеклования (данные не показаны). Однако как белки путешествовать несколько десятых долей нанометра в несколько наносекунд путем диффузии, есть еще достаточно времени для их столкновения с воздух вода интерфейс 100 Нм толщиной образца фильм несколько раз. Однако, количество белков, придерживаясь воздух вода интерфейс может быть значительно уменьшена эти пробелы в короткое время и может предотвратить денатурации белков или ограничено частиц ориентации. Еще один перспективный подход, который может защитить чувствительные белки от воздух вода интерфейс является для покрытия образца фильм с низкой молекулярной массой поверхностно-активных веществ. Эти соединения могут быть быстро введены принадлежности шаг в cryoWriter до подготовки сетки. Высокое отношение поверхности к объему microfluidic систем является дальнейшее ограничение cryoWriter, как пример потенциально могут быть потеряны при неспецифической адсорбционной на микрокапиллярной поверхность и нарушить количественный анализ путем подсчета частиц. Проблема решается двумя способами: во-первых, образец не преодолевать большие расстояния в пределах микрокапиллярной. Действительно объем образца nanoliter остается на капиллярной оконечности всей обработки. Во-вторых, поверхность соотношение объема далее уменьшается с помощью microcapillaries с относительно большим внутренним диаметром, например, 180 мкм. в-третьих, поверхностей microcapillaries может быть легко пассивируется, при необходимости, например, рассматривая их с коммерчески доступных polylysine этанола гликоли (PLL-PEG).
Высоким разрешением анализ белков от одной частицы подход, используемый в EM требует только 100 000 до нескольких миллионов изображений отдельных белковых частиц. Это означает, что методы microfluidic может обеспечить достаточно белковых комплексов для структурной расследования. Ранее28был разработан метод миниатюрных иммуно высыпание для быстрой изоляции белковых комплексов (примерно 1 час) от минимальной ячейки суммы (около 40 000 ячеек). Этот метод будет теперь напрямую связана с этапа подготовки миниатюрных образца cryoWriter. Конечная цель заключается в разработке комплексной microfluidic трубопровода для ультра-быстрой белка изоляции и крио ет сетки подготовки, что требует меньше чем за два часа во всех. Кроме того как показано на рисунке 6, минутный объем и объем материала, необходимые для подготовки проб и почти без потерь принадлежности и процедуры подготовки сетки с помощью cryoWriter, сделать это возможным для изучения белков комплексы отдельных клеток. Вместе метод миниатюрных иммуно осадков и cryoWriter заложить основы нового метода протеомики, под названием «одноклеточного визуальные протеомики», как мы недавно продемонстрировано для теплового шока эксперименты24. В настоящее время проводится тестирование алгоритмов анализа данных ориентирована на анализ изображений «визуальные протеомики».
Раскрытие информации
Авторы Штефан а. Арнольд, Хеннинг Штальберг и Томас Браун объявить следующие конкурирующих финансовых интересов: cryoWriter концепция является частью патентной заявке PCT / EP2015/065398 и EP16194230.
Благодарности
Авторы хотели бы поблагодарить мастерской Biozentrum Базельского университета за их поддержку, S. A. Мюллер для критических дискуссий и тщательно читать рукопись, A. Fecteau-Лефевр для оказания технической помощи с EM, Рикардо Adaixo, Фрэнк Леманн для мембранных белков испытания образцов (все от C-Сина, Biozentrum, Университет Базеля) и A. Engel, Почетный Базельского университета за его вдохновляющее разговоров. Испытательные образцы были любезно предоставлены P. Ringler, м.-а. Махи и т. Швед (Biozentrum, Университет Базеля), P. Лейман (Лаборатория структурной биологии и биофизики, EPFL) и р. Диас Авалос (Нью-Йорк центр структурной биологии, США). Проект был поддержан Швейцарский Институт нанотехнологий (SNI, проект P1401, ARGOVIA проекта MiPIS) и Швейцарский Национальный научный фонд (SNF, проекта 200021_162521).
Материалы
| Name | Company | Catalog Number | Comments |
| Liquid handling | |||
| Microcapillary tip | New Objective | FS360-100-30-N-20 | SilicaTips 30 µm tip ID, 100 µm ID , pk. 20 |
| FS360-150-30-N-20 | SilicaTips 30 µm tip ID, 150 µm ID , pk. 20 | ||
| Conductive sleeve | New Objective | CONGAS-1 | Conductive Elastomer for HV contact, 12" long |
| Fused silica tubing | BGB-Analytik | TSP-150375 | TSP Standard FS Tubing, 150 µm ID, 363 µm OD, 5 meter |
| PressFit Connector | BGB-Analytik | 2525LD | Deact. PressFit Connector 0.25 to 0.25 mm ID, pk. 25 |
| Syringe 10 µl | BGB-Analytik | HA-80001 | Hamilton 1701 LT - Luer Tip (needle not included) |
| Syringe pump controller | Cetoni | A3921000093 | neMESYS controller |
| Syringe pump dosing unit | Cetoni | A3921000095 | neMESYS dosing unit |
| Temperature control | |||
| Dew point sensor | Meltec | UFT75-AT | Humidity/Temperature sensor, dew point calculation, USB and embedded DLL |
| Temperature sensor | Sensorshop24.ch | LS7-PT1000-1.0-3L | Surface mountable temperature sensor Pt1000 |
| Peltier controller | Cooltronic | TC2812 | PID temperature controller for activation of Peltier driven systems with constant voltage output |
| Peltier element | Distrelec.ch | PE-127-14-15-S | 40x40 mm |
| Water-cooling block | - | - | Water cooling block for 40x40 mm peltier element, copper base |
| Water pump | Digitec.ch | 294877 | XSPC X20 750 Dual 5.25 Bay Reservoir Pump Black V4 |
| Water heat exchanger block | - | - | Water heat exchanger block with 2 fans to cool down circulating water |
| Small water coolers | PCHC.ch | 223050 | Alphacool MCX ram copper edition 2 pcs |
| Small peltier elements | Distrelec.ch | PE-031-10-15-S | Laird 15x15 mm 3.4 A 8.1 W 3.8 V 74 °C, 2 pcs |
| Mechanics | |||
| Linear stage z-axis | Dyneos AG | M-404.2PD | High-load precision translational stage, 50 mm travel range, DC motor |
| Stage controller | Dyneos AG | C-863 | Mercury Servo Controller |
| Microscope xy-axis stage | Prior Scientific | H117EIL5 | Motorized stage for Zeiss Axiovert 200 inverted microscope |
| Small permanent magnets | Supermagnete | S-05-08-N | Rod magnet Ø 5 mm, height 8.47 mm, neodymium, N45, nickel-plated, pk. 10 |
| Small electromagnet | Schramme | EG1025A02/110 | Electromagnet 24V 220 N 150 N 2,5 W |
| Controller electromagnet | Conrad.ch | MST-1630.001 7 | Electromagnet control PCB board |
| Solenoid hub | Distrelec.ch | HD8286-R-F-24V100% | Kuhnke Solenid Hub 30 mm 16 N 2 N 16 W |
| Mini tweezers | Electron Microscopy Sciences | 0302-M5S-PS | Dumont Type 5 mini, super thin tips |
| Various optomechanical parts | Thorlabs | - | - |
| Various mechanical parts | Workshop Biozentrum, University Basel | - | Custom designed adapter plates, holders, etc. see attached CAD files |
| Optics | |||
| Laser diode | Thorlabs | CPS780S | 780 nm laser diode module 2.5 mW |
| Photo detector | Thorlabs | PDA100A-EC | Si Switchable Gain Detector, 320-1100 nm, 2.4 MHz BW, 100 mm2 |
| EM grids | |||
| DURASIN FILM TEM | emsdiasum.com | DTF-03523 | 30 nm DuraSiN™ silicon nitride membranes for TEM, pack of 5 |
| Quantifoil Cu 200 mesh R 2/1 | Quantifoil Micro Tools GmbH | ||
| Quantifoil Cu 200 mesh R 1.2/1.3 | Quantifoil Micro Tools GmbH | ||
| Buffers / Neg. stain | |||
| PBS | Sigma | D8537 SIGMA | Dulbecco’s Phosphate Buffered Saline |
| NanoVan 2% | nanoprobes.com | Negative stain vanadium based | |
| NanoW 2% | nanoprobes.com | Negative stain tungsten based | |
| Software | |||
| openBEB | The openBEB 2 framework is avaible upon request, version 3 will be downloadable | ||
| CryoWriter control software (openBEB plugin) | Avaible upon request, extra fees for 3rd party driver software might apply. |
Ссылки
- Kuhlbrandt, W. Biochemistry: The resolution revolution. Science. 343 (6178), 1443-1444 (2014).
- Bai, X. -. c., McMullan, G., Scheres, S. H. W. How cryo-EM is revolutionizing structural biology. Trends Biochem Sci. 40 (1), 49-57 (2015).
- Dubochet, J., Adrian, M., Chang, J. J., Homo, J. C., Lepault, J., McDowall, A. W., Schultz, P. Cryo-electron microscopy of vitrified specimens. Q Rev Biophys. 21 (2), 129-228 (1988).
- Lepault, J., Booy, F. P., Dubochet, J. Electron microscopy of frozen biological suspensions. J Microsc. 129, 89-102 (1983).
- Baker, L. A., Rubinstein, J. L. Radiation damage in electron cryomicroscopy. Methods Enzymol. , (2010).
- Crewe, A. V., Eggenberger, D. N., Wall, J., Welter, L. M. Electron gun using a field emission source. Rev Sci Instrum. , (2003).
- Zemlin, F. Expected contribution of the field-emission gun to high-resolution transmission electron microscopy. Micron. 25 (3), 223-226 (1994).
- Scheres, S. H. RELION: implementation of a Bayesian approach to cryo-EM structure determination. J Struct Biol. 180 (3), 519-530 (2012).
- Grigorieff, N. FREALIGN: high-resolution refinement of single particle structures. J Struct Biol. 157 (1), 117-125 (2007).
- Li, X., Mooney, P., Zheng, S., Booth, C. R., Braunfeld, M. B., Gubbens, S., Agard, D. a., Cheng, Y. Electron counting and beam-induced motion correction enable near-atomic-resolution single-particle cryo-EM. Nat methods. 10, 584-590 (2013).
- Milazzo, A. -. C., Cheng, A., Moeller, A., Lyumkis, D., Jacovetty, E., Polukas, J., Ellisman, M. H., Xuong, N. -. H., Carragher, B., Potter, C. S. Initial evaluation of a direct detection device detector for single particle cryo-electron microscopy. J Struct Biol. 176 (3), 404-408 (2011).
- Ruskin, R. S., Yu, Z., Grigorieff, N. Quantitative characterization of electron detectors for transmission electron microscopy. J Struct Biol. 184 (3), 385-393 (2013).
- Veesler, D., Campbell, M. G., Cheng, A., Fu, C. -. y., Murez, Z., Johnson, J. E., Potter, C. S., Carragher, B. Maximizing the potential of electron cryomicroscopy data collected using direct detectors. J Struct Biol. 184 (2), 193-202 (2013).
- Campbell, M. G., Cheng, A., Brilot, A. F., Moeller, A., Lyumkis, D., Veesler, D., Pan, J., Harrison, S. C., Potter, C. S., Carragher, B., Grigorieff, N. Movies of ice-embedded particles enhance resolution in electron Cryo-microscopy. Structure. 20 (11), 1823-1828 (2012).
- Ripstein, Z. A., Rubinstein, J. L. Processing of Cryo-EM movie data. Methods in Enzymology. 579, 103-124 (2016).
- Li, X., Mooney, P., Zheng, S., Booth, C. R., Braunfeld, M. B., Gubbens, S., Agard, D. A., Cheng, Y. Electron counting and beam-induced motion correction enable near-atomic-resolution single-particle cryo-EM. Nature Methods. 10 (6), 584-590 (2013).
- McLeod, R. A., Kowal, J., Ringler, P., Stahlberg, H. Robust image alignment for cryogenic transmission electron microscopy. J Struct Biol. 197 (3), 279-293 (2017).
- Cheng, Y., Grigorieff, N., Penczek, P. A., Walz, T. A primer to single-particle cryo-electron microscopy. Cell. 161 (3), 438-449 (2015).
- Brenner, S., Horne, R. W. A negative staining method for high resolution electron microscopy of viruses. Biochim Biophys Acta. 34, 103-110 (1959).
- De Carlo, S., Harris, J. R. Negative staining and cryo-negative staining of macromolecules and viruses for TEM. Micron. 42 (2), 117-131 (2011).
- Glaeser, R. M. How good can cryo-EM become. Nat Methods. 13, 28-32 (2016).
- Engel, A., Graslund, A., Rigler, R., Widengren, J. in . Single Molecule Spectroscopy in Chemistry, Physics and Biology. 96, 417-431 (2010).
- Kemmerling, S., Ziegler, J., Schweighauser, G., Arnold, S. A., Giss, D., Müller, S. A., Ringler, P., Goldie, K. N., Goedecke, N., Hierlemann, A., Stahlberg, H., Engel, A., Braun, T. Connecting µ-fluidics to electron microscopy. J Struct Biol. 177 (1), 128-134 (2012).
- Arnold, S. A., Albiez, S., Opara, N., Chami, M., Schmidli, C., Bieri, A., Padeste, C., Stahlberg, H., Braun, T. Total sample conditioning and preparation of nanoliter volumes for electron microscopy. ACS nano. 10 (5), 4981-4988 (2016).
- Kemmerling, S., Arnold, S. A., Bircher, B. A., Sauter, N., Escobedo, C., Dernick, G., Hierlemann, A., Stahlberg, H., Braun, T. Single-cell lysis for visual analysis by electron microscopy. J Struct Biol. 183, 467-473 (2013).
- Arnold, S. A., Albiez, S., Bieri, A., Syntychaki, A., Adaixo, R., McLeod, R. A., Goldie, K. N., Stahlberg, H., Braun, T. Blotting-free and lossless cryo-electron microscopy grid preparation from nanoliter-sized protein samples and single-cell extracts. J Struct Biol. 197 (3), 220-226 (2017).
- Ramakrishnan, C., Bieri, A., Sauter, N., Roizard, S., Ringler, P., Müller, S. A., Goldie, K. N., Enimanev, K., Stahlberg, H., Rinn, B., Braun, T. openBEB: open biological experiment browser for correlative measurements. BMC Bioinformatics. 15, 84 (2014).
- Giss, D., Kemmerling, S., Dandey, V., Stahlberg, H., Braun, T. Exploring the interactome: microfluidic isolation of proteins and interacting partners for quantitative analysis by electron microscopy. Anal Chem. 86, 4680-4687 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены