Method Article
RNA プルダウン長い非コード RNA の RNA 標的を識別する手順
要約
この RNA プルダウン法は、長い非コード RNA (lncRNA) の RNA ターゲットを識別することができます。自家製、設計されたアンチセンス DNA のオリゴヌクレオチドのプローブ適切に固定ティッシュまたは細胞のこの lncRNA に固有の交配に基づいて、それは効率的に、lncRNA のすべての RNA ターゲットの捕獲をできます。
要約
規制非コード RNA の家族に属している長い非コード RNA (lncRNA) で定義されているリーディング ・ フレームなしの 200 以上のヌクレオチドのシーケンスであります。その生物学的機能は主不明のまま、これらの lncRNAs の数は着実に増加している、今人間が 10,000 を超えるようなトラン スクリプトをかもしれないことを推定されています。これらのいくつかは、転写レベルでも RNA co - と転写後の成熟のさまざまなステップで行われる遺伝子発現の重要な規制の経路に関与する知られています。後者の場合では、識別すること、lncRNA によって目標とされる Rna があります。なぜそれが直接関連付けられている Rna の間接的利益の lncRNA との識別を有効にする方法を開発する便利な理由です。
シーケンスが関連するクロマチンと共に lncRNA の分離を許可する以前に公開されたプロトコルに触発された、このプロトコルは、関連付けられている Rna の分離を許可するように脚色されました。我々 は 2 つの手順がこのプロトコルの効率のために重要であることを決定しました。最初の関心の lncRNA に交配させることができる特定のアンチセンス DNA オリゴヌクレオチド プローブのデザインです。このため、lncRNA 二次構造予測はバイオインフォマティクスとアンチセンス オリゴヌクレオチド プローブの内部基本ペアリングの低確率を表示する領域の強い親和性で設計されていました。プロシージャの 2 番目の重要なステップは、組織や分子のすべてのパートナー間のネットワークを維持するために、培養細胞の定着性の条件に依存します。高スループット RNA シーケンスと相まって、この RNA のプルダウンのプロトコルは興味の lncRNA の全 RNA インタラクトームを提供できます。
概要
ここで説明したメソッドの全体的な目標は、長鎖非コード RNA (lncRNA) の RNA 分子のパートナーを識別することです。LncRNA は、定義されているリーディング ・ フレームなしの 200 以上のヌクレオチドのシーケンスに対応します。それらのいくつかは、転写レベルでだけでなく、RNA co - と転写後の成熟のさまざまなステップでも遺伝子発現調節に関与する示されています。後者の場合、lncRNA の分子のパートナー、識別は、Rna です。直接関連付けられている Rna の間接的利益の lncRNA とを識別できる方法が開発が不可欠になります。
RNA 精製 (チャープ)1,2とキャプチャ交配分析の RNA ターゲット (グラフ) が3,4クロマチンの分離のハイスループット検出を許可のような以前公開メソッド、RNA 結合タンパク質と特定の lncRNA のゲノム結合部位。これらの 2 つの方法で関心の lncRNA は、ビオチン化相補的なオリゴヌクレオチドにハイブリダイズ最初と当時の複雑なストレプトアビジン ビーズを使用して分離しました。これらの 2 つの方法の主な違いは lncRNAs をターゲット プローブのデザインに関連します。チャープ、タイル、lncRNA の全体の長さに短いの相補的な DNA オリゴヌクレオチド プローブのプールの設計から成っていた RNA 魚に触発さの戦略。対照的に、グラフ、著者は、プローブの交配に利用可能なサイトに lncRNAs の RNase H マッピング分析を適応しました。
提案ここデザイン アンチセンス DNA のビオチン標識オリゴヌクレオチド プローブを使用して内部の低確率を表示する領域の強い親和性プローブ バイオインフォマティクス モデリング lncRNA 二次構造5を選択する手順ペアリングをベースします。この手順には、タイリング オリゴヌクレオチド プローブ2のプールに基づくものよりも安価と RNAse H 感度4に基づくものよりもより時間がかかるという利点があります。
LncRNAs6で転写後の遺伝子発現制御のための証拠の成長するボディがある、lncRNA のターゲットである Rna のキャプチャを有効にするアプローチを開発する非常に便利です。さらに、ほとんどのアプリケーションに使用可能は、アプローチは培養細胞および組織抽出液の両方に最適化されました。
プロトコル
すべてのプロシージャは、D. ベッケ (県デ内にブーシュ ・ デュ ・ ローヌ承認番号 13-002) に付与欧州経済共同体のケアと実験動物 (86/609/EEC および 2010/63/UE) とライセンスの下で使用のための厳密な調和で行われました。
1. プローブの設計
-
興味の lncRNA の主なシーケンスを使用すると、「RNAstructure ウェブサーバ」5その二次構造を生成します。
注: このサイトで異なるアルゴリズムを使用することがことができます。プローブの設計のために最良の結果を与える 3 つの予測ツール:「倍」(最低の自由エネルギー構造)、"MaxExpect"(可能性が高い塩基対) と"Probnot"(シュード ノットを含む可能性の高い塩基対)。これらの 3 つの解析の実行および比較が可能します。ウィーン RNA websuite7などの他の web サーバーを使用もできます。- 内部基本ペアリングの低確率を表示し、これらの地域の強い親和性を持つ 25 拠点のアンチセンス オリゴヌクレオチド プローブをデザインする領域を選択します。
注: これらのプローブの GC 含量は、40 と 60% の間で構成する必要があります。配列検索ツール (ブラスト) を使用して、選択したアンチセンス オリゴヌクレオチド プローブは選択したセルのシステムで表される他の RNA の塩基配列を認識していないことを確認します。
- 内部基本ペアリングの低確率を表示し、これらの地域の強い親和性を持つ 25 拠点のアンチセンス オリゴヌクレオチド プローブをデザインする領域を選択します。
- 興味のゲノムの関心の lncRNA も他の rna のどちらのアフィニティが表示されます 25 拠点の非特異的 DNA オリゴヌクレオチド プローブ デザインもございます。
- 3' 端にビオチンとプローブを注文します。
注: 立体障害を減らすためにオリゴヌクレオチドとビオチンとの間の距離は、triethyleneglycerol スペーサーと増加します。それがアンチセンス オリゴヌクレオチドのプローブ デザイン 3 別に推奨は最良の結果と、プルダウンの結果の特異性を評価することができるし、実験の効率を比較します。
2. 架橋
-
培養細胞の架橋
- 文化、GH4C1 sommatolactotroph 下垂体細胞 15% 馬血清と 2% 牛胎児血清を添加したハムの F10 中。78.5 cm2培養皿で合流までセルを育てなさい。これは約 1 × 10 の7セルに対応します。
- 合流 GH4C1 78.5 cm2培養プレートから細胞培養液を削除、し、すすぎ中リン酸量 x 1 緩衝生理食塩水 (PBS)
- PBS (78.5 cm2料理 10 mL) で 1% パラホルムアルデヒド溶液のセルを修復します。このソリューションは、4% パラホルムアルデヒド原液から作りたてする必要があります。室温 (RT) で 10 分間撹拌下で架橋します。
注意: パラホルムアルデヒド (PFA) は、毒性があり注意して処理する必要があります。 - グリシン 1.25 M (パラホルムアルデヒド溶液 10 mL あたり 1 mL) の 1/10 ボリュームを追加することによってパラホルムアルデヒド アクションを消す室温 5 分を扇動します。
- PBS の中量 X 1 (5 分) 時間吸引してリンス 2 メディアを破棄します。
- 1 に対応する PBS のボリュームを追加収集細胞細胞スクレーパー、遠心管に転送しますと、メディアのボリュームの 10 分。
- 5 分の 4 ° C で 510 g で回転します。
- 可能な限りの上澄みを削除します。
- -80 ° C で必要に応じて無期限にペレットを格納します。
-
組織の架橋
- 1% パラホルムアルデヒド PBS (約組織のボリューム x 10) で希釈した溶液に新鮮な得られたマウス下垂体腺組織の 5 mg を入れ、室温 10 分間攪拌
- パラホルムアルデヒド アクションを癒やす 1.25 M グリシン溶液 (パラホルムアルデヒド溶液 10 mL あたり 1 mL) を追加することによって、室温 5 分を扇動
- 吸引によりメディアを破棄、PBS (約組織のボリューム x 10) で 2 回をすすいでください。可能な限りの上澄みを削除します。
- -80 ° C で無期限に架橋の組織を保存します。
3. 細胞または組織溶解
- 換散バッファー (50 mM トリス塩酸 pH 7.0, 10 ミリメートルの EDTA、RNAse 阻害剤溶液 200 U/mL とプロテアーゼ阻害剤 5 μ L/mL のカクテル補足 1 %sds) を準備します。
- 事前解凍しなくても分離のサンプルを取得、再細胞ペレットまたはこのバッファー (細胞ペレットや組織の 100 mg 当たり約 1 mL) に架橋組織を中断します。1 x 107細胞から得られた細胞ペレットは、タンパク質の約 20 mg を含む分離サンプルに上昇を与えます。
注: を使用して、組織に応じて機械的破壊の手順を追加する必要があります。この場合、この追加の手順の中にサンプルの加熱を避けるために重要です。
4. 超音波処理
-
超音波処理条件の最適化
- プログラムの 30 s の 2 に 5 シリーズ超音波発生装置と 30 オフです。
- 希薄化後分離サンプル (希釈倍率 1/2 または蛋白質の約 10 または 5 mg に対応する ¼) の超音波照射条件を最適化するためにテストを実行します。場所は、4 ° C の水浴の分離のサンプルを希釈し、超音波シリーズを開始します。
- RNA 精製キットまたは RNA の分離試薬に対して (例えばTrizol) と Rna を浄化します。
- TBE バッファーに 1% の agarose のゲル電気泳動法で浄化された RNA の全体の負荷は、RNA 断片の長さをチェックします。200 と 800 bp の間この長さの範囲。
注: RNA のフラグメント サイズ アンチセンス オリゴヌクレオチド プローブの効率によって異なります。その後、プローブ超音波処理の異なる条件下での効率を確認することをお勧めします。
-
分離試料の超音波処理
- 4 ° C の (3.2 後取得) 蛋白質の 20 mg に対応する場所によってサンプル水槽し、4.1 の手順で最適化された超音波シリーズを開始します。
- 超音波処理、4 ° C で 12,000 g で 5 分間遠心した直後に新しい遠心チューブに上清を転送します。
注: の均質性を確保するため、レプリケート清プールできこの段階で再配分されます。
5. RNA プルダウン
-
1 日目-交配のステップ
- 交配バッファー (50 mM トリス塩酸 pH 7.0、750 mM 1 mM EDTA、塩化ナトリウム 1 %sds ホルムアミド追加即席 15%) の 2 つの容積を追加清超音波処理ステップ後に収集します。渦。
- 遠心分離機管 (入力サンプル) の各サンプルの 20 μ L を転送し、-20 ° C で保存
- ビオチン標識オリゴヌクレオチド プローブ (特定または非特異的;表 1を参照) の 100 pmol を各サンプルに追加します。室温チューブ回転子に適度な撹拌下で 4 〜 6 時間インキュベートします。
- RNAse 阻害剤溶液 200 U/mL とプロテアーゼ阻害剤 5 μ L/mL のカクテルと補われる磁気ストレプトアビジン ビーズの 50 μ L を追加します。
- 室温チューブ回転子に適度な撹拌下で一晩インキュベートします。
-
2 日目-RNA 分離のステップ
- 細胞ライセートからビーズを分離し、上澄みを廃棄、洗浄バッファーの 900 μ L でビーズを洗う磁気サポートを使用 (SDS 0.5%、SSC 2 x)。繰り返し 5 回点在室温回転で 5 分攪拌
- 最後の洗浄後、最後の一時間をデカントし、Proteinease K バッファー (10 mM トリス塩酸 pH 7.0 では、100 mM の NaCl、1 mM EDTA、0.5 %sds) の 95 μ L を追加、プロテイナーゼ k (20 mg/mL) をサンプルに 5 μ L。
- 氷の上入力サンプル (20 μ L) を解凍し、Proteinease K バッファーの 75 μ L とプロティナーゼ K (20 mg/mL) の 5 μ L を追加します。
- 50 ° C 95 ° C で、10 分の 45 分のプロティナーゼ K のすべてのサンプルをインキュベートします。
- 磁気のサポートと Rna からビーズを分離する前に 3 分間氷のサンプルを冷やします。上清を維持し、ビーズを破棄します。
- Rna を DNA 消化手順を含める必要があります RNA 精製キットで浄化します。-80 ° C で Rna を保存します。
- 逆のトランスクリプション qPCR (RT qPCR) 特異的プライマー (表 1) を使用して qPCR 続く RT キットを使用してを実行します。
- それぞれの特定の Neat1 プローブ (表 1) で得られた 2 つの RNA プールに対応する 2 つの DNA ライブラリを構築します。次世代シーケンシング システムでシーケンスを実行します。
結果
いくつかの最近の調査示した lncRNAs がほぼすべての重要な生物学的プロセスに重要な役割を果たすこと、この役割は、転写、転写後のレベルで両方で発生する遺伝子発現の制御が行われますRna lncRNAs6の標的となる可能性を後者の場合を示します。
LncRNA 核濃縮豊富な転写 1 (Neat1)、異なる neuropathologies で前頭側頭型認知症、筋萎縮性側索硬化症、またはてんかん8,9,10として関与している、misregulated はまたさまざまな癌11,12。
この lncRNA は、特定の原子力機関、paraspeckles の構造のコンポーネントと遺伝子式13の転写後の概日リズム調節に関与するにも知られています。すべての細胞の核内にある、いくつかの RNA 結合タンパク質 (RBP)14、周りだけでなく、それらの形成に必要な Neat1 だけでなく周りに形成が Paraspeckles が15 核内 RNA ターゲットを保持することができる確かに知られています。.Paraspeckles の形成は、さまざまなコンポーネントの協会によって実現されます。この形成は、RNA ターゲット13のリズミカルな核保有を運転概日リズム パターンを表示する示されました。RBP へのバインディングを介して、または直接 RNA/協会を通じて、paraspeckles による RNA ターゲットの核の保持が発生するが、rna paraspeckles の対象となる範囲を決定する持っていた。直接ターゲットに RNA を識別するためにまたは直接 Neat1、によって RNA のプルダウンのプロトコル設計されましたいない分離や組織サンプル (グラフィックの図 1を参照してくださいのように培養細胞と同様にすべての Neat1 RNA 標的の同定ができます。技術のプレゼンテーション)。
プロトコルは、別の lncRNA 転移関連付けられた肺腺癌成績証明書 1 (Malat1) の RNA 標的の同定にも正常に適用されました。Malat1 は、一緒にいくつかの RNA スプライシング因子核スペックルが見つかりました非常に節約され、表現された lncRNA です。Malat1 は、いくつかの初期の mRNA16,17のスプライシングの調節に関与すると知られています。
特定 (SO) と非特異的オリゴヌクレオチド (NSO) プローブは、ここで説明されているプローブの設計方法を使用して生成されました。この戦略は、lncRNA の二次構造の予測として内部塩基対の低確率を表示する領域の選択、これらの地域の強い親和性を持つ特定のプローブの設計に依存します。これらのバイオインフォマティクスの予測、Neat1 の一連の二次構造予測の写真の代表的な結果として (1,480 に 2,000 のヌクレオチド) プローブは、図 2で与えられるように設計されています 2 つの位置と共に。
設計されたプローブは、Neat1 または Malat1 をラット培養 GH4C1 細胞とマウス Neat1 下垂体組織のエキス (表 1) のために指示されました。入力のサンプルに対する非特異的, 特異プローブの相対的な強化の Neat1 または Malat1 を計算しました。図 3は、GH4C1 下垂体細胞株 (図 3 a) ラット プル ダウン Neat1 特定のプローブの効率とマウス下垂体組織を抽出 (図 3 b)。生成する特定のオリゴヌクレオチド (ので) Malat1 宛てにプローブ プローブ設計プロトコルを使用して (図 4 a) 十分に効率的ではなかった別の中、効率的なプローブが得られた 1 つ破棄されます。
RNA の後 GH4C1 抽出物の Neat1 または Malat1 に関連付けられる Rt-qpcr 実験、特異的プライマー (表 1) を評価いくつかの Rna によって続いてプル ダウン手順を示した。GH4C1 細胞抽出液の Neat1 に関連付けられている Rna も下垂体抽出液について Neat1 に関連する示されていた。確かに、Neat1 RNA プルダウン後 Malat1 は GH4C1 細胞株、マウスの下垂体組織抽出物 (図 5 a) 両方 Neat1 で対象とする発見されました。相互、Neat1 は豊か Malat1 RNA プルダウンの GH4C1 細胞 (図 4 b) 特定のプローブを実行後の大幅になりました。これらの結果が Neat1 と Neat1 RNA 発現18,のバリエーションを表示 Malat1 ノックアウト マウスによって提案された Malat1 の潜在的なコンテンツ共同規制役割と一致している 2 つの lncRNAs の密接な関係を強調することによって19. 主な 2 つの下垂体ホルモン、プロラクチン (Prl) (図 5) と成長ホルモン (Gh) (図 5 b) の成績証明書が GH4C1 細胞、下垂体特定のプローブ Neat1 RNA プルダウン後濃縮大幅抽出物、Neat1 によって 2 つのホルモン性制御の可能性を示唆しています。使用される 2 つの特定のプローブを比較すると、それは RNA ターゲットと見なされます (図 5 bおよび図 5) によってその効率が変わるという点登場しました。これらの結果は、その RNA ターゲットの濃縮でプルダウン ・ lncRNA の濃縮で最高効率だけでなく、最高レベルの効率性を表示するものを選択するためにいくつかの特定のプローブを設計の必要性を強調します。
利益13の lncRNA の RNA ターゲットの包括的なリストを取得する RNA 高スループット シーケンスによって RNA プルダウン法がわかります。上記 2 つの特定のプローブを用いた Neat1 RNA プルダウンを実行した後、GH4C1 下垂体細胞の RNA シーケンス解析。NSO と RNA プルダウンが図書館の建設を許可するのに十分な RNA のレベルが回復された場合、NSO を用いた負の制御も RNA シーケンス解析にさらされることが注意する必要があります。これは以前経験13の場合ではなかった。トップハット/カフリンクスを使用して特定のプローブの使用を行った後に生成されたライブラリ パイプライン20及び成績につきプラスミドあたりフラグメントの値だけ万マップリード (FPKM) 1 は考慮したよりも高い。Neat1 に 2 つの特定のプローブで得られたリスト (表 1) 結果の特異性を評価するために交差しました。4,268 遺伝子は、paraspeckles、GH4C1 セル13で表現された成績証明書の 28% を占めているに関連付けられていました。QPCR 分析 (図 5 a C) を使用して得られた結果と一致して、Gh、Prl と Malat1 の成績は、Neat1 に関連する発見されました。RNA プルダウン法は、lncRNAs とその RNA ターゲット間の相互作用を探検する効率的なツールであること従って証明されています。
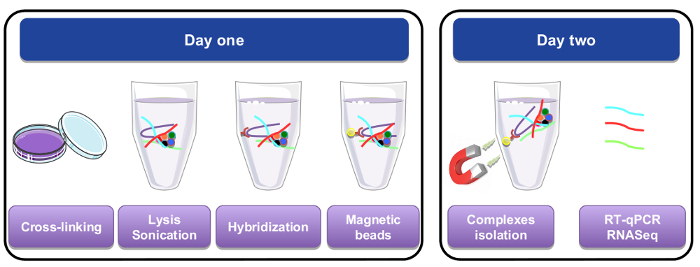
図 1: RNA のグラフィカルな表現を下ろす手順です。最初の日に細胞や組織されたパラホルムアルデヒドをクロスリンクした溶解し,、ビオチン化特定プローブを追加することによって行われた交配手順の前に超音波処理します。細胞ライセートの残りの部分から別の特定の材料に磁気ストレプトアビジン ビーズを追加されました。2 日目、ビーズは磁石によって分離され数回洗浄され。・ デ ・架橋ステップには、精製と Rt-qpcr または RNA シーケンス解析に使用された Rna の回復が許可され。この図の拡大版を表示するのにはここをクリックしてください。
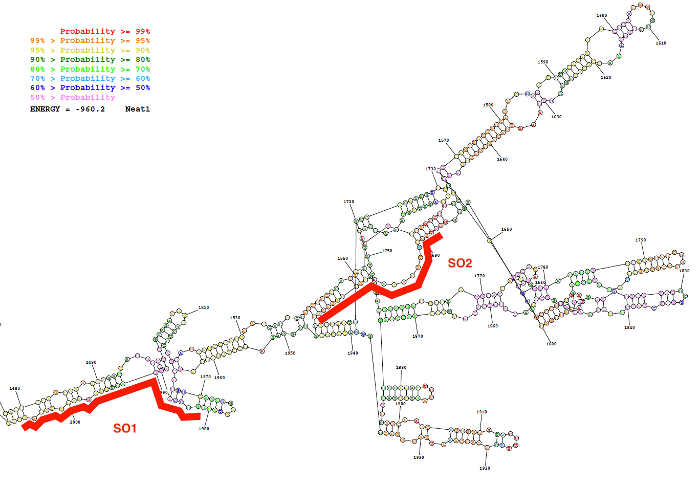
図 2: 二次構造バイオインフォマティクス リソース (RNAstructure ウェブサーバ; 最低の自由エネルギー構造) によって予測された Neat1 シーケンス (ヌクレオチド 1,480 に 2,000).構造は基本ペアの確率のある程度に従って色の。2 つのオリゴヌクレオチド プローブ (SO1 と SO2) 赤では、Neat1 RNA の構造に沿って配置されます。この図の拡大版を表示するのにはここをクリックしてください。
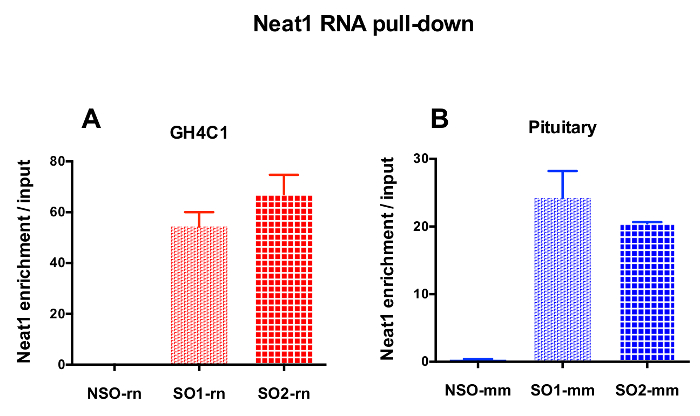
図 3: 入力対 Neat1 濃縮の qPCR 検証します。Neat1 RNA 後入力対 Neat1 濃縮の qPCR の検証は、2 つ異なる特定のプローブ (GH4C1 細胞と SO1 mm SO2 rn SO1 rn および下垂体組織の SO2 mm) に比べて非特異的でプルダウン (GH4C1 細胞の NSO-rn と NSO mm 1 つ下垂体組織) (B) GH4C1 ラット細胞 (A) とマウス下垂体組織を抽出します。結果は、3 に 10 の実験で得られた平均 ± SEM です。この図の拡大版を表示するのにはここをクリックしてください。
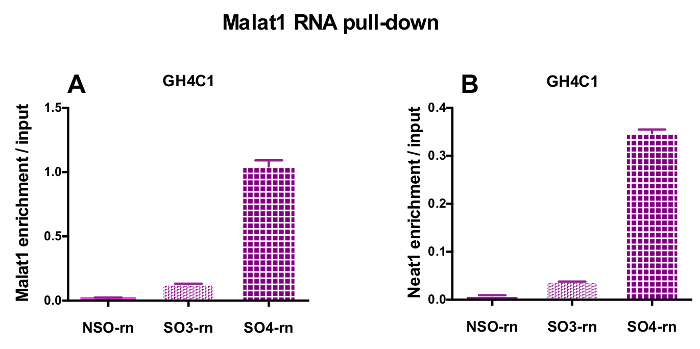
図 4: Malat1 RNA 後入力対 Malat1、Neat1 濃縮の qPCR 検証がプルダウンします。Malat1 の qPCR の検証 (A) と Neat1 後 Malat1 RNA 入力対 (B) の濃縮を 2 つ異なる特定のプローブ (SO3-rn と SO4-rn) に比べて非特異的でプルダウン 1 つ (NSO rn) GH4C1 ラット細胞で。結果は、3 の実験で得られた平均 ± SEM です。この図の拡大版を表示するのにはここをクリックしてください。
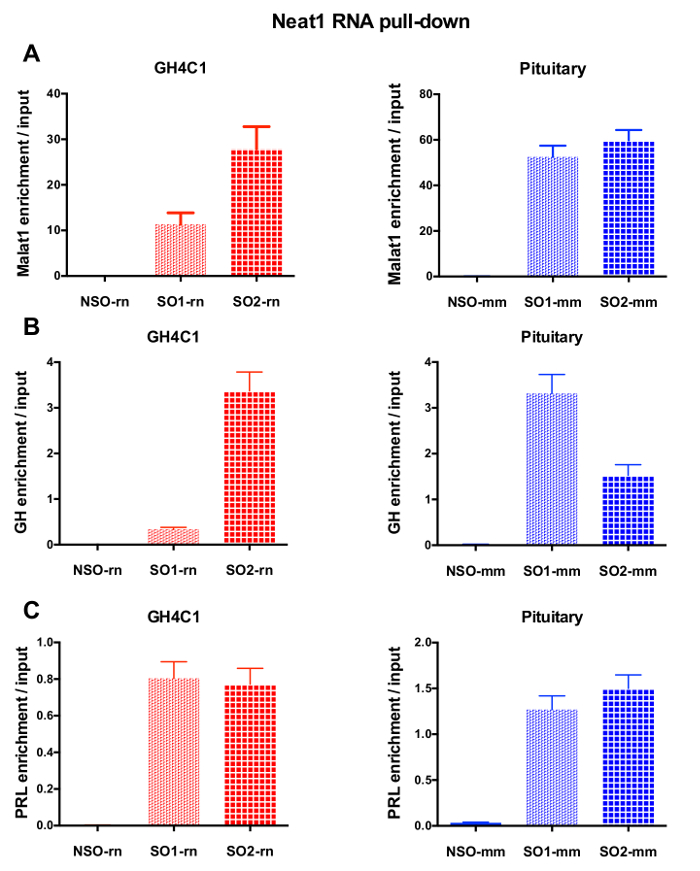
図 5: Malat1、Gh、Prl 濃縮 Neat1 RNA をプルダウンした後、入力対の qPCR 検証します。Malat1 の qPCR の検証 (A)、Gh (B) Neat1 RNA 後入力対 Prl (C) 濃縮プルダウンして GH4C1 ラット細胞における非特定の 1 つと比較すると異なる特定のプローブを使用し、マウス下垂体組織を抽出します。結果は、3 に 8 実験で得られた平均 ± SEM です。この図の拡大版を表示するのにはここをクリックしてください。
| プローブ名 | シーケンス | |
| NSO Rn | TAAAATACCATTTGATGTTTGAAATTAT | |
| SO1 Rn | CTCCACCATCATCAATCCTCTGGAC | |
| SO2-Rn | GCCTTCCCACATTTAAAAACACAAC | |
| SO3-Rn | AACTCGTGGCTCAAGTGAGGTGACA | |
| SO4-Rn | AAGACTCTCAGGCTCCTGCTCATTC | |
| NSO mm | GTTTGTGGTTTAACAGTGGGAAGGC | |
| SO1 mm | GCCTTCCCACTGTTAAACCACAAAC | |
| SO2 mm | CTCACCCGCACCCCGACTCCTTCAA | |
| qPCR プライマー: | ||
| ドブネズミ | ||
| Neat1 | AAGGCACGAGTTAGCCGCAAAT | |
| TGTGCACAGTCAGACCTGTCATTC | ||
| Malat1 | GAAGGCGTGTACTGCTATGCTGTT | |
| TCTCCTGAGGTGACTGTGAACCAA | ||
| Gh1 | CCGCGTCTATGAGAAACTGAAGGA | |
| GGTTTGCTTGAGGATCTGCCCAAT | ||
| Prl | TGAACCTGATCCTCAGTTTGGT | |
| AGCTGCTTGTTTTGTTCCTCAA | ||
| ハツカネズミ | ||
| Neat1 | TGGGCCCTGGGTCATCTTACTAGATA | |
| CACAGCTGTTCCAATGAGCGATCT | ||
| Gh1 | CTCGGACCGTGTCTATGAGAAACTGA | |
| TTTGCTTGAGGATCTGCCCAACAC | ||
| Prl | TGAACCTGATCCTCAGTTTGGT | |
| AGCTGCTTGTTTTGTTCCTCAA | ||
表 1: シーケンスの DNA オリゴヌクレオチド プローブと qPCR プライマー
ディスカッション
長鎖非コード Rna (lncRNAs) の数と多様性は研究の大規模なフィールドを表し、自分の役割のほとんどは、まだ発見されます。これらの lncRNAs の多くは核局在化、その中で、いくつかに関与している規制経路遺伝子発現の転写または転写メカニズムを通して。この分野における現在の課題の 1 つは Rna の転写後の処理でこれらの lncRNAs の関連性を理解します。この目的のためを識別する lncRNAs の標的 Rna があります。クロマチンと lncRNAs の関連に焦点を当てた先行研究に触発され、我々 は、lncRNA に関連付けられている Rna の同定を可能にするプロシージャを開発しました。このプロトコル、RNA プルダウンの成功は主に 2 つの重要な手順に依存、すなわちアンチセンス DNA オリゴヌクレオチド プローブの設計がある具体的には、専ら関心の lncRNA 組織の条件と交配させるかすべての分子のパートナー間のネットワークの整合性を維持する必要があるセル固定。
以前の関連するクロマチン シーケンス (チャープ1、2グラフ3,4) と共に lncRNA を分離するための手順を提供するプロトコルを公開しました。これらのプロトコルの異なる戦略はアンチセンス DNA のビオチン標識オリゴヌクレオチドのプローブの設計に採用されました。チャープの手順では、著者はすべて冗長および非固有のプローブ1,2の排除後興味の lncRNA の全体の長さを含む DNA ビオチン標識オリゴヌクレオチド プローブのプールを使用します。グラフ プロトコルで著者は交配のためよりアクセスしている、lncRNA の領域を同定したし、これらの地域をターゲットにキャプチャ オリゴヌクレオチドを設計されています。これらの地域は、RNase H 感度に基づいて選ばれました。確かに、RNA DNA 結合部位で Rna を分解するリボヌクレアーゼ H のプロパティを使用して、lncRNA でアクセス可能なサイトに交配させるオリゴヌクレオチドは RNA-DNA の雑種を生産し、lncRNA の酵素の開裂。著者はこれらの候補者のキャプチャ オリゴヌクレオチドの 3 つを選択し、カクテル3,4にそれらを使用します。
手順我々 はグラフ プロトコルで使用のアンチセンス DNA ビオチン標識オリゴヌクレオチド プローブが近くにいたデザインに使用しますが、目的の lncRNA の交配利用可能な地域の RNAse H 感度に基づいて選択されていないが、lncRNA 二次構造バイオインフォマティクス モデリングによって決定される内部基本ペアリングの低確率によると。それは、異なるアルゴリズムを使用して、別の二次構造が予測される、選択されるプローブは、二次構造予測の最大数の lncRNA の利用可能なシーケンスに交配させるそれらをする必要がありますに気づいたする必要があります。個別に設計された 3 つのカクテル、特定プローブまたは単一のプローブを使用して同じ結果が得られました。これは、2 つの独立した、特定のプローブを使用し、これらの 2 つのプローブに共通するものとして肯定的な結果の考察を促した。最後に、最適な結果のための手法の開発の初めにお勧めしたがって、3 異なるアンチセンス オリゴヌクレオチドを設計する、プルダウンの結果の特異性を評価することができるプローブと比較して実験効率、プローブ効率はセル lysate の準備によって変更することが、特に以来。それにもかかわらず、二次構造を用いて残ったタイル オリゴヌクレオチド プローブ2プールに基づくより比較的安価、今回はベースの方法よりもより時間がかかる lncRNA のバイオインフォマティクス モデリングに基づくプローブ設計の手順RNAse H 感度4。
ネガティブ コントロール負キャプチャ オリゴヌクレオチドどちらか意味 DNA ビオチン標識オリゴヌクレオチドのプローブを使用して実行する必要があります。 またはオリゴヌクレオチド プローブ、または無関係な RNA に対するオリゴヌクレオチドをスクランブルします。自然のアンチセンス転写産物 lncRNAs が存在するため意味オリゴヌクレオチド プローブを使用できないがあります十分です。ネガティブ コントロール用に選択されたオリゴヌクレオチド プローブに関係なくそれはない、知られている RNA と交配させる爆発を確認してこのオリゴヌクレオチドがまだ非注釈付き lncRNA に交配させることができます念頭に必要があります。
これら RNA プルダウン実験で使用されるセル lysates は 10 から得られた6 107細胞組織を操作するときに培養細胞と 1 から 10 mg までを操作するときに。セル lysates の準備、最適化しなければならない 2 つの主な手順で使用されるティッシュまたは細胞のタイプに応じて調整する必要があります: すなわち、架橋のステップ、lncRNA と、パートナーである分子間に共有結合の形成を可能にして、クロマチンを破砕により粘度を低減させる超音波処理ステップ。
架橋ステップの目的は、分子のすべてのパートナーとの間のネットワークの形成を誘導することによって、lncRNA に閉じたまますべての RNA ターゲットにあることを確認することです。LncRNA とそのパートナーとの間に共有結合を形成するパラホルムアルデヒド治療ステップにより、網状.にネットワークグラフ プロトコル全体ライセート細胞核 lncRNA のパラホルムアルデヒドと最初の処置を実行する操作と 2 番目が示唆された核酸分画の分離3,4治療。この補助ステップが、プローブの効率をおそらく減少し、細胞内の lncRNA アクセシビリティを減らすことによって観察した.したがって、パラホルムアルデヒドで網目の度にセルを考慮するまたは興味の lncRNA に設計されたプローブの効率のローカリゼーション、組織型を使用します。
細胞を溶解しながら、クロマチン ライセートで解放され、その粘性が増加それは興味の lncRNA にプローブをサンプルの流動性を高め、それ故、オリゴヌクレオチドのアクセシビリティを促進する超音波処理によるクロマチンを細断処理するために必要。ただし、超音波処理、また関心の lncRNA で抽出した Rna を細断します。それは 200-800 跪く超音波処理時間は非常なるメモ間液の粘度は低くなりますが、効率的にもできる RNA のフラグメントの長さのように超音波処理時間を最小限にすることが重要で構成し、量と組織や培養細胞使用の型の両方に依存します。
結論としては、2 〜 3 日で必要な lncRNA の RNA ターゲットのキャプチャを可能ここで説明されている手順。Rt-qpcr と相まって、これらのメソッドは、候補者のアプローチとして目的の lncRNA によって mRNA の特定の関連法規を探してします。ゲノムワイドなアプローチは、高スループットの RNA シーケンスを目的の lncRNA に関連付けられているすべての Rna の検索が可能で RNA プルダウン実験を分析できます。選択の何の分析戦略、RNA プル ダウン手順新しい重要な知識 RNA 規制で提供 lncRNAs。
開示事項
著者が明らかに何もありません。
謝辞
本作はエクス ・ マルセイユ大学と CNRS によってサポートされ、ファイザー社の研究所からの助成金によって資金を供給します。
資料
| Name | Company | Catalog Number | Comments |
| Bioruptor Plus | Diagenode | B01020001 | Sonicator |
| Dynabeads My One | Thermo-Fisher | 65001 | Magnetic streptavidin beads |
| Formamide | Thermo-Fisher | 15515-026 | |
| Gel electrophoresis apparatus | Advance | Mupid-One | Gel electrophoresis apparatus |
| Proteinase K | Sigma | P2308 | |
| RNA XS purification kit | Macherey-Nagel | 740902 | RNA purificationkit |
| RNAseOUT | Thermo-Fisher | 10777-019 | RNAse inhibitor |
| Trizol | Thermo-Fisher | 15596018 | RNA purification |
| Tube Rotator | Stuart | SB2 | Eppendorf tube rotator |
| RNA to DNA | Thermo-Fisher | 4387405 | Reverse transcription kit |
| iTaq Universal SYBR Green Supermix | BioRad | 1725124 | qPCR reagent |
| Applied 7500 Fast | Thermo-Fisher | 4351107 | qPCR apparatus |
| Illumina TruSeq Stranded mRNA Sample Preparation kit | Illumina | 20020594 | DNA library construction kit |
| Illumina NextSeq 500 | Illumina | SY-415-1002 | NGS system |
参考文献
- Chu, C., Qu, K., Zhong, F. L., Artandi, S. E., Chang, H. Y. Genomic maps of long noncoding RNA occupancy reveal principles of RNA-chromatin interactions. Mol Cell. , 667-678 (2011).
- Chu, C., Quinn, J., Chang, H. Y. Chromatin isolation by RNA purification (ChIRP). J Vis Exp. , e3912 (2012).
- Simon, M. D., Wang, C. I., Kharchenko, P. V., West, J. A., Chapman, B. A., Alekseyenko, A. A., Borowsky, M. L., Kuroda, M. I., Kingston, R. E. The genomic binding sites of a noncoding RNA. Proc Natl Acad Sci U S A. , 20497-20502 (2011).
- Simon, M. D. Capture hybridization analysis of RNA targets (CHART). Curr Protoc Mol Biol. , (2013).
- Reuter, J. S., Mathews, D. H. RNAstructure: software for RNA secondary structure prediction and analysis. BMC Bioinformatics. 11, 129 (2010).
- Sun, X., Haider Ali, M. S. S., Moran, M. The role of interactions of long non-coding RNAs and heterogeneous nuclear ribonucleoproteins in regulating cellular functions. Biochem J. , 2925-2935 (2017).
- Gruber, A. R., Lorenz, R., Bernhart, S. H., Neuböck, R., Hofacker, I. L. The Vienna RNA websuite. Nucleic Acids Res. , W70-W74 (2008).
- Tollervey, J. R., Curk, T., Rogelj, B., Briese, M., Cereda, M., Kayikci, M., König, J., Hortobágyi, T., Nishimura, A. L., Zupunski, V., Patani, R., Chandran, S., Rot, G., Zupan, B., Shaw, C. E., Ule, J. Characterizing the RNA targets and position-dependent splicing regulation by TDP-43. Nat Neurosci. , 452-458 (2011).
- Riva, P., Ratti, A., Venturin, M. The long non-coding RNAs in neurodegenerative diseases: novel mechanisms of pathogenesis. Curr Alzheimer Res. (27338628), (2016).
- Barry, G., Briggs, J. A., Hwang, D. W., Nayler, S. P., Fortuna, P. R., Jonkhout, N., Dachet, F., Maag, J. L., Mestdagh, P., Singh, E. M., Avesson, L., Kaczorowski, D. C., Ozturk, E., Jones, N. C., Vetter, I., Arriola-Martinez, L., Hu, J., Franco, G. R., Warn, V. M., Gong, A., Dinger, M. E., Rigo, F., Lipovich, L., Morris, M. J., O'Brien, T. J., Lee, D. S., Loeb, J. A., Blackshaw, S., Mattick, J. S., Wolvetang, E. J. The long non-coding RNA NEAT1 is responsive to neuronal activity and is associated with hyperexcitability states. Sci Rep. , 40127 (2017).
- Adriaens, C., Standaert, L., Barra, J., Latil, M., Verfaillie, A., Kalev, P., Boeckx, B., Wijnhoven, P. W., Radaelli, E., Vermi, W., Leucci, E., Lapouge, G., Beck, B., van den Oord, J., Nakagawa, S., Hirose, T., Sablina, A. A., Lambrechts, D., Aerts, S., Blanpain, C., Marine, J. C. p53 induces formation of NEAT1 lncRNA-containing paraspeckles that modulate replication stress response and chemosensitivity. Nat Med. , (2016).
- Fang, J., Qiao, F., Tu, J., Xu, J., Ding, F., Liu, Y., Akuo, B. A., Hu, J., Shao, S. High expression of long non-coding RNA NEAT1 indicates poor prognosis of human cancer. Oncotarget. , (2017).
- Torres, M., Becquet, D., Blanchard, M. P., Guillen, S., Boyer, B., Moreno, M., Franc, J. L., François-Bellan, A. M. Circadian RNA expression elicited by 3'-UTR IRAlu-paraspeckle associated elements. Elife. , (2016).
- Chen, L. L., DeCerbo, J. N., Carmichael, G. G. Alu element-mediated gene silencing. EMBO J. , 1694-1705 (2008).
- Tripathi, V., Ellis, J. D., Shen, Z., Song, D. Y., Pan, Q., Watt, A. T., Freier, S. M., Bennett, C. F., Sharma, A., Bubulya, P. A., Blencowe, B. J., Prasanth, S. G., Prasanth, K. V. The nuclear-retained noncoding RNA MALAT1 regulates alternative splicing by modulating SR splicing factor phosphorylation. Mol Cell. , 925-938 (2010).
- Engreitz, J. M., Sirokman, K., McDonel, P., Shishkin, A. A., Surka, C., Russell, P., Grossman, S. R., Chow, A. Y., Guttman, M., Lander, E. S. RNA-RNA Interactions Enable Specific Targeting of Noncoding RNAs to Nascent Pre-mRNAs and Chromatin Sites. Cell. , 188-199 (2014).
- Nakagawa, S., Ip, J. Y., Shioi, G., Tripathi, V., Zong, X., Hirose, T., Prasanth, K. V. Malat1 is not an essential component of nuclear speckles in mice. RNA. , (2012).
- Zhang, B., Arun, G., Mao, Y. S., Lazar, Z., Hung, G., Bhattacharjee, G., Xiao, X., Booth, C. J., Wu, J., Zhang, C., Spector, D. L. The lncRNA Malat1 is dispensable for mouse development but its transcription plays a cis-regulatory role in the adult. Cell Rep. , 111-123 (2012).
- Trapnell, C., Roberts, A., Goff, L., Pertea, G., Kim, D., Kelley, D. R., Pimentel, H., Salzberg, S. L., Rinn, J. L., Pachter, L. Differential gene and transcript expression analysis of RNA-seq experiments with TopHat and Cufflinks. Nat Protoc. , 562-578 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved