Method Article
真核生物 mRNA 蛋白質複合体を回復するオリゴヌクレオチド系タンデム型 RNA の隔離プロシージャ
要約
内生的に形成された mRNA 蛋白質複合体の回復のためのタンデムの RNA 分離手順 (旅行) を説明します。具体的には、RNA 蛋白質の複合体は、生体内で架橋 polyadenylated Rna ランダムプライマー ビーズ抽出物から分離された、特定の Mrna が変更された RNA アンチセンス オリゴヌクレオチドでキャプチャされます。イムノブロット解析による蛋白質の Mrna にバインドが検出されます。
要約
RNA 結合タンパク質 (Rbp) は、遺伝子発現の転写後のコントロールに重要な役割を再生します。したがって、mRNA 蛋白質複合体の生化学的解析の相互作用の蛋白質または非コーディング RNAs によって推定される遺伝子の発現調節を理解することが欠かせません。ここで、細胞抽出物から内生的に形成された mRNA がタンパク質複合体の精製ができるタンデム RNA 分離プロシージャ (旅行) をについて説明します。2 段階のプロトコルを含む Mrna のアンチセンス ランダムプライマー ビーズとそれに続くキャプチャで分離できることは、3'-ビオチン化 2'-O-メチル化アンチセンス RNA オリゴヌクレオチド、興味の mRNA の polyadenylated の分離ストレプトアビジン ビーズ。旅行は、酵母、線虫、さらに RNA および蛋白質の分析のためのひと細胞から体内架橋 (mRNP) の mRNA のリボ核蛋白質複合体を回復に使用されました。したがって、旅行は polyadenylated Rna 細胞または環境のキューによって課された mRNPs の動的再配置を検討する生物間でのすべてのタイプに合わせることができる汎用性の高いアプローチです。
概要
転写後の遺伝子発現制御の駆動 RNA 結合タンパク質 (Rbp)、非コーディングの Rna (ncRNAs) および Mrna 間の相互作用を直接処理、ローカリゼーション、翻訳、セル1内すべてのトラン スクリプトの崩壊,2。 つまり、Rbp、ncRNA リボ核蛋白質複合体/粒子 (結合) と呼ばれるものを確立する特定の Mrna との相互作用の同定 Mrna と遺伝子発現制御の運命を理解する鍵です。相補的アプローチ、RNP 複合体3,4の生化学的解析の実施:「タンパク質中心」のアプローチは特定の Rbp の浄化に基づいて、「RNA 中心型」アプローチを含む、集団または個別の Rna と相互作用の蛋白質または Rna の後の分析の分離。最近、RBP レパートリーの polyadenylated との相互作用の同定のため RNA を中心としたアプローチ (poly(A)) Rna5がますます人気となって蛋白・ RNA を安定させるために紫外線 (UV) 光架橋ステップを組み込むことによって相互作用前のひと細胞6,7,8,9,10,11に Rbp のカタログを大幅に拡張する Mrna の単離線虫12、酵母12,13,14、および他の生物15,16,17,18、 19,20。しかし、蛋白質および/または特定の成績証明書に組み立てられた ncRNAs のマッピングはまだ大きな課題です。このため、2 つの主要なアプローチを現在使用されている: RNA アプタマー タグを親和性の浄化を可能にする興味の RNA に融合する一方で。これにより、RNA アプタマー バインド トブラマイシン ストレプトマイシン21,22,23,24, を含むアミノ配糖体抗生物質と外被蛋白質などの蛋白質に親和性が高いMS2/R17 バクテリオファージまたは細菌ストレプトアビジン S125,26,27,28,29。このアプローチは、比較的堅牢で汎用性の高いことが示された、調査、設計、RNA へのクローン作成が必要です、自然な Mrna をキャプチャする使用できません。その一方で、アンチセンス オリゴヌクレオチド (ASOs) は回復のため早い段階で使用され、ネイティブ結合30,31とウイルス Rna の32の特性が高発現します。最近では、ASOs 長い非コーディング RNAs33,34,35をキャプチャして体外mRNPs36を形成.RNA 中心の方法のすべてで 1 つの主要な制限要因より問題となる低発現 Mrna の回復を行って、興味の RNA のコピー数です。反応; をアップスケー リングによってこの制限を克服できます。ただし、これはバック グラウンドの増加になる可能性が。
ここで、私たちの最近開発された阿蘇ベース タンデム高選択性37 . (図 1) とネイティブの mRNA がタンパク質複合体を分離するための RNA の隔離プロシージャ (旅行) について述べるプロトコルが 2 つのシーケンシャル阿蘇ベース浄化手順に、すなわち市販ランダムプライマーを多 Mrna の分離結合する具体的に設計された短いビオチン化 2'-メトキシを使用して特定の Mrna をキャプチャに続いてビーズRNA ASOs。この 2 つの手順は、汚染タンパク質を排除することができ、調整と最適化のための機会を追加します。このインスタンスで、旅行は、酵母、線虫から選択した Mrna に適用されましたし、体内を確認するひと細胞 mRNA 蛋白質複合体を形成しました。
プロトコル
1. デザイン アンチセンス オリゴヌクレオチド (ASOs)
- MRNA またはその38使用可能なオンライン ツールを使用してフラグメントの二次構造を分析します。したがって、空のボックスに塩基 (nt) を入力します。基本的なオプション ボックスで分離の塩基対を避けるため最低の自由エネルギー (MFE) とパーティション関数を選択します。出力オプション ボックスでインタラクティブな RNA 二次構造プロットを選択し、最後に進むボタンをクリックします。興味の mRNA の二次構造を表示する新しいウィンドウがポップアップします。
- 少なくとも 3 つの異なるに優先的に検出可能な二次構造に欠けている地域での興味の mRNA 内 21-24 nts 長いシーケンスを選択 (e.g。、構造化されていないループで) 非翻訳領域 (UTR) を 3 ' と。
注: それ観察されている 3' 非翻訳領域 (UTR) のシーケンスに焼鈍 ASOs は最善の実行します。1 つの可能性は、コーディング シーケンス (CD) にバインドされているリボゾームが ASOs の焼鈍を妨げる可能性があります時折です。5 ' UTRs 焼鈍 ASOs はテストしませんでした。- グアニジン/シトシン比 50% に近い地域を選択して、ヌクレオチド タンデムを欠けているヘアピンや自己アニーリングの潜在的な形成を避けるために繰り返されます。
- 手動でデザイン 2'-メトキシ変更軸受ビオチン基 3'、目的内の選択した領域 (ステップ 1.2) に完全に相補的な RNA オリゴヌクレオチド mRNA のターゲットします。
注: 2'-メトキシ変更 RNA 耐性細胞 RNases をレンダリング、溶融温度の厳しい洗浄を可能にする二重が増加します。ビオチン基は、ストレプトアビジンと ASOs のキャプチャに必要です。- 60 ~ 65 に RNA の雑種の融点を調整する ° C 高い言語シーケンスの複雑さがいることを確認し、(> 60%) 適切なオンライン ツール39で決定されました。
- トランスクリプトームにおける他の Mrna と潜在的な麻生十字交配を検索する基本的なローカル配列検索ツール40を使用します。ヌクレオチド爆発、空のボックスでシーケンスを挿入し、興味の生物を選択します。残りのパラメーターの既定値としてし爆発をクリックします。
注: 8-10 国税庁のでも、部分的に連続配置は十字交配、この mRNA の回復につながります。
2. 細胞培養、紫外線照射とセル換散
注: 次の手順は出芽酵母出芽酵母、線虫C. elegans、および人間の萌芽期の腎臓の細胞 (HEK293) については。それにもかかわらず、それは明示的にテストしていませんがまだは、同様に、他の生物に適応できます。
- 出芽酵母
- 酵母を育てる (e.g、ひずみ BY4743 派生物;。MATa/α his3Δ1/his3Δ1 leu2Δ0/leu2Δ0 LYS2/lys2Δ0 met15Δ0/MET15 ura3Δ0/ura3Δ0 PFK2:TAP/PFK2) 500 mL の YPD 培地で (1% 酵母エキス、ペプトン 2%、2 %d-グルコース) 220 rpm で一定の揺れで 30 ° c。
- 中間ログの段階で細胞を収集 (光学密度 600 nm (OD)600 〜 0.6) 0.45 μ m ナイロン フィルターを用いたろ過することによって部屋の温度 (RT) で 2 分間 3,000 × g で遠心分離します。それぞれフローを介して、または、上清を捨てます。
- 0.45 μ m ナイロン フィルターを用いたリン酸緩衝食塩 (PBS) 25 mL で 3 回セルを洗浄または RT で 2 分間 3,000 × g で遠心分離によって収集し、上澄みを廃棄します。できるだけ早く課されたストレスが RNA 蛋白質の相互作用に影響を与える可能性があります、セルを収集します。
- 25 mL の PBS で細胞を再懸濁し、15 cm シャーレの懸濁液を注ぐ。氷の上の皿を配置、フタ、400 mJ cm-2穏やかな混合とそれぞれの露出サイクル間氷の上 2 分区切りで UV 架橋剤の 254 nm の紫外線にセルを 3 回を公開します。
- 50 mL のチューブにセルを転送し、4 ° C で 3 分間 3,000 × g で遠心分離によって細胞を収集上澄みを廃棄し、ペレットを維持します。
注: セルを液体窒素で凍結し、-80 ° C で保存されているスナップインできます。 - 冷やして換散バッファー A の 4 mL の細胞を再懸濁します (LB、100 mm トリス-HCl、pH 7.5、500 mM LiCl、10 ミリメートルの EDTA、1% トリトン X-100, 5 mM DTT、20 U ml-1プロテアーゼ阻害剤カクテルの無料の EDTA を完了私は、100 U ml-1 RNasin、DNase)。
- 2 つの 2 mL チューブにセルを転送します。Max を追加します。2/3 量ガラスビーズを冷やして、30 Hz で 4 ° C で 10 分間の組織 lyser のセルを破壊
- 熱い針をチューブの底に穴を開けるし、30 600 × g で遠心分離により、新鮮な 1.5 mL チューブにライセート転送 s。
- 4 ° C、3 分間 3,000 × g で 3 連続遠心によって溶解し、5,000 × g と 10,000 × g 5 分でクリアします。
注: 抽出液体窒素でスナップ凍結でき-80 ° C で保存
- 線虫 c. エレガンス
- マツ材線虫病成長媒体 (NGM) 板 (0.3% 食塩水、1.7% 寒天、0.25% ペプトン、1 ミリメートル CaCl2、5 μ G/ml コレステロール、1 mM MgSO4、25 mM KPO4バッファー、pH 6.0)エシェリヒア属大腸菌OP50 ひずみとシードに 20 ° c 文化ブリストル N2 ワーム41.
- ワームを再懸濁します 15 mL チューブにワームを転送するプレートを振る、各プレートに M9 バッファー41 (0.3% KH2PO40.6% Na2HPO4、0.5% 食塩水、1 mM MgSO4) 5 mL を追加します。スライド内の懸濁液 2 μ L を置き、顕微鏡を用いた懸濁液でワームをカウントします。ワームあたり板の数を計算する係数を適用します。
- 収集 〜 (400 × g、2 分、RT) 室温で遠心分離によって 120,000 のワーム、上澄みを廃棄します。
- ワームを 3 回洗浄します。したがって、M9 バッファーの 10 mL を追加し、インバージョンによるミックス、右で 2 分間 400 × g で遠心分離してワームを収集
- ワームに 15 mL の M9 バッファーを追加し、室温 15 分間回転ホイール上に配置
- NGM プレート (プレートあたり4,000 〜 ワーム) にワームを転送し、UV ライトに公開 (254 nm) 300 mJ cm-2 UV 架橋剤で。
- プレートに直接 5 mL の M9 バッファーを追加し、バッファーでワームを再懸濁しますにプレートを振る。15 mL チューブにピペットの懸濁液を転送し、右で 2 分間 400 × g で遠心分離してワームを収集
- 2 mL の溶解バッファー B でワームを再懸濁します (LB B; 100 mM トリス-HCl、pH 8.0、150 mM の NaCl、1 mM EDTA、0.75 %1 mM DTT、20 U mL-1 DNase EDTA フリー プロテアーゼ阻害剤のカクテルを完了私は、100 U mL-1 RNasin、IGEPAL)。
- 液体窒素を充填モルタルでワームを挽きます。50 mL のチューブおよび室温解凍で粉を収集します。
注: 液体窒素は安全プロシージャ (例えば、ヒューム フード ・安全手袋) に従って処理する必要があります。 - 10 分 14,000 × g で遠心分離によって脂肪層を含むライセートをオフにし、明らかに渡すその後注射器で 0.45 μ m のフィルターを通してライセート。
- ひと培養細胞
注: 以下の説明は pGL3 CDKN1B 3 HEK293 細胞のトランスフェクションに基づいて ' UTR 記者プラスミドのホタルのルシフェラーゼ遺伝子42の下流 CDKN1B/27 3′UTR を表す。- HEK293 細胞でダルベッコ変更されたワシの媒体 (DMEM) 25 mM グルコースと 1 mM ピルビン酸ナトリウムを含む 100 U mL-1ペニシリン, 100 μ g mL-1ストレプトマイシン, 10% 牛胎児血清 (FBS) を添加した、37 ° c で孵化させなさい、加湿チャンバー (インキュベーター) 5% CO2を含みます。
- ~ 3 種 × 106 HEK293 細胞の標準的な 10 cm の組織培養皿、トランスフェクション前日です。診断とセルをカウントします。
- レポーターの遺伝子のミックス 2 μ g (e.g。 pGL3 p27 3 ' UTR) トランスフェクション試薬の 20 μ l で transfect 70% の confluency (〜 7 × 106細胞) の細胞と。
- さらに 48 時間 37 ° C でインキュベーターで収穫前にセルを配置します。
- 血清ピペットで培地を取り除き、37 ° C に加温した PBS の 10 mL で 2 回洗浄を迅速に血清ピペットと PBS を削除します。
- 皿に 6 mL の PBS を追加、氷の上に配置し、紫外線に細胞を公開 (254 nm) 100 mJ cm-2 UV 架橋ので。
注: プレートは紫外線露光中に氷で保たれなければなりません。 - PBS で 15 mL チューブへの転送 (合計 10 〜7細胞) の細胞をこすり落とします。
- 4 ° C で 10 分間 250 × g で細胞をスピン、ピペットで上澄みを取り外します。
注: 細胞ペレットできますスナップ液体窒素で凍結、使用するまで-80 ° C で保存します。 - あらかじめ冷やして換散バッファーの 2 mL の細胞を再懸濁します (LB-A) の上下にピペットで 5-6 回、氷の上の管を維持しながら。
- 氷上に置いた 5 mL 管にピペットでライセートを転送します。
- 対象 30 と 10 μ m の振幅で 20 s バーストから成る超音波照射の 3 つのラウンドにライセート氷上期間を冷却の s。
注: 細胞と DNA のフラグメントの溶解が完了すると、超音波がお勧めします。 - 2 mL の管および 15,000 × g で 4 ° C で 10 分間遠心にライセートを転送します。上澄み (= エキス) を集め、新しい管へ転送。さらに蛋白質および RNA の解析のための分析サンプル (5-10%) を削除します。
注: この手順は、任意の残りの細胞の残骸を削除する非常に重要ですし、繰り返すことができます。
3. 最初のステップ: 多 RNA 分離
- ランダムプライマー25の 1 mg を平衡-それぞれの換散バッファーの 500 μ L の磁気ビーズを結合します。
- ランダムプライマー25 mg の 1 それぞれ、5 mg、10 mg、4 mg (タンパク質)酵母、線虫HEK293 エキスを組み合わせる-磁気ビーズを結合します。積極的にミキサーで 25 ° C で 10 分間のサンプルをミックスします。
注: 抽出液のタンパク質濃度は、参照標準としてウシ血清アルブミン (BSA) を使用してブラッドフォードの試金で決定できます。サンプルの活発な動揺は、ビーズの沈降を防ぎます。MRNA の分離の特異性を評価するには、polyadenylic 酸 (pA) の超過分 (20 μ g) を追加することによって、並列制御実験を実行できます。 - 10 s および削除、マグネット スタンドにチューブを置き、上澄み。氷回復 (ステップ 3.7) の後のラウンドの上清をしてください。
- 500 μ L の洗浄バッファー A に追加 (10 mM トリス-HCl、pH 7.5、600 mM LiCl、1 mM EDTA、0.1% トリトン X-100) ビーズと 5 の渦に s。
メモ: 濃度 LiCl の洗浄バッファーが異なることができます。600 mM LiCl を推奨しますが、低濃度また (500 mM の線虫、HEK293 300 mM)、テストされました。 - 磁石でビーズを収集し、洗浄バッファー B (WB; 10 mM トリス-HCl、pH 7.5、600 mM LiCl、1 mM EDTA) 500 μ で二回ビーズを洗浄します。
- ミキサーで 10 mm トリス-HCl、pH 7.5 連続振動 (1,000 rpm) と 2 分のための 80 ° C で 30 μ L の RNA を溶出します。すぐにマグネット スタンドにチューブを置き、10 後の溶出液を回収米保存浄化の追加ラウンド ビーズ。
注: は、低い温度でビーズに Mrna の潜在的な再バインドの防止にできるだけ早く溶出液を収集します。 - 3.3 のステップで収集した上清を前の手順からビーズを追加し、キャプチャ、洗濯および溶出 Mrna の 2 回 (ステップ 3.3 3.6) を繰り返します。繰り返しラウンドから溶出し、結合され、-80 ° C で保存することができます。
4. 第 2 ステップ: 3'-ビオチン化 2'-メトキシ変性アンチセンス RNA オリゴヌクレオチドと特定のキャプチャの Mrna
注: ASOs の適合性をテストするには、次の手順は細胞から分離された総 Rna を実行できます。
- バインドの 1 mL にストレプトアビジン結合磁性体ビーズ 30 μ L を平衡させ、洗浄バッファー (B & W バッファー; 10 mM トリス-HCl、pH 7.5、150 mM の NaCl、0.5 ミリメートルの EDTA、pH 8.0) で回転させ 1 時間で 0.1 mg mL-1大腸菌トランスファー RNA (tRNA) を含むRT。
- B & W バッファーの 750 μ L にビードを 3 回洗浄しなさい。
- B & W バッファーの 30 μ L のビードを再停止しなさい、使用するまで氷の上を保ちます。
- 希釈前の多分離から総蛋白質の ~ 35 μ g (3 参照) 1.5 mL チューブにバッファーが B & W の 100 μ L に。
注: 総 RNA の ASOs の特異性をテストするには、追加 600 B & W バッファーの 100 μ L に浄化された総 RNA の ng。 - それぞれの麻生の 200 pmol を追加し、70 の ° c で 5 分間インキュベートします。
注意: 高温は、麻生の焼鈍を促進する RNA の二次構造を解決します。 - デバイスから熱ブロック全体を削除し、常温でゆっくりとクールダウン 10 分置きます。
- 手順 4.1 から平衡ストレプトアビジン結合磁性体ビーズ 30 μ L をサンプルに追加します。
- ミキサーで 950 rpm で一定の揺れと 25 ° C で 30 分のための混合物を孵化させなさい。
注: ビーズの沈降を防ぐために管の 10 分毎をフリックすることをお勧めします。 - マグネット スタンドにチューブを置き、上澄みを除去し、55 ° C で予め温めておいた B & W バッファーの 750 μ L にビードを 3 回洗浄しなさい
注: 最適な洗浄温度若干異なる/異なります異なる ASOs の間。細胞抽出液を用いた実験を行う非架橋総 RNA 前とこの条件を調整することをお勧めします。 - 10 mm トリス-HCl、pH 7.5 ミキサー.で 950 rpm で一定の揺れと 10 分のための 90 ° C で 20 μ L の RNA を溶出します。マグネット スタンドにチューブを置き、すぐに溶出液を収集します。
注: タンパク質解析ビーズに 1 × 塩化物イオンとバッファーの 20 μ L を追加し、5 分タンパク質は標準的な実験室のプロトコルのイムノブロット解析によって監視されるため、95 ° C で孵化させなさい。
結果
3 つの異なる生物37からのバインドされたタンパク質の特定の Mrna をキャプチャするための旅行と呼ばれる、麻生に基づく RNA 分離戦略を開発しました。本質的に、RNA 蛋白質の複合体が生体内で架橋された市販オリゴ (dT) 結合磁性ビーズが回収された Rna、254 nm 帯、および多細胞の紫外線照射によって、興味の mRNA と分離3'-ビオチン標識 2-0'-メトキシ変更アンチセンス RNA オリゴヌクレオチド (図 1)。我々 したがって酵母、線虫人間から選択した Mrna 内の領域に完全相補性といくつかの 21-24 変更 nts ASOs を設計および (プライマー、ASOs のリストはテーブルで与えられる興味の mRNA を回復する適性をテスト1). 効率と個々 の ASOs の特異性をまずそれぞれの生物から分離された非架橋総 RNA と行った。これらの実験で RNA ASOs はストレプトアビジン共役常磁性ビーズに結合され対応する有機体から調製した非架橋総 RNA と孵化させます。ビーズからキャプチャされた Mrna のリリース後 mRNA の存在ターゲット Mrna の逆のトランスクリプション (RT) によって監視された無関係のものとして同様のコントロール-ポリメラーゼの連鎖反応 (PCR)37。我々 は、その 2 つの変数、塩濃度、温度洗浄バッファー、3 つ異なる ASOs (図 2 a) でテストされたイーストからのPFK2 mRNA の捕獲の効率に重要な役割を果たしたに気づいた。回復を削減 25 mM に塩 (NaCl) 濃度を下げる負の mRNA (PFK1) をすべて ASOs と非検出可能なレベルにコントロールが目的の回復も低減されるターゲット mRNA PFK2 (入力の 10-15%)。逆に、生理学的なレベル (150 mM NaCl) に塩濃度の増加増加PFK2 Mrna の回復 75% をPFK1のコントロールを超える阿蘇 PFK2-2 と mRNA が少なくとも割増 (図 2 a)。さらにノートの別の ASOs 示した mRNA の大きな変化ターゲット キャプチャ効能生理的塩濃度で ASOs.の実証検証の必要性を強調MRNA 回復の洗浄バッファーの温度依存は、線虫 cep 1と酵母RPS20 Mrna、それぞれ ASOs (表 1) を使用して例示です。最適な洗浄温度が 50 ° C から 55 ° C の場合は、無関係な Mrna と (図 2 b) Mrna ターゲットの効率的回収低バック グラウンドから明らかなように、だったことを観察した.この時点で、我々 は ASOs の他の Mrna とのクロス交配の可能性を強調したいです。たとえば、シーケンスを符号化するDNM1内のシーケンスを完全に補完 DNM1 麻生がACT1 mRNA と焼鈍も部分的に。DNM1 ASOs クロス交配 (図 2) のための強い傾向を示す洗濯温度に関係なく両方の Mrna を回復しました。最後に、上記の電気検査を用いて、それぞれのターゲット Mrna からの回復には適していた 3 つの ASOs を選択する最適化トータル RNA 由来の酵母、線虫ひと細胞 (図 2 D).
適切な ASOs のin vitro での最初の選択後 UV 架橋有機体/細胞 (図 1) から得られた細胞抽出物と旅行を行った。具体的には、我々 は 3 つの異なった有機体からの 3 つの異なる Mrna の回復をテスト: 酵母出芽酵母、cep 1線虫C. elegans記者からPFK2 mRNA mRNA (pGL3 CDKN1B 3'UTR) 3' UTR 軸受人間のCDKN1B/p27 mRNA のシーケンスは、HEK293 細胞一過性発現のルシフェラーゼ (リュック) 記者に融合。RNA の隔離の特異性を制御するため我々 はいくつかの無関係な Mrna の回復を監視し、ランダムプライマー25 に細胞の Mrna の結合と競う細胞抽出液に pA の過剰添加による競争実験を行った最初の精製ステップ中にビーズ。非架橋総 RNA サンプル (図 2)、RT-PCR 確認で以前見た豊かなそれぞれの Mrna のターゲット mRNA の旅行中にいくつかのコントロールの非関連 Mrna が濃縮されたに対し (図 3 a)。また、どちらの Mrna は、ASOs、非特異的結合を避けるためブロックの適切な手順を示すことがなくビーズで見つかりませんでした。この線上では、無関係なスクランブル ASOs 可能性がありますもコントロールとして使用、特定の Mrna と結合タンパク質の推定のキャプチャとのクロス交配の可能性は、考慮されます。最終的な溶出液中のタンパク質は、銀染色ポリアクリルアミドのゲル (データは示されていない) のほとんど視覚化できます、ので以前知られている mRNA の相互作用の蛋白質の存在はさらにイムノブロット解析を行い評価されました。これは出芽酵母、リボソーム独立した方法12; PFK2 mRNA に選択的に結合するから Pfk2p が含まれていますC. の elegans GLD 1、3' UTR cep 1のシーケンスにバインド正規 RBP mRNA 翻訳制御43;ベンハー、mRNA の安定性と44 p27/CDKN1B mRNA の翻訳を調節する RBP。予想通り、すべてのこれらの蛋白質はそれぞれ Mrna 旅行溶出物の西部のしみの分析 (図 3 b) によって識別されました。
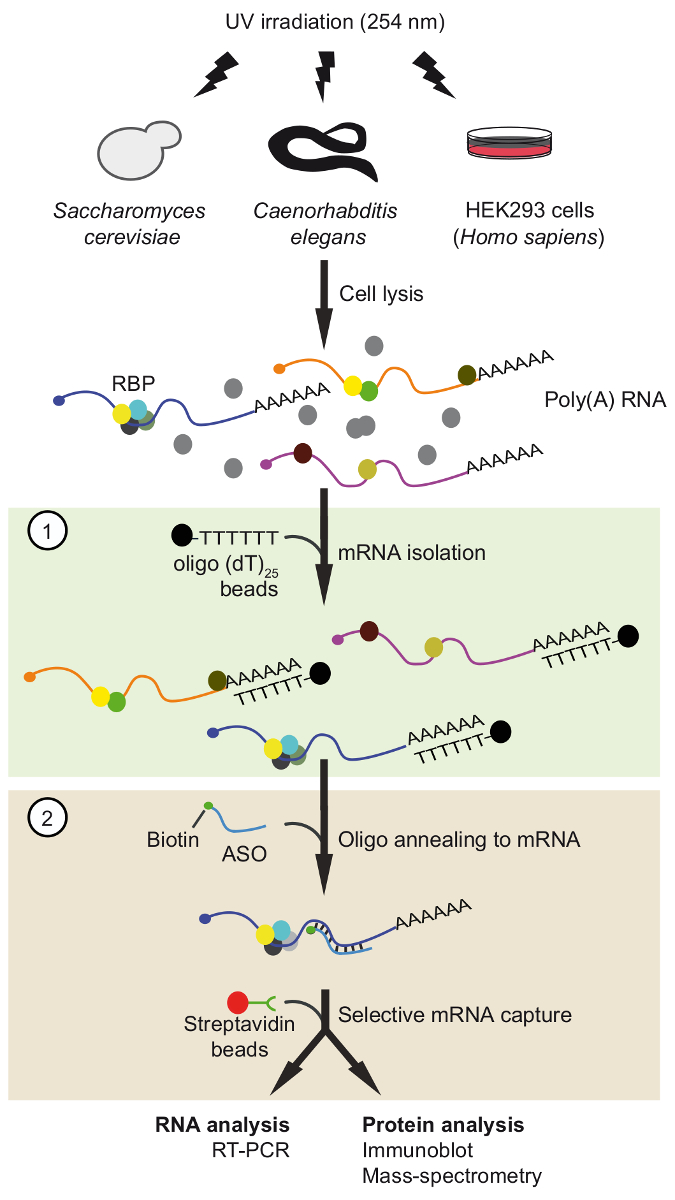
図 1。旅の概略図。タンパク質は、RNA生体内で紫外線照射による架橋です。最初のステップ (ライト グリーン ボックス) で多 RNA 蛋白質複合体は自由な蛋白質を削除する厳しい洗浄条件の適用ランダムプライマー25ビーズ回復されます。2 番目の手順 (ピンク色のボックス)、ターゲット mRNP がプルをビオチン化アンチセンス RNA オリゴヌクレオチドとストレプトアビジン ビーズ。浄化された mRNPs は、RT-PCR およびイムノブロット/質量分析法 (MS) Rna とそれぞれ興味の mRNA との相互作用の蛋白質を識別するために、分析しています。図は、アクセス許可と前文書37から変更されました。この図の拡大版を表示するのにはここをクリックしてください。
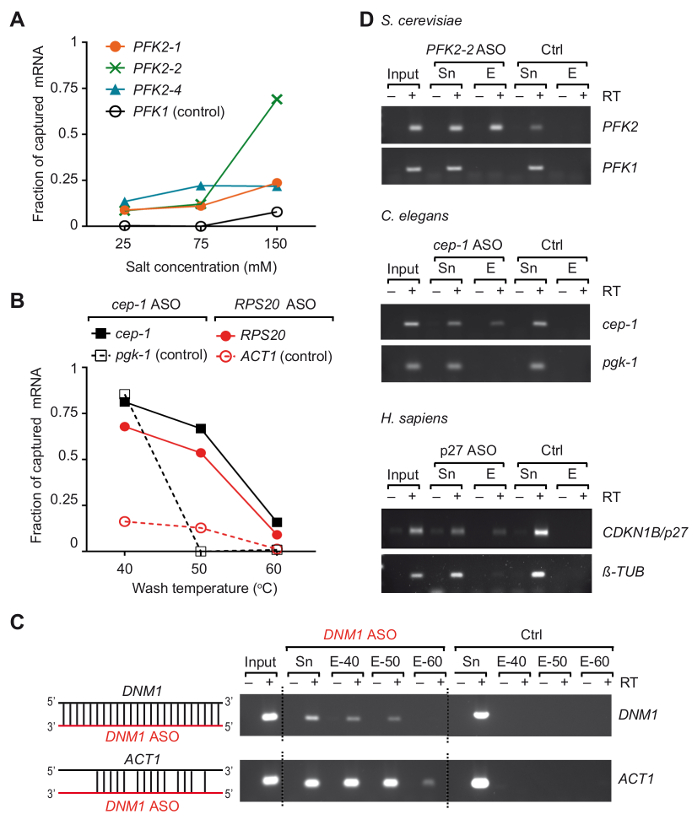
図 2。選択した Mrna 非架橋細胞/生物を使用して総 RNA からの分離はキャプチャのアンチセンス RNA プローブを変更します。(A) 酵母 ASOs のPFK2 mRNA のキャプチャ効率に対する塩濃度の影響。酵母からの総 RNA は示されている ASOs と組み合わせるし、55 ° C で指定された塩 (NaCl) 濃度バッファーで洗浄緑、青とオレンジのラインを表す RT-PCR37によって決定される異なる ASOs のPFK2 mRNA 回復: 3' UTR、CD のPFK2 4でPFK2 1とPFK2 -2 アニールします。PFK1は否定的な mRNA を制御します。PCR は 32 の増幅サイクルを行い、上記37として定量化されました。(B) c. eleganscep 1および酵母RPS20麻生のほんの一部は、それぞれ黒と赤の線分で表される異なる洗浄温 Mrna がバインドされます。C. eleganspgk 1酵母ACT1は、非ターゲット (コントロール) Mrna。30 と 32 の PCR のサイクルはそれぞれ酵母と線虫の Mrna の検出の適用されました。(C) DNM1 DNM1 mRNA と同様に潜在的なクロス交配のシーケンスのACT1 mRNA と阿蘇 (赤) の交配の模式図が左側に表示されます。ビーズから溶出、酵母のDNM1 、 ACT1の Mrna の検出のための RT-PCR の反作用 (30 サイクル) から製品を示す agarose のゲルが右側に表示されます。入力、総 RNA;Sn、ASOs; の孵化後の上清E、溶出液で洗ったビーズ (40 ° C、50 ° C と 60 ° C) 温度事前の溶出を示されています。制御実験 (ctrl キー) は、麻生を追加することがなく並列で行われました。(D) Agarose のゲルの酵母出芽酵母、線虫、HEK293 細胞 (H. サピエンス) の総 RNA からキャプチャ (右) の Mrna の検出のための RT-PCR の製品を示します。入力、総 RNA;Sn、上澄み。E ビーズ溶出液。PCR を行った酵母 Mrna の増幅サイクル 30 回、 c. の elegansの mRNAs のため 32 サイクルと 28 と 30 はそれぞれ人間チューブリンとp27 Mrna のサイクルします。図は、アクセス許可と前文書37から変更されました。この図の拡大版を表示するのにはここをクリックしてください。
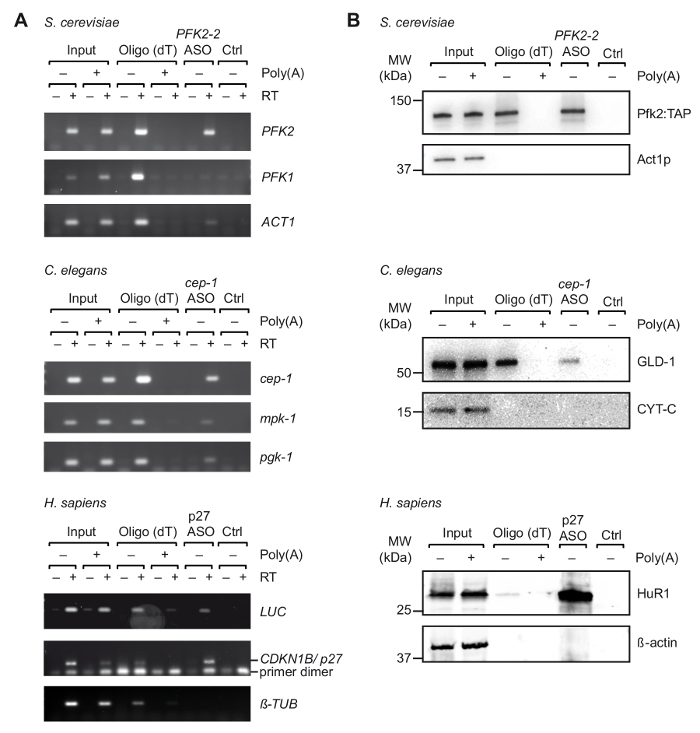
図 3。旅行と UV 架橋細胞由来の抽出物から特定の mRNA がタンパク質複合体のキャプチャします。(A) Agarose のゲル (右) RT-PCR のランダムプライマーと出芽酵母、線虫人間 (H. サピエンス) 細胞抽出液から示されている ASOs キャプチャ時に Mrna の検出のため。架橋細胞/生物からの総 RNA の入力Ctrl、麻生なしコントロール。多、多との競争。RT-PCR を行った説明37 35 の増幅サイクルとしてリュック、 p27の 32 サイクルと 29 は、チューブリンのサイクルします。(B) 指示された抗体 (右) と mRNA 結合タンパク質のイムノブロット解析。読み込まれた分数は、次のとおり: 0.1%、2.5% と 1% 酵母、線虫および人間の入力。10%、10%、5% 酵母、線虫および人間のランダムプライマー レーン。すべての ASOs レーンの 66%。分子量 (MW)、キロダルトン (kDa) で示されます。図37アクセス許可と再版されます。この図の拡大版を表示するのにはここをクリックしてください。
| プライマー名 | シーケンス | ターゲット | サイズ | |
| Pfk2_Fwd | GTGTTAAGGGTTCACATGTCG | PFK2 出芽酵母 | 133 bp | |
| Pfk2_Rev | CTTCCAACCAAATGGTCAGC | PFK2 出芽酵母 | 133 bp | |
| Pfk1_Fwd | GGTGATTCTCCAGGTATGAATG | PFK1 出芽酵母 | 97 bp | |
| Pfk1_Rev | CTTCGTAACCTTCGTAAACAGC | PFK1 出芽酵母 | 97 bp | |
| Act1_Fwd | GTCTGGATTGGTGGTTCTATC | ACT1 出芽酵母 | 85 bp | |
| Act1_Rev | GGACCACTTTCGTCGTATTC | ACT1 出芽酵母 | 85 bp | |
| Dnm1_Fwd | CTGTGTTCGATGCATCAGAC | DNM1 出芽酵母 | 156 bp | |
| Dnm1_Rev | CGCACTCCAATTCTTCTCTC | DNM1 出芽酵母 | 156 bp | |
| Rps20_Fwd | CGCTGAACAACACAACTTGG | RPS20 出芽酵母 | 228 bp | |
| Rps20_Rev | GGAAGCAACAACAACTTCGAC | RPS20 出芽酵母 | 228 bp | |
| Cep1_Fwd | CGATGAAGAGAAGTCGCTGT | セップ-1 線虫 | 110 bp | |
| Cep1_Rev | ATCTGGGAACTTTTGCTTCG | セップ-1 線虫 | 110 bp | |
| Pgk1_Fwd | GCGATATTTATGTCAATGATGCTTTC | pgk 1 線虫 | 74 bp | |
| Pgk1_Rev | TGAGTGCTCGACTCCAACCA | pgk 1 線虫 | 74 bp | |
| Mpk1_Fwd | TGCTCAGTAATCGGCCATTG | mpk 1 線虫 | 74 bp | |
| Mpk1_Rev | TCCAACAACTGCCAAAATCAAA | mpk 1 線虫 | 74 bp | |
| p27_Fwd | TTTAAAAATACATATCGCTGACTTCATGG | p27 世人 | 212 bp | |
| p27_Rev | CAAAGTTTATGTGCTACATAAAAGGTAAAAA | p27 世人 | 212 bp | |
| Luc_Fwd | AATGGCTCATATCGCTCCTGGAT | ルシフェラーゼP. pγralis | 117 bp | |
| Luc_Rev | TGGACGATGGCCTTGATCTTGTCT | ルシフェラーゼP. pγralis | 117 bp | |
| Β-TUBULIN_Fwd | CTGAACCACCTTGTCTCAGC | Β-チューブリン世人 | 136 bp | |
| Β-TUBULIN_Rev | AGCCAGGCATAAAGAAATGG | Β-チューブリン世人 | 136 bp | |
| PFK2-1 阿蘇 | AAUAGAAAGUGUAAUAAAAGGUCAU | 3' UTR PFK2 酵母 | - | |
| PFK2-2 阿蘇 | GUUUCAUGGGGUAGUACUUGU | 3' UTR PFK2 酵母 | - | |
| PFK2-4 麻生 | CUUGAAGAGGAGCGUUCAUA | ORF PFK2 酵母 | - | |
| DNM1麻生 | UCGGUCAGUGGAGGUUCAGCGUUU | ORF DNM1 酵母 | - | |
| RPS20麻生 | GUCGGUAAUAGCCUUCUCAUUCUUG | ORF RPS20 酵母 | - | |
| セップ-1麻生 | GUGAGAAAUGCGGUGCUUUGAAA | 3' UTR cep 1 線虫 | - | |
| p27麻生 | UCAUACCCCGCUCCACGUCAGUU | 3' UTR p27 世人 | - | |
テーブル 1。オリゴヌクレオチドの配列。PCR のプライマーおよび ASOs 増幅後この作業、プライマー シーケンス、遺伝子ターゲットと予想されるフラグメントのサイズで使用されるの一覧です。
ディスカッション
旅行は、行きの特定の Mrna生体内で生化学的な意味でタンパク質の解析を許可します。特定の Rbp 異なる生物・細胞からの mRNA ターゲットとの相互作用を検証するメソッドを使用しており、旅行も多 Rna, 細胞質の長い ncRNAs などの他の種類の研究に適用されるかもしれない。さらに、MS または RNA シーケンスにバインドされたタンパク質や Rna の体系的な分析は、スケール アップの手順によって達成できます。この点で、我々 の予備的なデータは、イースト文化の 1 L と少なくとも 1 億 HEK293 細胞が発現された mRNAs のため信頼性の高い MS のデータを取得する (未発表結果) 十分な開始材料を提供できることを示します。
説明の旅プロトコルを含む 254 で紫外光を用いた細胞照射架橋 RNA 蛋白質相互作用する nm。これは、浄化の間に厳しい洗浄条件の実装をできます。それにもかかわらず、明示的にテストが架橋はオプションであり、生理学的なバッファーをアクティブな結合を回復も可能性がありますに注意してくださいします。ただし、この場合、溶解液のターゲット RNA に蛋白質または RNAs の潜在的な再配置すべきアカウント。逆に、UV または他の架橋の手順が適用される (例えばホルムアルデヒド)、RNA の整合性は RNA の劣化 mRNPs の減少の回復につながると評価する必要があります。また、UV 架橋は効率の悪い (~ 5%)、二本鎖 RNA と結合した蛋白質のも少ないのでは Rbp の12の特定のクラスを検出するためのバイアスを生じる。最後に、UV 照射することができますもデータ解釈45,46を考慮すべきタンパク質間、タンパク質-DNA のクロスリンクを誘発します。したがって、代替架橋プロシージャ、例えば、ホルムアルデヒドとは、Mrna 上の大きな蛋白質アセンブリをキャプチャに特に関心の可能性があります。
旅行の特徴の一つは、2 段階の特定の Rna、選択性を増やすと共同の汚染物質を浄化の可能性が減って回復する阿蘇ベースの精製法です。たとえば、1 つの懸念は、ビオチン結合タンパク質の共同浄化につながる細胞抽出液に直接ビオチン ASOs の追加に関連します。これが共有結合 oligo-(dT)25磁気ビーズを用いて多 Rna の精製 RNA タンパク質インタラクトーム キャプチャが厳格な精製条件についてできるの最初のラウンドを実装することによって旅行で回避されます。さらに、ポリ a RNA 選択は、リボソーム Rna や Trna など、非常に豊富な ncRNAs が削除され、したがってサンプルとクロス交配および汚染の潜在的なソースの複雑さが軽減されます。2 番目の手順では、特定の Mrna はビオチンで回復、mRNA ターゲットの領域とアニール ASOs を変更します。また、変更された ASOs も直接共有に接続でしたアミン リンカーを介して磁気ビーズ ビオチン結合タンパク質をキャプチャする傾向を減らします。しかし、私たちの経験では ASOs ストレプトアビジン ビーズを添加する前にポリ a RNA 分数のインキュベーション回復 mRNPs 麻生結合ビーズの直接添加よりも効率的に。おそらく、無料 oligos、速度論的固定化 oligos と比較して構造化された rna シーケンスへのアクセス改善に好まれています。したがって、サンプルの孵化前にビーズに ASOs の共有結合の結合 RNA ターゲットの回復のため有害であることが、経験的にテストするには。
阿蘇ベースのメソッド 1 つの欠点は、ターゲット Mrna はいくつかの非効率的な回復です。我々 したがって、トラン スクリプトのさまざまな地域にアニール複数 ASOs の評価を推奨します。具体的には、私達は 3' UTR のシーケンスとアニール 2 3 ASOs または興味の mRNA の CD のデザインを提案します。各麻生対応する mRNA ターゲットの回復のためのさまざまな効率を示すことができるし、実証する必要があります (図 2 a Bのデータが示されていない) をテストします。最後に、わかった 3' UTRs に焼鈍 ASOs は優れたパフォーマンスを発揮する CD をアニールのものと比較してリボゾームは CD 内で効率的な交配を遮るに対し、リボソームの翻訳の不在のための結合 UTRs サイトのアクセシビリティを増加可能性があります。私たちはそれをまた経験いくつか ASOs の組み合わせ豊富な非標的 Mrna から高められた汚染につながるし、プルダウン効率が低下します。競争実験によっていずれの場合も、選んだ oligos の選択度を制御できます (e.g。、競合 oligos の追加)。
さらに無関係な Rna との潜在的なクロス交配に関連する懸念見たようにその他の Mrna も部分的な交配につながります (図 2) その mRNA の回復。設計の ASOs の適合性を評価するには、初期の in vitro塩濃度およびバッファーの洗浄温度を最適化するトータル Rna を使用したテストを実行するためお勧めします。私たちの手で最高の 55 ° C で塩化ナトリウムが実行されたときに 150 の mM を含んでいるバッファーのストレプトアビジン結合磁性体ビーズ洗浄しますが、それぞれ設計されていた麻生の条件の独立したテストをお勧めします。、注目されることが判明した (図 2 D) in vitro実験から選択したすべての ASOs 架橋細胞抽出物 (図 3) からそれぞれの mRNA のターゲットをキャプチャするために適切なのの有効性をさらに実証体外テストします。MRNA キャプチャ適切な ASOs の設計、ほかの追加要素選択性に影響を与える可能性があります。したがって、ビーズ型の仕様によると BSA や tRNA と包括的なブロックの手順は、ビーズに不明確な結合を防ぐことができます。タンパク質の非特異的吸収をさらに減らすためには、また勧めします Lo バインド チューブの使用サンプルの少量を使用する場合に特に。
一般的に、旅行は、ASOs と Rna をキャプチャする以前に確立されたアプローチを補完できます。例えば、非コード RNA Xistは全体のトラン スクリプトをカバー (90-mer) ビオチン化 DNA オリゴヌクレオチド長いの配列を使用して 2 億 UV 架橋細胞から派生した核抽出液からバインドされた蛋白質の分離34,35。ただし、選択したタイルのアプローチが無関係な Rna とのクロス交配の素晴らしい可能性に照らして問題になるし、例の特定のコピーを選択する使用できません。、スプライシング フォーム。最近では、特にロックされた核酸 (LNA) を設計または DNA 阿蘇 mixmers の無細胞抽出からの in vitro転写または非常に表現されたリボソーム Rna を回復する磁性樹脂に接続された共有しかし、それは体内で形成される mRNA がタンパク質複合体36の回復のためテストされませんでした。Rbp と ncRNA による転写後遺伝子制御の増加の認識に照らして旅行が組成と RNP 複合体細胞と環境の手がかりとその影響の時に細胞内での動態を検討する有用な方法であると考えてください。健康と病気。
開示事項
著者が明らかに何もありません。
謝辞
PFK2とセップ 1 ASOs、博士マイケル参加 p27/CDKN1B、ASOs の博士ラファウ Ciosk (Friedrich 症候群 (9) 生物医学研究所、設計のための合成のため博士ジョナサン ホールとマウロ ・ ツィンマーマン (チューリッヒ工科大学) に感謝しておりますバーゼル) アンチ GLD 1 抗体。この作品は、バイオ テクノロジー ・生物科学研究会議 (BB/K009303/1) とロイヤル社会ウォルフソン研究功労賞 (WM170036) A.P.G. に支えられました。
資料
| Name | Company | Catalog Number | Comments |
| MaxQ 5000 Large Incubated and Refrigerated Orbital Shaker | Thermo Fisher Scientific | SHKE5000-8CE | Floor shaker to grow yeast cells |
| BBD 6220 | Thermo Fisher Scientific | CO2 incubator to grow human cells | |
| Sonicator Soniprep150 | MSE | MSS150.CX4.5 | Sonicator/cell disruptor. Used to shear DNA in human cell lysates |
| Stratalinker 1800 | Stratagene | Stratalinker to expose cells to UV light at 254 nm | |
| Tissue Lyser | Qiagen | RETSCH MM200 | Device to mechanically disrupt yeast cells |
| Refrigerated Centrifuge | Eppendorf | 5810R | Centrifuge to spin down cells, lysates |
| Shaking incubator, Thriller | Peqlab | Thermoshaker for 1.5 mL tubes | |
| Glass beads 0.5mm | Stratech Scientific Limited | 11079105 | Lysis of yeast cells |
| Nylon Filter, 0.41 μm | Millipore | NY4104700 | Collection of yeast cells |
| Millex-HA Filter, 0.45 µm | EMD Millipore | SLHA02510 | Filter to clear nematode lysate |
| Eppendorf LoBind microcentrifuge tubes Protein 1.5 mL | Sigma-Aldrich | 22431081 | Minimise protein loss |
| 2 mL microfuge tube | Ambion | AM12425 | Yeast extract preparation and other applications |
| 5 mL tube | Thermo Fisher Scientific | 129A | Collection of HEK293 cell lysate |
| 15 mL tube | Sarstedt | 62.547.254 | Collection C. elegans |
| 50 mL plastic tube | Sarstedt | 62.554.502 | Collection yeast cells |
| DMEM, high glucose, pyruvate | Thermo Fisher Scientific | 41966 | Media for culturing HEK293 cells |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | Used to supplement cell culture media to control bacterial contamination |
| Fetal Bovine Serum (FBS) | Sigma-Aldrich | F7524 | Used to supplement cell culture media |
| Lipofectamine 2000 | Thermo Fisher Scientific | 11668027 | Transfection reagent |
| RQ1 RNase-Free DNase | Promega | M6101 | DNAse I to degrade DNA from cell lysate |
| RNasin Plus RNase Inhibitor | Promega | N2611 | RNase inhibitor to avoid RNA degradation |
| cOmplete, Mini, EDTA-free Protease Inhibitor Cocktail | Roche | 11836170001 | Protease inhibitor cocktail to avoid protein degradation |
| Dynabeads Oligo (dT)25 | Thermo Fisher Scientific | 61011 | Magnetic beads required for the first step of mRNA-protein complex purification |
| Dynabeads M-280 Streptavidin | Thermo Fisher Scientific | 11205D | Magnetic beads required for the second step of mRNA-protein complex purification |
| E. coli tRNA | Sigma-Aldrich | 10109550001 | transfer RNA from E. coli used for blocking streptavidin beads and avoid unsepecific interactions |
| Quick Start Bradford 1x Dye Reagent | BioRad | 5000205 | To determine protein concentration within lysates, using BSA as reference |
| Bovine Serum Albumin | Sigma | A7906-100G | Used to perform the standard curve that will be used as reference for protein concentration determination |
| mouse anti-Act1 | MP Biomedicals | 869100 | Antibody for detection of yeast actin in Western blot (1:2,500) |
| mouse anti-Act1 | Sigma | A1978 | Antibody for detection of human actin in Western blot (1:2,000) |
| mouse anti-HuR | Santa Cruz | sc-5261 | Antibody for detection of HuR in Western blot (1:500) |
| mouse anti–CYC-1 | Invitrogen | 456100 | Antibody for detection of Cyc-1 in Western blot (1:1,000) |
| peroxidase anti-peroxidase soluble complex | Sigma | P1291 | Detection of Pfk2:TAP in Western blot (1:5,000) |
| HRP-conjugated sheep anti-mouse IgG | Amersham | NXA931 | HRP-coupled secondary antibody |
参考文献
- Mitchell, S. F., Parker, R. Principles and properties of eukaryotic mRNPs. Molecular Cell. 54 (4), 547-558 (2014).
- Iadevaia, V., Gerber, A. P. Combinatorial Control of mRNA Fates by RNA-Binding Proteins and Non-Coding RNAs. Biomolecules. 5 (4), 2207-2222 (2015).
- McHugh, C. A., Russell, P., Guttman, M. Methods for comprehensive experimental identification of RNA-protein interactions. Genome Biology. 15 (1), 203 (2014).
- Matia-González, A. M., Gerber, A. P., Sesma, A., von der Haar, T. Ch. 14. Fungal RNA Biology. , 347-370 (2014).
- Tsvetanova, N. G., Klass, D. M., Salzman, J., Brown, P. O. Proteome-wide search reveals unexpected RNA-binding proteins in Saccharomyces cerevisiae. PLoS One. 5 (9), (2010).
- Castello, A., et al. Insights into RNA biology from an atlas of mammalian mRNA-binding proteins. Cell. 149 (6), 1393-1406 (2012).
- Baltz, A. G., et al. The mRNA-bound proteome and its global occupancy profile on protein-coding transcripts. Molecular Cell. 46 (5), 674-690 (2012).
- Castello, A., et al. System-wide identification of RNA-binding proteins by interactome capture. Nature Protocols. 8 (3), 491-500 (2013).
- Liao, Y., et al. The Cardiomyocyte RNA-Binding Proteome: Links to Intermediary Metabolism and Heart Disease. Cell Reports. 16 (5), 1456-1469 (2016).
- Liepelt, A., et al. Identification of RNA-binding Proteins in Macrophages by Interactome Capture. Molecular Cell Proteomics. 15 (8), 2699-2714 (2016).
- Conrad, T., et al. Serial interactome capture of the human cell nucleus. Nature Communications. 7, 11212 (2016).
- Matia-Gonzalez, A. M., Laing, E. E., Gerber, A. P. Conserved mRNA-binding proteomes in eukaryotic organisms. Nature Structural and Molecular Biology. 22 (12), 1027-1033 (2015).
- Mitchell, S. F., Jain, S., She, M., Parker, R. Global analysis of yeast mRNPs. Nature Structural and Molecular Biology. 20 (1), 127-133 (2013).
- Beckmann, B. M., et al. The RNA-binding proteomes from yeast to man harbour conserved enigmRBPs. Nature Communications. 6, 10127 (2015).
- Wessels, H. H., et al. The mRNA-bound proteome of the early fly embryo. Genome Research. 26 (7), 1000-1009 (2016).
- Sysoev, V. O., et al. Global changes of the RNA-bound proteome during the maternal-to-zygotic transition in Drosophila. Nature Communications. 7, 12128 (2016).
- Despic, V., et al. Dynamic RNA-protein interactions underlie the zebrafish maternal-to-zygotic transition. Genome Research. 27 (7), 1184-1194 (2017).
- Zhang, Z., et al. UV crosslinked mRNA-binding proteins captured from leaf mesophyll protoplasts. Plant Methods. 12, 42 (2016).
- Reichel, M., et al. In Planta Determination of the mRNA-Binding Proteome of Arabidopsis Etiolated Seedlings. Plant Cell. 28 (10), 2435-2452 (2016).
- Koster, T., Marondedze, C., Meyer, K., Staiger, D. RNA-Binding Proteins Revisited - The Emerging Arabidopsis mRNA Interactome. Trends Plant Sciences. 22 (6), 512-526 (2017).
- Hamasaki, K., Killian, J., Cho, J., Rando, R. R. Minimal RNA constructs that specifically bind aminoglycoside antibiotics with high affinities. Biochemistry. 37 (2), 656-663 (1998).
- Bachler, M., Schroeder, R., von Ahsen, U. StreptoTag: a novel method for the isolation of RNA-binding proteins. RNA. 5 (11), 1509-1516 (1999).
- Vazquez-Pianzola, P., Urlaub, H., Rivera-Pomar, R. Proteomic analysis of reaper 5' untranslated region-interacting factors isolated by tobramycin affinity-selection reveals a role for La antigen in reaper mRNA translation. Proteomics. 5 (6), 1645-1655 (2005).
- Hartmuth, K., Vornlocher, H. P., Luhrmann, R. Tobramycin affinity tag purification of spliceosomes. Methods Molecular Biology. 257, 47-64 (2004).
- Beach, D. L., Keene, J. D. Ribotrap : targeted purification of RNA-specific RNPs from cell lysates through immunoaffinity precipitation to identify regulatory proteins and RNAs. Methods Molecular Biology. 419, 69-91 (2008).
- Slobodin, B., Gerst, J. E. A novel mRNA affinity purification technique for the identification of interacting proteins and transcripts in ribonucleoprotein complexes. RNA. 16 (11), 2277-2290 (2010).
- Slobodin, B., Gerst, J. E. RaPID: an aptamer-based mRNA affinity purification technique for the identification of RNA and protein factors present in ribonucleoprotein complexes. Methods Molecular Biology. 714, 387-406 (2011).
- Yoon, J. H., Gorospe, M. Identification of mRNA-Interacting Factors by MS2-TRAP (MS2-Tagged RNA Affinity Purification). Methods Molecular Biology. 1421, 15-22 (2016).
- Leppek, K., Stoecklin, G. An optimized streptavidin-binding RNA aptamer for purification of ribonucleoprotein complexes identifies novel ARE-binding proteins. Nucleic Acids Research. 42 (2), 13 (2014).
- Blencowe, B. J., Sproat, B. S., Ryder, U., Barabino, S., Lamond, A. I. Antisense probing of the human U4/U6 snRNP with biotinylated 2'-OMe RNA oligonucleotides. Cell. 59 (3), 531-539 (1989).
- Lingner, J., Cech, T. R. Purification of telomerase from Euplotes aediculatus: requirement of a primer 3' overhang. Proceedings of the National Academy of Sciences U S A. 93 (20), 10712-10717 (1996).
- Upadhyay, A., Dixit, U., Manvar, D., Chaturvedi, N., Pandey, V. N. Affinity capture and identification of host cell factors associated with hepatitis C virus (+) strand subgenomic RNA. Molecular Cell Proteomics. 12 (6), 1539-1552 (2013).
- Imig, J., et al. miR-CLIP capture of a miRNA targetome uncovers a lincRNA H19-miR-106a interaction. Nature Chemical Biology. 11 (2), 107-114 (2015).
- Chu, C., et al. Systematic discovery of Xist RNA binding proteins. Cell. 161 (2), 404-416 (2015).
- McHugh, C. A., et al. The Xist lncRNA interacts directly with SHARP to silence transcription through HDAC3. Nature. 521 (7551), 232-236 (2015).
- Rogell, B., et al. Specific RNP capture with antisense LNA/DNA mixmers. RNA. 23 (8), 1290-1302 (2017).
- Matia-Gonzalez, A. M., Iadevaia, V., Gerber, A. P. A versatile tandem RNA isolation procedure to capture in vivo formed mRNA-protein complexes. Methods. , 93-100 (2017).
- Gruber, A. R., Lorenz, R., Bernhart, S. H., Neubock, R., Hofacker, I. L. The Vienna RNA websuite. Nucleic Acids Research. 36 (Web Server issue), W70-W74 (2008).
- Kalendar, R., Khassenov, B., Ramankulov, Y., Samuilova, O., Ivanov, K. I. FastPCR: An in silico tool for fast primer and probe design and advanced sequence analysis. Genomics. 109 (3-4), 312-319 (2017).
- Altschul, S. F., Gish, W., Miller, W., Myers, E. W., Lipman, D. J. Basic local alignment search tool. Journal of Molecular Biology. 215 (3), 403-410 (1990).
- Stiernagle, T. Maintenance of C. elegans. WormBook. , 1-11 (2006).
- Kedde, M., et al. A Pumilio-induced RNA structure switch in p27-3' UTR controls miR-221 and miR-222 accessibility. Nature Cell Biology. 12 (10), 1014-1020 (2010).
- Schumacher, B., et al. Translational repression of C. elegans p53 by GLD-1 regulates DNA damage-induced apoptosis. Cell. 120 (3), 357-368 (2005).
- Ziegeler, G., et al. Embryonic lethal abnormal vision-like HuR-dependent mRNA stability regulates post-transcriptional expression of cyclin-dependent kinase inhibitor p27Kip1. Journal of Biological Chemistry. 285 (20), 15408-15419 (2010).
- Itri, F., et al. Femtosecond UV-laser pulses to unveil protein-protein interactions in living cells. Cellular and Molecular Life Sciences. 73 (3), 637-648 (2016).
- Zhang, L., Zhang, K., Prandl, R., Schoffl, F. Detecting DNA-binding of proteins in vivo by UV-crosslinking and immunoprecipitation. Biochemical and Biophysical Research Communications. 322 (3), 705-711 (2004).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved