Method Article
RNA に基づく誘導多能性幹細胞に主線維芽細胞のプログラムし直す
要約
ここで初期化因子をエンコード変更された Mrna を用いた誘導多能性幹細胞に主線維芽細胞をプログラムし直すための臨床的に関連性の高い、高効率、フィーダー フリー法について述べるし、成熟したマイクロ Rna 367/302 を模倣しています。リプログラミング効率を評価する手法クローン iPSC のコロニーを拡大し、トラ 1 60 多能性マーカーの発現の確認も含まれます。
要約
誘導多能性幹細胞 (Ips) は、発達や病気を研究する貴重なツールであると証明しました。さらに Ips、再生として治療を進める安全、堅牢なと方便のリプログラミング プロトコルが必要です。非統合アプローチを使用して Ips にひと真皮線維芽細胞のリプログラミング非常に高効率のための臨床的に関連性の高い、ステップバイ ステップ プロトコルを紹介します。プロトコルのコアは多能性の要因を表現する、(SOX2、KLF4、cMYC LIN28A、NANOG、OCT4 MyoD 融合)の in vitro転写メッセンジャー Rna 合成からヌクレオチド (変更された Mrna) を変更します。トランスフェクション リプログラミング変更された Mrna は、2 週間の主線維芽細胞成熟胚性幹細胞特異マイクロ Rna-367/302 mimics と共にすべての 48 h に。結果 iPSC 植民地が分離するし、フィーダー無料条件で直接展開できます。RNA のトランスフェクション養生法を含む各種のパラメーターを最適化する線維芽細胞標本全体効率とリプログラミング プロトコルの一貫性を最大化、transfections、培養条件および播種密度のタイミング。重要なは、私たちのメソッドはプログラムし直すことは困難高齢者、病気や老齢のサンプルを含む、ほとんどの線維芽細胞ソースから高品質の Ips を生成します。
概要
誘導多能性幹細胞 (Ips) に体細胞をリプログラミング多能性1,2を維持する上で重要な転写因子のコア セットの拡張表現が必要です。Ips 臨床応用のための生産、処理中に入力セル内変異の負担を最小限に抑える iPSC 生成の効率が比較的高いレベルで患者サンプルの間で維持されることが必要です。ただし、これらのどの限界の臨床的有用性アプローチ3非常に低のリプログラミング効率苦しんでいる無料の統合のプロトコルを含む、メソッドをリプログラミングの大半。リプログラミング効率も選択結果 Ips の変異導入による負担の増加、既存の突然変異を運ぶ細胞のリプログラミングを促進するかもしれません。さらに、すべて DNA に基づくリプログラミング手法、レンチ ウイルスと episomal-ベースのアプローチなどに苦しむ DNA がランダムにゲノムに統合し、有害な挿入変異と不要な (のための機会を作成することの安全性の懸念下流組織誘導体4多能性遺伝子の潜在的発癌性) の式です。
多能性細胞の効率的な誘導を達成し、結果 Ips の変異導入による負担を軽減する有望なアプローチは頂いたメッセンジャー Rna 合成を使用するを含む5をプログラムし直すための核酸塩基 (変更された Mrna) を変更します。変更された mRNA ベースのリプログラミング手法の効率は胚性幹細胞 (ESC) を追加することによりさらに高めることが-特定のマイクロ Rna (Mirna)-367/3023, と体細胞をプログラムし直すために示されている増加効率6 ,7。ただし、miRNAs-367/302 も併用変更リプログラミング mRNA ベースのアプローチはしばしば新鮮単離の患者細胞3アプリケーションで失敗します。この変更された mRNA ベースのアプローチのアドレスの矛盾に我々 は最近報告された高い成功率を持つ人間の一次繊維芽細胞に多能性を誘導する、両方の変更された Mrna のエンコーディングを利用して最適化された、無料の統合戦略リプログラミング因子と成熟 miRNA 367/3028を模倣します。本手法には, カクテル リプログラミングの変更された mRNA には OCT4 MyoD の転写活性化ドメイン (M3O と呼ばれる)9と 5 の他の初期化因子 (SOX2、KLF4、cMYC、LIN28A、NANOG) との融合の修正バージョンが含まれています。Mimics は、miRNA と多能性要因をエンコード変更された mRNA を結合このプロトコルの効率をリプログラミングの相乗効果が登場。RNA 遺伝子導入療法の最適化が追加細胞播種、培養条件と超高レベル8へのアプローチのリプログラミング効率化に必要です。
他の多くのプロトコルとは異なりプログラムし直す取り組み通常のみ数千入力線維芽細胞が必要です。さらに、多く一般的な非統合戦略 episomal プラスミドを用いた、センダイ ウイルス、または RNA の自己複製を含む生成された Ips でリプログラミングのベクトルを希釈する広範な継します。逆に、変更された mRNA と成熟 miRNA mimics 短い半減期を持ってし、細胞から急速に排除されます。一緒に取られて、患者サンプルと使用可能な Ips の世代の収集間累積的な細胞培養時間の量は、このアプローチ、効果的に結果の Ips で突然変異の蓄積を制限し、費用対効果では最小です。
8組合せ変更された mRNA/miRNA ベースのアプローチを使用して Ips に大人のひと線維芽細胞のプログラムし直す高効率を達成するために詳細な手順プロトコルを紹介します。この RNA 基づか初期化プロトコル統合無料 Ips 研究、潜在的な臨床応用を生成するための簡単で低コスト、かつ堅牢なメソッドを提供します。さらに、さまざまな困難な-に-再設定、疾患関連を含む線維芽、老化と老化線維芽細胞のリプログラミングに適用されます。線維芽細胞をプログラムし直すためのプロトコルの概略は図 1に示します。プロトコルは特に形式 6 ウェル プレートでの大人主線維芽細胞の 3 つの井戸をプログラムし直すための方法を説明します。2 つの井戸は通常高品質 iPSC コロニーの十分な数をもたらします。多くの場合も 1 つだけが必要です, と 3 番目もリプログラミング効率の解析に使えます。必要な場合、井戸の数をスケール アップすることができます。
プロトコル
RNase フリーの条件の下で働くし、可能な場合の無菌技術を使用します。生物学的安全キャビネットの無菌技術を使用してのすべての細胞培養関連操作を実行します。ひと細胞での仕事のため制度的バイオ標準に続きます。
1. 試薬および開始をリプログラミングの準備のための機器
- 変更された mRNA にエンコードの初期化因子カクテルを準備します。
- In vitro転写、キャッピングを行い個々 のリプログラミング因子ごとの変更された mRNA の手順を dephosphorylation10以前に公開されたプロトコルに従ってください。最終的な浄化のステップの後ヌクレアーゼ フリー水で変更された mRNA を溶出、1 U/μ L RNase 阻害剤と精製された mRNA ソリューションを補完、分光光度計を使用して修正された Mrna を量的に表わす、-80 ° C で 6 ヶ月保存します。凍結融解サイクルの数を最小限に抑えるためにそれぞれ変更された mRNA の複数の因数を準備します。
注: 変更された mrna 生産がされている類似したプロトコルは別途5,8,11報告。生体外のトランスクリプションのためのテンプレートは、10以前に公開されたプロトコルに従って材料の表に記載されているプライマーを使用して対応するプラスミッドのテンプレートから pcr によって生成できます。各リプログラミング因子のプラスミッドのテンプレート (M3O9SOX2、KLF4、cMYC、NANOG、LIN28A)、mWasabi (transfection のためコントロール) は Addgene、非営利のプラスミッドのリポジトリで利用。 - 一緒に 3:1:1:1:1:1 のモル比で変更されたすべての Mrna を混合 (M3O: SOX2: KLF4: cMYC: NANOG: LIN28A) 10% を含めると mWasabi は、トランスフェクション効率のコントロールとして mRNA を変更します。1 U/μ L RNase 阻害剤を添加したヌクレアーゼ フリー水を追加することにより 100 ng/μ L の最終的な集中にミックスをリプログラミング完全な変更された mRNA の濃度を調整します。7 準備完全の 33 μ 因数変更 mRNA カクテル。混合のリプログラミング因数-80 ° C で保存します。
注: 各の transfection のため 1,000 ウェルあたり変更された mRNA カクテルの ng が追加されます (すなわち3,000 の合計 3 井戸 ng)。各 33 μ L 分注 6 ウェル形式プレートの 3 井戸を使ってサイズし、3 μ L 分注エラーを考慮して余分なボリュームが含まれています。7 つの準備 33 μ 因数は 6 ウェル形式プレート 3 井戸のにおける線維芽細胞のリプログラミングを完了するのに十分な。
- In vitro転写、キャッピングを行い個々 のリプログラミング因子ごとの変更された mRNA の手順を dephosphorylation10以前に公開されたプロトコルに従ってください。最終的な浄化のステップの後ヌクレアーゼ フリー水で変更された mRNA を溶出、1 U/μ L RNase 阻害剤と精製された mRNA ソリューションを補完、分光光度計を使用して修正された Mrna を量的に表わす、-80 ° C で 6 ヶ月保存します。凍結融解サイクルの数を最小限に抑えるためにそれぞれ変更された mRNA の複数の因数を準備します。
- MiRNA の模倣をリプログラミングのカクテルを準備します。
- 凍結乾燥ディゾルブ miRNA 模倣 (Syn-が-ミール-302 a-3 p、Syn-が-ミール-302b-3 p、Syn-が-ミール-302 c-3 p、Syn-が-ミール-302d-3 p, Syn-が-ミール-367-3 p) 1 U/μ L の RNase 阻害剤を添加したヌクレアーゼ フリー水 5 pmol/μ L (5 μ M) の最終的な集中に。各 miRNA 模倣の複数の因数を準備し、長期保存-80 ° C で保存します。
- 5 pmol/μ L (5 μ M) の最終的な集中に 1:1:1:1:1 のモル比ですべての miRNA mimics をミックスします。7 準備 miRNA の 14 μ 因数ミックスを模倣しています。-80 ° C の混合試料を保存します。
注: 各トランスフェクション (すなわち合計 3 井戸 60 pmol) ウェルあたりの miRNA mimics ミックス 20 pmol が追加されます。各 14 μ L 分注 6 ウェル形式プレートの 3 井戸を使ってサイズし、2 μ L 分注エラーを考慮して余分なボリュームが含まれています。7 つの準備 14 μ 因数は 6 ウェル形式プレート 3 井戸のにおける線維芽細胞のリプログラミングを完了するのに十分な。
- 遺伝子導入バッファーを準備します。
- あらかじめ暖かい 500 mL ボトル 1 本と約 2 時間 (RT) 室温新鮮減少血清培地の 100 mL ボトル 1 本。水浴を使用しないでください。
- バイオ セーフティ キャビネットに pH メーターを転送します。ヌクレアーゼ フリー水でメーターのガラス電極を洗います。製造元の指示に従って pH メーターを調整します。ヌクレアーゼ フリー水で再び電極を洗います。
- バイオ セーフティ キャビネットに減少血清中の両方のボトルを転送します。500 ml RT を使って pH を調整します。
- バッファーの pH 計のガラス電極を挿入することによって減少血清中の基本 pH を測定します。メーターに pH を読む前に 1 分を待ちます。
- 減少血清培地 500 mL に 1 M 水酸化ナトリウムの 3-4 mL を追加し、瓶を閉じて、よく混ぜます。PH 測定のためのびんを開く前に最大 5 分を待ちます。バッファーに pH メーターの電極を挿入し、pH メーターの読みが安定するまで待ちます。
- 続けて減少血清培地の pH に達する 8.15-8.17 まで 1 M NaOH の少量を追加します。処理中に数回の pH メーターを調整します。任意の時点で pH は 8.18 より高くなると、予め温めておいた 100 mL ボトル (ステップ 1.3.1) から新鮮な減少血清培地を追加することで減らします。
注: 減少血清培地ベースのトランスフェクション バッファーの pH が重要です。リプログラミングは、トランスフェクション バッファーの pH は約 8.2 ± 0.05 が pH が 8.25 より高い場合が失敗する場合、成功するでしょう。したがって、バッファーの pH に達すると 8.15-8.17 NaOH の追加を停止することをお勧めします。これは、トランスフェクションのバッファーの最終 pH は滅菌後約 8.2-8.22 を保証されます。 - フィルターは、0.22 μ m の真空ろ過システムを用いた遺伝子導入バッファーを殺菌します。因数空気間隔は最小限 5 や 15 mL チューブの滅菌バッファー。
- 4 ° C で最大 3 カ月のトランスフェクション バッファーの因数を格納します。試料の pH を定期的に測定します。PH が 8.25 より高い場合は、試料を破棄します。遺伝子導入バッファーの大気への露出増加バッファーの pH にのみ、2 transfections に分注の使用を制限します。
- 線維芽細胞拡張メディア (FEM) の準備: 10% 牛胎児血清 (FBS)、非本質的なアミノ酸、1 x グルタミン、55 μ M 2-メルカプトエタノール、1 x ペン/連鎖球菌/fungizone x 1 最小必須培。ストア 4 ° C で有限要素法
- リプログラミングのメディアの準備: 20% ノックアウト血清交換 (KOSR)、非本質的なアミノ酸 x 0.5、0.5 x グルタミン、55 μ M 2-メルカプトエタノール、50 μ g/mL アスコルビン酸、1 x ペン/連鎖球菌/fungizone、100 ng/mL bFGF 添加 DMEM/F12 (HEPES なし)、と 200 ng/mL B18R。BFGF と B18R、なしリプログラミングの開始時のメディアの準備、4 ° C で保存1 月の翌月の準備を越えてそれを使わない。各使用の直前にその日使用するため大きさを因数に bFGF と B18R を追加します。
- 5% 熱不活化 (HI) 20% を含有するリプログラミング媒質に FBS を追加してめっきメディアの準備 bFGF と手順 1.5 から B18R なし KOSR。当日使用目的の中の新鮮なを準備します。リプログラミングの 0 日目に使用直前に bFGF と B18R を追加します。
- ハンドヘルド デジタル CO2アナライザーを使用して、製造元の指示に従って初期化を開始する前に、組織文化のインキュベーターを調整します。確実に成功 iPSC 生成低 O2インキュベーター プログラムし直す手順を使用します。
2. リプログラミングの線維芽細胞を培養
- 線維芽細胞リプログラミング (日-2) の開始前に準備をします。
- 5 ml の 0.1% ゼラチンの新しい 10 cm 組織培養プレートをコートします。タップまたは全体の表面をコーティングすることを確保するためプレートを旋回します。37 ° C で 15 分間インキュベートします。ゼラチンを吸引し、有限要素法セット脇 10 mL を追加します。有限要素法を追加する前に乾燥するプレートの塗装面を許可しません。
- 慎重に、繊維芽細胞から使用済み培地を吸引します。残留の血清を削除する DPBS 5 mL で一度セルをすすいでください。トリプシン-EDTA の 3 mL を加えます。セルを介して完全なカバレッジを確保するためプレートがみ合います。
- トリプシンの 〜 500 μ L を残し、余分な水分を吸引します。過剰を吸い出してはいけない、これは乾燥し、繊維芽細胞を殺すことができます。トリプシン-EDTA 37 ° C で 3 分間で線維芽細胞を孵化させなさい
- インキュベーターからプレートを削除し、しっかり、でも優しく、細胞を取り除くためプレートの側面をタップします。顕微鏡下で細胞を確認します。セルは戸建とフローティング、進みます。セルがまだ接続されている場合は、別の 3 分間インキュベートします。
- すぐにリンス/収集トリプシン-EDTA を中和するために有限要素法の 5 mL を使用して剥離細胞。線維芽細胞懸濁液を 15 mL の円錐管に移動します。細胞が十分に混合されたことを確認します。
- 細胞の大きな塊を破るし、診断上それらを数える細胞懸濁液を軽く混ぜます。2.1.1 準備したゼラチン コーティング 10 cm 皿に転送 2.5 x 105細胞。37 ° C、5% CO2加湿の定期的培養インキュベーターで一晩細胞を孵化させなさい。
注: セル密度、リプログラミング効率を達成するために重要な繊維芽細胞が急速に割ると健康的なことが重要です。5セル 2.5 x 10 をメッキ線維芽細胞のほとんどのサンプルの後で 2 日間 40-60% の confluency が得られます。それに応じて量を調整する目的の 40-60% の confluency 後 48 h を達成するために病気や老化細胞の。 - 培地 10 mL の新鮮な有限要素法の翌日 (日-1) に置き換えます。
- (0 日目) のリプログラミングを開始する線維芽細胞をプレートします。
- 40-60% の confluency (図 2は、0 日目) に再プログラムする線維芽細胞があることを確認します。セルの上または下の合流場合、手順 2.1 で繊維芽細胞を通過し、メッキ密度を調整します。別の 2 日間の文化。
- DPBS 4 mL を 15 mL の円錐管に転送します。リコンビナントヒト (rh) ラミニン 521 の 100 μ L を追加します。ピペットの上下に混和します。
- 6 ウェル プレートの 3 井戸に希釈 rhLaminin 521 の井戸あたり 1 ml を追加します。2 h の 37 ° C でコーティングされたプレートを孵化させなさい。
- 有限要素法の 6 mL、4 mL 播種培地を 37 ° C の暖かい100 ng/mL の最終的な集中に bFGF と 200 ng/mL の最終的な集中に B18R メッキ媒体を補足します。
- 慎重に線維芽細胞 (ステップ 2.2.1) から使用済み培地を吸引します。リンスの DPBS の 5 mL の細胞とトリプシン-EDTA の 3 mL を加えます。優しくロック トリプシン-EDTA とセルをカバーするプレート。
- 2.1.3 のステップで実行、トリプシンの 〜 500 μ L のまま、余分な水分を吸引します。トリプシン-EDTA 37 ° C で 3 分間で線維芽細胞を孵化させなさいインキュベーターからプレートを削除し、しっかり、でも優しく細胞を取り除くためプレートの側面をタップします。顕微鏡下で細胞を確認します。セルは戸建とフローティング、進みます。セルがまだ接続されている場合は、別の 3 分間インキュベートします。
- リンス/トリプシン-EDTA を中和するために有限要素法の 5 mL を使用して剥離細胞を収集します。線維芽細胞懸濁液を 15 mL の円錐管に移動します。セルが十分に混合された診断にそれらを数えることを確認します。2.2.4 のステップから prewarmed めっき中の 4 mL ピペット 12,000 セル。
注: はない任意の時点で細胞を遠心分離機します。めっきされたセルの数を調整することができますアップまたはそれぞれまたは高速-成長の遅いラインに必要なダウンします。 - インキュベーターからコーティングのプレートを外し、コーティングされた井戸から希釈 rhLaminin 521 を吸引します。乾燥する井戸の表面は認めません。優しくめっき培地で細胞を再懸濁します。各コーティングに細胞懸濁液の 1 mL をピペットも (すなわち3,000/ウェルの細胞)。
- O2 5% (低 O2) に設定、トライ ガス培養孵卵器にめっきされたセルを配置します。板を設定すると、やさしく、徹底的にはアップ/ダウン、左/右の動きを交互細胞を分散します。モーション 2 回を繰り返します。セルを一晩インキュベートします。ミックス プレートは旋回しません。
- 15 mL の円錐管に媒体をリプログラミングの 4 mL をピペット、一晩平衡に緩めたキャップ低 O2インキュベーター内に置きます。次の日まで bFGF と B18R を追加することはできません。
3. リプログラミング (1 日目) の開始
注: 書き換えが開始されると、日常のメンテナンスは、必要な約 1 ヶ月です。それに応じて計画してください。すべてのそれに続くセル孵化は 37 ° C、5% CO25% O2加湿トライ ガス培養インキュベーター低 O2条件下で行う必要があります。
- めっき中少なくとも 1 トランスフェクション前に h を交換してください。
- 低-O2インキュベーターから平衡リプログラミング メディアを削除します。200 ng/mL の最終的な集中に 100 ng/mL と B18R の最終的な集中に bFGF を追加します。よく混ぜます。
- 1 一度にうまく進める、使用済み培地を取り除き、1 ml のリプログラミング培 bFGF と B18R の交換に 1 mL ピペットを使用します。各ウェルにこれを繰り返します。過度に細胞を乾燥、ストレスを引き起こし、リプログラミング効率が低下、真空吸引を使用しないでください。セル板を低-O2インキュベーターに戻します。
- RNAiMax トランスフェクション試薬変更された mRNA の 1 μ g あたりの 5 μ L で線維芽細胞を transfect、トランスフェクションあたり 1 μ L あたり 6 pmol miRNA のトランスフェクション試薬の模倣します。
注: transfections が 16-20 h に進むときに最適な結果が得られます。トランスフェクション試薬が希釈 10 x;100 ng/μ L が変更された mRNA カクテルは希釈 5 x;ミックスは 5 pmol/μ L miRNA mimics 希釈錯形成する前に遺伝子導入バッファーと 8.33 x。トランスフェクションのセットアップの概要については表 1を参照してください。- ミックス、トランスフェクションを準備する試薬の RNase に対する潜在的な標準的な実験室の練習に従うことによって最小限に抑えます。
- 室温約 1 h のトランスフェクション バッファー (手順 1.3) の因数を平衡します。遺伝子導入バッファーを暖めるは 37 ° C の水浴やインキュベーターを含めないでください。
- 変更された Mrna (33 μ L) の 1 つの因数を取り外し、miRNA は-80 ° C から (14 μ L) を模倣し、解凍まで約 3-5 分の RT にそれらを暖めます。37 ° C で因数で解凍しないでください。それらをスピンを簡単に、および microfuge の。
- 約 3-5 分の RT にトランスフェクション試薬を温めます。37 ° C の水浴やインキュベーターを使用しないでください。2-3 回閉鎖チューブを反転、試薬を混合します。それでスピンダウンすると簡潔に、および microfuge。
- RNase フリーの遠心管に 279 μ RT トランスフェクション バッファーを転送します。31 μ l 添加 310 μ L の最終巻を達成するためにトランスフェクション試薬のピペッティングで徹底的にミックス。ボルテックスにかけないでください。1 分の RT でチューブを孵化させなさい。
注: この希薄トランスフェクション試薬量は複雑な十分な変更された mRNA および miRNA の両方を模倣ステップ 3.2.3 から因数。 - 変更された mRNA の 33 μ 因数に RT トランスフェクション バッファーの 132 μ L を追加します。軽く混ぜてピペット: 最終巻は 165 μ L。
- MiRNA の模倣の 14 μ 因数に RT トランスフェクション バッファーの 102.6 μ L を追加します。軽く混ぜてピペット: 最終巻は 116.6 μ L。
- 165 μ L 希釈するステップ 3.2.5 から希薄化後のトランスフェクション試薬の 3.2.6 のステップからの mRNA の変更を追加します。ミックスするピペット: 最終巻は 330 μ L。
- 3.2.5 のステップからステップ 3.2.7 から希釈した miRNA mimics ミックスに 116.6 μ L 希釈トランスフェクション試薬を追加します。よく混ぜる (最終巻は 233.2 μ L)。変更された Mrna と複雑なトランスフェクション バッファーを許可する常温 15 分間インキュベートし、miRNA を模倣します。
- 低-O2インキュベーターから細胞をプレートを取り外します。100 μ L (1 μ g)、複合の変更各ウェルに mRNA トランスフェクション ミックス滴下井戸全体を追加します。徹底的に攪拌し、アップ/ダウン、左/右の動きと板が軽くによるトランスフェクション錯体を分散させます。ミックス プレートは旋回しません。
- 追加 66.7 μ L (20 pmol) 複合 miRNA mimics トランスフェクション ミックスの各ウェルに滴下、だけに。徹底的に攪拌し、アップ/ダウン、左/右の動きと板が軽くトランスフェクション錯体を分散させます。ミックス プレートは旋回しません。
- O2 5% (低 O2) に設定、トライ ガス インキュベーターに transfected セルを配置します。板を設定すると、一度分散トランスフェクション錯体再び優しく徹底的に攪拌し、アップ/ダウン、左/右の動きと板が。
- 15 mL の円錐管に媒体をプログラムし直すの 4 mL をピペット、一晩平衡に緩めたキャップ低 O2インキュベーター内に置きます。次の日まで bFGF と B18R を追加することはできません。
| 管 1 - RNAiMax 希釈 (1 ミックス) | ||
| 試薬 | 濃度 | ボリューム |
| 遺伝子導入バッファー | 279 Μ L | |
| RNAiMax (追加 2) | 10 倍 | 31 Μ L |
| 合計: 310 μ L | ||
| (1 分室温で孵化させなさい) | ||
| 管 2 - 変更された mRNA ミックス (2 ミックス) | ||
| 試薬 | 濃度 | ボリューム |
| 変更された mRNA ミックス | 100 ng/μ l (5 x) | 33 Μ L |
| 遺伝子導入バッファー | 132 Μ L | |
| 合計: 165 μ L | ||
| (チューブ 1 から希釈 RNAiMax の等量を追加) | ||
| チューブ 3 - miRNA mimics ミックス (3 ミックス) | ||
| 試薬 | 濃度 | ボリューム |
| miRNA 模倣ミックス | 5 pmol/μ L (8.33 x) | 14 Μ L |
| 遺伝子導入バッファー | 102.6 Μ L | |
| 合計: 116.6 μ L | ||
| (チューブ 1 から希釈 RNAiMax の等量を追加) | ||
表 1: トランスフェクション ミックスの準備。
4. Transfections の間にリプログラミング媒体を交換 (2、4、6、8、10、12 日間)
- 3.1.1–3.1.2 で説明したように中 16-20 h 後トランスフェクションを置き換えます。リプログラミング中因数に 200 ng/mL の最終的な集中に 100 ng/mL と B18R の最終的な集中に bFGF を追加します。
- EGFP を視覚化する構成されている顕微鏡を用いた遺伝子導入品質を確認するには、mWasabi 式毎日を監視します。
注: mWasabi 式に最低限 2 日目に判明、各追加のトランスフェクションと明るさを増します。
5-その他-毎日 Transfections (3、5、7、9、11、13 日間)
- 3.2 で説明されているように、トランスフェクションを実行します。トランスフェクションの日に媒体を変更しないでください。
- 媒体をリプログラミングの 4 mL の約数を準備し、次の日に中型の変更の平衡に低 O2インキュベーター。次の日まで bFGF と B18R を追加することはできません。
6. 最終的なトランスフェクション後に実行する手順
- 約から 14 日目まで毎日媒体変更を実行 17 日目。7 mL の培地を 37 ° C をプログラムし直すを暖かく100 ng/mL の最終的な集中に bFGF を追加します。
注: B18R は最終的なトランスフェクション後必要なもはやです。14 日を超えてもはや低 O2インキュベーターで一晩中を平衡に必要としてます。 - 血清ピペットを使用してすべての井戸からメディアを削除します。吸引を使用してを回避し続けます。ウェルあたり bFGF 培をリプログラミングの 2 mL を追加します。
- 17 日と 18 日に反転または解剖顕微鏡の下でプログラムし直された井戸を分析します。コロニーがリプログラミングの高効率化のため互いに近接で形成され、手動で分離することはできない場合は、手順 7 の次に記載されているプログラムし直された井戸のオプション継を実行して植民地を区切ります。植民地もまばらですし十分に分離はステップ 8 および標準のプロトコルによるとサブカルチャー Ips の説明同様に手動で、プログラムし直されたから直接クローンを選択します。
7. オプションの手順: 継 EDTA を用いた再観測井戸からの細胞
- 0.5 M EDTA 原液を希釈して 0.5 mM EDTA DPBS (EDTA) を準備します。フィルターは、0.22 μ m の真空ろ過システムを使用して EDTA を殺菌します。
- 製造元の指示に従ってフィーダー無料多能性幹細胞 (PSC) 媒体 (例えばmTeSR1) を準備します。37 ° c. に PSC 媒体の事前暖かい 32 mL
- 製造元の指示に従って hESC 修飾の細胞外マトリックス (ECM) と 2 つの 6 形式プレートのすべての井戸をコートします。パラフィン フィルム プレートを密封し、室温 1 時間それらを孵化させなさい
- 予め温めておいたプレートから ECM ソリューションを吸引し、ウェルあたり PSC 培地 2 mL に置き換えます。乾燥する井戸の表面は認めません。わきに置きます。
- 植民地が広いと明確に形成されたときの日 2 プログラムし直された井戸からリプログラミング培地を吸引 (通常 18 日)。EDTA と吸引 1 mL で 1 回すすぎます。
- ウェルあたり EDTA の 1 mL を追加します。37 ° C で 4 分間インキュベートします。
- 優しくインキュベーターからプレートを削除し、キャビネット、バイオ セーフティにおけるそれを配置します。
注: この時点で、セル可能性があります非常に緩く付着と簡単に外れてしまい。 - 慎重に両方の井戸から EDTA を吸い出しなさい。EDTA と同様に予め温めておいた PSC 媒体の 3 mL を追加します。優しくは徹底的に両方の井戸から細胞を取り除くため細胞スクレーパーを使用します。
- 血清ピペットを使用して、優しく細胞懸濁液をピペットし、大きな塊を分割します。すべての細胞の塊がなくなるまではピペットないです。IPSC クラスターを保持します。
注: 大きな塊をメッキしても iPSC コロニー伸長、与えません。極端に大きな細胞塊が存在する場合は、単に次の料理にそれらを転送を避けます。 - 血清ピペットを使用して、各 EDTA 処理井戸から細胞の細胞外マトリックス コート 6 ウェル プレートの各ウェルに均等にピペット 0.5 mL を配る。
メモ: プログラムし直された井戸からセル組み合わせて使用しない (すなわち、よく再プログラム 1 は最初 6 ウェル プレートに均等に分散する必要があります、2 番目の 6 ウェル プレートにプログラムし直されたよく 2 を均等に分散する必要があります)。 - めっきされたセルを低-O2インキュベーターに戻します。行ったり来たり、左右にセルを均等に分散、各プレートを振る。旋回はしません。PSC 媒体を毎日交換してください。
8. ピッキング iPSC のコロニー
- 37 ° c. に PSC 媒体の事前暖かい 15 mL製造元の指示に従って hESC 修飾 ECM とシングル 6 ウェル プレートのすべての井戸をコートします。パラフィン フィルムでプレートを密封し、室温 1 時間それらを孵化させなさい
- Ips を収集するために使用されている井戸から培養液を吸い出しなさい。EDTA と吸引 1 mL で 1 回すすぎます。ウェルあたり EDTA の 1 mL を追加します。37 ° C で 4 分間インキュベートします。細胞の培養は、予め温めておいたプレートから ECM ソリューションを吸引、ウェルあたり PSC 培地 2 mL に置き換えます。プレート置いておきます。
- インキュベーターから選択し、キャビネット、バイオ セーフティにおける配置に Ips とプレートを慎重に取り外します。
注: この時点で、セル可能性があります非常に緩く付着と簡単に外れてしまい。 - 慎重に EDTA を吸い出しなさい。非常に穏やかに予め温めておいた PSC 媒体、iPSC のコロニーが外れないように世話の 3 mL を加えます。
- プレートより反転または解離性範囲を視覚化する植民地に移動します。1 mL ピペット滅菌チップを準備します。優しくゆっくりと植民地を収集するために先端に液体を描きながら植民地をこすりするピペット チップを使用して完全に、プランジャーを押し下げます。IPSC コロニーを拾いながら可能な限り小さな媒体として描画します。
- 植民地を転送するには、ピペットの上下に 3-4 回ステップ 8.2 から ECM コーティング プレートの単一の井戸の。6 植民地を選んだおよび個々 の井戸に転送完了するまでを繰り返します。手順 7 で説明したオプション継が実行された場合、任意の単一の井戸から以上 2 コロニーを拾います。
- すべての残りの井戸を凍結する標準的な人間の幹細胞のプロトコルを使用します。解凍し、再凍結する在庫をプレートより多くの植民地を後でピックアップする必要がある場合。
9. Ips の特性
- TRA-1-60 染色リプログラミング効率 (18 日) の分析を実行します。
注: 再プログラム 3 のうち 2 ウェルズは将来コロニーピッ キングの継代します。よく使用することができます残りのトラ-1-60 の汚損のため。研究室のベンチ上にこの手順を実行できます。- 1 mL の PBS でよく、プログラムし直されたを洗い流します。5 分-20 ° C で氷冷メタノールで細胞を固定します。
- メタノールを吸い出しなさい。乾燥約 2 分も過剰が乾燥しないよう注意してください。セル/マット半透明色になるとき十分な乾燥します。
- 穏やかな揺れでの 5 分の 1 mL の PBS とも 3 回洗います。洗浄中、3% 過酸化水素 in PBS の 3 mL を準備します。
- PBS を吸い出しなさい。希釈過酸化水素溶液 2 mL を追加します。穏やかな揺れで室温で 15 分間インキュベートします。ブロッキング溶液 4 mL を準備: PBS で 10% ウシ血清アルブミン (BSA)。
- 過酸化水素溶液を吸引します。5 分の 1 mL の PBS とも 2 回を洗ってください。
- PBS を吸引し、同様に解決を妨げる 2 mL を追加します。室温 1 時間インキュベートします。
- 穏やかな揺れでの 5 分の 1 mL の PBS とも 3 回洗います。
- 0.05% アジ化ナトリウムを添加したブロッキング液で 1: 100 で一次の対策-トラ-1-60 抗体を希釈します。6 ウェル フォーマット皿の 1 の抗体希釈の 1 mL を準備します。井戸の中に抗体希釈を追加し、パラフィルム蒸発を避けるためにプレートをラップします。穏やかな揺れで 4 ° C で一晩インキュベートします。
注: 必要な場合、一次抗体の孵化は穏やかな揺れで常温 1 時間行うことが。一次抗体の希釈は、再 5 回まで使用できます。 - 一次抗体の孵化後、穏やかな揺れでの 5 分の 1 mL の PBS とも 3 回を洗ってください。
- ブロッキング液で 1: 200 で二次抗マウス HRP 標識抗体を希釈します。穏やかな揺れで常温 2 時間二次抗体希釈で井戸を孵化させなさい。
- 二次抗体希釈を吸引し、穏やかな揺れで 5 分の 1 mL の PBS でよく 3 回洗浄します。
- 3 つ目の洗濯の際に製造元の指示に従って基板ソリューションを準備します。最終的な洗浄の後に、PBS を吸い出しなさい。基質溶液 1 mL を追加し、目的の色を開発する (約 10 分) までを孵化させなさい。
- 基板の解決を吸い出しなさい。軽く振りながら 5 分間水と井戸をすすいでください。
- 必要な場合は、コロニーをカウントします。リプログラミング効率 = (コロニー数)/(メッキ線維芽細胞数) x 100%。
- 長期保存のためステンド グラスのプレートからの水を吸引したシールで一晩乾燥板パラフィルムを風乾し、後でリプログラミング効率を評価するためには、2 年間の 4 ° C で保存します。
結果
通常、線維芽細胞リプログラミング Ips (図 1) の最初のバイアルの凍結開始から約 5-6 週間かかります。リプログラミングのプロトコルは、一般的に 2 つのフェーズに分類できます。フェーズ 1 では、線維芽細胞培養と分離、拡張、および iPSC の植民地の特性 7 transfections カクテル リプログラミングの RNA をすべての 48 の h. フェーズ 2 の実行が含まれます。
プロトコルを開始する、前に再プログラムする線維芽細胞が良い品質のものを確保されなければなりません。健康な線維芽細胞は紡錘形、バイポーラ、出現して倍加時間は約 24 時間で屈折します。0 日で日-2 10 cm 皿にメッキ 250,000 の細胞は 40-60% の confluency (図 10 日目) に成長し、約 6-10 x 10 の5セルを生成する必要があります。遅い速度で増殖細胞日-2、リプログラミングの 0 日目に高い密度でのめっきによって補正できます。
線維芽細胞リプログラミングの 6 ウェル フォーマット皿のウェルに非常に疎次めっきが現れます (図 2は、1 日目)。二十四時間の最初のトランスフェクションに続いて線維芽細胞は紡錘形を失い、リプログラミングの残りの部分を介して維持されるより丸みを帯びた形態 (図 22 日目) を採用します。MWasabi から緑色蛍光 mRNA 最小観察 2 日目、4 日目ではっきり見えるように明るさで着実に増加します。MWasabi 蛍光を検出する機能できますスコープの感度とセットアップによって異なります。細胞密度徐々 にかつ一貫して中に拡大する (日 1-6) の最初の 3 つの transfections 日 7 と 8 の間に発生する増殖の明白なバースト。セルは、(図 210 日目) 10 日で主合流になります。最初の iPSC 植民地することができます (図 211 日目) 11 日目には早く表示されます。しかし、植民地は 18 日として遅くまで観測可能なオブジェクトをできません。通常、日 15-18 がある大規模な明白な iPSC コロニー周辺、不完全なプログラムし直された線維芽細胞から明確に区別できる (図 215 日目、図 317 日)。トラ 1 60 多能性マーカーの免疫染色は、(図 317、トラ 1 60 日) リプログラミング効率を評価するために実行できます。私たちの経験ではほとんど線維芽収量当たりの植民地の何百もよく再プログラム (図 3、インセット B)。
準最適めっき密度プロトコル リプログラミングの減らされた効率のための最も一般的な理由し、病気、老化、または高通路線維芽細胞に頻繁に関連付けられています。播種密度が低すぎる場合 (図 4) をリプログラミングの終わりに大規模な無細胞不毛のパッチがあるし、iPSC コロニーがあります (図 4) を形成しません。プログラムし直された細胞は 14 日までに非常に合流する必要があります (図 4 aと4 bを図 2に比較 14 日目)。同様に、セルも密集をめっきまたは余りにすぐに増殖、リプログラミング効率が劇的に減少します。
患者由来の Ips の均質性を維持するために単一コロニーから細胞ラインを拡大することが重要です。リプログラミング効率は私達のプロトコルが非常に高く、近隣の iPSC コロニー近くに形成可能性があり、各別 (図 3、日 15-17) に成長します。クローン性増殖の単一コロニーを機械的に分離するが難しくもなります。我々 は、最初の通路をプログラムし直されたもし、大きな文化圏の間でそれを希釈に便利だ発見しました。良い通過率均等に分割プログラムし直された 6 よく形式プレートも全体の 6 ウェル プレートで構成されます。
次の希釈通路 Ips コロニーとして成長し、線維芽細胞 (図 518 日目) から簡単に区別できます。当初、iPSC のコロニーによって緩く詰まるかもしれない、および個々 のセルがある比較的大きな細胞質領域。4-7 日間にわたって、Ips は増殖し、定義されたエッジを持つ特徴的な密集コロニーを形成します。植民地内の個々 のセルは、小体 (図 522 日目) に大規模な原子力割合を持っています。各井戸を形成する多くの植民地があるはずし、iPSC の古典的な形態でのみ、拡大のため選ばれるべき。
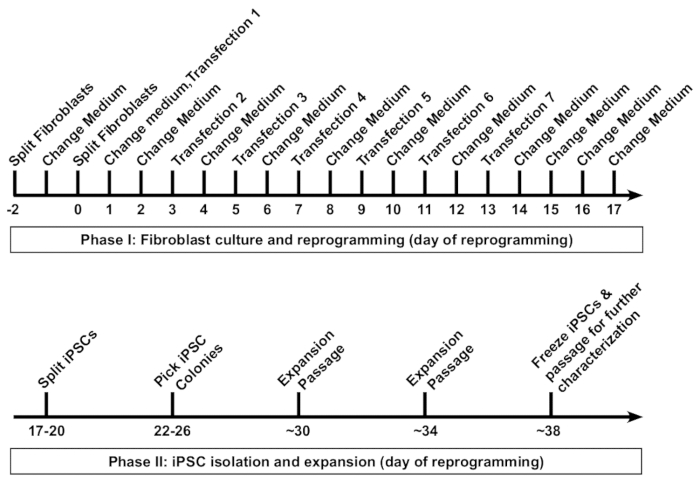
図 1: ひと繊維芽細胞へのリプログラミング誘導多能性幹細胞 (Ips).線維芽細胞のリプログラミングのスケマティック プロトコルが表示されます。線維芽細胞は、最初 6 ウェル フォーマット皿、48 h 間隔で 7 つの transfections に続いてのウェルに低密度で継代します。媒体ごとのトランスフェクション後交換 16-20 h は。プログラムし直された Ips が約一日 18、およびクローンのコロニーで継代最初の日 26 によって選択されます。通常、長期保管の場合、38 日目で iPSC の線維芽細胞由来線を固定できます。この図の拡大版を表示するのにはここをクリックしてください。
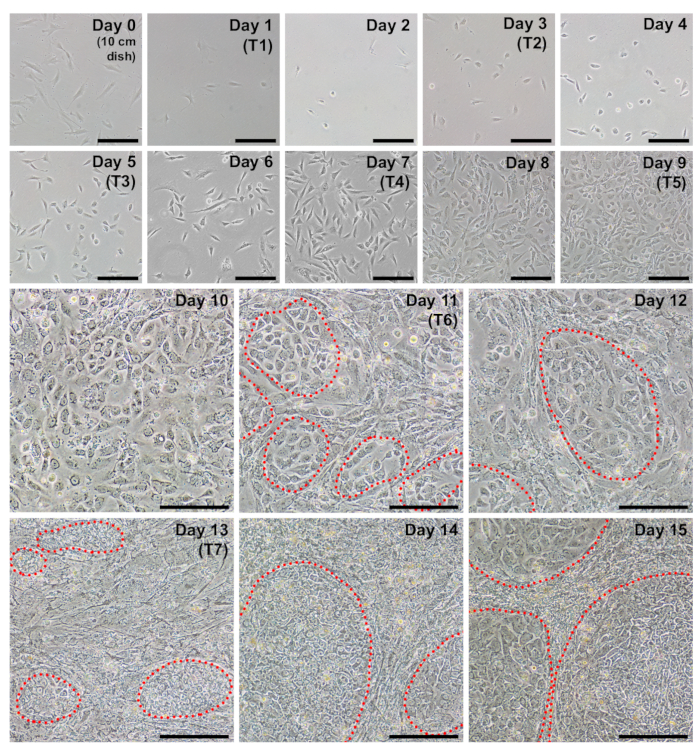
図 2: リプログラミングのそれぞれの日中に代表的な毎日イメージ。線維芽細胞のリプログラミングを開始する通路の時に約 40-60% の合流をする必要があります (日 0、10 cm 皿にメッキパーツを多数細胞)。1 日目で最初のトランスフェクション (T1) が発生して、細胞に非常に疎なが表示されますこの時点で。次の日 (2 日目) より丸みを帯びた形態は明らかになるはずです。セルは、iPSC クラスター (赤丸部分) 11 日目には早くも見えはじめたプロトコル全体密度で増加していきます。15 日までに、iPSC のコロニーは控えめな境界と大きくなります。スケール バー = 200 μ m.この図の拡大版を表示するのにはここをクリックしてください。
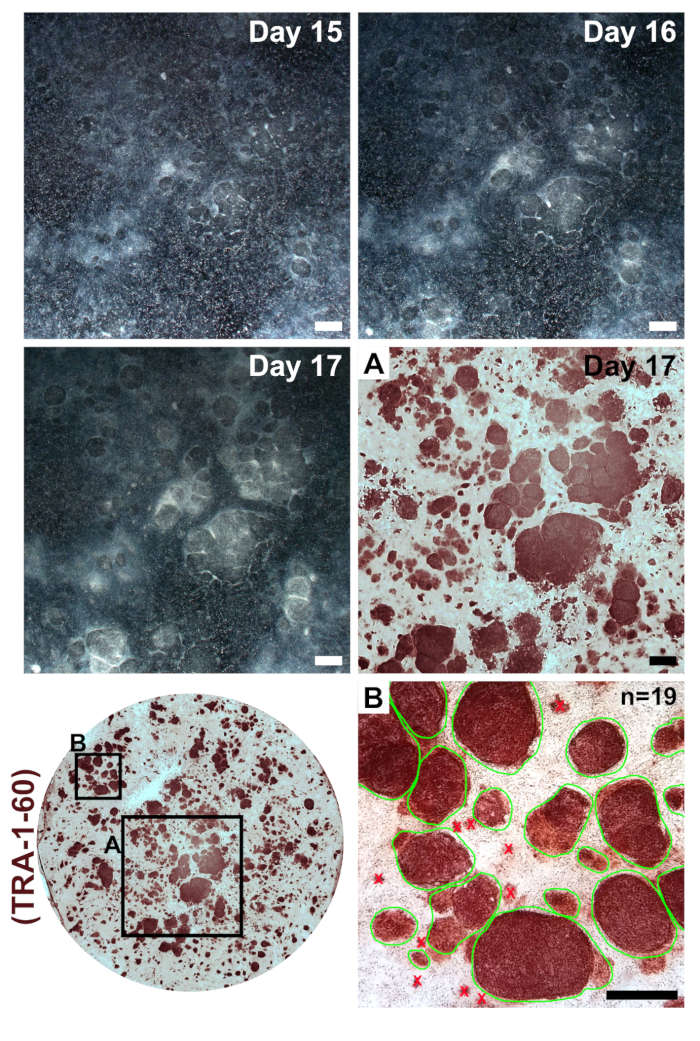
図 3: 次のリプログラミングと transfections コロニー形成変更 Mrna および miRNA を模倣します。低倍率撮影を行った日 15-17 リプログラミング代表。次の最終的なトランスフェクション プログラムし直された Ips 定義された境界のサイズが拡大し、不完全なプログラムし直された周囲線維芽細胞から明確に区別になることを凝縮と明確な植民地が形成されます。トラ 1 60 多能性マーカーの免疫染色は Ips (差込み A) の存在を示す、単一の井戸 (緑線で囲んで可算コロニーの差込み B、例) 内のすべてのコロニーをカウントすることによって効率をリプログラミングの計算に使用することができます。スケール バー = 1 mm.この図の拡大版を表示するのにはここをクリックしてください。
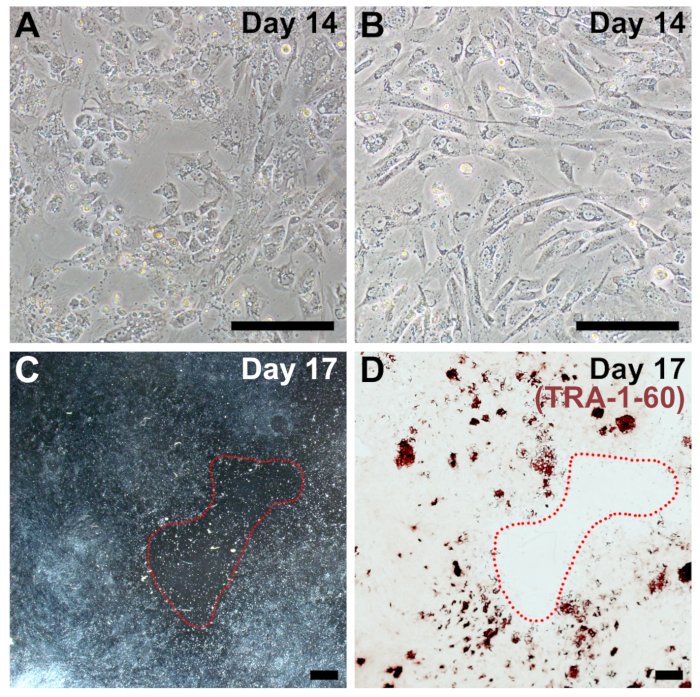
図 4: リプログラミングのサブ最適なめっき密度の代表的なイメージです。(A, B)リプログラミングの 14 日目であまりにもスパースでは線維芽細胞の例 (図 2と比較して 14 日目)。大規模な不毛のパッチでリプログラミングの 17 日 (C) 低倍率のイメージは、赤で囲まれて。(D) 同じ井戸は修正され、トラ-1-60 全体的な貧困層を確認するために染色細胞密度が低いため効率をプログラムし直します。スケール バー = 200 μ m (a, B)、そして 1 mm (C, D)。この図の拡大版を表示するのにはここをクリックしてください。
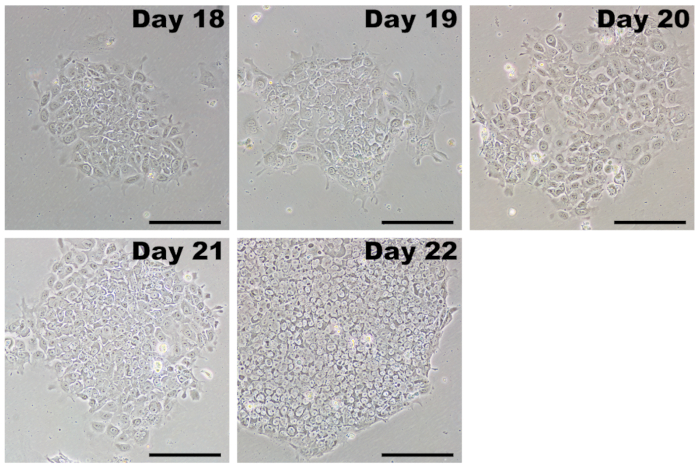
図 5: 初期通過後 Ips の代表的なイメージです。変更された Mrna および miRNA を模倣、プログラムし直された細胞をリプログラミングと transfections を完了した後、日 17-20 で継代します。Ips は PSC 媒体の成長の利点があるし、不完全なプログラムし直され、繊維芽細胞を急速にオーバー テイクします。当初は、Ips は緩い定義が不十分な線で表示されるコロニーを形成します。数日以内、細胞は急速に増殖し、境界は明瞭に植民地にしっかりとクラスタ リング高核・細胞質比の堅く詰められた細胞の特徴的な形態を取る。スケール バー = 200 μ m.この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
このプロトコルでは、通常、疾患に関連するひと線維芽株の超高効率で Ips にプログラムし直すことができます、非統合、RNA に基づく臨床的に関連するメソッドについて説明します。までに、説明プロトコルの再設定を試みたすべてひと繊維芽細胞ライン下流用高品質 Ips の十分な数をもたらした。結果 Ips はすぐに転送し、フィーダー フリー培養条件で展開できます。
線維芽細胞リプログラミングの品質:
成功をプログラムし直す、線維芽細胞の開始の品質に大きく依存。理想的には、リプログラミングは最高の効率を達成するために利用可能な最も低い通路の芽を開始必要があります。2-4 の通路の線維芽細胞をリプログラミング効率お勧めします。リプログラミング扱うことができますまだ高通路 (通路 5-8)、線維芽細胞も老化、とはいえ効率が低下。時々 低通過線維芽細胞が利用できないまたは患者サンプル健全な成長を妨げる遺伝子の突然変異があります。この場合、めっき初期密度の最適化が必要。危険にさらされた線維芽株のリプログラミング、RNA transfections 中細胞死と通常関連付けられます。その結果、プログラムし直すも細胞は、リプログラミングの 10-14 日間で疎であると表示されます。よく表示を無細胞の大部分もされます。これは、場合は、リプログラミングのプロトコルは線維芽細胞の高い初期開始番号を再開始する必要があります。ほとんどの大人の線維芽細胞ラインのための一貫した動作形式 6 皿の井戸あたり 3,000 の入力セルをメッキします。ただし、5,000-10,000 (老齢線 50,000) にめっきの数を増やすことは、前文書8で報告されている疾患に関連するサンプルのリプログラミングを改善を助けるかもしれない。逆に、リプログラミングに耐性に細胞の密度にあまりにも早く到達できます。細胞 Rna をリプログラミングと transfections があまりにも急速に増殖かどうか (主な新生児線維芽細胞の場合は時々)、開始 6 ウェル フォーマット皿8ウェルあたり 500 線維芽細胞のリプログラミング。
遺伝子導入バッファーの処理:
遺伝子導入バッファー (8.2 pH に調整減少血清中) の pH は、このプロトコルをプログラムし直すために必要な最適なトランスフェクションの効率を達成するために重要です。このため、トランスフェクション バッファーの処理に関するいくつかの注意事項はお勧めします。遺伝子導入バッファーの大気への露出も短いバッファーの pH に影響を与えることが分かった.したがって、トランスフェクション バッファーは、最小限の空気スペース (5 または 15 mL スクリュー キャップ円錐管を使用) とスクリュー キャップの容器に検体する必要があります。さらに大気暴露を最小限に抑えるため、2 つの transfections の最大値の各遺伝子導入バッファー分注を使用します。最後に、温度影響 pH 以来トランスフェクション バッファーはトランスフェクションの複合体のアセンブリの RT に平衡するが重要です。暖かいは 37 ° c. にトランスフェクション バッファーをお勧め
Ips の通過。
多くの以前発行プロトコルをお勧めしますリプログラミングの終わりに個々 の iPSC コロニーを拾う、これはリプログラミング効率が非常に高い、または植民地を一緒に、クラスターのケースはよくある場合を達成するために難しいかもしれません、プロトコル。IPSC の植民地が互いに近くにある場合は、まず手動でコロニーを拾う前にプログラムし直された Ips を広げて細胞を継を推奨します。この初期の通路のステップを実行するいくつかの利点があります。植民地に広がるそれらを与える成長するより多くの部屋オリジナルよく達成される可能性がそれ以外の場合よりもはるかに大きいコロニー ピッキングの降伏。選択されたクローンから iPSC ラインを確立することで成功率が大幅に向上します。また、希釈比率ではある線維芽細胞, と追加の培養時間は選んだ iPSC の植民地の平均的な質を改善するために表示を見つけます。不完全なプログラムし直された線維芽細胞フィーダー フリー培養条件への直接移行を和らげるし、Ips を確立するために継続支援のパラクライン因子があります。線維芽細胞は偶然 Ips mTeSR1 で培養した場合と比較して選択成長欠点を持っています。したがって、汚染の線維芽細胞細胞集団はすぐに 3-4 の通路内で取るに足りない量を薄くなります。
Y-27632 など ROCK 阻害薬人間 Ips の日常文化によく使用されます。我々 は、いくつかの iPSC 行 Y-27632 の頻繁におよび/または拡張の文化が全体的な品質に有害な影響を持つことができますを発見しました。メソッドを継塊を使用する場合など、edta、Y-27632 必要はありません分割後 iPSC の生存を維持するために。我々 は完全に iPSC 分離や拡張、ルーチン文化 Y-27632 を補間メディアを排除しています。
プロトコルの制限事項:
説明 RNA に基づくリプログラミング アプローチの 1 つの制限は、初期費用とリプログラミング試薬の調製に伴う複雑さです。試薬すべてのルーチンは、以前されている mRNA を生成する準備手順説明 (PCRの in vitro転写、DNase 処理、キャッピング、脱燐酸化反応、精製)、累積的 mRNA 試薬の生産は比較的長いと非自明なプロセス。この議定書の他の主要な課題は transfect 細胞リプログラミングのプロトコルの労働強度の増加ごとの 48 h に必要です。これらの考慮事項は、のみいくつかの忍耐強いサンプルの書き換えが必要な場合は禁則であるかもしれないです。ただし、主な考慮事項は、臨床的に関連性の高い Ips または非常に高いリプログラミング効率を達成するための世代で説明 RNA 基づか初期化アプローチが理想的です。
要約すると、説明高効率 RNA 基づか初期化メソッドは、私たち以前の文書8に示す再プログラムする体細胞型の最適化されたトランスフェクション効率にかかっています。本研究で提示された RNA のトランスフェクション プロトコル主線維芽細胞のチューニングですが、様々 な体細胞のリプログラミング効率を改善する他の細胞型に合わせて調整することができます潜在的。
開示事項
特許出願「メソッドと組成のリプログラミング細胞」、PCT 出願の権利で共同発明者は、g. b. I.K.PCT/US2016/063258。
謝辞
健康の国民の協会 (T32AR007411-33) やコロラド大学皮膚疾患研究コアセンター (P30AR057212) からの支援を資金調達のために感謝しております。我々 も先天性表皮水疱症 (EB) 研究協力、EB 医療研究財団、治療 EB 慈善、筋ジストロフィー先天性表皮水疱症研究会 (デブラ) 国際、キング ボードウィン財団の Vlinderkindje 基金と感謝ゲートフロンティア基金。
資料
| Name | Company | Catalog Number | Comments |
| Plasmid templates for PCR | |||
| pcDNA3.3_KLF4 | Addgene | 26815 | |
| pcDNA3.3_SOX2 | Addgene | 26817 | |
| pcDNA3.3_c-MYC | Addgene | 26818 | |
| pcDNA3.3_LIN28A | Addgene | 26819 | |
| pCR-Blunt_hM3O | Addgene | 112638 | |
| pCR-Blunt_hNANOG | Addgene | 112639 | |
| pCR-Blunt_mWasabi | Addgene | 112640 | |
| Modified mRNA in vitro transcription and miRNA mimics | |||
| Forward Primer | Integrated DNA Technologies | TTGGACCCTCGTACAGAAGC TAATACG | |
| Reverse Primer (Ordered as ultramer, 4nmol scale) | Integrated DNA Technologies | TTTTTTTTTTTTTTTTTTTTTTTT TTTTTTTTTTTTTTTTTTTTTTTT TTTTTTTTTTTTTTTTTTTTTTTT TTTTTTTTTTTTTTTTTTTTTTTT TTTTTTTTTTTTTTTTTTTTTTTT CTTCCTACTCAGGCTTTATTCA AAGACCA | |
| (ARCA Cap) 3´-0-Me-m7G(5')ppp(5')G | New England Biolabs | S1411S | |
| Pfu Ultra II Hotstart 2x Master Mix | Agilent | 600850-51 | |
| 5-Methylcytidine-5'-Triphosphate | Trilink Biotechnologies | N-1014 | |
| Antarctic Phosphatase | New England Biolabs | M0289L | |
| DNase I | NEB | M0303S | |
| MEGAscript T7 Transcription Kit | ThermoFisher Scientific | AM1334 | |
| Pseudouridine-5'-Triphosphate | Trilink Biotechnologies | N-1019 | |
| Riboguard RNase Inhibitor | Lucigen | RG90910K | |
| RNA Clean & Concentrator | ZymoResearch | R1019 | |
| Syn-hsa-miR-302a-3p miScript miRNA Mimic | Qiagen | MSY0000684 | |
| Syn-hsa-miR-302b-3p miScript miRNA Mimic | Qiagen | MSY0000715 | |
| Syn-hsa-miR-302c-3p miScript miRNA Mimic | Qiagen | MSY0000717 | |
| Syn-hsa-miR-302d-3p miScript miRNA Mimic | Qiagen | MSY0000718 | |
| Syn-hsa-miR-367-3p miScript miRNA Mimic | Qiagen | MSY0000719 | |
| Water (Nuclease free, Not DEPC-treated) | Fisher | AM9937 | Use to dilute modified mRNAs and miRNA mimics |
| Fibroblast culture and reprogramming | |||
| 0.1% Gelatin in H2O | StemCell technologies | #07903 | |
| Stericup-GV Sterile Vacuum Filtration System | EMD Millipore | SCGVU05RE | Use to sterilize the transfection buffer and 0.5 mM EDTA in DPBS |
| 2-Mercaptoethanol | ThermoFisher Scientific | 21985023 | |
| 6-well plates (tissue culture treated) | Corning | 3516 | |
| DMEM/F12 | ThermoFisher Scientific | 11320033 | |
| Fetal Bovine Serum | Fisher | 26-140-079 | |
| FGF Basic | ThermoFisher Scientific | phg0263 | |
| GlutaMax Supplement | ThermoFisher Scientific | 35050061 | Glutamine supplement used for the prepration of media |
| Heat Inactivated FBS | Gibco Technologies | 10438026 | |
| KnockOut Serum Replacement | ThermoFisher Scientific | 10828010 | |
| Lipofectamine RNAiMAX Transfection Reagent | ThermoFisher Scientific | 13778500 | The protocol is optimized for the Lipofectamine RNAiMax transfection reagent |
| MEM | ThermoFisher Scientific | 11095080 | |
| MEM Non-essential amino acids | ThermoFisher Scientific | 11140050 | |
| Opti-MEM I Reduced Serum Medium | ThermoFisher Scientific | 31985070 | Reduced-serum medium, use to make the transfection buffer by adjusting the pH to 8.2, 500 mL |
| Opti-MEM I Reduced Serum Medium | ThermoFisher Scientific | 31985062 | Reduced-serum medium, use to make the transfection buffer by adjusting the pH to 8.2, 100 mL |
| 10 M NaOH | Sigma-Aldrich | 72068 | Make a 1 M solution by diluting in nuclease free water and use for pH adjustment |
| Water (Nuclease free, Not DEPC-treated) | Fisher | AM9932 | Use to dilute NaOH and wash a pH meter |
| Pen/Strep/Fungizone | GE Healthcare | SV30079.01 | |
| rhLaminin-521 | ThermoFisher Scientific | A29248 | Supplied at a concentration of 100 µg/mL, use as a matrix for the reprogramming procedure |
| Dulbecco's phosphate-buffered saline (DPBS) | Life Technologies | 14190144 | |
| Trypsin-EDTA 0.25% Phenol Red | Life Technologies | 2520056 | |
| Vaccinia Virus B18R (CF) | ThermoFisher Scientific | 34-8185-86 | |
| iPSC culture | |||
| Corning Matrigel hESC-Qualified Matrix | Corning | 354277 | Extracellular matrix (ECM) for culturing iPSCs |
| EDTA, 0.5 M stock solution | K&D Medical | RGF-3130 | Dilute to 0.5 mM in DPBS, filter sterilize and use for iPSC passaging |
| mTeSR1 | StemCell Technologies | 85850 | Pluripotent stem cell (PSC) medium, provides growth advantage to iPSCs over fibroblasts |
| Antibodies and Detection | |||
| Rabbit anti Mouse (HRP conjugated) | Abcam | ab97046 | |
| Tra-1-60 (mouse anti human) | Stemgent | 09-0010 | |
| Hydrogen Peroxide (30%) | LabChem | LC154301 | Dilute to 3% with PBS |
| Bovine Serum Albumin (BSA) | Fisher | BP9703100 | |
| Phosphate-buffered salin (PBS) | Hyclone | SH30258.02 | Supplied as 10x, dilute to 1x |
| VECTOR NovaRED Peroxidase Substrate Kit | Vector Laboratories | SK-4800 | |
| Special Equipment | |||
| Description | Notes | ||
| Biological safety cabinet | |||
| Regular humidified tissue culture incubator | Calibrate CO2 using digital meter, fyrite, or equivalent. Equilibrate incubator to 5% CO2, 37 °C. | ||
| Tri-gas humidified tissue culture incubator | Calibrate CO2 using digital meter, fyrite, or equivalent. Equilibrate incubator to 5% CO2, 5% O2, 37 °C. Use for the reprogramming procedure. | ||
| pH Meter | Must have resolution to two decimal places. Designate to RNA work if possible. | ||
| Inverted microscope | Microscope configured to visualize EGFP for monitoring transfection efficiency. |
参考文献
- Takahashi, K., Yamanaka, S. Induction of Pluripotent Stem Cells from Mouse Embryonic and Adult Fibroblast Cultures by Defined Factors. Cell. 126 (4), 663-676 (2006).
- Takahashi, K., et al. Induction of Pluripotent Stem Cells from Adult Human Fibroblasts by Defined Factors. Cell. 131 (5), 861-872 (2007).
- Schlaeger, T. M., et al. A comparison of non-integrating reprogramming methods. Nature Biotechnology. 33 (1), 58-63 (2015).
- Hacein-Bey-Abina, S., et al. LMO2-Associated Clonal T Cell Proliferation in Two Patients after Gene Therapy for SCID-X1. Science. 302 (5644), 415-419 (2003).
- Warren, L., et al. Highly efficient reprogramming to pluripotency and directed differentiation of human cells with synthetic modified mRNA. Cell Stem Cell. 7 (5), 618-630 (2010).
- Judson, R. L., Babiarz, J. E., Venere, M., Blelloch, R. Embryonic stem cell-specific microRNAs promote induced pluripotency. Nature Biotechnology. 27 (5), 459-461 (2009).
- Anokye-Danso, F., et al. Highly efficient miRNA-mediated reprogramming of mouse and human somatic cells to pluripotency. Cell Stem Cell. 8 (4), 376-388 (2011).
- Kogut, I., et al. High-efficiency RNA-based reprogramming of human primary fibroblasts. Nature Communications. 9 (1), (2018).
- Hirai, H., et al. Radical acceleration of nuclear reprogramming by chromatin remodeling with the transactivation domain of MyoD. Stem Cells. 29 (9), 1349-1361 (2011).
- Mandal, P. K., Rossi, D. J. Reprogramming human fibroblasts to pluripotency using modified mRNA. Nature Protocols. 8 (3), 568-582 (2013).
- Avci-Adali, M., et al. In vitro synthesis of modified mRNA for induction of protein expression in human cells. Journal of Visualized Experiments. , e51943 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved