Method Article
인간의 기본 섬유 아 세포의 유도 만능 줄기 세포로 재프로그래밍 RNA 기반
요약
여기 우리 재활 요인 인코딩 수정된 mRNAs를 사용 하 여 유도 만능 줄기 세포로 인간의 기본 섬유 아 세포를 재 설 정할 임상 관련, 높은 효율, 피더 무료 메서드를 설명 하 고 성숙한 예측에 관한-367/302 모방. 또한는 재활 효율성을 평가 하는 방법 클론 iPSC 식민지 확장 및 pluripotency 마커 TRA-1-60의 식을 확인 있습니다.
초록
유도 만능 줄기 세포 (Ipsc)는 인간 개발과 질병을 공부 하는 유용한 도구가 될을 입증 했다. Ipsc를 재생으로 치료를 진행 하 고 더 안전 하 고, 강력한, 및 편법 재활 프로토콜 필요 합니다. 여기, 선물이 Ipsc 비 통합 방식을 사용 하 여에 인간 피부 섬유 아 세포의 매우 높은 효율 프로그래밍에 대 한 임상 관련, 단계별 프로토콜. 프로토콜의 핵심 표현 pluripotency 요인의 구성 (SOX2, KLF4, cMYC, LIN28A, NANOG, OCT4 MyoD 퓨전) 생체 외에서 베낀된 메신저 RNAs를 합성에서 뉴클레오티드 (수정 된 mRNAs) 수정. 재활 수정된 mRNAs는 2 주 동안 기본 fibroblasts 성숙한 배아 줄기 세포 관련 예측에 관한-367/302 모방 함께 모든 48 h에 페. 결과 iPSC 식민지 수 있습니다 다음 격리 되며 직접 급지대 무료 조건에서 확장. 섬유 샘플을 효율성과 우리의 재활 프로토콜의 일관성을 최대화 하려면 우리 RNA transfection 처방을 포함 한 다양 한 매개 변수를 최적화 transfections, 문화 조건 및 시드 밀도의 타이밍. 중요 한 것은, 우리의 메서드는 원본의 대부분 섬유, 어려운 재 병, 세, 또는 노화 샘플을 포함 하 여 높은-품질 Ipsc를 생성 합니다.
서문
유도 만능 줄기 세포 (Ipsc)로 체세포를 재프로그래밍 pluripotency1,2를 유지 하는 중요 한 녹음 방송 요인의 핵심 집합의 확장된 식이 필요 합니다. Ipsc 임상 응용 프로그램에 대 한 생산 때 처리 하는 동안 입력된 셀에 mutational 부담 최소화 및 iPSC 생성의 효율성은 환자 샘플에서 상대적으로 높은 수준에서 유지에 필수적 이다. 그러나, 프로그래밍 통합 무료 프로토콜을 포함 하 여 방법의 대부분은 매우 낮은 재활 효율성, 이러한 제한 임상 유용성 있는 접근3에서 겪고 있다. 낮은 재활 효율 또한 기존 돌연변이, 결과 Ipsc mutational 부담 증가 운반 하는 세포의 선택적 프로그래밍 홍보 수 있습니다. 또한, 모든 DNA 기반 재활, 같은 방법을 lentivirus 및 episomal 기반 접근, DNA 수 있습니다 무작위로 게놈으로 통합 하 고 유해한 insertional mutagenesis와 원치 않는 (에 대 한 기회를 만드는 안전 관심사에서 고통 다운스트림 조직 파생 상품4pluripotency 유전자의 잠재적으로 종양) 식입니다.
유망한 접근 pluripotency 체세포에서의 효율적인 유도 달성 하 고 결과 Ipsc mutational 부담을 줄이기 위해 합성 출장된 메신저 RNAs를 사용 하는 nucleobases (수정 된 mRNAs)5프로그래밍에 대 한 수정 포함. 수정 된 mRNA 기반 재활 접근의 효율성은 배아 줄기 세포 (ESC)를 추가 하 여 더 강화 될 수 있다-특정 microRNAs (miRNAs)-367/302s3체세포와 함께 프로그램을 표시 되었습니다 증가 효율6 ,7. 그러나, miRNAs-367/302s의 추가 함께 수정된 mRNA 기반 재활 접근은 종종 갓 격리 환자 세포3응용 프로그램 중 실패합니다. 이 수정 된 mRNA 기반 방식의 주소 불일치, 하 우리는 최근 보고 pluripotency 높은 성공률과 함께 인간의 기본 fibroblasts에 유도 하 고 인코딩 두 수정 된 mRNAs를 활용 하는 최적화 된, 통합 무료 전략 프로그래밍 요소와 성숙한 미르-367/3028을모방 합니다. 우리의 방법에 칵테일 재활 수정된 mRNA OCT4 MyoD transactivation 도메인 (M3O 라는)9 와 다른 5 개 재활 요인 (SOX2, KLF4, cMYC, LIN28A, 및 NANOG) 융합의 수정된 된 버전을 포함 합니다. 미르와 pluripotency 요인 인코딩 수정된 mRNA 결합 모방 프로그래밍이 프로토콜의 효율성에 시너지 효과가 나타났다. RNA transfection 처방의 추가 최적화 셀 시드, 그리고 자란 조건 했다 또한 초고 레벨8에 접근의 재활 효율성을 증가 하는 데 필요한.
다른 많은 프로토콜 달리 재활 접근에만 몇 천 입력된 fibroblasts를 일반적으로 필요합니다. 또한, 많은 일반적인 비 통합 전략 episomal 플라스 미드를 사용 하 여, 센다이 바이러스, 또는 각자 복제 RNA 포함 광범위 한 재활 벡터 생성된 Ipsc에 희석을 뿌리고. 반대로, 수정 된 mRNA와 성숙한 미르 모방 짧은 반감기를가지고 빠르게 셀에서 제거 됩니다. 함께 찍은 환자 샘플 및 사용 가능한 Ipsc의 세대 수집 사이 누적 셀 문화 시간이이 접근, 효과적으로 결과 Ipsc 돌연변이 축적을 제한 하 고 비용 효율성 개선에서 최소 이다.
여기, 우리는 Ipsc 우리의 조합 수정된 mRNA/miRNA 기반 접근8를 사용 하 여에 성인 인간 섬유 아 세포의 재프로그래밍 하는 높은 효율을 달성 하기 위해 자세한 단계별 프로토콜을 제시. 이 RNA 기반 재활 프로토콜 연구와 잠재적인 임상 응용 프로그램에 대 한 통합 무료 Ipsc를 생성 하기 위한 비용 효율적인, 간단 하 고 강력한 방법을 제공 한다. 또한, 그것은 세, 그리고 노화 섬유 아 세포 등 어려운-하-재, 질병 관련 된 섬유 아 세포 라인의 다양 한의 프로그래밍에 적용 됩니다. 인간 섬유 아 세포를 재 프로그램에 대 한 프로토콜의 회로도 그림 1에 표시 됩니다. 프로토콜은 특별히 인간 성인 기본 섬유 아 세포 형식 6-잘 접시에서의 3 개의 우물을 프로그래밍 하는 방법을 설명 합니다. 두 웰 스는 일반적으로 높은-품질 iPSC 식민지의 충분 한 수 양보. 많은 경우에, 단 하나 잘 필요한 이며 세 번째 잘 프로그래밍 효율 분석에 사용할 수 있습니다. 필요한 경우에 우물의 수 확장할 수 있습니다.
프로토콜
RNase 무료 조건 하에서 작동 하 고 가능 하면 무 균 기술을 사용 하 여. 생물학 안전 장은 무 균 기술을 사용 하 여 모든 셀 문화 관련 조작을 수행 합니다. 인간의 세포와 작업에 대 한 기관 biosafety 표준을 따릅니다.
1. 시 약 및 초기화 프로그래밍의 준비를 위한 장비
- 수정 mRNA 칵테일 인코딩 재활 요소를 준비 합니다.
- 이전에 게시 프로토콜10 생체 외에서 전사, 상한, 수행 하 고 각 수정된 mRNA 인코딩 개별 재활 요소에 대 한 절차를 dephosphorylation에 따라. 마지막 정화 단계 후 nuclease 무료 물으로 수정 된 mRNA elute 하 고, 순화 수정된 mRNA 솔루션 1 U / µ L RNase 억제제 보충 하 고, 분 광 광도 계를 사용 하 여 수정 된 mRNAs를 quantitate 한-80 ° C에서 최대 6 개월까지 저장. Freeze-thaw 주기 수를 최소화 하기 위해 각 수정 된 mRNA의 여러 aliquots를 준비 합니다.
참고: 수정 된 mRNA 생산 되었습니다에 대 한 유사한 프로토콜 보고 다른 곳5,,811. 10이전 게시 된 프로토콜 따라 재료의 테이블에 에서 나열 된 뇌관을 사용 하 여 해당 플라스 미드에서에서 PCR 증폭에 의해 생체 외에서 전사에 대 한 서식 파일을 생성할 수 있습니다. 각 재활 요소에 대 한 플라스 미드 템플릿 (M3O9, SOX2, KLF4, cMYC, NANOG, LIN28A) 및 mWasabi (transfection에 대 한 제어) Addgene, 비영리 플라스 미드 저장소에서에서 사용할 수 있습니다. - 3:1:1:1:1:1의 어 금 니 비율에서 모든 수정 된 mRNAs를 함께 믹스 (M3O: SOX2: KLF4: cMYC: NANOG: LIN28A) 10%를 포함 하 고 mWasabi transfection 효율에 대 한 제어로 mRNA를 수정. 완전 한 수정된 mRNA nuclease 무료 물 보충 1 U / µ L RNase 억제제를 추가 하 여 100 ng / µ L의 최종 농도에 믹스를 프로그래밍의 농도 조정 합니다. 7 준비 완료의 33 µ L aliquots 수정 mRNA 칵테일. -80 ° c.에서 혼합된 재활 aliquots 저장
참고: 각 transfection에 대 한 1000 수정된 mRNA 칵테일의 ng 잘 당 추가 됩니다 (즉, 총 3000 ng 3 웰 스에 대 한). 각 33 µ L aliquot 형식 6 잘 플레이트의 3 우물 transfect 크기는 pipetting 오류를 초과 볼륨의 3 µ L를 포함 한다. 7을 준비 하는 것은 33 µ L aliquots 6-잘 형식 접시에서 3 우물의 전체 섬유 프로그래밍을 완료 하는 데 충분 하다.
- 이전에 게시 프로토콜10 생체 외에서 전사, 상한, 수행 하 고 각 수정된 mRNA 인코딩 개별 재활 요소에 대 한 절차를 dephosphorylation에 따라. 마지막 정화 단계 후 nuclease 무료 물으로 수정 된 mRNA elute 하 고, 순화 수정된 mRNA 솔루션 1 U / µ L RNase 억제제 보충 하 고, 분 광 광도 계를 사용 하 여 수정 된 mRNAs를 quantitate 한-80 ° C에서 최대 6 개월까지 저장. Freeze-thaw 주기 수를 최소화 하기 위해 각 수정 된 mRNA의 여러 aliquots를 준비 합니다.
- MiRNA 모방 프로그래밍의 칵테일을 준비 합니다.
- 디졸브 동결 건조 된 미르 모방 (Syn-는-미르-302a-3 p, Syn-는-미르-302b-3 p, Syn-는-미르-302 c-3 p, Syn--미르-302d-3 p, Syn--미르-367-3 p) nuclease 무료 물 보충 RNase 억제제의 1 U / µ L에에서 5 pmol / µ L (5 µ M) 최종 농도에. 각 미르 모방의 여러 aliquots를 준비 하 고 장기 저장을 위한-80 ° C에서 저장.
- 5 pmol / µ L (5 µ M)의 최종 농도에 1:1:1:1:1 어 금 니 비율에서 모든 miRNA 모방을 혼합. 7 준비는 miRNA의 14 µ L aliquots 모방 믹스. -80 ° c.에서 혼합된 aliquots를 저장
참고: 각 transfection 미르 모방 믹스의 20 pmol 잘 (즉, 총 3 웰 스에 대 한 60 pmol) 당 추가 됩니다. 각 14 µ L aliquot 형식 6 잘 플레이트의 3 우물 transfect 크기는 pipetting 오류를 초과 볼륨의 2 µ L를 포함 한다. 7 준비 14 µ L aliquots 6-잘 형식 접시에서 3 우물의 전체 섬유 프로그래밍을 완료 하는 데 충분 하다.
- Transfection 버퍼를 준비 합니다.
- 미리 따뜻한 한 500 mL 병 및 실 온 (RT) 약 2 시간에 대 한 신선한 감소-혈 청 매체의 한 100 mL 병. 물 목욕을 사용 하지 마십시오.
- Biosafety 캐비닛을 pH 미터를 전송. 미터의 유리 전극 nuclease 무료 물으로 씻는 다. 제조업체의 지침에 따라 pH 미터 보정. 전극 nuclease 무료 물으로 다시 씻는 다.
- Biosafety 캐비닛에 감소-혈 청 매체의 두 병을 전송 합니다. 500 mL RT 병을 사용 하 여 pH를 조정.
- 감소-혈 청 매체의 기본 pH 유리 전극 pH 미터의 버퍼에 삽입 하 여 측정 합니다. PH 미터에 읽기 전에 최대 1 분을 기다립니다.
- 감소 된 혈 청 매체의 500 mL로 3-4 mL의 1 M NaOH 추가 병, 닫고 잘 섞어. PH 측정을 위한 병을 열기 전에 최대 5 분 기다리십시오. PH 미터의 전극 버퍼에 삽입 하 고 pH 미터에 읽기 안정화 될 때까지 기다립니다.
- 계속 감소-혈 청 매체의 pH 8.15-8.17에 도달할 때까지 1 M NaOH의 작은 볼륨을 추가 합니다. 여러 번 과정에서 pH 미터를 보정. 어떤 시점에서 pH 8.18 보다 더 높은 되 면, 미리 데워 진된 100 mL 병 (1.3.1 단계)에서 신선한 감소-혈 청 매체를 추가 하 여 그것을 줄일.
참고: 감소-혈 청 매체에 기초를 둔 transfection 버퍼의 pH이 중요 합니다. 프로그래밍 됩니다 성공적인 경우 transfection 버퍼의 pH 약 8.2 ± 0.05 pH는 8.25 보다 높은 경우 실패할 수 있습니다. 따라서 버퍼의 pH에 도달 하면 8.15-8.17 NaOH 추가 중지 하는 것이 좋습니다. 이렇게 하면 transfection 버퍼의 최종 pH는 약 8.2-8.22 사용 하 여 살 균 후. - 필터는 0.22 μ m 진공 여과 시스템을 사용 하 여 transfection 버퍼 소독. 약 5 또는 15 mL 튜브 최소한의 공기 공간 소독된 버퍼 수.
- 4 ° c.에 최대 3 개월까지 transfection 버퍼의 aliquots를 저장 aliquots의 pH를 정기적으로 측정 합니다. PH는 8.25 보다 높은 경우는 aliquots을 삭제 합니다. 대기 공기에 노출의 transfection 버퍼는 버퍼의 pH를 증가 하는 때문에 2 transfections aliquot 사용을 제한 합니다.
- 구와 확장 매체 (FEM) 준비: 10% 태아 둔감 한 혈 청 (FBS), 1 x 1 x 펜/strep/fungizone, 55 μ M 2-mercaptoethanol, 1 x 글루타민 보충, 비필수 아미노산으로 보충 하는 최소 필수 매체. 4 ° c.에 FEM을 저장
- 재활 매체 준비: DMEM/F12 (HEPES) 20% 녹아웃 혈 청 (KOSR), 비 본질적인 아미노산 x 0.5, 0.5 x 글루타민 보충, 55 μ M 2-mercaptoethanol, 50 µ g/mL 의약품, 1 x 펜/strep/fungizone, 100 ng/mL bFGF와 보충 그리고 200 ng/mL B18R. BFGF와 B18R, 없이 프로그래밍의 개시에 매체를 준비 하 고 4 ° c.에 그것을 저장합니다 준비 1 달 넘어 그것을 사용 하지 마십시오. 그 날의 사용에 대 한 크기는 약 수를 각 사용 직전 bFGF와 B18R를 추가 합니다.
- 5% 열 비활성화 (HI) 20%를 포함 하는 재활 매체로 FBS 추가 하 여 도금 매체를 준비 KOSR bFGF와 B18R 단계 1.5에서에서 하지 않고. 사용 당일 중간 신선한을 준비 합니다. 하루 0 프로그래밍에 사용 직전 bFGF와 B18R를 추가 합니다.
- 휴대용 디지털 공동2 분석기를 사용 하 여 제조업체의 지침에 따라 프로그래밍을 시작 하기 전에 조직 문화 인큐베이터를 보정. 재활 단계에 대 한 낮은-O2 인큐베이터를 사용 하 여 성공적인 iPSC 생성 되도록.
2. 프로그래밍에 대 한 섬유 아 세포 배양
- (하루-2) 프로그래밍의 개시 전에 fibroblasts을 준비 합니다.
- 0.1% 젤라틴의 5 mL와 함께 새로운 10 cm 조직 배양 플레이트 코트. 탭 또는 전체 표면 코팅 되도록 접시 소용돌이. 37 ° c.에 15 분 동안 품 어 젤라틴을 발음 하 고 따로 FEM. 세트의 10 mL를 추가 합니다. FEM.를 추가 하기 전에 건조 하 판의 코팅된 표면을 허용 하지 않습니다
- 신중 하 게에 섬유 아 세포에서 보낸된 중간 발음. 잔여 혈 청을 제거 하는 DPBS의 5 mL로 한 번 셀 린스. 트립 신-EDTA의 3 mL를 추가 합니다. 부드럽게 셀에 완전 한 범위를 보장 하기 위해 접시 바위.
- ~ 500 µ L의 트립 신을 떠나 초과 하는 액체, 발음 -발음 하지 마십시오,이 건조 하 고는 섬유 아 세포를 죽 일 수 있습니다. 트립 신-EDTA 37 ° c.에서 3 분으로 섬유 아 세포를 품 어
- 인큐베이터에서 접시를 제거 하 고 단단히 하지만 부드럽게 누릅니다 셀을 꺼내 접시의 측면. 현미경의 밑에 있는 셀을 확인 합니다. 세포 분리 및 부동 인 경우 진행 합니다. 세포는 여전히 연결 되어 있다면, 다른 3 분 동안 품 어.
- 신속 하 게 린스/수집 트립 신-EDTA 무력화 FEM의 5 mL을 사용 하 여 분리 된 셀. 섬유 아 세포 현 탁 액 15 mL 원뿔 튜브로 이동 합니다. 잘 혼합 셀 인지 확인 합니다.
- 부드럽게 혼합 셀의 큰 덩어리를 휴식 하는 hemocytometer 그들을 의지할 세포 현 탁 액. 2.1.1 단계에서 준비 된 젤라틴 코팅 10 cm 접시로 전송 2.5 x 105 셀. 37 ° C, 5% CO2 습도 일반 조직 문화 인큐베이터에서 하룻밤 셀을 품 어.
참고: 셀 밀도는 섬유 아 세포는 건강 하 고 빠르게 나누어 중요 한 재활 고효율 달성에 중대 하다. 2.5 x 10 도금5 셀 40-60 %confluency 2 일 후 대부분 섬유 샘플에 대 한 생성 합니다. 그에 따라 금액 조정 달성 하기 원하는 40-60% confluency 48 h 후에 질병 또는 노화 세포에 대 한. - 다음 날 (day-1) 10 mL 신선한 FEM의와 매체를 교체 합니다.
- (0 일) 프로그래밍을 시작 하려면 fibroblasts 접시
- 40-60 %confluency (그림 2, 0)에서 fibroblasts 재설정을 확인 합니다. 셀 이상-또는-합칠 경우, 단계 2.1에에서 설명 된 대로 섬유 아 세포를 통과 하 고 따라 도금 밀도 조정 합니다. 또 다른 2 일 동안 문화입니다.
- 15 mL 원뿔 튜브로 DPBS의 4 mL를 전송 합니다. 재조합 형 인간 (rh) laminin-521의 100 µ L를 추가 합니다. 아래로 철저 하 게 혼합 플라스틱.
- 6 잘 플레이트의 3 우물에 희석된 rhLaminin-521의 당 1 ml를 추가 합니다. 2 h 37 ° C에서 코팅된 접시를 품 어.
- FEM의 고 37 ° c.를 중간 도금의 4 mL 6 mL 따뜻한 100 ng/mL의 최종 농도에 bFGF와 B18R 200 ng/mL의 최종 농도에 도금 매체를 보충.
- 신중 하 게 섬유 아 세포 (단계 2.2.1)에서 보낸된 중간 발음. 린스 DPBS의 5 mL로 세포를 트립 신-EDTA의 3 개 mL를 추가. 부드럽게 트립 신-EDTA와 셀 커버 플레이트 바위.
- 2.1.3 단계에서 완료 ~ 500 µ L의 트립 신, 떠나 초과 하는 액체, 발음 트립 신-EDTA 37 ° c.에서 3 분으로 섬유 아 세포를 품 어 인큐베이터에서 접시를 제거 하 고 단단히 하지만 부드럽게 누릅니다 셀을 꺼내 접시의 측면. 현미경의 밑에 있는 셀을 확인 합니다. 세포 분리 및 부동 인 경우 진행 합니다. 세포는 여전히 연결 되어 있다면, 다른 3 분 동안 품 어.
- 린스/트립 신-EDTA를 무력화 FEM의 5 mL을 사용 하 여 분리 된 세포를 수집 합니다. 섬유 아 세포 현 탁 액 15 mL 원뿔 튜브로 이동 합니다. 셀 잘 혼합 되는 hemocytometer 그들을 의지할 확인 하십시오. 2.2.4 단계에서 prewarmed 도금 매체의 4 mL를 피펫으로 12000 셀.
참고: 언제 든 지 세포를 원심 하지 마십시오. 도금 된 셀의 수를 조정할 수 있습니다 또는 각각 느린 또는 빠른-성장 라인에 대 한 필요에 따라 아래로. - 인큐베이터에서 코팅된 접시를 제거 하 고 코팅된 우물에서 희석된 rhLaminin-521 발음. 건조 우물의 표면을 허용 하지 않습니다. 부드럽게 도금 매체에 셀 resuspend. 각 코팅 셀 서 스 펜 션의 1 mL를 플라스틱 잘 (즉, 3000 잘 당 세포).
- 도금된 셀을 O2 5% (낮은 O2)로 설정 된 트라이 가스 조직 문화 인큐베이터에 넣으십시오. 접시 설정 되 면 부드럽게 하지만 철저 하 게 분산 셀 위/아래 마우스 왼쪽/오른쪽 동작을 교대로 하 여. 동작 2 번 더 반복 합니다. 셀을 밤새 품 어. 섞어 접시를 소용돌이 친다 하지 마십시오.
- 15 mL 원뿔 튜브를 프로그래밍 4 mL를 플라스틱 그리고 equilibrate 하룻밤에 불린된 모자와 낮은 O2 인큐베이터에 배치. 다음 날까지 bFGF와 B18R를 추가 하지 마십시오.
3. 프로그램을 다시 만들 (주 1)의 개시
참고:는 프로그래밍 시작 되 면 일일 유지 관리는 필요한 약 1 개월. 적절 하 게 계획 해야 합니다. 모든 후속 셀 외피는 37 ° C, 5% CO2, 5% O2 습도 트라이-가스 조직 문화 인큐베이터에서 낮은 O2 조건 하에서 수행 되어야 합니다.
- 도금 매체 적어도 transfection 이전 h 1을 교체 합니다.
- 저 O2 인큐베이터에서 equilibrated 재활 매체를 제거 합니다. BFGF 200 ng/mL의 최종 농도를 100 ng/mL 및 B18R의 최종 농도에 추가 합니다. 잘 믹스.
- 한 번에 잘 1 proceeding 보냈다 매체를 제거 하 고 재활 매체 bFGF와 B18R 보충의 1 mL를 1 mL 피 펫을 사용 합니다. 각 잘이 반복 합니다. 지나치게 셀 건조, 스트레스, 원인과 재활 효율 감소는 진공 포부를 사용 하지 마십시오. 낮은-O2 인큐베이터에 셀과 접시를 다시 이동 합니다.
- 수정 된 mRNA의 1 µ g 당 RNAiMax transfection 시 약의 5 µ L로 fibroblasts transfect 그리고 미르의 6 pmol 당 transfection 시 약의 1 µ L 당 transfection 모방.
참고: 최적의 결과 얻을 수 있습니다 transfections 16-20 h에 대 한 진행. Transfection 시 약은 희석된 10 x; 100 ng / µ L 수정된 mRNA 칵테일은 희석 5 배; 그리고 믹스 5 pmol / µ L 미르 모방 희석 complexation 이전 transfection 버퍼 8.33 x. Transfection 설치 요약 표 1 을 참조 하십시오.- 믹스는 transfection를 준비 하는 동안 표준 실험실 연습에 따라 RNase에 노출 시 약의 가능성을 최소화 합니다.
- Transfection 버퍼 (1.3 단계) 실시간에서 약 1 시간에 대 한의 약 수를 equilibrate Transfection 버퍼를 따뜻하게 하는 37 ° C 물 목욕 또는 인큐베이터를 사용 하지 마십시오.
- 수정 된 mRNAs (33 µ L)의 단일 약 수를 제거 하 고 미르-80 ° c에서 (14 µ L)를 모방 하 고 따뜻한 그들 rt 약 3-5 분, 해 동 때까지. 37 ° c.에 aliquots 해 동 하지 마십시오 스핀 들 아래로 짧게는 microfuge에.
- 약 3-5 분 rt transfection 시 따뜻한. 37 ° C 물 목욕 또는 인큐베이터를 사용 하지 마십시오. 반전 닫힌된 관 2-3 시간 시 약을 혼합. 스핀 그것 아래로 짧게는 microfuge에.
- RNase 무료 microcentrifuge 튜브에 RT transfection 버퍼의 279 µ L를 전송 합니다. 31 µ L 310 µ L의 최종 볼륨을 달성 하기 위해 transfection 시 약의 추가 pipetting으로 철저 하 게 믹스. 와 동 하지 마십시오. 1 분에 대 한 실시간에 튜브를 품 어.
참고:이 희석된 transfection 시 약의 볼륨이 충분 한 복잡 한 수정 된 mRNA와 미르 모방 단계 3.2.3에서에서 aliquots. - 수정 된 mRNA의 33 µ L 약 수를 RT transfection 버퍼의 132 µ L를 추가 합니다. 부드럽게 혼합 플라스틱: 최종 볼륨은 165 µ L.
- MiRNA 모방의 14 µ L 약 수를 RT transfection 버퍼의 102.6 µ L를 추가 합니다. 부드럽게 혼합 플라스틱: 최종 볼륨은 116.6 µ L.
- 추가 하는 희석 단계의 3.2.5 희석된 transfection 시 약의 165 µ L 단계 3.2.6에서에서 mRNA를 수정 합니다. 피 펫 혼합: 최종 볼륨은 330 µ L.
- 3.2.5 단계에서 단계의 3.2.7 희석된 미르 모방 믹스 희석된 transfection 시 약의 116.6 µ L를 추가 합니다. 잘 믹스 (최종 볼륨은 233.2 µ L). 수정 된 mRNAs와 복잡 한 transfection 버퍼 수 있도록 RT에서 15 분 동안 품 어와 미르 모방.
- 저 O2 인큐베이터에서 세포와 플레이트를 제거 합니다. 100 µ L (1 µ g)는 complexed의 mRNA transfection 혼합 각 잘 잘 걸쳐 dropwise 수정 추가 합니다. 철저 하 게 위/아래 마우스 왼쪽/오른쪽 모션 접시 agitating 하지만 부드럽게 여 transfection 단지 분산. 섞어 접시를 소용돌이 친다 하지 마십시오.
- 추가 66.7 µ L (20 pmol) complexed 미르 모방 transfection 믹스의 각 음에 dropwise 잘 통해. 철저 하 게 위/아래 마우스 왼쪽/오른쪽 모션 접시 agitating 하지만 부드럽게 여 transfection 단지 분산. 섞어 접시를 소용돌이 친다 하지 마십시오.
- O2 5% (낮은 O2)로 설정 된 트라이 가스 인큐베이터에 transfected 세포를 놓습니다. 접시 설정 되 면 분산 transfection 단지 다시 여 부드럽게 철저 하 게 위/아래 마우스 왼쪽/오른쪽 모션 접시를 교 반 하지만.
- 15 mL 원뿔 튜브로 매체를 프로그래밍 4 mL를 플라스틱 그리고 equilibrate 하룻밤에 불린된 모자와 낮은 O2 인큐베이터에 배치. 다음 날까지 bFGF와 B18R를 추가 하지 마십시오.
| 튜브 1-RNAiMax 희석 (1 일 믹스) | ||
| 시 약 | 농도 | 볼륨 |
| Transfection 버퍼 | 279 Μ L | |
| RNAiMax (추가 2) | 10 배 | 31 Μ L |
| 총: 310 µ L | ||
| (실 온에서 1 분을 품 어) | ||
| 튜브 2-수정된 mRNA 믹스 (믹스 2) | ||
| 시 약 | 농도 | 볼륨 |
| 수정 된 mRNA 믹스 | 100 ng / µ l (5 배) | 33 Μ L |
| Transfection 버퍼 | 132 Μ L | |
| 총: 165 µ L | ||
| (튜브 1에서 같은 양의 희석된 RNAiMax 추가) | ||
| 튜브 3-미르 모방 믹스 (3 믹스) | ||
| 시 약 | 농도 | 볼륨 |
| miRNA 모방 믹스 | 5 pmol / µ L (8.33 x) | 14 Μ L |
| Transfection 버퍼 | 102.6 Μ L | |
| 총: 116.6 µ L | ||
| (튜브 1에서 같은 양의 희석된 RNAiMax 추가) | ||
표 1: 준비 transfection 혼합 합니다.
4. 대체 프로그램을 다시 만들 매체 Transfections 사이 (2, 4, 6, 8, 10, 그리고 12 일)
- 3.1.1–3.1.2에 설명 된 대로 중간 16-20 h 후 transfection를 교체 합니다. BFGF 재활 중간 aliquots로 200 ng/mL의 최종 농도를 100 ng/mL 및 B18R의 최종 농도에 추가 합니다.
- MWasabi 식 매일 EGFP 시각화 하도록 구성 하는 현미경을 사용 하 여 transfection 품질 확인 모니터링 합니다.
참고: mWasabi 식 최소한 명백한 하루에 2와 있어야 각 추가 transfection와 밝기에 증가 합니다.
5. 기타-매일 Transfections (3, 5, 7, 9, 11, 및 13 일)
- 3.2 단계에서 설명한 대로 transfection를 수행 합니다. Transfection의 일에 매체를 변경 하지 마십시오.
- 매체를 프로그래밍 4 mL 약 수를 준비 하 고 다음 날에 매체 변화에 대 한 equilibrate를 낮은 O2 인큐베이터에 배치. 다음 날까지 bFGF와 B18R를 추가 하지 마십시오.
6. 최종 Transfection 후 수행 하는 절차
- 약에서 하루 14 통해 매일 매체 변경 작업을 수행 일 17. 따뜻한 매체 37 ° c 프로그래밍 7 mL BFGF 100 ng/mL의 최종 농도에 추가 합니다.
참고: B18R는 더 이상 필요한 최종 transfection 후. 이상의 14, 그것은 더 이상 낮은 O2 인큐베이터에서 하룻밤 매체를 equilibrate 하는 데 필요한입니다. - 혈 청 학적인 피 펫을 사용 하 여 모든 우물에서 매체를 제거 합니다. 포부를 사용 하지 않는 것 계속 합니다. 프로그래밍을 잘 당 bFGF와 보충 하는 매체의 2 개 mL를 추가 합니다.
- 17, 18 일에 거꾸로 또는 해 현미경 재설정된 우물을 분석 합니다. 식민지는 프로그래밍의 높은 효율으로 인해 서로 게 가까운 근접에서 형성 되 고 수동으로 격리 수 없습니다, 경우 재설정 우물 아래 7 단계에 설명 된 선택적 뿌리고 수행 하 여 식민지를 구분 합니다. 표준 프로토콜에 따라 subculture Ipsc 단계 8에서 설명 하는 대로 잘 식민지 스파스과 잘 분리 된 경우, 수동으로 재설정에서 직접 클론 선택.
7. 선택적 절차: 뿌리고 EDTA를 사용 하 여 재설정 우물에서 셀
- 0.5 M EDTA 재고 솔루션을 diluting 하 여 0.5 m EDTA DPBS (EDTA)를 준비 합니다. 필터는 0.22 μ m 진공 여과 시스템을 사용 하 여 EDTA 소독.
- 제조업체의 지침에 따라 피더 무료 만능 줄기 세포 (PSC) 매체 (예: mTeSR1)을 준비 합니다. 37 ° c PSC 매체의 미리 따뜻한 32 mL
- 제조업체의 지침에 따라 hESC 한정 된 세포 외 기질 (ECM)와 두 형식 6-잘 접시의 모든 웰 스 코트. 파라핀 영화 판 및 실시간에서 1 시간에 대 한 그들을 품 어
- 미리 데워 접시에서 ECM 솔루션을 발음 하 고 잘 당 PSC 매체의 2 mL와 함께 그것을 대체. 건조 우물의 표면을 허용 하지 않습니다. 그들을 따로 설정 합니다.
- 식민지는 크고 명확 하 게 형성 된 날에 2 재설정된 우물에서 재활 중간 발음 (일반적으로 하루 18). EDTA와 aspirate의 1 mL와 함께 한 번 헹 구 십시오.
- 잘 당 EDTA의 1 mL를 추가 합니다. 37 ° c.에 4 분 동안 품 어
- 부드럽게 인큐베이터에서 접시를 제거 하 고 캐비닛는 biosafety에 배치.
참고:이 시점에서, 셀 수 있습니다 매우 느슨하게 준수 하 고 쉽게 빠질 수 있습니다. 있습니다 - 신중 하 게 두 우물에서 EDTA 발음. EDTA로 잘 치료 각각 미리 따뜻하게 PSC 매체의 3 mL를 추가 합니다. 셀-스 크레이 퍼를 사용 하 여 부드럽게 하지만 철저 하 게 꺼내 두 우물에서 셀.
- 혈 청 학적인 피 펫을 사용 하 여 부드럽게 플라스틱 세포 현 탁 액 및 큰 대단히 짧은 시간을 휴식. 모든 셀 덩어리 사라 때까지 플라스틱 하지 않습니다. IPSC 클러스터 유지 합니다.
참고: 큰 덩어리를 도금 미치지 않습니다 iPSC 식민지 파생물. 지나치게 큰 세포 덩어리 있다면 단순히 다음 그릇에 그들을 전송 하지 마십시오. - 혈 청 학적인 피 펫을 사용 하 여 균등 하 게 분산 각 EDTA 치료 잘에서 셀 하면 pipetting 0.5 mL ECM 코팅 6 잘 플레이트의 각 음에.
참고: 재설정된 우물에서 세포를 결합 하지 마십시오 (즉, 잘 재설정 1 첫 번째 6 잘 플레이트에 균등 하 게 배포 해야 하 고 재설정된 잘 2 두 번째 6 잘 플레이트에 균등 하 게 배포 해야 합니다). - 저 O2 인큐베이터에 도금된 셀을 다시 이동 합니다. 균일 하 게 배포 셀, 뒤로-및-앞뒤와 측면 각 접시를 흔들어. 소용돌이 친다 하지 마십시오. 매일 PSC 매체를 교체 합니다.
8. 따기 iPSC 식민지
- 37 ° c PSC 매체의 미리 따뜻한 15 mL 제조업체의 지침에 따라 하는 hESC 한정 ECM와 단일 6 잘 플레이트의 모든 우물을 코트. 파라핀 영화 판 및 실시간에서 1 시간에 대 한 그들을 품 어
- Ipsc를 수집 하는 데 사용 되는 우물에서 문화 매체 발음 EDTA와 aspirate의 1 mL와 함께 한 번 헹 구 십시오. 잘 당 EDTA의 1 mL를 추가 합니다. 37 ° c.에 4 분 동안 품 어 셀은 잠복기 동안 미리 데워 접시에서 ECM 솔루션을 발음 하 고 잘 당 PSC 매체의 2 개 mL를 바꿉니다. 플레이트를 따로 설정 합니다.
- 부드럽게 Ipsc 인큐베이터에서 고른 수 고에 biosafety 캐비닛에 접시를 제거 합니다.
참고:이 시점에서, 셀 수 있습니다 매우 느슨하게 준수 하 고 쉽게 빠질 수 있습니다. 있습니다 - EDTA는 신중 하 게 발음. 아주 부드럽게 iPSC 식민지를 꺼내 려 하지 않도록 주의 복용 미리 따뜻하게 PSC 매체의 3 mL를 추가 합니다.
- 식민지를 시각화 하는 접시를 거꾸로 또는 해 범위를 이동 합니다. 1 mL 피 펫 멸 균 팁을 준비 합니다. 플런저를 완벽 하 게, 우울 다음 부드럽게 천천히 식민지 수집을 끝으로 액체를 그리는 동안 식민지를 긁어 피 펫 팁을 사용 합니다. IPSC 식민지를 따기 동안 가능한 작은 매체로 그립니다.
- 식민지를 전송 하려면 플라스틱 아래로 3-4 회에 단계 8.2 ECM 코팅 접시의 단일 잘. 6 식민지 선택 되어 개별 우물으로 전송 될 때까지 반복 합니다. 수행는 선택적 뿌리고 7 단계에서 설명한 어떤 단일 우물에서 2 개 이상의 식민지를 선택 합니다.
- 표준 인간 줄기 세포 프로토콜을 사용 하 여 모든 나머지 우물 아래로 동결. 해 동 하 고 다시 더 많은 식민지 나중에 선택 해야 하는 경우 냉동된 주식을 판.
9입니다. Ipsc의 특성
- TRA-1-60 얼룩 프로그래밍 효율 (18 일)의 분석을 수행 합니다.
참고: 2 중 3 재설정된 웰 스는 미래의 식민지 따기 위해 passaged. 나머지 잘 사용할 수 있는 TRA-1-60 얼룩에 대 한. 실험실 벤치 정상에이 절차를 수행할 수 있습니다.- 워시 1 mL의 PBS로 잘는 재설정. 5 분 동안-20 ° C에서 얼음 처럼 차가운 메탄올을 가진 셀을 수정 합니다.
- 메탄올 발음 건조 약 2 분에 대 한 잘 될 지나치게 건조 하지 않도록 주의 하십시오. 셀 반투명/매트 색상 되기 때 충분히 건조 했습니다.
- 부드러운 진동으로 5 분 동안 1 mL의 PBS로 잘 3 회 씻는 다. 세척, 동안 3 mL PBS에 3%의 과산화 수소의 준비.
- PBS 발음 희석된 과산화 수소 솔루션의 2 개 mL를 추가 합니다. 부드러운 진동으로 RT에 15 분 동안 품 어. 4 mL 차단 솔루션의 준비: 10% 소 혈 청 알 부 민 (BSA) PBS에.
- 과산화 수소 솔루션 발음 5 분 동안 1 mL의 PBS로 잘 2 번 씻는 다.
- PBS를 발음 하 고 우물에 솔루션을 차단의 2 개 mL를 추가 합니다. 실시간에서 1 시간에 품 어
- 부드러운 진동으로 5 분 동안 1 mL의 PBS로 잘 3 회 씻는 다.
- 0.05% 나트륨 아 지 드와 함께 보충 차단 솔루션에서 1: 100에서 기본 안티-TRA-1-60 항 체 희석. 형식 6-잘 접시의 1에 대 한 항 체 희석의 1 mL를 준비 합니다. 우물에 항 체 희석을 추가 하 고 증발을 피하기 위해 parafilm으로 접시를 포장. 부드러운 진동으로 4 ° C에서 밤새 품 어.
참고: 지금까지 필요한 경우에 1 차적인 항 체를 가진 외피 부드러운 떨고와 RT에 1 시간에 할 수 있습니다. 1 차적인 항 체 희석 다시 5 번까지 사용할 수 있습니다. - 1 차적인 항 체를 가진 외피, 후 1 mL의 PBS로 잘 3 번 부드러운 진동으로 5 분 동안 세척.
- 보조 반대로 마우스 HRP 활용 된 항 체에 차단 솔루션에서 1: 200 희석. 부드러운 진동으로 RT에서 2 h에 대 한 2 차 항 체 희석으로 잘 품 어.
- 이차 항 체 희석 발음 하 고 부드러운 떨고와 5 분 동안 1 mL의 PBS로 잘 3 번 씻어.
- 세 번째 세척 중 기판 솔루션 제조 업체의 지시에 따라 준비 합니다. 최종 세척 후 PBS 발음. 기판 솔루션의 1 mL을 추가 하 고 원하는 색상 개발 (약 10 분)까지 품 어.
- 기판 솔루션 발음 부드럽게 진동 하는 동안 5 분 물으로 잘을 헹 구 십시오.
- 원하는 경우, 식민지를 계산 합니다. 프로그래밍 효율 = (식민지의 수) / (도금된 섬유 아 세포의 수) x 100%.
- 장기 저장을 위한 물 묻은 접시에서 발음 하 고 하룻밤 말린된 플레이트 parafilm와 실시간 도장에 건조 후 재활 효율성을 평가 하기 위해 2 년까지 4 ° C에서 저장.
결과
그것은 일반적으로 섬유 Ipsc (그림 1)의 첫 번째 튜브의 동결을 프로그래밍의 개시에서 약 5-6 주 걸립니다. 재활 프로토콜은 일반적으로 두 단계로 분류할 수 있습니다. 단계 1 구와 문화를 포함 하 고 7 transfections, 칵테일 재활 RNA와 모든 48 h. 단계 2 수행 포함 절연, 확장, 및 iPSC 식민지의.
프로토콜을 시작 하기 전에 좋은 품질의 재설정을 섬유 아 세포는 보장 되어야 합니다. 스핀 들-모양, 바이 폴라, 건강 fibroblasts 나타납니다 그리고 대략 24 h의 2 배 시간 refractile. 하루 0, 하루-2에 10 cm 그릇에 도금 하는 250000 셀 40-60 %confluency (그림 1, 0)에 성장 하 고 약 6-10 105 셀 x 항복 한다. 느린 속도로 증식 하는 세포-2 당일 및 하루 0 프로그래밍에 더 높은 밀도에서 도금에 의해 보상 될 수 있습니다.
섬유 아 세포의 프로그래밍에 대 한 6-잘 형식 요리에 매우 스파스 다음 도금 나타납니다 (그림 2, 1 일). 24 시간 첫 번째 transfection fibroblasts 스핀 들 모양을 잃게 되며 프로그래밍의 나머지를 통해 유지 되는 더 둥근된 형태 (그림 2, 주 2)을 채택. MWasabi에서 녹색 형광 mRNA 최소한 하루에 2 관찰할 수 고 꾸준히 하루에 4에 의해 명확 하 게 표시 되도록 밝기 증가 해야 합니다. MWasabi 형광을 감지 하는 능력 범위 민감도 설정에 달려 있습니다. 셀 밀도 점차적으로 그리고 지속적으로 증가 (일 1-6), 처음 세 개의 transfections에 걸쳐 확산 일 7과 8 사이 발생에 명백한 버스트와 함께. 셀 (그림 2, 10 일째) 10 일에 의해 크게 confluent 나타납니다. 첫 번째 iPSC 식민지 하루 11 (그림 2, 하루 11); 일찍 나타날 수 있습니다. 그러나, 식민지 하루 18 늦게까지 관찰을 않을 수 있습니다. 일반적으로, 15-18 일 있을 것입니다 명확 하 게 다른 주변, 불완전 하 게 재설정된 섬유 아 세포는 크고 분명 iPSC 식민지 (하루 15,그림 2, 그림 3, 17 일). Pluripotency 마커 TRA-1-60에 대 한 Immunostaining (그림 3, 하루 17, TRA-1-60) 재활 효율성을 평가 하기 위해 수행할 수 있습니다. 우리의 경험에서는, 대부분의 섬유 라인은 잘 재설정 수백 당 식민지 항복 (그림 3, 삽입 B).
차선의 도금 밀도 우리의 프로토콜 프로그래밍의 감소 효율성에 대 한 가장 일반적인 이유 이며, 질병, 노화, 및 높은 통과 하는 섬유 아 세포와 자주 관련입니다. 밀도 도금 하는 것이 너무 낮은 경우 큰 acellular 불모의 패치 (그림 4C), 프로그래밍의 끝에 있을 것입니다 그리고 iPSC 식민지 (그림 4D)를 형성 하지 않을 수 있습니다. 하루 14 매우 confluent 재설정된 셀 해야 한다 ( 그림 4A 와 4B 그림 2, 비교 주 14). 마찬가지로, 세포는 밀도가 너무 도금 또는 너무 빨리 증식, 프로그래밍 효율은 극적으로 감소.
환자 파생 Ipsc의 동질성을 유지 하려면 그것은 하나의 식민지에서 셀 라인을 확장 하는 것이 중요입니다. 효율을 프로그래밍 하는 것이 우리의 프로토콜에 매우 높은 때문에 가까운 근접에서 형성 하 고 각 다른 (그림 3, 15-17 일)으로 성장 수 있습니다 이웃 iPSC 식민지. 이 때로는 어렵게 기계적으로 클론 확장에 대 한 단일 식민지를 분리 합니다. 우리는 그것이 첫 번째 통로 재설정 잘 및 더 큰 문화의 영역에 걸쳐 희석 하는 데 도움이 나타났습니다. 좋은 통행 비율 전체 6 잘 플레이트에서 잘 재설정된 6 잘 포맷 접시를 균등 하 게 분할 이루어져 있다.
희석 통로 따라 Ipsc 식민지로 성장 하 고 섬유 아 세포 (그림 5, 하루 18)에서 쉽게 구별할 수 있습니다. 처음, iPSC 식민지는 느슨하게 포장 될 수 있습니다, 그리고 개별 세포는 비교적 큰 세포질 영역. 4-7 일 동안는 Ipsc 격 증 하 고 정의 된 가장자리와 특성 단단히 포장 식민지를 형성 한다. 식민지 내에서 개별 셀 (그림 5, 하루 22) 저명한 nucleoli는 큰 핵 부분이 있다. 많은 식민지에 각 잘 형성 해야 하 고 고전적인 iPSC 형태 들만 확장에 대 한 선택 해야 합니다.
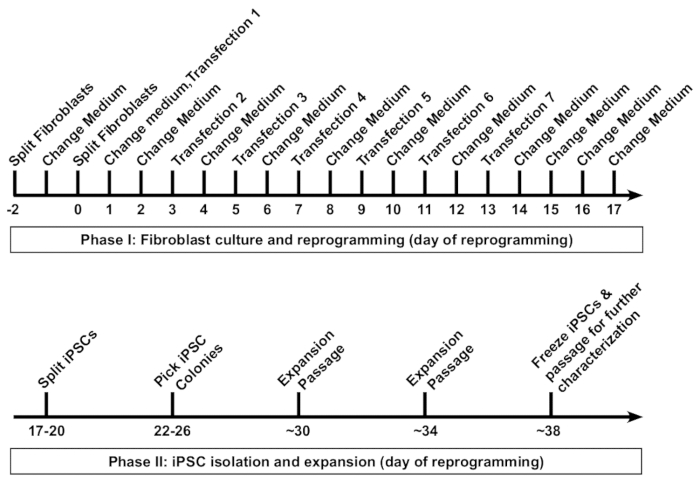
그림 1 : 프로그래밍으로 인간의 섬유 아 세포의 유도 만능 줄기 세포 (Ipsc). 인간 섬유 아 세포의 프로그래밍에 대 한 도식 프로토콜 제공 됩니다. 섬유 아 세포는 먼저 7 transfections 48 h 간격으로 수행 하 여 다음 형식 6-잘 접시의 우물에 낮은 밀도에서 passaged. 보통은 각 transfection 후 대체 16-20 h. 재설정된 Ipsc는 약 하루에 18, 그리고 클론 식민지에 passaged 처음 하루 26에 의해 선택 됩니다. 일반적으로, 섬유 아 세포 파생 iPSC 라인 장기 보관을 위해 하루 38 동결 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
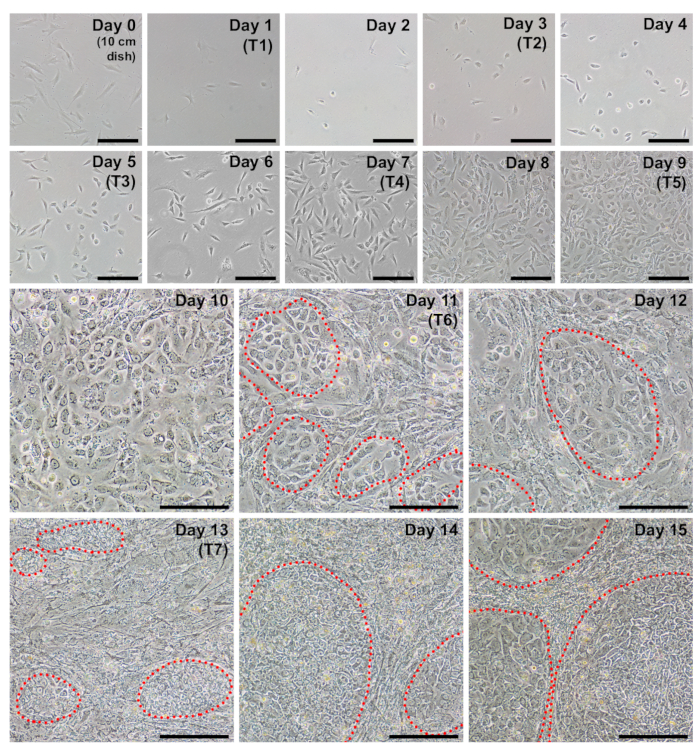
그림 2 : 프로그래밍의 각 하루 동안 대표 매일 이미지. 섬유 아 세포는 프로그래밍을 시작 하는 통행의 때에 약 40-60% 합칠 이어야 한다 (0, 세포는 10 cm 접시에 도금). 하루에 1, 첫 번째 transfection (T1) 발생 하 고 셀이 시점에서 매우 희박 나타납니다. 다음 날 (2 일), 더 둥근된 형태는 명백한 될 것입니다. 셀 빠르면 하루 11 (빨간색에서 동그라미)에 표시 하기 시작 하는 iPSC 클러스터와 프로토콜을 통해 밀도 증가 나갈 것입니다. 하루 15, iPSC 식민지 신중 경계와 큰 있을 것입니다. 눈금 막대 = 200 µ m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
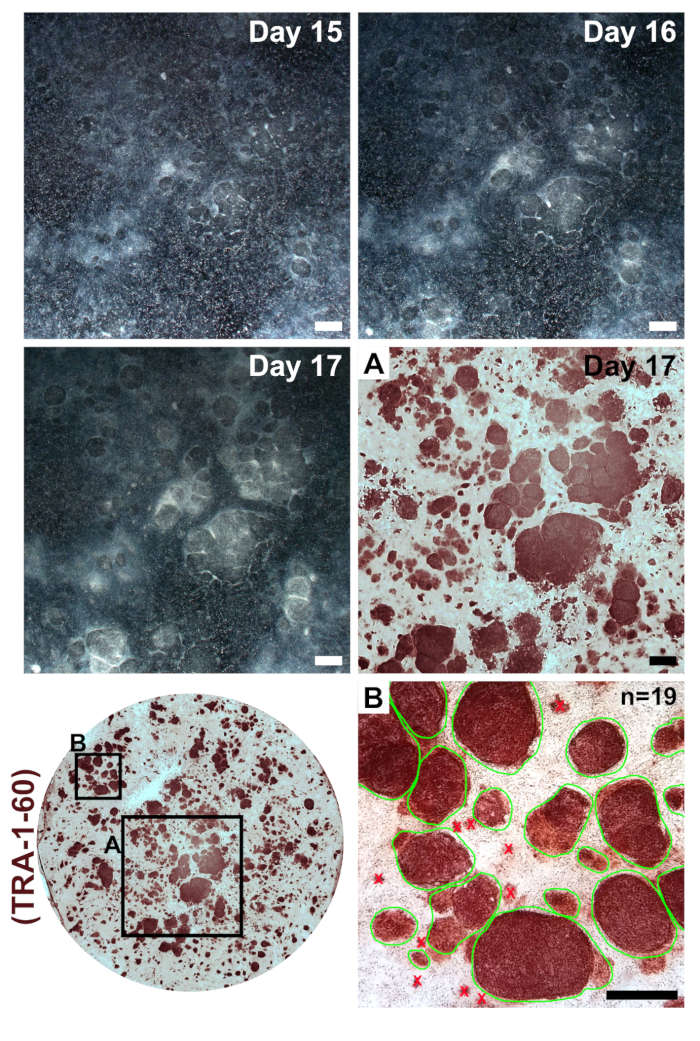
그림 3 : 식민지 형성 프로그래밍으로 transfections를 다음 수정 mRNAs와 미르 모방. 낮은 확대 이미지 대표 일 15-17에 프로그래밍의 촬영 했다. 최종 transfection 다음 재설정된 Ipsc는 크기에서 확장 하 고 불완전 하 게 재설정된 주변 fibroblasts에 명확 하 게 구별 될 응축 하는 정의 된 경계와 명확한 식민지를 형성할 것 이다. Pluripotency 마커 TRA-1-60에 대 한 Immunostaining Ipsc (인세트 A)의 존재를 표시 하 고 단일 잘 (녹색에서 동그라미 수 식민지의 인세트 B, 예) 내 모든 식민지를 계산 하 여 효율성을 프로그래밍의 계산에 사용할 수 있습니다. 눈금 막대 = 1 m m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
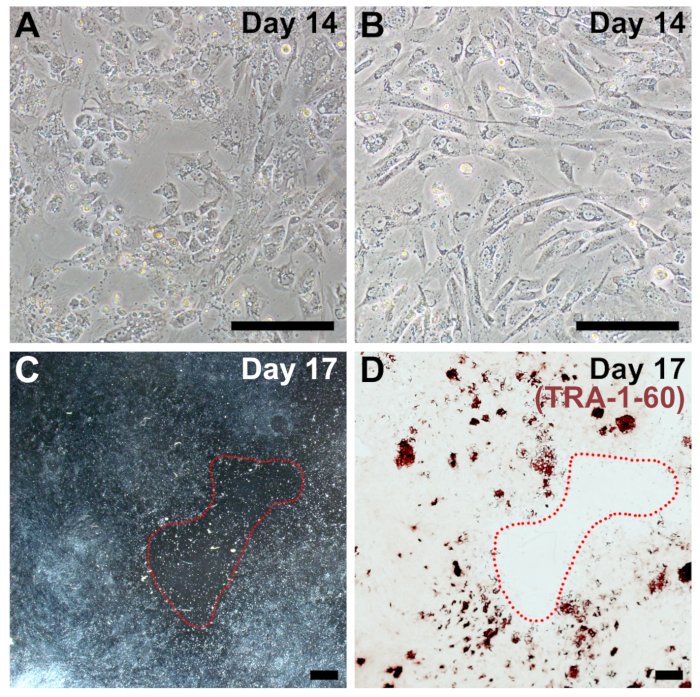
그림 4 : 프로그래밍에 대 한 최적의 도금 밀도의 대표 이미지. (A, B) 프로그래밍의 14 일까 너무 스파스는 섬유 아 세포의 예 ( 그림 2, 비교 주 14). (C) 낮은 확대 이미지 큰, 불모의 패치 프로그래밍의 하루 17에 빨간색으로 동그라미. (D) 같은 잘 고정 되었고 TRA-1-60 전반적인 가난한 것인지에 대 한 스테인드 프로그래밍 효율 낮은 세포 밀도 때문. 스케일 바 = 200 µ m (A, B), 그리고 1 m m (C, D). 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
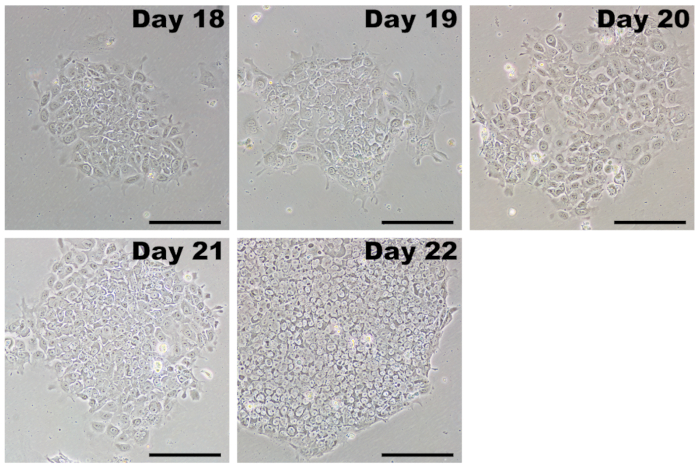
그림 5 : 초기 통과 후 Ipsc의 대표 이미지. 프로그래밍 수정된 mRNAs와 미르 모방, 재설정된 세포와 transfections를 완료 한 후 17-20 일에 의해 passaged 있습니다. Ipsc는 PSC 매체에 성장 이점이 있고 불완전 하 게 재설정 했다 어떤 섬유 아 세포를 빠르게 추월. 처음, Ipsc는 가난 하 게 정의 된 경계와 느슨한 나타날 수 있는 식민지를 형성할 것 이다. 몇 일 이내 셀 빠르게 증식 하 고 높은 핵-세포질 비율, 단단히 가지 테두리와 식민지로 클러스터링 단단히 포장된 셀의 특성 형태에 걸릴. 눈금 막대 = 200 µ m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
이 프로토콜 Ipsc는 매우 높은 효율로 일반 및 질병 관련 인간의 섬유 아 세포 라인의 프로그래밍에 대 한 수 임상 관련, 비 통합, RNA 기반 방법을 설명 합니다. 날짜 하려면, 모든 인간의 섬유 아 세포 선 우리 설명 프로토콜 프로그램을 시도 했습니다 다운스트림 응용 프로그램에 대 한 높은-품질 Ipsc의 만족 수를 굴복 했다. 결과 Ipsc 즉시 전송 하 고 지류 무료 문화 조건에 확장 수 있습니다.
프로그래밍에 대 한 섬유 아 세포의 품질:
프로그래밍 성공 하는 것은 시작 하는 섬유 아 세포의 품질에 크게 의존입니다. 이상적으로, 프로그래밍 최고의 효율을 달성 하기 위해 사용할 수 있는 가장 낮은 통행 fibroblasts와 함께 시작 되어야 합니다. 효율을 프로그래밍 하는 것은 통로 2-4의 섬유 아 세포와 가장 좋습니다. 프로그래밍 사용할 수 있습니다 여전히 높은 통로 (통로 5-8), 심지어 노화 섬유 아 세포, 효율을 감소와 함께 쓰 신. 때로는 낮은 통로 섬유 아 세포는 사용할 수 없습니다 또는 환자 샘플 건강 한 성장을 방지 하는 유전 돌연변이. 이 경우에, 초기 도금 밀도의 최적화가 필요할 수 있습니다. 손상 된 섬유 아 세포 라인의 프로그래밍 하는 것은 일반적으로 RNA transfections 동안 증가 세포 죽음 연관 된다. 그 결과, 잘 프로그래밍에 셀 프로그래밍 10-14 일 스파스 될 나타납니다. 또한 대형 acellular 지역에는 잘 표시 되지 것입니다. 이 경우 재활 프로토콜 수 섬유 아 세포의 더 높은 초기 시작 번호를 다시 시작 해야 합니다. 형식 6-잘 접시의 당 3000 입력된 셀 도금 가장 성인 섬유 아 세포 라인에 대 한 일관 되 게 작동 합니다. 그러나, 5000-10000 (노화 라인에 대 한 50000) 도금 수 우리의 이전 게시8에서 보고 된 질병 관련 된 샘플의 프로그래밍을 개선 하기 위해 도움이 됩니다. 반대로, 세포 confluency를 너무 일찍 도달 프로그래밍에 저항력이 될 수 있습니다. 경우 셀 RNAs를 프로그래밍으로 transfections를 받고 너무 급속 하 게 확산 (로 때때로 주 신생아 섬유 아 세포의 경우), 형식 6-잘 접시8의 당 500 fibroblasts와 프로그래밍 시작.
Transfection 버퍼의 처리:
Transfection 버퍼 (8.2의 pH를 조정 하는 감소-혈 청 매체)의 pH 프로토콜 프로그래밍이 필요한 최적의 transfection 효율을 달성 하는 최고 이다. 이러한 이유로, transfection 버퍼의 처리에 관한 몇 가지 예방 조치는 것이 좋습니다. 우리는 대기 공기에도 짧은 노출 transfection 버퍼의 버퍼의 pH에 영향을 발견 했다. 따라서, transfection 버퍼 (우리는 5 또는 15 mL 나사 모자 원뿔 관 사용) 최소한의 공기 공간 스크류 캡 용기에 aliquoted 이어야 한다. 추가 공기 노출 최소화, 2 개의 transfections의 최대 각 transfection 버퍼 aliquot을 사용 합니다. 마지막으로, 온도 영향 pH, 이후 transfection 버퍼 transfection 단지의 어셈블리에 대 한 rt equilibrated은 중요 하다. 37 ° c transfection 버퍼 따뜻한 하지 하는 것이 좋습니다.
Ipsc의 뿌리고.
많은 이전 프로토콜 추천 개별 iPSC 식민지 프로그래밍의 끝을 따기에 출판, 그러나이 프로그래밍의 효율성은 매우 높은 또는 식민지 클러스터 함께 있는 경우로 하는 경우를 달성 하기 어려울 수 있습니다 우리의 프로토콜입니다. 따라서, iPSC 식민지 서로 가까이에 있다면, 먼저 뿌리고 셀 수동으로 식민지를 따기 전에 재설정된 Ipsc 밖으로 확산 하는 것이 좋습니다. 이 이른 통행 단계를 수행 하는 것 몇 가지 이점이 있다. 식민지에 밖으로 퍼지는 그들이 제공 성장, 더 많은 공간에 원래 잘 달성 될 수 있었다 그렇지 않으면 보다 따기에 대 한 훨씬 더 큰 식민지를 양보 합니다. 이 크게 고른된 클론에서 iPSC 라인에서 성공률을 향상 시킵니다. 우리는 또한 섬유 아 세포와 함께 추가 문화 시간 희석된 비율에도 불구 하 고 나타나는 고른된 iPSC 식민지의 평균 품질을 개선 하기 위해 찾으십시오. 불완전 하 게 재설정된 fibroblasts 지원 paracrine 요소는 Ipsc를 설정 하 고 셀 피더-무료 문화 조건으로 직접 전환을 쉽게 도움을 계속 제공할 수 있습니다. 섬유 아 세포는 우연히 Ipsc mTeSR1에서 경작 하는 경우에 비해 선택적 성장 단점이 있다. 따라서, 오염 fibroblast 세포 인구는 3-4 구절 내에서 무시할 수 수량을 신속 하 게 희석 된다.
Y-27632 등 록 억제제 인간의 Ipsc의 일상적인 문화에 자주 사용 됩니다. 우리는 자주 또는 확장 문화 Y-27632와 일부 iPSC 라인의 전반적인 품질에 해로운 효력이 있을 수 있다을 발견 했다. 덩어리 뿌리고 메서드를 사용 하 여 같은 EDTA와 Y-27632 않습니다 분한 후 iPSC 생존 능력을 유지 하는 데 필요한. 우리 완전히 모든 iPSC 격리, 확장, 또는 일상적인 문화에 대 한 Y-27632와 보충 미디어를 제거 했습니다.
프로토콜 제한 사항:
설명된 RNA 기반 재활 접근 한 제한은 초기 비용과 복잡성 재활 시 약의 준비와 관련 된입니다. 시 약은 모든 루틴 및 이전 되었습니다 mRNA를 생성 하는 준비 절차 설명 (PCR, 녹음 방송 생체 외에서 DNase 치료, 상한, dephosphorylation, 정화), 누적 mRNA 시 약의 생산은 상대적으로 길고 특수 과정입니다. 이 프로토콜을 다른 주요 도전 transfect 세포 마다 48 h, 재활 프로토콜의 노동 강도 증가 하는 필요 이다. 이러한 고려 사항 몇 환자 샘플의 프로그래밍은 원하는 경우 금지 있을 수 있습니다. 그러나, 1 차 배려 임상 관련 Ipsc 또는 매우 높은 재활 효율 달성의 세대 이면 설명된 RNA 기반 재활 접근 이상적입니다.
요약, 설명된 고효율 RNA 기반 재활 방법 우리의 이전 게시8에 설명 된 대로 재설정 체세포 형식의 최적화 transfection 효율에 경첩. 이 연구에서 제시 하는 RNA transfection 프로토콜 인간의 기본 fibroblasts에 대 한 높은 조정 하지만 잠재적으로 다양 한 체세포의 재활 효율 향상을 위해 다른 셀 형식에 맞게 수 있습니다.
공개
I.K.와 G.B.는 공동 발명가 "방법 및 구성에 대 한 프로그래밍 세포", PCT 출원 번호를 받을 수 있는 특허 출원에 PCT/US2016/063258입니다.
감사의 말
우리는 건강의 국가 학회 (T32AR007411-33)와 콜로라도 대학 피부 질병 연구 핵심 센터 (P30AR057212)에서 지원 자금에 대 한 감사. 우리는 또한 선 피 (EB) 연구 협력, EB 의료 연구 재단, 치료 EB 자선, Dystrophic 선 피 연구 협회 (데 브라) 국제, 킹 보두앵의 Vlinderkindje 기금, 재단과 게이츠 감사 프론티어 기금입니다.
자료
| Name | Company | Catalog Number | Comments |
| Plasmid templates for PCR | |||
| pcDNA3.3_KLF4 | Addgene | 26815 | |
| pcDNA3.3_SOX2 | Addgene | 26817 | |
| pcDNA3.3_c-MYC | Addgene | 26818 | |
| pcDNA3.3_LIN28A | Addgene | 26819 | |
| pCR-Blunt_hM3O | Addgene | 112638 | |
| pCR-Blunt_hNANOG | Addgene | 112639 | |
| pCR-Blunt_mWasabi | Addgene | 112640 | |
| Modified mRNA in vitro transcription and miRNA mimics | |||
| Forward Primer | Integrated DNA Technologies | TTGGACCCTCGTACAGAAGC TAATACG | |
| Reverse Primer (Ordered as ultramer, 4nmol scale) | Integrated DNA Technologies | TTTTTTTTTTTTTTTTTTTTTTTT TTTTTTTTTTTTTTTTTTTTTTTT TTTTTTTTTTTTTTTTTTTTTTTT TTTTTTTTTTTTTTTTTTTTTTTT TTTTTTTTTTTTTTTTTTTTTTTT CTTCCTACTCAGGCTTTATTCA AAGACCA | |
| (ARCA Cap) 3´-0-Me-m7G(5')ppp(5')G | New England Biolabs | S1411S | |
| Pfu Ultra II Hotstart 2x Master Mix | Agilent | 600850-51 | |
| 5-Methylcytidine-5'-Triphosphate | Trilink Biotechnologies | N-1014 | |
| Antarctic Phosphatase | New England Biolabs | M0289L | |
| DNase I | NEB | M0303S | |
| MEGAscript T7 Transcription Kit | ThermoFisher Scientific | AM1334 | |
| Pseudouridine-5'-Triphosphate | Trilink Biotechnologies | N-1019 | |
| Riboguard RNase Inhibitor | Lucigen | RG90910K | |
| RNA Clean & Concentrator | ZymoResearch | R1019 | |
| Syn-hsa-miR-302a-3p miScript miRNA Mimic | Qiagen | MSY0000684 | |
| Syn-hsa-miR-302b-3p miScript miRNA Mimic | Qiagen | MSY0000715 | |
| Syn-hsa-miR-302c-3p miScript miRNA Mimic | Qiagen | MSY0000717 | |
| Syn-hsa-miR-302d-3p miScript miRNA Mimic | Qiagen | MSY0000718 | |
| Syn-hsa-miR-367-3p miScript miRNA Mimic | Qiagen | MSY0000719 | |
| Water (Nuclease free, Not DEPC-treated) | Fisher | AM9937 | Use to dilute modified mRNAs and miRNA mimics |
| Fibroblast culture and reprogramming | |||
| 0.1% Gelatin in H2O | StemCell technologies | #07903 | |
| Stericup-GV Sterile Vacuum Filtration System | EMD Millipore | SCGVU05RE | Use to sterilize the transfection buffer and 0.5 mM EDTA in DPBS |
| 2-Mercaptoethanol | ThermoFisher Scientific | 21985023 | |
| 6-well plates (tissue culture treated) | Corning | 3516 | |
| DMEM/F12 | ThermoFisher Scientific | 11320033 | |
| Fetal Bovine Serum | Fisher | 26-140-079 | |
| FGF Basic | ThermoFisher Scientific | phg0263 | |
| GlutaMax Supplement | ThermoFisher Scientific | 35050061 | Glutamine supplement used for the prepration of media |
| Heat Inactivated FBS | Gibco Technologies | 10438026 | |
| KnockOut Serum Replacement | ThermoFisher Scientific | 10828010 | |
| Lipofectamine RNAiMAX Transfection Reagent | ThermoFisher Scientific | 13778500 | The protocol is optimized for the Lipofectamine RNAiMax transfection reagent |
| MEM | ThermoFisher Scientific | 11095080 | |
| MEM Non-essential amino acids | ThermoFisher Scientific | 11140050 | |
| Opti-MEM I Reduced Serum Medium | ThermoFisher Scientific | 31985070 | Reduced-serum medium, use to make the transfection buffer by adjusting the pH to 8.2, 500 mL |
| Opti-MEM I Reduced Serum Medium | ThermoFisher Scientific | 31985062 | Reduced-serum medium, use to make the transfection buffer by adjusting the pH to 8.2, 100 mL |
| 10 M NaOH | Sigma-Aldrich | 72068 | Make a 1 M solution by diluting in nuclease free water and use for pH adjustment |
| Water (Nuclease free, Not DEPC-treated) | Fisher | AM9932 | Use to dilute NaOH and wash a pH meter |
| Pen/Strep/Fungizone | GE Healthcare | SV30079.01 | |
| rhLaminin-521 | ThermoFisher Scientific | A29248 | Supplied at a concentration of 100 µg/mL, use as a matrix for the reprogramming procedure |
| Dulbecco's phosphate-buffered saline (DPBS) | Life Technologies | 14190144 | |
| Trypsin-EDTA 0.25% Phenol Red | Life Technologies | 2520056 | |
| Vaccinia Virus B18R (CF) | ThermoFisher Scientific | 34-8185-86 | |
| iPSC culture | |||
| Corning Matrigel hESC-Qualified Matrix | Corning | 354277 | Extracellular matrix (ECM) for culturing iPSCs |
| EDTA, 0.5 M stock solution | K&D Medical | RGF-3130 | Dilute to 0.5 mM in DPBS, filter sterilize and use for iPSC passaging |
| mTeSR1 | StemCell Technologies | 85850 | Pluripotent stem cell (PSC) medium, provides growth advantage to iPSCs over fibroblasts |
| Antibodies and Detection | |||
| Rabbit anti Mouse (HRP conjugated) | Abcam | ab97046 | |
| Tra-1-60 (mouse anti human) | Stemgent | 09-0010 | |
| Hydrogen Peroxide (30%) | LabChem | LC154301 | Dilute to 3% with PBS |
| Bovine Serum Albumin (BSA) | Fisher | BP9703100 | |
| Phosphate-buffered salin (PBS) | Hyclone | SH30258.02 | Supplied as 10x, dilute to 1x |
| VECTOR NovaRED Peroxidase Substrate Kit | Vector Laboratories | SK-4800 | |
| Special Equipment | |||
| Description | Notes | ||
| Biological safety cabinet | |||
| Regular humidified tissue culture incubator | Calibrate CO2 using digital meter, fyrite, or equivalent. Equilibrate incubator to 5% CO2, 37 °C. | ||
| Tri-gas humidified tissue culture incubator | Calibrate CO2 using digital meter, fyrite, or equivalent. Equilibrate incubator to 5% CO2, 5% O2, 37 °C. Use for the reprogramming procedure. | ||
| pH Meter | Must have resolution to two decimal places. Designate to RNA work if possible. | ||
| Inverted microscope | Microscope configured to visualize EGFP for monitoring transfection efficiency. |
참고문헌
- Takahashi, K., Yamanaka, S. Induction of Pluripotent Stem Cells from Mouse Embryonic and Adult Fibroblast Cultures by Defined Factors. Cell. 126 (4), 663-676 (2006).
- Takahashi, K., et al. Induction of Pluripotent Stem Cells from Adult Human Fibroblasts by Defined Factors. Cell. 131 (5), 861-872 (2007).
- Schlaeger, T. M., et al. A comparison of non-integrating reprogramming methods. Nature Biotechnology. 33 (1), 58-63 (2015).
- Hacein-Bey-Abina, S., et al. LMO2-Associated Clonal T Cell Proliferation in Two Patients after Gene Therapy for SCID-X1. Science. 302 (5644), 415-419 (2003).
- Warren, L., et al. Highly efficient reprogramming to pluripotency and directed differentiation of human cells with synthetic modified mRNA. Cell Stem Cell. 7 (5), 618-630 (2010).
- Judson, R. L., Babiarz, J. E., Venere, M., Blelloch, R. Embryonic stem cell-specific microRNAs promote induced pluripotency. Nature Biotechnology. 27 (5), 459-461 (2009).
- Anokye-Danso, F., et al. Highly efficient miRNA-mediated reprogramming of mouse and human somatic cells to pluripotency. Cell Stem Cell. 8 (4), 376-388 (2011).
- Kogut, I., et al. High-efficiency RNA-based reprogramming of human primary fibroblasts. Nature Communications. 9 (1), (2018).
- Hirai, H., et al. Radical acceleration of nuclear reprogramming by chromatin remodeling with the transactivation domain of MyoD. Stem Cells. 29 (9), 1349-1361 (2011).
- Mandal, P. K., Rossi, D. J. Reprogramming human fibroblasts to pluripotency using modified mRNA. Nature Protocols. 8 (3), 568-582 (2013).
- Avci-Adali, M., et al. In vitro synthesis of modified mRNA for induction of protein expression in human cells. Journal of Visualized Experiments. , e51943 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유