このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
アグロバクテリウムとサツマイモネコブセンチュウ-ジャガイモの変換を介したと GUS 染色によってスベリン遺伝子のプロモーター活性
要約
ここでは、ジャガイモを変換する 2 つのプロトコルを提案する.サツマイモネコブセンチュウ生成トランスジェニック植物毛状根自己伝達することができます野生型撮影アグロバクテリウム変換完了形質転換植物に します。我々 は、ガス変換された根の染色によるプロモーター活性を検出します。
要約
アグロバクテリウムの sp は、転送および独自の T-DNA を植物のゲノムに統合する能力があり、形質転換植物を得る最も広く使用されている方法の一つです。ここでは、遺伝子組み換えポテト (ジャガイモ) 植物を変更する 2 つの変換システムを提案する.A. 根頭がんしゅ病菌の変換で葉が感染している、変換されたセルが選択されて、新しい完全な形質転換体が 18 週間でホルモンを使用して再生成されます。A. 体の獲得変換で茎は針で細菌を注入することにより感染している、新登場の変換された毛状根は赤い蛍光マーカーを使用して検出されます、非変形の根が削除されます。5-6 週間で得られた植物は完全に開発された変換された毛状根と野生型撮影のコンポジットです。バイオマスの増加に変換された毛状根は摘出し、自己反映できます。我々 は両方アグロバクテリウム-仲介された変換方法スベリン生合成遺伝子プロモーターによるGUSレポーター遺伝子を表現する根を取得するを適用されます。GUS 染色手順は、プロモーター発現誘導の細胞局在化をことができます。両方の方法で変換したバレイショの根を示した GUS GUS 活性 suberized 内皮、外皮、およびさらに、 A. 体の獲得変換根を染色も根の出現で検出されました。A. 体の獲得が根に表現される遺伝子を研究する高速代替ツールをすることができますが示唆されました。
概要
経済的利益は別として遺伝子組換え植物の世代は、独自の関連性研究遺伝子の究極の機能を示すため、植物生理学と開発を理解します。最も広く法植物 DNA の挿入はアグロバクテリウム-変換を介した。アグロバクテリウムは、その腫瘍を誘発する (Ti) プラスミドの作用によって多くの植物種の感染組織におけるクラウン苛立つを生成することです。プラスミドには、植物ゲノムに組み込まれる予定、組織分化1,2を誘発する遺伝子のセットを持つ T DNA 領域が含まれています。遺伝子による T DNA 内でこれらの遺伝子の交換は表現型効果3を回避する特定の植物の変更の生成を許可しています。T DNA へのクローニング遺伝子のため、Ti プラスミドの遺伝子の残り中のバイナリのプラスミドと呼ばれる独立したプラスミドの DNA 領域が削除されて (T-DNA 転送と挿入メカニズムを許可する病原性遺伝子) がされています。ヘルパー プラスミドに配置されます。A. 根頭がんしゅ病菌による変換は、植物バイオ テクノロジー研究、いくつかの利点: それは高価な装置を必要としない、安定性と過渡工場変換とコピーに統合されている遺伝子の低い数字の両方を生成することができる、染色体4。ただし、ほとんどの植物がないシロイヌナズナ,安定形質転換細胞の生成に単一または外因性ホルモンは、骨の折れる、時間がかかり、このプロセスを作るを使用して少数の細胞からの植物体再生が必要です。A. 体の獲得は植物ゲノムを変更することができます毛状根や不定根 (Ri) のルート誘導プラスミド5でエンコードされたrol (根軌跡) 遺伝子の発現による感染部位での生産します。A. 根頭がんしゅ病菌より少ないが、 A. 体の獲得も遺伝子ルーツを取得する使用されます。この場合、 a. 体の獲得には、2 番目 T-DNA 遺伝子を運ぶとで Ri プラスミドとバイナリのプラスミッドの T-DNA 元にはが含まれています。感染サイトが茎や胚軸、野生型撮影から新興新しい毛深い遺伝子ルーツを持つ、複合植物が得られます。また、変換された毛状根育つことが自律的体外炭素ソース入力メディアで。A. 根頭がんしゅ病菌遺伝子組換え組織を生成するのではなくa. 体の獲得の使用は植物体再生は必須ではありません、それ故にそれはより速くより少なく高価なためルートに標的臓器と関連性を得ています。以前の研究は、ルート特定の遺伝子6,7,8,9表現型特性の充当方法論を実証しています。
塊茎はビタミンの良いソースであることの人間の消費のための栄養の関連性を持っているので、じゃがいも (ジャガイモ) は食糧および農業機構の国際連合 (FAO) によれば、世界で第 4 最も重要な作物やミネラル。そのため、ジャガイモは、農業バイオ テクノロジーのスポット ライトに置かれているし、遺伝と発達の良い生体モデルの研究10,11としてまた考慮されます。ジャガイモの変換は遺伝子の特徴を基になる suberized 組織スベリンに関与し、生合成12,13,14 をワックスの分子機構の理解に貢献 ,,1516,17、スベリン モノマーのトランスポート18と転写調節の19。FHT、スベリン フェルロイル トランスフェラーゼ遺伝子はこれらの特徴生合成遺伝子の 1 つそのダウンレギュレーションがスベリン型フェルラ酸エステルの強い減少やジャガイモ塊茎14ワックスと相関周皮の保護の強い障害を生じさせる。付随して、根およびシロイヌナズナの種子は、その推定の細胞 (ASFT/RWP1) のノックアウトもスベリン20,21アルキル ferulates の生産に於いての役割を示した。ジャガイモ、 FHT転写記者行と FHT 抗体を示したプロモーター活性およびタンパク質、外皮、内皮細胞は、一層誘導体と傷ついた組織15に位置して.
この作品は、 a. 体の獲得を使用して野生型撮影で保持されている遺伝子組換えの毛状根を生成する、複合ジャガイモ植物の生成や体外の自律的成長を摘出プロトコルを詳しく説明します。A. 根頭がんしゅ病菌を使用して完全なトランスジェニックバレイショを取得するプロトコルもあります。事例研究としてA. 体の獲得とA. 根頭がんしゅ病菌と同じバイナリ ベクトル変換は、 GUSレポーター遺伝子発現を運転FHTプロモーターと根を取得する使用されます。結果報告し、比較します。
プロトコル
A. 体の獲得の変形のプロトコルは適応し、ホーンら7から変更し、テスト遺伝子型はs. ニラssp. 結節性(品種デジレ)。A. 根頭がんしゅ病菌変形のプロトコルだった合わせたし、バネルジーら22から変更され、テスト遺伝子型s. ニラssp. 結節性(品種デジレ)および s. の結節の ssp andigena。それぞれ図 1 と図 2は、両方の手順の主な手順をまとめます。
注:体外の転送を実行する手順のすべての手順で急速に、そうと可能な場合維持プレートや鍋を閉じると、萎凋現象と汚染を避けるために空気に植物の露出を最小限に抑える。それ以外に、すべての植物の孵化は暗い 20 の ° C および 67 µmol m-1の-1の 24 ° C 光/12 h の 12 h の条件の下でキャビネットで行われました。それ以外に、転送を実行すべて細菌操作と体外植物層流フードの無菌条件で。表 S1は、アグロバクテリウムと体外の植物文化のすべてのメディアのレシピを提供しています。
注意:すべての遺伝子組み換え細菌や充当の廃棄物コンテナーに植物を入金します。
1アグロバクテリウム文化変換の使用。
注: A.体の獲得変換用ひずみ (博士インゲ Broer によって提供された) C58C1:Pri15837 , A. 根頭がんしゅ病菌のあった GV2260 (博士サロメ プラットによって提供された)。A. 体の獲得バイナリ ベクトル PK7GWIWG2_II-場 (VIB-Universiteit ゲントのプラント システムの生物学の部門; http://gateway.psb.ugent.be)、T-DNA 変換マーカーを運ぶ毛状根を監視するを含むと共に、変貌しました。形成します。A. 体の獲得とA. 根頭がんしゅ病菌によって生成された変換後の根を比較するには、とβ-glucoronidase (GUS)レポーターの遺伝子を運転 FHT プロモーターを運ぶ T DNA を含むベクター pKGWFS7 両方変形しました。選択可能なマーカー15としてカナマイシン耐性遺伝子。
- アグロバクテリウムのコロニーをピックアップし、200 rpm で振とうしながら 28 ° C で 50 mL の遠心管にして一晩 (O/N) 抗生物質 (表 S1) YEB 培の 5 mL の成長します。
- A. 根頭がんしゅ病菌変形のため OD600をする必要があります光の密度を測定 = 0.6 1.0。
- なら OD600に下げるサブカルチャーの光学密度は高く、文化に達する外径 φ600まで新鮮なメディアと待機 0.3 を = = 0.6-1。
- 室温で 10 分間、ベンチトップ遠心分離機で 3,000 x gでアグロバクテリウム文化の 1 mL を遠心します。
- ピペットで上澄みを除去し、抗生物質なし YEB 培の 1 mL の細胞を再懸濁します。抗生物質の完全な除去を確実にこの手順を繰り返します。
- A. 根頭がんしゅ病菌変形のための最後の再懸濁の OD600の最後の光学密度を得るため適切な YEB ボリュームを追加 = 0.8。
- 感染植物の準備しながら氷の上の細胞を保ちます。
2. 植物の変換のための材料
- 頂または滅菌体外ジャガイモ植物 (ドナー); から補助芽を含むいずれか 1 つまたは 2 つのノード幹挿し木を作る3 〜 4 週間 (図 1 a 図 2 a) の鍋の固体 2 ms 培地でそれらを育てます。
3. A. 体の獲得(図 1) を使用して変換を植える
注: この手順は、変換された毛状根の取得できます。導入遺伝子の発現を評価、否定的な制御が必要です。ネガティブ コントロールを準備するには、変形されてないか変換マーカー遺伝子を含む空のベクターで形質転換体の A. 獲得ひずみを用いた手順に従います。
- 新鮮なメディア プレートを使用します。また、プレートは、メディアの脱水症状を避けるために透明フィルムで密閉蓋側を上、4 ° C で保存することができます。正方形のメディア版を準備するには、傾斜それら ~ 15 °、MS、40 mL で塗りつぶし、固めるみましょう。これは培地の植物の地上部との接触を最小限に抑えます。
- 120 mm × 120 mm の正方形のプレートに 2 ms 培地からのドナー工場転送非常に慎重に。
- 手術針を使用してa. 体の獲得文化の 1 つの茎節 3 μ L に注入し、可能な場合は別の節で工場に 2 回それを繰り返します。
注: 独立した変換イベント (図 1 b) としてそれぞれの注入を検討してください。 - すぐに全体の植物に転送正方形板 0.1 mM acetosyringone を添加した固体の MS 培地で。プレート当たり 2 工場に対応します。
注: 1 M acetosyringone 原液 DMSO の準備は、-20 ° C で保存することができます。 - サージカル テープを使用してプレートをシールし、4 日間成長キャビネット内部それを縦方向に整列します。
- A. 体の獲得を殺すためにセフォタキシム ナトリウム [500 μ g/mL] を添加した MS 培地と新しい正方形のプレートに工場を移転します。
- 10-12 日後毛状根は (図 1、1 D) を表示する開始されます。植物のネイティブ ルーツを切除し、セフォタキシム ナトリウム [500 μ g/mL] を添加した MS 培地と新しい正方形のプレートに工場を移転します。
注: 変換された毛状根は下流変換マーカー (図 3 D) を使用する場合、赤い蛍光性でチェックできます。 - 複合植物 (図 1E) を得るためには、セフォタキシム ナトリウム [500 μ g/mL] を添加した MS 培地で 3-4 週間の成長形質の毛状根を聞かせて (媒体毎週に変更)。
- 目的に応じて、以下の通りトランスジェニック毛状根と負のコントロールを反映します。
- 養液栽培 (表 S2) または地盤に大規模な開発を行うために全体の複合工場を移転します。
- 個別に変換された毛状根を繁殖させるメスを使用して赤い蛍光変換マーカー (下流蛋白質) を表現する根をカット長さ 4-8 cm (図 1E) は、彼らのと Gamborg B5 固体培地をシャーレに移して2% ショ糖とセフォタキシム ナトリウム [500 μ g/mL] を補充しました。プラスチック研究所映画でプレートを密封し、20 ° C で暗闇の中でそれらを育てる
注: 装備 (材料表参照) 無菌条件下で蛍光を検出する顕微鏡の下で根を操作できます。 - バイオマス (すなわち、遺伝子発現解析)、5 cm 長い毛状根をカットし、Gamborg B5 液体培 2% ショ糖とセフォタキシム ナトリウム [500 μ g/mL] の 20 mL と 150 mL の三角フラスコに伝達します。20 の ° C および 60 rpm で暗闇の中で 6 週間の成長します。
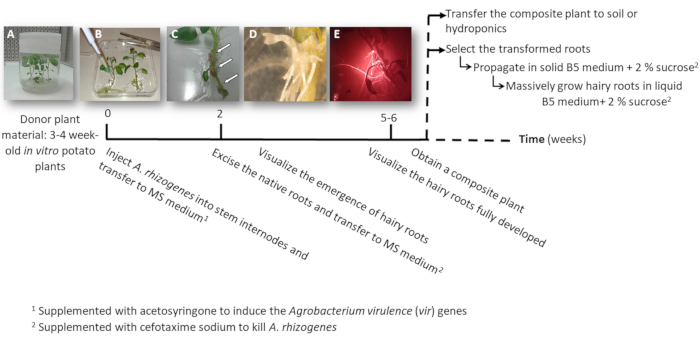
A. 体の獲得を用いたトランスジェニックの毛状根のポテトを取得する図 1: タイムライン。変換プロセスは、毛状根を成長する後続の手順の各段階に到達する累積的な週間が表示されます。さまざまな段階の代表的なイメージが描かれている: A. 体の獲得(B)、増殖性の形成を注入することにより植物の (A)、その後、感染症を植物体外3 週齢を使用してプロセスの開始新たな毛状根 (D) と組織 (C矢印) と開発した毛状根の赤い蛍光変換マーカーした DsRed (E) を表現します。この図の拡大版を表示するのにはここをクリックしてください。
4. A. 根頭がんしゅ病菌(図 2) を使用して変換を植える
注: この手順は、変換された植物の取得できます。遺伝子の効果の評価、否定的な制御が必要です。1 つは、空のベクターに変換するA. 根頭がんしゅ病菌を使用して手順を実行することです。また、野生型の植物が使用できます。
- 切断し、ペトリ皿で (図 2 a) の 3-4 週齢植物から葉を置きます。メスを使って、葉柄を除外し、(図 2 b) それらを切断を回避するエッジに葉の中心から横カット (葉のサイズによって 1-3) を加えます。
- すぐを背軸側のペトリ皿に液体メディア新鮮な 2 ms の 10 mL に浮かぶ葉っぱを置き、プレートを閉じる。収容最大 15 ステップ葉品種デジレと 25 は、ssp の葉 (葉のサイズ) によってndigenaを繰り返します。
- すぐに OD600 A. 根頭がんしゅ病菌文化 80 μ L を追加 = 液体媒体で 0.8 と細菌のソリューションを配布する 1 分の手動でプレートをホモジナイズしてください。
- 慎重にフィルムをシールで封印、アルミ箔でカバー、発生変換させる 24 の ° C で商工会議所で 2 日間孵化させなさい。
- CIM 媒体 (図 2 b) まで背軸側を保つ葉を転送し、キャビネットの成長で 1 週間それらを孵化させなさい。
- ピンセットで CIM 媒体をこすり、葉がより良いメディアに対応できます。
- SIM 培地 (図 2) まで背軸側を保つ葉を転送し、キャビネット、さわやかな媒体ごとの 7-10 日、シュートが約 2 センチまで成長にそれらをインキュベートします。
- 葉はメディアに完全に囲まれて ことができますように、ピンセットで SIM 培地をこすり。浮上の芽が蓋に達したら、背の高いペトリ皿で動作 (100 × 20 mm、高さ × 直径)。
注: 6-7 週間 (図 2 e) 後 SIM 培地 (図 2 D) とシュートで 2-3 週間後、カルスが形成されます。撮影は、独立した傷から形成されたカルスから現れるときに独立した変換イベントとみなされます。
- 葉はメディアに完全に囲まれて ことができますように、ピンセットで SIM 培地をこすり。浮上の芽が蓋に達したら、背の高いペトリ皿で動作 (100 × 20 mm、高さ × 直径)。
- 3 カット撮影 (同じ変換イベントを考慮) 各カルスから現れた (図 2 e) MG 培地で培養フラスコにそれらはようにセフォタキシム ナトリウム 250 mg/L を添加した転送数とサブセットのラベル、応援とキャビネット、3-4 週間または撮影が活発 (図 2 f) まで成長で孵化させなさい。
注: シュートをカットするときルートを形成しないそれ以外のカルスを削除もします。- 独立した線が必要な回数だけステップを繰り返します。5 の異なる変形までさまざまなイベントから植物は混合されていない完全な自信で動作する 8 cm の直径を持つ培養用フラスコにイベントを配置できます。
- 各イベントの最も活発な植物を選択、3-4 節で撮影の頂のセグメントをカット、セフォタキシム ナトリウム 250 mg/L と 2 ms 培が新しい培養用フラスコにそれを置きます。
植物が効率的に成長する 3-6 週間で注: 積極的なシュートと根の開発。- 戻す商工会議所非選択シュート選択植物が完全に開発されるまで。
- 少なくとも 1 つの節、頂芽の植物から幹セグメントをカットし、セフォタキシム [250 mg/L] 新しい 2 ms 培に転送。キャビネットの成長にそれらを孵化させなさい。
- 3-4 週間ごとにレプリケート生体外の変換ラインを確立します。
注: セフォタキシム ナトリウムは殺す必要がある 2 ms 中少なくとも 3 つの後続の転送でことを確認A. 根頭がんしゅ病菌;その後、 a. 根頭がんしゅ病菌の増殖が見られる場合メディアに転送植物再度 2 ms セフォタキシム ナトリウムを添加しました。
- 3-4 週間ごとにレプリケート生体外の変換ラインを確立します。
- 植物の表現型を特徴付けるための完全のキャラクタリゼーションのための土またはルート検査用養液栽培植物を転送します。
- 塊茎伝播し、確立したラインを維持する土壌で生産を続けます。

図 2: ジャガイモを取得するタイムラインの変形A. 根頭がんしゅ病菌を用いた植物。変換プロセスは、植物を育てるための以降の手順の各段階に到達する累積的な週間が表示されます。さまざまな段階の代表的なイメージが描かれている: (A) 3 週間の古い培養植物から葉のプロセスを使用して開始、CIM メディア (B)、葉への転送時に葉の負傷者と感染の転送SIM メディア (C)、SIM メディア (D)、SIM メディア (E)、9-11 週間後シュート形成と MG メディア (F) への転勤後撮影で 2-3 週間後に負傷した領域の周りのカルスの可視化。この図の拡大版を表示するのにはここをクリックしてください。
5. 水耕栽培
- 半分の力川砂の準備 (0.5 x) (表 S2) 10 L バケツに。
- 均質性と適切な酸素条件を維持するために水槽のポンプを浸します。
- 暗いところで根を成長するアルミ箔でバケツの壁をカバーしてください。
- 養液栽培植物体外に転送ルート損傷を避けます。
注: は、慎重に水に浸漬根を揺することによって潜伏中の微生物増殖を避けるために根からあらゆる残りの in vitro媒体を削除します。 - 十分な順化し成長の商工会議所で孵化させなさい温室のような透明なフィルムが付いている植物をカバーしてください。
- 3 日後、フィルムの穴を作る、後 1 週間完全に取り外します。
- 新鮮なメディア 10 日ごとに置き換えます。
6ガス化学レポーター遺伝子アッセイ。
注: 我々 の場合、ガス分析が 2-3 週間水耕栽培や体外で栽培の根で実行されていました。
- 冷蔵 90% アセトン (v/v) で根を修正し、氷の上 20 分インキュベートします。
- 蒸留水洗浄 2 つを実行します。
- 新鮮な GUS 染色液 (表 1) を追加し、真空を適用 (-70 Pa) 20 分。
- 37 ° c 4 h または青の色が表示されるまでの感光性のガスを保護するために暗闇の中で孵化させなさい。
注: フェリ ・ フェロシアン化ガスのソリューションの存在反応生成物の拡散を最小限に抑えるためより正確なローカライズを提供します。
注意: ヒューム フードを使用して、GUS ソリューション (フェリシアン化カリウム、フェロシアン化カリウム) の有毒なシアン化合物誘導体を処理するときは、防護服を着用します。ガス基板と廃棄物は安全に破棄されなければなりません。 - GUS 染色液を削除し、適切なコンテナーに破棄します。
- エタノール 70% (v/v) と 2 つの洗浄を実行します。
- 明視野顕微鏡下で観察します。
注: GUS 染色は安定して数週間です。ただし、最初の週の間にガス信号は明らかですし、隣接するセルに以下を拡散させます。長期保管のためチューブをシールし、4 ° C で保存
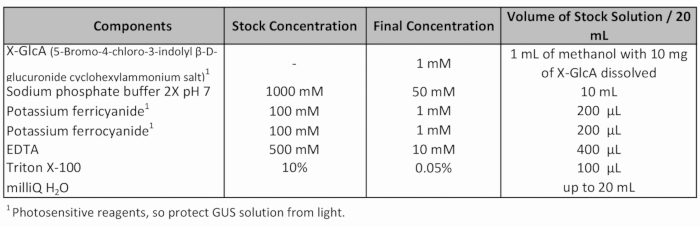
表 1:GUS 染色ソリューション レシピ。
結果
サツマイモネコブセンチュウ-ジャガイモ変換を介した
本稿では、手順A. 体の獲得と変換されたルートを取得するように設定が表示されます。図 1は、完全 (完全に開発された毛状根を取得するA. 体の獲得の注射) から 5-6 週間くらいは、プロシージャの概?...
ディスカッション
ジャガイモ, 安定した完全な遺伝子組換え植物を取得する最も一般的なシステムは、外因性のホルモンを使用して器官を必要とアグロバクテリウム菌株によって変換を使用します。アグロバクテリウムによるプロトコル非 T DNA ベクター シーケンス25を統合する潜在性があるが、この方法は、まだ最も、安価バレイショを変換できます。A. 体の獲得に関心?...
開示事項
著者はある利益相反を開示します。
謝辞
この作品は、ジローナ大学 (博士号付与 SF とグラントと資金 (AGL2012 36725, AGL2015 67495 C2 1 R) のフェダー Ministerio デ Economía y Competitividad Ministerio デ Innovación y サイエンス (AGL2009 13745、PB に FPI グラント) によって支えられました。SING11/1)。A. 体の獲得とA. 根頭がんしゅ病菌株を提供するため、著者は博士インゲ Broer (ドイツ ・ ロストック市土地利用、ロストック大学研究所) および博士サロメ ・ プラット (セントロ ナシオナル ・ デ ・ Biotecnología、マドリード、スペイン) に感謝してそれぞれ、博士施されたソレルとヘルプとサポートA. 体の獲得変換実験を開始する受信博士アンナ プラセンシア (トゥールーズ III ポール ・ サバティエ大学、CNRS、植物研究所 (LRSV)、カスタネット Tolosanフランス)。著者は研究所の仕事の遂行としていた間、実験のいくつかの植物・ フェラン Fontdecaba くださったカーラ ・ サンチェスの世話で彼女の貴重な援助ありがとうサラ ・ ゴメス (局・ デ ・ Biologia、UdG、ジローナ)彼らの最終的な程度のプロジェクト。
資料
| Name | Company | Catalog Number | Comments |
| Acetone | Panreac | 1.310.071.21 | |
| Acetosyringone | Acros | 115540050 | |
| Aquarium pump | Prodac | MP350 | |
| Autoclave | Ragpa Strelimatic | ||
| Bacteriological agar | Lab Conda | 1800 | |
| BAP | Duchefa | B0904 | |
| Beef extract | Lab Conda | 1700 | |
| Plant growing cabinet | Nuaire | ||
| Carbenicillin | Duchefa | C0109 | |
| Cefotaxime sodium | Duchefa | C0111 | |
| DMSO | Merck | 1029310161 | |
| Ecotron infors | HT | 29378 | |
| Ethanol | Merck | 1,009,831,011 | |
| Falcon tube | Control tecnica | CFT011500 | |
| Ferricyanate | Sigma | 101001081 | |
| Ferrocyanate | Sigma | 100979088 | |
| Flask (8.06 cm diameter and 11.3 cm height) and plastic lid for in vitro culture | Apiglass | ref16 | |
| GA3 | Sigma | G7645 | |
| Gamborg B5 media | Duchefa | G0210 | |
| Gelrite | Duchefa | G1101 | |
| Glucosa | Sigma | G5767 | |
| Kanamycin | Sigma | K1377 | |
| Leukopor tape | BSN Leukopor | BDF47467 | |
| Lupe | Wild-Heerbrugg | M420 | |
| Magnetic shaker | Agimatic | 7000243 | |
| MES hydrate | Sigma | M2933-25G | |
MgSO4 | Panreac | 131404 | |
| Microscope | Olympus | ||
| Minufugue centrifugue 5415R | Eppendorf | ||
| Murashige and Skoog media | Duchefa | M0254.0050 | |
Na2HPO4 | Panreac | 131679 | |
| NAA | Duchefa | N0903 | |
| NaCl | Panreac | 131659 | |
NaH2PO4 | Sigma | 58282 | |
| NightSea Stereo | SFA Moonting Adapter | ||
| Parafilm | Anorsa | PRFL-001-001 | |
| Peptone | Lab Conda | 1616 | |
| Petri dishes (90 x 14) | Anorsa | 200200 | |
| pHmetre | Crison | ||
| Phytotron | Inkoa | RFTI-R5485 | |
| Plant Agar | Duchefa | P1001 | |
| Refrigeratot | Liebherr Medline | ||
| Rifampicin | Duchefa | R0146 | |
| Spectinomycin | Sigma | 59007 | |
| Spectrophotometer | Shimadzu | ||
| Square plates (120 x 120) | Deltalab | 200204 | |
| Streptomycin | Sigma | S6501 | |
| Sucrose | Panreac | 131621 | |
| Surgical blades | Swann-Morton | 201 | |
| Surgical needle | NIPRO | 015/0204 | |
| Triptone | Lab Conda | 1612 | |
| Triton | Serva | 37240 | |
| Unimax 1010 shaker | Heidolph | ||
| Vacuum | Dinko | ||
| x-GlcA (5-Bromo-4-chloro-3-indoxyl-beta-D-glucuronic acid, sodium salt anhydrous) | Biosynth | B-7398 | |
| Yeast extract | Lab Conda | 1702.00 | |
| Zeatin riboside | Sigma | 1001042850 |
参考文献
- Gelvin, S. B. Traversing the Cell: Agrobacterium T-DNA's journey to the host genome. Frontiers in Plant Science. 3, 1-11 (2012).
- Lacroix, B., Citovsky, V. The roles of bacterial and host plant factors in Agrobacterium-mediated genetic transformation. The International Journal of Developmental Biology. 57 (6-8), 467-481 (2013).
- Lee, L. Y., Gelvin, S. B. T-DNA binary vectors and systems. Plant Physiology. 146 (2), 325-332 (2008).
- Ishida, Y., et al. High efficiency transformation of maize (Zea mays L.) mediated by Agrobacteriumtumefaciens. Nature Biotechnology. 14 (6), 745-750 (1996).
- White, F. F., Taylor, B. H., Huffman, G. A., Gordon, M. P., Nester, E. W. Molecular and genetic analysis of the transferred DNA regions of the root-inducing plasmid of Agrobacterium rhizogenes. Journal of Bacteriology. 164 (1), 33-44 (1985).
- Dinh, P. T. Y., Brown, C. R., Elling, A. A. RNA Interference of effector gene Mc16D10L confers resistance against Meloidogyne chitwoodi in Arabidopsis and Potato. Phytopathology. 104 (10), 1098-1106 (2014).
- Horn, P., et al. Composite potato plants with transgenic roots on non-transgenic shoots: a model system for studying gene silencing in roots. Plant Cell Reports. 33 (12), 1977-1992 (2014).
- Plasencia, A., et al. Eucalyptus hairy roots, a fast, efficient and versatile tool to explore function and expression of genes involved in wood formation. Plant Biotechnology Journal. 14 (6), 1381-1393 (2015).
- Ron, M., et al. Hairy root transformation using Agrobacteriumrhizogenes as a tool for exploring cell type-specific gene expression and function using tomato as a model. Plant Physiology. 166 (2), 455-469 (2014).
- Zhang, W., et al. Development and application of a universal and simplified multiplex RT-PCR assay to detect five potato viruses. Journal of General Plant Pathology. 83 (1), 33-45 (2017).
- Almasia, N. I., et al. Successful production of the potato antimicrobial peptide Snakin-1 in baculovirus-infected insect cells and development of specific antibodies. BMC Biotechnology. 17 (1), 1-11 (2017).
- Serra, O., et al. Silencing of StKCS6 in potato periderm leads to reduced chain lengths of suberin and wax compounds and increased peridermal transpiration. Journal of Experimental Botany. 60 (2), 697-707 (2009).
- Serra, O., et al. CYP86A33-Targeted gene silencing in potato tuber alters suberin composition, distorts suberin lamellae, and impairs the periderm's water barrier function. Plant Physiology. 149 (2), 1050-1060 (2008).
- Serra, O., et al. A feruloyl transferase involved in the biosynthesis of suberin and suberin-associated wax is required for maturation and sealing properties of potato periderm. The Plant Journal. 62 (2), 277-290 (2010).
- Boher, P., Serra, O., Soler, M., Molinas, M., Figueras, M. The potato suberin feruloyl transferase FHT which accumulates in the phellogen is induced by wounding and regulated by abscisic and salicylic acids. Journal of Experimental Botany. 64 (11), 3225-3236 (2013).
- Serra, O., Chatterjee, S., Figueras, M., Molinas, M., Stark, R. E. Deconstructing a plant macromolecular assembly: chemical architecture, molecular flexibility, and mechanical performance of natural and engineered potato suberins. Biomacromolecules. 15 (3), 799-811 (2014).
- Vulavala, V. K. R., et al. Identification of genes related to skin development in potato. Plant Molecular Biology. 94 (4-5), 481-494 (2017).
- Landgraf, R., et al. The ABC transporter ABCG1 is required for suberin formation in potato tuber periderm. The Plant Cell. 26 (8), 3403-3415 (2014).
- Verdaguer, R., et al. Silencing of the potato StNAC103 gene enhances the accumulation of suberin polyester and associated wax in tuber skin. Journal of Experimental Botany. 67 (18), 5415-5427 (2016).
- Molina, I., Li-Beisson, Y., Beisson, F., Ohlrogge, J. B., Pollard, M. Identification of an Arabidopsis feruloyl-coenzyme A transferase required for suberin synthesis. Plant Physiology. 151 (3), 1317-1328 (2009).
- Gou, J. Y., Yu, X. -. H., Liu, C. J. A hydroxycinnamoyltransferase responsible for synthesizing suberin aromatics in Arabidopsis. Proceedings of the National Academy of Sciences of the United States of America. 106 (44), 18855-18860 (2009).
- Banerjee, A. K., Prat, S., Hannapel, D. J. Efficient production of transgenic potato (S. tuberosum L. ssp. andigena) plants via Agrobacterium tumefaciens-mediated transformation. Plant Science. 170 (4), 732-738 (2006).
- Sunil Kumar, G. B., Ganapathi, T. R., Srinivas, L., Revathi, C. J., Bapat, V. a. Expression of hepatitis B surface antigen in potato hairy roots. Plant Science. 170 (5), 918-925 (2006).
- Schmidt, J. F., Moore, M. D., Pelcher, L. E., Covello, P. S. High efficiency Agrobacteriumrhizogenes-mediated transformation of Saponariavaccaria L. (Caryophyllaceae) using fluorescence selection. Plant Cell Reports. 26 (9), 1547-1554 (2007).
- Petti, C., Wendt, T., Meade, C., Mullins, E. Evidence of genotype dependency within Agrobacteriumtumefaciens in relation to the integration of vector backbone sequence in transgenic Phytophthorainfestans-tolerant potato. Journal of Bioscience and Bioengineering. 107 (3), 301-306 (2009).
- Gaudin, V., Vrain, T., Jouanin, L. Bacterial genes modifying hormonal balances in plants. Plant Physiology and Biochemistry. 32 (1), 11-29 (1994).
- Nemoto, K., et al. Function of the aux and rol genes of the Ri plasmid in plant cell division in vitro. Plant Signaling &. Behavior. 4 (12), 1145-1147 (2009).
- Visser, R. G. F., et al. Expression and inheritance of inserted markers in binary vector carrying Agrobacteriumrhizogenes-transformed potato (Solanumtuberosum L.). Theoretical and Applied Genetics. 78 (5), 705-714 (1989).
- Guillon, S., Trémouillaux-Guiller, J., Pati, P. K., Rideau, M., Gantet, P. Hairy root research: recent scenario and exciting prospects. Current Opinion in Plant Biology. 9 (3), 341-346 (2006).
- Georgiev, M. I., Agostini, E., Ludwig-Müller, J., Xu, J. Genetically transformed roots: from plant disease to biotechnological resource. Trends in Biotechnology. 30 (10), 528-537 (2012).
- Ooms, G., Lenton, J. R. T-DNA genes to study plant development: precocious tuberisation and enhanced cytokinins in A. tumefaciens transformed potato. Plant Molecular Biology. 5 (4), 205-212 (1985).
- de Vries-Uijtewaal, E., et al. Fate of introduced genetic markers in transformed root clones and regenerated plants of monohaploid and diploid potato genotypes. TAG. Theoretical and applied genetics. 78 (2), 185-193 (1989).
- Bird, D., et al. Characterization of Arabidopsis ABCG11/WBC11, an ATP binding cassette (ABC) transporter that is required for cuticular lipid secretion. The Plant Journal: For Cell and Molecular Biology. 52 (3), 485-498 (2007).
- Luo, B., Xue, X. Y., Hu, W. L., Wang, L. J., Chen, X. Y. An ABC transporter gene of Arabidopsis thaliana, AtWBC11, is involved in cuticle development and prevention of organ fusion. Plant and Cell Physiology. 48 (12), 1780-1802 (2007).
- Panikashvili, D., et al. The Arabidopsis DESPERADO/AtWBC11 transporter is required for cutin and wax secretion. Plant Physiology. 145 (4), 1345-1360 (2007).
- Panikashvili, D., et al. The Arabidopsis DSO/ABCG11 transporter affects cutin metabolism in reproductive organs and suberin in roots. Molecular Plant. 3 (3), 563-575 (2010).
- Bjelica, A., et al. Fatty acid ω-hydroxylases from Solanum tuberosum. Plant Cell Reports. 35 (12), 2435-2448 (2016).
- Ding, Y., et al. Abscisic acid coordinates nod factor and cytokinin signaling during the regulation of nodulation in Medicago truncatula. The Plant Cell. 20 (10), 2681-2695 (2008).
- Isayenkov, S., Mrosk, C., Stenzel, I., Strack, D., Hause, B. Suppression of allene oxide cyclase in hairy roots of Medicagotruncatula reduces jasmonate levels and the degree of mycorrhization with glomus intraradices 1[w]. Plant Physiology. 139 (3), 1401-1410 (2005).
- Dalton, D. A., et al. Physiological roles of glutathione S-Transferases in soybean root Nodules 1[C][W][OA]. Plant Physiology. 150 (1), 521-530 (2009).
- Limpens, E., et al. RNA interference in Agrobacteriumrhizogenes-transformed roots of Arabidopsis and Medicago truncatula. Journal of Experimental Botany. 55 (399), 983-992 (2004).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved