É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Agrobacterium tumefaciens e Agrobacterium rhizogenes-transformação mediada de batata e a atividade de promotor de um Gene de suberina por GUS Staining
Neste Artigo
Resumo
Aqui, apresentamos dois protocolos para transformar plantas de batata. A transformação de Agrobacterium tumefaciens leva a uma planta transgénica completa enquanto o Agrobacterium rhizogenes produz raízes peludas transgênicas em uma selvagem tipo de fotos que podem ser propagados Self. Nós então detectar atividade de promotor por GUS coloração nas raízes transformadas.
Resumo
Agrobacterium SP. é um dos métodos mais utilizados para obter plantas transgênicas, pois tem a capacidade de transferir e integrar sua próprias T-DNA no genoma da planta. Aqui, apresentamos dois sistemas de transformação para modificar geneticamente as plantas de batata (Solanum tuberosum). Na transformação da . tumefaciens , folhas são infectadas, as células transformadas são Selecionadodas e uma nova planta completa de transformada é regenerada usando fitohormônios em 18 semanas. Na transformação da . rhizogenes , hastes estão infectados por injetar a bactéria com uma agulha, as novas raízes peludas surgiu transformadas são detectadas usando um marcador fluorescente vermelho e as raízes não-transformadas são removidas. Em 5-6 semanas, a planta resultante é um composto de um tiro de tipo selvagem com raízes peludas transformados totalmente desenvolvidos. Para aumentar a biomassa, as raízes peludas transformadas podem ser extirpadas e self propagadas. Nós aplicamos os dois métodos de transformação Agrobacterium -mediada para obter raízes expressando o gene repórter GUS impulsionado por um promotor do gene biossintética de suberina. O procedimento de coloração GUS é fornecido e permite a localização de célula da indução promotor. Em ambos os métodos, as raízes de batata transformada mostraram GUS coloração na cor endoderme e exoderme e além disso, em raízes de a. rhizogenes transformou a atividade de GUS também foi detectado o surgimento de raízes laterais. Estes resultados sugerem que a. rhizogenes pode ser uma ferramenta rápida alternativa para estudar os genes que são expressos em raízes.
Introdução
Além de interesse econômico, a geração de plantas transgênicas tem sua própria relevância na pesquisa para demonstrar a função final dos genes e para entender melhor a fisiologia vegetal e desenvolvimento. O mais amplamente utilizado método para inserção de DNA de plantas é Agrobacterium-mediado transformação. Agrobacterium tumefaciens é capaz de gerar coroa galhas em muitas espécies de plantas, o tecido infectado pela ação do seu do plasmídeo indutor de tumor (Ti). O plasmídeo contém uma região de T-DNA com um conjunto de genes que será integrado no genoma da planta e induzir o tecido quê1,2. A troca destes genes dentro do T-DNA pelo transgene permitiu a geração de modificações específicas planta evitando efeitos fenotípicos3. Para facilitar o transgene clonagem no T-ADN, a região de T-DNA tem sido retirada em um plasmídeo independente chamado um plasmídeo de binário, enquanto o resto dos genes do plasmídeo Ti (os genes de virulência que permitem que os mecanismos de transferência e inserção de T-DNA) têm sido colocadas em um plasmídeo ajudante. Para pesquisa de biotecnologia de plantas, transformação pela . tumefaciens tem várias vantagens: não necessita de dispositivos caros, é capaz de gerar tanto transformação planta estável e transitória e baixo número de cópias são integradas de gene a cromossoma4. No entanto, para a maioria das plantas, mas não de Arabidopsis, a geração de transformants estável requer regeneração de plantas de uma única ou algumas células usando fitohormônios exógenos, tornando este processo trabalhoso e demorado. A. rhizogenes também é capaz de modificar o genoma da planta, produzindo raízes peludas ou adventícias raízes dos locais de infecção devido a expressão de genes de rol (raiz loci) codificado na raiz de indução (Ri) do plasmídeo5. Embora menos estudado do que a. tumefaciens, a. rhizogenes também é usado para a obtenção de raízes transgénicas. Neste caso, a a. rhizogenes contém o T-DNA original no plasmídeo Ri e um plasmídeo binário com um segundo T-DNA carregando o transgene. Quando o local de infecção é em hastes ou hipocótilo, uma planta composta pode ser obtida, com novas raízes transgénicas peludas emergentes de rebentos de tipo selvagem. Alternativamente, raízes transformadas peludas podem crescer autonomamente em vitro na mídia com entradas de fonte de carbono. O uso de a. rhizogenes em vez de a. tumefaciens para produzir tecidos transgênicos está ganhando relevância quando a raiz é o órgão-alvo, porque a regeneração da planta não é necessária e, portanto, é mais rápido e menos dispendioso. Estudos anteriores têm demonstrado esta metodologia apropriada para a caracterização fenotípica de raiz genes específicos6,7,8,9.
A batata (Solanum tuberosum) é a quarta mais importante colheita no mundo de acordo com a organização a alimentação e agricultura das Nações Unidas (FAO) desde que o tubérculo tem relevância nutricional para consumo humano, por ser uma boa fonte de vitaminas e minerais. Por esse motivo, a batata foi colocada no centro do atenções da biotecnologia agrícola e também é considerada como um bom modelo biológico para genética e do desenvolvimento de estudos de10,11. Transformação de batata contribuiu significativamente para a compreensão dos mecanismos moleculares subjacentes tecidos cor através da caracterização de genes envolveram em suberina e cera biossíntese12,13,14 ,15,16,17, suberina monômero transporte18 e transcrição Regulamento19. Gene da suberina feruloyl transferase, FHT, é um destes genes biossintéticos caracterizadas; seu downregulation dá origem a um forte comprometimento da proteção periderme, que está correlacionado com uma forte diminuição em ésteres Ferulato de suberina e ceras em tubérculos de batata14. Concomitantemente, nas raízes e sementes de Arabidopsis, o nocaute do seu putativo orthologue (ASFT/RWP1), também demonstrou seu papel na produção de ferulates de alquila em suberina20,21. Na batata, a linha de repórter transcriptional FHT e o anticorpo FHT mostraram respectivamente que a atividade de promotor e a proteína estão localizados na exoderme, a endoderme, os felogênio-derivados e em tecidos feridos,15.
Neste trabalho, detalhamos um protocolo utilizando a. rhizogenes para produzir transgênicas raízes peludas que são mantidas em uma sessão do tipo selvagem, gerando plantas de batata composto ou extirpado para crescer autonomamente em vitro. Nós também fornecemos o protocolo utilizando a. tumefaciens para obter plantas de batata transgénica completa. Como um estudo de caso, a. rhizogenes e a. tumefaciens transformada com o vetor binário mesmo são usados para obter as raízes com o promotor FHT dirigindo a expressão do gene repórter GUS . Os resultados são relatados e comparados.
Protocolo
O protocolo de transformação a. rhizogenes foi adaptado e modificado de Horn et al.7 e o genótipo testado foi S. tuberosum ssp. tuberosum (CV Désirée). O protocolo de transformação da . tumefaciens foi adaptado e modificado de Banerjee et al.22 e os genótipos testados foram S. tuberosum ssp. tuberosum (CV Désirée) e S. tuberosum SSP. andigena. As principais etapas de ambos os procedimentos são resumidas na Figura 1 e Figura 2, respectivamente.
Nota: Em todas as etapas do procedimento de realizar transferências em vitro , fazê-lo rapidamente e quando possível, manter as placas ou vasos fechados, minimizando assim a exposição da planta ao ar para evitar contaminação e murcha. Contrário, toda a incubação do planta foram feitas em armários sob as condições de 12 h de 24 ° C luz/12 h de 20 ° C escuro e 67 µmol m-1 s-1. Contrário, realize todas as bactérias e manipulação em vitro planta transferências em condições assépticas numa vizinhança de fluxo laminar. Todas as receitas de mídia para culturas de plantas de Agrobacterium e in vitro são fornecidas na Tabela S1.
Atenção: Deposite todas as bactérias geneticamente modificadas e as plantas para o recipiente de resíduos adequado.
1. culturas de Agrobacterium usadas para transformação
Nota: A tensão usada para a transformação da. rhizogenes foi o C58C1:Pri15837 (gentilmente cedido pelo Dr. Inge Broer) e para a a. tumefaciens foi o GV2260 (gentilmente cedido pelo Dr. Salomé Prat). A. rhizogenes foi transformada com o vetor binário PK7GWIWG2_II-RedRoot (VIB-departamento de biologia de sistemas planta na Universiteit Gent; http://gateway.psb.ugent.be) que contém um T-DNA carregando um marcador de transformação para monitorar a raiz pilosa formação. Para comparar as raízes transformadas geradas pela . rhizogenes e a. tumefaciens, ambos foram transformados com o vetor binário pKGWFS7 que contém um T-DNA carregando o promotor FHT dirigindo o gene repórter β-glucoronidase (GUS) e o gene de resistência de canamicina como um marcador selecionável de15.
- Escolher uma colônia de Agrobacterium e cultivá-la durante a noite (O/N) em 5 mL de meio YEB suplementado com antibióticos (Tabela S1) num tubo de centrífuga de 50 mL a 28 ° C com agitação a 200 rpm.
- Para a transformação da . tumefaciens , medir a densidade óptica, o que deve ser OD600 = 0.6-1.0.
- Se a densidade óptica é mais elevada, fazer uma subcultura abaixá-la para OD600 = 0.3 com mídia fresca e espere até que a cultura atinja OD600 = 0,6-1.
- Centrifugar 1 mL da cultura de Agrobacterium a 3.000 x g em uma centrífuga de bancada para 10 min à temperatura ambiente.
- Remover o sobrenadante por pipetagem e ressuspender as células em 1 mL de meio fresco de YEB sem antibióticos. Repita esta etapa para assegurar a remoção completa dos antibióticos.
- Para a transformação da . tumefaciens , no último ressuspensão adicionar o volume apropriado de YEB para obter uma densidade óptica final de OD600 = 0,8.
- Manter as células no gelo enquanto prepara as plantas para ser infectado.
2. material para a transformação da planta
- Fazer um ou dois nó estaquia também contendo o apical ou os botões auxiliares de estéril em vitro batata plantas (doador); cultivá-las em meio sólido 2MS em uns potenciômetros para 3 a 4 semanas (figura 1A e Figura 2A).
3. planta de transformação usando a. rhizogenes (Figura 1)
Nota: Este procedimento permite a obtenção de raízes peludas transformadas. Para avaliar a expressão do transgene, é necessário um controlo negativo. Para preparar o controlo negativo, siga o procedimento utilizando uma cepa da . rhizogenes unlit ou transformada com o vetor vazio que inclui o gene marcador de transformação.
- Usar placas de mídia fresco; Alternativamente, as placas podem ser mantidas a 4 ° C, com a tampa para cima, firmemente seladas com película transparente para evitar a desidratação de mídia. Para preparar os pratos quadrados mídia, inclinai-los ~ 15°, enchê-lo com 40 mL de MS e deixar solidificar. Isto irá minimizar o contato da parte aérea da planta com o meio.
- Transferência de cuidadosamente uma planta doadora do meio de 2MS para uma placa quadrada de 120 x 120 mm.
- Injetar a um haste entrenó 3 μL da cultura a. rhizogenes usando uma agulha cirúrgica e repeti-lo duas vezes por planta em diferentes entrenós quando possível.
Nota: Considere cada injecção como um evento de transformação independente (figura 1B). - Transferi imediatamente a planta inteira para uma placa quadrada com sólido MS suplementado com 0,1 mM acetosyringone. Acomodar 2 plantas por placa.
Nota: A solução 1 M acetosyringone é preparada em DMSO e pode ser armazenada a-20 ° C. - Selar a placa usando fita cirúrgica e organizá-lo verticalmente dentro de um armário de crescimento por 4 dias.
- Transferi a fábrica para uma nova placa quadrada com MS suplementado com cefotaxima sódio [500 µ g/mL] para matar a. rhizogenes.
- Depois de 10-12 dias, peludas raízes começarão aparecer (Figura 1,1D). Em seguida, excisar as raízes nativas da planta e transferir a fábrica para uma nova placa quadrada com MS suplementado com cefotaxima sódio [500 µ g/mL].
Nota: Raízes peludas transformadas podem ser verificadas por fluorescência vermelha quando usando um marcador DsRed de transformação (Figura 3D). - Para obter uma planta composta (Figura 1E), deixe as raízes transgénicas peludas crescer por 3-4 semanas em MS suplementado com cefotaxima sódio [500 μg/mL] (mudar o médio toda semana).
- Dependendo da finalidade, propaga as raízes transgénicas peludas e os controles negativos como segue.
- Transferi a planta inteira composta para uma hidropônico (Tabela S2) ou média de solo para permitir o desenvolvimento maciço.
- Para propagar individualmente as raízes peludas transformadas, usar um bisturi corta as raízes expressando o marcador vermelho fluorescente transformação (proteína DsRed) quando eles são 4-8 cm de comprimento (Figura 1E) e transferi-los para uma placa de Petri com meio sólido de Gamborg B5 suplementado com 2% de sacarose e cefotaxima sódio [500 μg/mL]. Selar as placas com película de plástico de laboratório e cultivá-las no escuro a 20 ° C.
Nota: As raízes podem ser manipuladas sob um microscópio estereoscópico equipado para detectar a fluorescência sob condições estéreis (ver Tabela de materiais). - Para a produção de biomassa (ou seja, análise de expressão do gene), cortar uma raiz muito peludo de 5cm e propagá-la em um Erlenmeyer de 150 mL com 20 mL de meio líquido de Gamborg B5 suplementado com 2% de sacarose e cefotaxima sódio [500 µ g/mL]. Cultivá-la por 6 semanas no escuro a 20 ° C e 60 rpm.
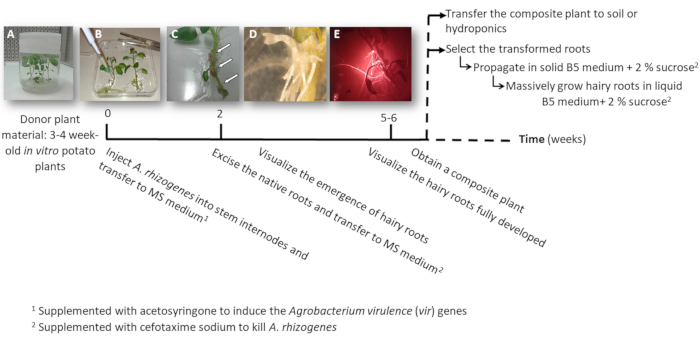
Figura 1: Linha do tempo para obter batata transgênicas raízes peludas usando a. rhizogenes. As semanas cumulativas para alcançar cada etapa do processo de transformação e as etapas subsequentes para crescer as raízes peludas são mostradas. Imagens representativas das diferentes fases são descritas: a iniciação do processo usando 3 semanas em vitro de plantas (A), em seguida de infecção das plantas injetando a. rhizogenes (B), a formação da proliferativa tecido (C, setas) com raízes peludos emergentes (D) e as raízes peludas desenvolvidas expressando o marcador vermelho fluorescente transformação DsRed (E). Clique aqui para ver uma versão maior desta figura.
4. plante transformação usando a. tumefaciens (Figura 2)
Nota: Este procedimento permite a obtenção de plantas transformadas. Para avaliar efeito do transgene, é necessário um controlo negativo. Uma opção é seguir o procedimento usando um a. tumefaciens transformada com o vetor vazio. Alternativamente, podem ser usadas plantas tipo selvagem.
- Corte e coloque uma folha das plantas de 3-4 semana de idade (Figura 2A) em uma placa de Petri. Usando um bisturi excluir o pecíolo e fazer cortes transversais (1-3, dependendo do tamanho da folha) no centro da folha para as bordas, evitando cortá-los (Figura 2B).
- Coloque a folha a flutuar em 10 mL de 2MS fresco media líquidos em uma placa de Petri com o lado abaxial imediatamente e fechar a chapa. Repita a etapa, acomodando até 15 folhas para CV Désirée e 25 folhas para SSP. umndigena (dependendo do tamanho da folha).
- Imediatamente adicione 80 µ l da . tumefaciens cultura no OD600 = 0,8 nos meios líquidos e homogeneizar a placa manualmente durante 1 min distribuir a solução bacteriana.
- Cuidadosamente com filme de vedação do selo, cubra com papel alumínio e incubar durante dois dias em uma câmara de 24 ° c e deixe a transformação ocorrer.
- Transfira as folhas mantendo lado abaxial até meio CIM (Figura 2B) e incube-os por uma semana em um armário de crescimento.
- Raspe o meio CIM com a pinça para que as folhas podem ser melhor acomodadas na mídia.
- Transfira as folhas mantendo lado abaxial até meio SIM (Figura 2) e incube-os em um armário, refrescando o meio cada 7-10 dias, até que os brotos são cerca de 2 cm de altura de crescimento.
- Raspe o meio SIM com a pinça, para que as folhas podem ser totalmente cercadas pela mídia. Quando os brotos surgiu alcançar a tampa, trabalho com altos pratos de Petri (100 x 20 mm, altura x diâmetro).
Nota: Os calos formarão após 2-3 semanas SIM médio (Figura 2D) e os brotos após 6-7 semanas (Figura 2E). Os brotos serão considerados eventos de transformação independente quando eles emergem do calo, formado a partir de feridas independentes.
- Raspe o meio SIM com a pinça, para que as folhas podem ser totalmente cercadas pela mídia. Quando os brotos surgiu alcançar a tampa, trabalho com altos pratos de Petri (100 x 20 mm, altura x diâmetro).
- Corte três tiros surgiu do cada calo (considerado o mesmo evento de transformação) (Figura 2E), transferência para frascos de cultura com meio MG suplementados com cefotaxima sódio [250 mg/L] para permitir a torcer, rotular o subconjunto com um número e incube em um crescimento do armário para 3-4 semanas ou até que os brotos são vigorosas (Figura 2F).
Nota: Ao cortar os brotos, remova bem o calo senão que não formará a raiz.- Repita o passo tantas vezes quantas linhas independentes são necessários. Até 5 transformação diferentes eventos podem ser colocados em um frasco de cultura com um diâmetro de 8 cm para trabalhar em plena confiança que as plantas de eventos diferentes não se misturam.
- Selecione a planta mais vigorosa de cada evento, cortar o segmento apical das filmagens com 3-4 entrenós e colocá-lo em um novo frasco de cultura com 2 MS suplementado com cefotaxima sódio [250 mg/L].
Nota: Em 3-6 semanas que a planta crescerá com eficiência, desenvolvendo um broto vigoroso e raízes.- Trazer de volta para a câmara os brotos não selecionado até que a planta selecionada desenvolveu-se plenamente.
- Cortar segmentos de caule da planta pelo menos um entrenó ou com o broto apical e transferi-los para nova 2 MS suplementado com cefotaxima [250 mg/L]. Incube-os no crescimento do armário.
- Replica a cada 3-4 semanas para estabelecer as linhas em vitro transformado.
Nota: O sódio cefotaxima é necessária pelo menos três transferências subsequentes a 2MS médio para ter a certeza para matar a a. tumefaciens; Depois, se supercrescimento da . tumefaciens é observado, transferi as plantas novamente para mídia de 2 MS suplementada com sódio de cefotaxima.
- Replica a cada 3-4 semanas para estabelecer as linhas em vitro transformado.
- Para caracterizar o fenótipo da planta, transferir as plantas ao solo para a sua caracterização completa ou a cultura de hidroponia para inspeção de raiz.
- Manter os tubérculos produzidos no solo para propagar e manter as linhas estabelecidas.

Figura 2: Linha do tempo para obter batata transformou plantas usando a. tumefaciens. As semanas cumulativas para alcançar cada etapa do processo de transformação e as etapas subsequentes para crescer as plantas são mostradas. Imagens representativas dos diferentes estágios são descritas: o início do processo, usando folhas de plantas em vitro 3 semana de idade (A), a transferência dos feridos e infectados deixa para a mídia CIM (B), as folhas quando transferido para SIM media (C), a visualização do calo em torno das áreas feridos após 2-3 semanas na mídia (D) SIM, a formação de tiro depois de 9-11 semanas na mídia SIM (E) e os brotos depois sendo transferido para mídia MG (F). Clique aqui para ver uma versão maior desta figura.
5. hidropônica cultura
- Preparar a solução de Hoagland a uma metade da força (0.5 x) (Tabela S2) em um balde de 10L.
- Mergulhe uma bomba de aquário para manter a homogeneidade e condições adequada de oxigênio.
- Cobrir as paredes do balde com folha de alumínio para criar raízes no escuro.
- Evitando danos de raiz, transferi em vitro plantas para cultura hidropónica.
Nota: Remova qualquer meio restantes em vitro de raízes para evitar a proliferação de microorganismos durante a incubação, agitando cuidadosamente as raízes imergidas em água. - Cobrir as plantas com película transparente como uma estufa de vidro para permitir a adequada aclimatação e incubar em câmara de crescimento.
- Faça furos no filme depois de 3 dias e removê-lo completamente uma semana depois.
- Substitua com mídia fresca em 10 dias.
6. ensaio de gene repórter histochemical GUS
Nota: No nosso caso o GUS análise foi realizada com raízes de 2-3 semanas, cultivadas em hidroponia ou in vitro.
- Corrigir as raízes com acetona gelada de 90% (v/v) e incube-lo por 20 minutos no gelo.
- Execute duas lavagens com água destilada.
- Adicione fresco GUS coloração solução (tabela 1) e aplicar vácuo (-70 Pa) por 20 min.
- Incube a 37 ° C, no escuro, para proteger o GUS fotossensível por 4h ou até uma cor azul é visível.
Nota: A presença de ferri - e ferrocianeto em solução GUS minimizar a difusão dos produtos de reação e fornecer localização mais precisa.
Atenção: Usar uma coifa e utilizar vestuário de protecção ao manusear os derivados tóxicos de cianeto em solução GUS (o ferricianeto de potássio e ferrocianeto de potássio). O substrato de GUS e o material de descarte devem ser descartados com segurança. - Remover o GUS solução de coloração e descartá-lo em recipientes apropriados.
- Execute duas lavagens com etanol 70% (v/v).
- Observe em um microscópio de campo claro.
Nota: GUS coloração é estável por algumas semanas; no entanto, durante a primeira semana, o sinal de GUS é claro e difunde-se menos em células de vizinhos. Para uma conservação mais longa, fechar o tubo e armazená-lo em 4 ° C.
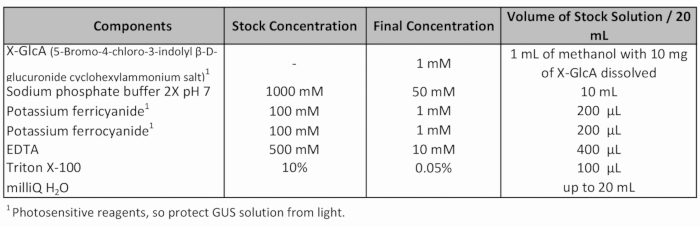
Tabela 1: Receita de solução coloração de GUS.
Resultados
Agrobacterium rhizogenes -mediado transformação de batata
Neste manuscrito, é apresentado o procedimento passo a passo para obter a raiz transformada com a. rhizogenes . A Figura 1 apresenta uma visão geral do processo, que ao todo leva cerca de 5-6 semanas (a partir de injeção da . rhizogenes para obtenção de raízes peludas total...
Discussão
Em batata, o sistema mais comum para obter plantas transgênicas completas estáveis usa a transformação por cepas de Agrobacterium tumefaciens que exigem organogênese usando fitohormônios exógenos. Embora os protocolos de Agrobacterium baseado tem potencial para integrar o vetor não-T-DNA sequência25, esta metodologia é ainda o mais fácil e menos caro disponível para transformar plantas de batata. Durante os últimos anos, o interesse na . rhizogenes-transform...
Divulgações
Os autores têm sem conflitos de interesse a divulgar.
Agradecimentos
Este trabalho foi apoiado pelo Ministerio de Innovación y Ciencia (AGL2009-13745, FPI grant para PB), o Ministerio de Economía y competitividade e FEDER financiamento (36725-AGL2012, AGL2015-67495-C2-1-R) e a Universidade de Girona (bolsa de doutorado para SF e grant SING11/1). Os autores são gratos ao Dr. Inge Broer (Instituto para o uso da terra, Universidade de Rostock, Rostock, Alemanha) e Dr. Salomé Prat (Centro Nacional de Biotecnología, Madrid, Espanha) para fornecer o a. rhizogenes e a cepa da . tumefaciens , respectivamente e Dr. Marçal Soler e Dr. Anna Plasencia para a ajuda e o apoio recebido no início das experiências de transformação a. rhizogenes (Toulouse III Paul Sabatier University — CNRS, laboratório de pesquisa da planta (LRSV), Castanet Tolosan, A França). Os autores agradecer sua valiosa assistência na realização do trabalho de laboratório e cuidar de plantas e Ferran Fontdecaba e Carla Sánchez assistida com alguns dos experimentos enquanto eles estavam fazendo Sara Gómez (Departament de Biologia, UdG, Girona) seus projetos de grau final.
Materiais
| Name | Company | Catalog Number | Comments |
| Acetone | Panreac | 1.310.071.21 | |
| Acetosyringone | Acros | 115540050 | |
| Aquarium pump | Prodac | MP350 | |
| Autoclave | Ragpa Strelimatic | ||
| Bacteriological agar | Lab Conda | 1800 | |
| BAP | Duchefa | B0904 | |
| Beef extract | Lab Conda | 1700 | |
| Plant growing cabinet | Nuaire | ||
| Carbenicillin | Duchefa | C0109 | |
| Cefotaxime sodium | Duchefa | C0111 | |
| DMSO | Merck | 1029310161 | |
| Ecotron infors | HT | 29378 | |
| Ethanol | Merck | 1,009,831,011 | |
| Falcon tube | Control tecnica | CFT011500 | |
| Ferricyanate | Sigma | 101001081 | |
| Ferrocyanate | Sigma | 100979088 | |
| Flask (8.06 cm diameter and 11.3 cm height) and plastic lid for in vitro culture | Apiglass | ref16 | |
| GA3 | Sigma | G7645 | |
| Gamborg B5 media | Duchefa | G0210 | |
| Gelrite | Duchefa | G1101 | |
| Glucosa | Sigma | G5767 | |
| Kanamycin | Sigma | K1377 | |
| Leukopor tape | BSN Leukopor | BDF47467 | |
| Lupe | Wild-Heerbrugg | M420 | |
| Magnetic shaker | Agimatic | 7000243 | |
| MES hydrate | Sigma | M2933-25G | |
MgSO4 | Panreac | 131404 | |
| Microscope | Olympus | ||
| Minufugue centrifugue 5415R | Eppendorf | ||
| Murashige and Skoog media | Duchefa | M0254.0050 | |
Na2HPO4 | Panreac | 131679 | |
| NAA | Duchefa | N0903 | |
| NaCl | Panreac | 131659 | |
NaH2PO4 | Sigma | 58282 | |
| NightSea Stereo | SFA Moonting Adapter | ||
| Parafilm | Anorsa | PRFL-001-001 | |
| Peptone | Lab Conda | 1616 | |
| Petri dishes (90 x 14) | Anorsa | 200200 | |
| pHmetre | Crison | ||
| Phytotron | Inkoa | RFTI-R5485 | |
| Plant Agar | Duchefa | P1001 | |
| Refrigeratot | Liebherr Medline | ||
| Rifampicin | Duchefa | R0146 | |
| Spectinomycin | Sigma | 59007 | |
| Spectrophotometer | Shimadzu | ||
| Square plates (120 x 120) | Deltalab | 200204 | |
| Streptomycin | Sigma | S6501 | |
| Sucrose | Panreac | 131621 | |
| Surgical blades | Swann-Morton | 201 | |
| Surgical needle | NIPRO | 015/0204 | |
| Triptone | Lab Conda | 1612 | |
| Triton | Serva | 37240 | |
| Unimax 1010 shaker | Heidolph | ||
| Vacuum | Dinko | ||
| x-GlcA (5-Bromo-4-chloro-3-indoxyl-beta-D-glucuronic acid, sodium salt anhydrous) | Biosynth | B-7398 | |
| Yeast extract | Lab Conda | 1702.00 | |
| Zeatin riboside | Sigma | 1001042850 |
Referências
- Gelvin, S. B. Traversing the Cell: Agrobacterium T-DNA's journey to the host genome. Frontiers in Plant Science. 3, 1-11 (2012).
- Lacroix, B., Citovsky, V. The roles of bacterial and host plant factors in Agrobacterium-mediated genetic transformation. The International Journal of Developmental Biology. 57 (6-8), 467-481 (2013).
- Lee, L. Y., Gelvin, S. B. T-DNA binary vectors and systems. Plant Physiology. 146 (2), 325-332 (2008).
- Ishida, Y., et al. High efficiency transformation of maize (Zea mays L.) mediated by Agrobacteriumtumefaciens. Nature Biotechnology. 14 (6), 745-750 (1996).
- White, F. F., Taylor, B. H., Huffman, G. A., Gordon, M. P., Nester, E. W. Molecular and genetic analysis of the transferred DNA regions of the root-inducing plasmid of Agrobacterium rhizogenes. Journal of Bacteriology. 164 (1), 33-44 (1985).
- Dinh, P. T. Y., Brown, C. R., Elling, A. A. RNA Interference of effector gene Mc16D10L confers resistance against Meloidogyne chitwoodi in Arabidopsis and Potato. Phytopathology. 104 (10), 1098-1106 (2014).
- Horn, P., et al. Composite potato plants with transgenic roots on non-transgenic shoots: a model system for studying gene silencing in roots. Plant Cell Reports. 33 (12), 1977-1992 (2014).
- Plasencia, A., et al. Eucalyptus hairy roots, a fast, efficient and versatile tool to explore function and expression of genes involved in wood formation. Plant Biotechnology Journal. 14 (6), 1381-1393 (2015).
- Ron, M., et al. Hairy root transformation using Agrobacteriumrhizogenes as a tool for exploring cell type-specific gene expression and function using tomato as a model. Plant Physiology. 166 (2), 455-469 (2014).
- Zhang, W., et al. Development and application of a universal and simplified multiplex RT-PCR assay to detect five potato viruses. Journal of General Plant Pathology. 83 (1), 33-45 (2017).
- Almasia, N. I., et al. Successful production of the potato antimicrobial peptide Snakin-1 in baculovirus-infected insect cells and development of specific antibodies. BMC Biotechnology. 17 (1), 1-11 (2017).
- Serra, O., et al. Silencing of StKCS6 in potato periderm leads to reduced chain lengths of suberin and wax compounds and increased peridermal transpiration. Journal of Experimental Botany. 60 (2), 697-707 (2009).
- Serra, O., et al. CYP86A33-Targeted gene silencing in potato tuber alters suberin composition, distorts suberin lamellae, and impairs the periderm's water barrier function. Plant Physiology. 149 (2), 1050-1060 (2008).
- Serra, O., et al. A feruloyl transferase involved in the biosynthesis of suberin and suberin-associated wax is required for maturation and sealing properties of potato periderm. The Plant Journal. 62 (2), 277-290 (2010).
- Boher, P., Serra, O., Soler, M., Molinas, M., Figueras, M. The potato suberin feruloyl transferase FHT which accumulates in the phellogen is induced by wounding and regulated by abscisic and salicylic acids. Journal of Experimental Botany. 64 (11), 3225-3236 (2013).
- Serra, O., Chatterjee, S., Figueras, M., Molinas, M., Stark, R. E. Deconstructing a plant macromolecular assembly: chemical architecture, molecular flexibility, and mechanical performance of natural and engineered potato suberins. Biomacromolecules. 15 (3), 799-811 (2014).
- Vulavala, V. K. R., et al. Identification of genes related to skin development in potato. Plant Molecular Biology. 94 (4-5), 481-494 (2017).
- Landgraf, R., et al. The ABC transporter ABCG1 is required for suberin formation in potato tuber periderm. The Plant Cell. 26 (8), 3403-3415 (2014).
- Verdaguer, R., et al. Silencing of the potato StNAC103 gene enhances the accumulation of suberin polyester and associated wax in tuber skin. Journal of Experimental Botany. 67 (18), 5415-5427 (2016).
- Molina, I., Li-Beisson, Y., Beisson, F., Ohlrogge, J. B., Pollard, M. Identification of an Arabidopsis feruloyl-coenzyme A transferase required for suberin synthesis. Plant Physiology. 151 (3), 1317-1328 (2009).
- Gou, J. Y., Yu, X. -. H., Liu, C. J. A hydroxycinnamoyltransferase responsible for synthesizing suberin aromatics in Arabidopsis. Proceedings of the National Academy of Sciences of the United States of America. 106 (44), 18855-18860 (2009).
- Banerjee, A. K., Prat, S., Hannapel, D. J. Efficient production of transgenic potato (S. tuberosum L. ssp. andigena) plants via Agrobacterium tumefaciens-mediated transformation. Plant Science. 170 (4), 732-738 (2006).
- Sunil Kumar, G. B., Ganapathi, T. R., Srinivas, L., Revathi, C. J., Bapat, V. a. Expression of hepatitis B surface antigen in potato hairy roots. Plant Science. 170 (5), 918-925 (2006).
- Schmidt, J. F., Moore, M. D., Pelcher, L. E., Covello, P. S. High efficiency Agrobacteriumrhizogenes-mediated transformation of Saponariavaccaria L. (Caryophyllaceae) using fluorescence selection. Plant Cell Reports. 26 (9), 1547-1554 (2007).
- Petti, C., Wendt, T., Meade, C., Mullins, E. Evidence of genotype dependency within Agrobacteriumtumefaciens in relation to the integration of vector backbone sequence in transgenic Phytophthorainfestans-tolerant potato. Journal of Bioscience and Bioengineering. 107 (3), 301-306 (2009).
- Gaudin, V., Vrain, T., Jouanin, L. Bacterial genes modifying hormonal balances in plants. Plant Physiology and Biochemistry. 32 (1), 11-29 (1994).
- Nemoto, K., et al. Function of the aux and rol genes of the Ri plasmid in plant cell division in vitro. Plant Signaling &. Behavior. 4 (12), 1145-1147 (2009).
- Visser, R. G. F., et al. Expression and inheritance of inserted markers in binary vector carrying Agrobacteriumrhizogenes-transformed potato (Solanumtuberosum L.). Theoretical and Applied Genetics. 78 (5), 705-714 (1989).
- Guillon, S., Trémouillaux-Guiller, J., Pati, P. K., Rideau, M., Gantet, P. Hairy root research: recent scenario and exciting prospects. Current Opinion in Plant Biology. 9 (3), 341-346 (2006).
- Georgiev, M. I., Agostini, E., Ludwig-Müller, J., Xu, J. Genetically transformed roots: from plant disease to biotechnological resource. Trends in Biotechnology. 30 (10), 528-537 (2012).
- Ooms, G., Lenton, J. R. T-DNA genes to study plant development: precocious tuberisation and enhanced cytokinins in A. tumefaciens transformed potato. Plant Molecular Biology. 5 (4), 205-212 (1985).
- de Vries-Uijtewaal, E., et al. Fate of introduced genetic markers in transformed root clones and regenerated plants of monohaploid and diploid potato genotypes. TAG. Theoretical and applied genetics. 78 (2), 185-193 (1989).
- Bird, D., et al. Characterization of Arabidopsis ABCG11/WBC11, an ATP binding cassette (ABC) transporter that is required for cuticular lipid secretion. The Plant Journal: For Cell and Molecular Biology. 52 (3), 485-498 (2007).
- Luo, B., Xue, X. Y., Hu, W. L., Wang, L. J., Chen, X. Y. An ABC transporter gene of Arabidopsis thaliana, AtWBC11, is involved in cuticle development and prevention of organ fusion. Plant and Cell Physiology. 48 (12), 1780-1802 (2007).
- Panikashvili, D., et al. The Arabidopsis DESPERADO/AtWBC11 transporter is required for cutin and wax secretion. Plant Physiology. 145 (4), 1345-1360 (2007).
- Panikashvili, D., et al. The Arabidopsis DSO/ABCG11 transporter affects cutin metabolism in reproductive organs and suberin in roots. Molecular Plant. 3 (3), 563-575 (2010).
- Bjelica, A., et al. Fatty acid ω-hydroxylases from Solanum tuberosum. Plant Cell Reports. 35 (12), 2435-2448 (2016).
- Ding, Y., et al. Abscisic acid coordinates nod factor and cytokinin signaling during the regulation of nodulation in Medicago truncatula. The Plant Cell. 20 (10), 2681-2695 (2008).
- Isayenkov, S., Mrosk, C., Stenzel, I., Strack, D., Hause, B. Suppression of allene oxide cyclase in hairy roots of Medicagotruncatula reduces jasmonate levels and the degree of mycorrhization with glomus intraradices 1[w]. Plant Physiology. 139 (3), 1401-1410 (2005).
- Dalton, D. A., et al. Physiological roles of glutathione S-Transferases in soybean root Nodules 1[C][W][OA]. Plant Physiology. 150 (1), 521-530 (2009).
- Limpens, E., et al. RNA interference in Agrobacteriumrhizogenes-transformed roots of Arabidopsis and Medicago truncatula. Journal of Experimental Botany. 55 (399), 983-992 (2004).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados