Method Article
体内の内因性遺伝子操作のリモート制御システムのアプリケーション
要約
このプロトコルでは、生きた動物の細胞強化lacリプレッサーとテト活性化システムを使用して興味の内因性遺伝子のトランスクリプションを条件付きで制御できるモデル システムを生成するために必要な手順について説明します。
要約
ここでリモート コントロール システム (再反転可能Manipulation of Transcription Endogenous 座) のリバーシブルと可変式制御を実装するためのプロトコルを記述します。生活の興味の内因性遺伝子モデル システムです。リモート コントロール システムでは、ダウンまたは単一の生物学的システムで標的遺伝子の発現を達成するために強化されたラック抑圧とテト活性化システムを採用しています。結合部位が柔軟に位置するリプレッサーからタイトな抑圧を実現できます転写伸長を阻害することによって転写開始部位の下流まで。堅牢なアップレギュレーションがテト同種のプロモーターの転写活性化因子をターゲットに内因性遺伝子のトランスクリプションを高めることによって得られます。この可逆と可変式コントロールが適用され生物で繰り返し撤回できます。効力と内因性Dnmt1 、ここに示されているように、システムの汎用性より正確な体内機能解析により、さまざまな表現のレベルでの遺伝子機能の調査との可逆性をテストすることによって、表現型。
概要
遺伝子ノックアウトまたは形質は、動物モデルでの遺伝子の機能を研究する効果的な手段をされています。しかし、これらの方法による発現制御 (オン/オフ) 二分、時間的、従って遺伝子の完全な機能的なスペクトルを明らかにすることができるではないです。条件付き Cre/LoxP技術は、時空間的不活性化や遺伝子機能の活性化を許可しているが、二分本来引き続き細胞致死性と不可逆性1,2などの制限を提起,3。 この隙間を埋めるために条件付きのノックダウン アプローチはテトを使用して開発されている-shRNA や miRNA4を規制。しかし、オフターゲット効果の RNAi5への関心のまま、体内.を制御するために挑戦されています。もっと最近、CRISPR/Cas を介した転写制御技術はアップと内因性遺伝子発現のダウンレギュレーションの両方を達成するためのより柔軟なアプローチを導入し、実証のユーティリティ6,7.しかし、CRISPR/Cas を介した転写制御の有効性は、まだ体内の明確な KRAB ベース抑圧の可逆性はまだ KRAB で見たように、強い抑圧との相互作用の蛋白質 KAP1 が誘導するために示されています。永久的な遺伝子8,9を黙らせます。
新規転写制御システムの条件付きでリバーシブルの内因性遺伝子の発現を制御することができるこれらの制限に対処するために開発した、マウスを使用して可変的設計原バイナリ転写規制システム10。規制配位子、 lacとテトなどを原核生物バイナリ転写規制システムはこのような可逆を有効にしているし、可変式制御11,12,13, 14. ただし、現在のバイナリ システムの不十分な抑制効力哺乳類における内因性遺伝子の発現を制御するため、普及の妨げとなった。内在性遺伝子の抑圧の十分に強力な強化されたラック抑圧システムを開発し、達成するために内因性遺伝子の同種のプロモーターに直接テト転写活性化因子をターゲットの新たな戦略を採用堅牢なアップレギュレーション (図 1)10。この技術により、ほぼ可変、誘導、かつ可逆的な10の内因性Dnmt1遺伝子の発現制御を 2 桁を実現しました。ここでは、他の遺伝子と生物モデル種としてマウスを用いた in vivo 応用のためのステップバイ ステップの手順を提供します。

図 1: リモート コントロール システムの概要。内因性のターゲット遺伝子の転写は、設計されたラックのリプレッサーとテト活性化システムを使用して調整できます。ターゲット遺伝子プロモーターやイントロンはタイトバインディング LacIGY リプレッサーおよび/またはrtの演算子を含めるように設計されて TA M2 活性化。R では、Repron (担当者2977億 intr上)、部分的なウサギのベータ globin イントロン プラス 12 対称 lac オペレーター (S) が含まれていることを示します。T は、テトの演算子を示します。リプレッサーおよび/または活性化/組織固有のプロモーターから表現されます。ターゲット遺伝子の発現、可逆チューニングできる目的の式のレベルに IPTG (イソプロピル β-D-1-thiogalactopyranoside、LacIGY リプレッサーの拮抗薬) またはドキシサイクリン (Dox) の管理によって。この図は、李ら10から変更されているこの図の拡大版を表示するのにはここをクリックしてください。
このプロトコルを開始する前に、表 1遺伝子発現の目的のコントロールの関連するステップを識別するを確認します。たとえば、"遺伝子 X"のリバーシブルのダウンレギュレーションを可能にするマウスを設計、セクション 1、3、および 4 を完了、プロトコルの下。表 1はまた、リモート コントロール システムの必要なコンポーネントをまとめたものです。
| 目的の式の変更 | 弾圧のみ | アクティブ化のみ | 抑圧と活性化 |
| プロトコルの関連セクション | 1, 3-4 | 2-4 | 1-4 |
| ターゲット遺伝子で必要なリモート制御シーケンス | Repron (「抑圧イントロン"; 12 対称 lac オペレーター プラス部分的なウサギのベータ globin イントロン) | テト オペレーター | Repron とテトのオペレーター |
| リモート制御シーケンスの場所 | イントロン | プロモーター | イントロン ・ プロモーター |
| 目的のコントロールに必要な活性化/抑制因子 | LacIGY リプレッサー | 情報を頼むこと M2 活性化 | LacIGY リプレッサーと情報を頼むこと M2 活性化 |
| 規制配位子 | IPTG | ドキシサイクリン | IPTG および/またはドキシサイクリン |
表 1:リモート コントロール コンポーネントの概要します。
プロトコル
すべての動物の手続きを実施した機関動物ケアおよび使用委員会 (IACUC)、南カリフォルニア大学とヴァン アンデル研究所のガイドに準拠してのケアと実験動物の使用のための承認健康15の国家機関。
1. リモート制御による抑圧のための興味の遺伝子を変更します。
- Repron シーケンスの挿入のための興味の遺伝子の 5' 末端に向かって転写不活性イントロンを識別する、次のガイドラインを使用して ("担当者2977億 intrの"; 12 対称ラック演算子に加えて、部分的なウサギのベータ globin イントロン)。興味の遺伝子のための代替のプロモーター認識し制御する成績によるとイントロンを選択 (すべての成績証明書または 1 つによって共有イントロンすなわち目的のトラン スクリプトに固有)。
注: 遺伝子イントロンなしまたは 3' 端の方と、プロモーターに Repron シーケンスを挿入 (イ ・ら10詳細な手順を参照してください)。- 興味の遺伝子のためのゲノムの配列を取得します。
- UCSC のゲノムのブラウザーの16,17に移動し、マウスのゲノム (マウス GRCm38/mm10 出版時点で)、[ゲノム] タブでは、現在の最新の下書きを選択します。
- 遺伝子のトラン スクリプトを表示するには、検索バーに名前または興味の遺伝子の記号を入力します。Goをクリックします。
- 興味の遺伝子のため希望のトラン スクリプトのバリアントを選択します。
- (暗いボックスに以前に選択したトラン スクリプトのシンボルになります) 興味のトラン スクリプトのバリアントの横の遺伝子記号をクリックします。
- シーケンスとツールとデータベースへのリンクのバナーの下ゲノム配列のリンクをクリックします。
- シーケンス取得地域オプション、選択だけエクソン (5' UTR、CD、および 3' UTR)、イントロン、およびデフォルトの遺伝子ごとに 1 つの FASTA のレコード。シーケンスの書式設定オプションでは、大文字、小文字で他のすべてのエクソンとマスクが繰り返され N (反復配列を隠そう) を選択します。送信をクリックします。
- 上-を維持する、このシーケンスを保存し、小文字の書式設定、ドキュメントやプログラムを付けることができます。
- 遺伝子調節機能を持つ領域を示す可能性のある CpG の島の中断を避けるため。
注: 5' イントロンが Repron シーケンスの挿入のために望ましいが、最初のイントロンが CpG の島 (この手順で検査される) などの転写調節または要素を含めるエンハンサー (1.1.4 の手順で検査される)、Repron のために避けるべきであります。挿入。- UCSC のゲノムのブラウザーの発現と制御のバナー、 CpG の島トラックの表示を選択、更新をクリックします。
- 5' イントロンにズームイン、各 CpG の島 (存在する場合は出版物の時に緑色で表示) をクリックし、この機能のビューの DNAを選択します。
- N が繰り返されマスクを選択すると、CpG の島のシーケンスを取得するDNA を取得をを選択します。
- 元のシーケンスのファイルでこれらのシーケンスをオーバーレイし、可能な遺伝子の規定する機能のために回避するイントロン領域としてこれらの注釈を付けます。
- 彼らは、調節機能を持っている場合に、非コーディングの Rna の中断を避けるため。
- UCSC のゲノムのブラウザーの遺伝子と遺伝子の予言バナー、 GENCODE (Ensembl)トラックの表示を選択、更新をクリックします。
- 5' イントロンにズームイン、(存在する場合は出版物の時に緑色で表示)、各非コーディングの RNA のクリックし、その染色体の座標をクリックしてそれぞれの DNA シーケンスを取得します。
- [表示] ドロップ ダウン メニューでDNA、しマスクが繰り返され Nをクリックします。DNA を取得] をクリックします。
- 元のシーケンスのファイルでこれらのシーケンスをオーバーレイし、可能な遺伝子の規定する機能のために回避するイントロン領域としてこれらの注釈を付けます。
- エンハンサー、H3K4me1、H3K27ac、や DNase などの tissue(s) で署名とイントロン領域を避ける私 CTCF 結合と同様、過敏症18,19,20,21,22,23をループの増強物を規制するサイト。
- エンコード データベース24,25に移動し、実験アイコンを選択します。
- アッセイ タイプのチップ seqやDNase seqを選択し、他のカテゴリ (生物バイオ型等) に従って設計するセルを設定します。
- 機能を選択した後、青でピクトグラムを合わせる、(出版物の時に一番左の絵文字) を結果リストとして表示するが表示されます 1 つを選択します。
- H3K4me1、H3K27ac、DNase のターゲットのデータセットを選択・設計するセルに最も近い CTCF。
- 各関連のデータセット内でファイル] セクションまでスクロール、その mm10 (または最新のゲノム バージョン) ことを確認、UCSC を選択し、表示ボタンをクリックします。
- UCSC のゲノムのブラウザーおよび興味の遺伝子の 5' イントロンにズームイン、クリックしてごとの H3K4me1、H3K27ac、DNase 私と、それぞれの注釈付きピーク トラックの CTCF ピークします。
- その染色体の座標をクリックして各ピーク領域の DNA シーケンスを取得します。
- [表示] ドロップ ダウン メニューでDNA、しマスクが繰り返され Nをクリックします。DNA を取得] をクリックします。
- 元のシーケンスのファイルでこれらのシーケンスをオーバーレイし、可能な遺伝子の規定する機能のために回避するイントロン領域としてこれらの注釈を付けます。
- エクソンの適切な選択的スプライシングと干渉しないように、シーケンスをスプライシング コンセンサスの混乱を避けるため。
注: スプライシングに必要なシーケンスに閉じ込め、イントロンの 5' 端に約 6 拠点に26と 3 ' 約 60 拠点終了27、これらからかなり広いマージンを可能にする大規模なイントロンを選択することをお勧めです。接続に影響を与える可能性を最小限に抑えるためコンセンサス地域。潜在的なスプライス シーケンスのより徹底的な分析には SVM BPfinder28, などのイントロン解析ツールの使用をお勧めします。
- 興味の遺伝子のためのゲノムの配列を取得します。
- 特定した後 (として例示Dnmt1の補足データで)、上記の条件を満たしているがオンライン sgRNA を使用してシーケンスを画面イントロン領域は高い特異性を持つ地域で sgRNA を識別するツールをデザインして予測効率スコア。
- CRISPOR29など選択したオンライン sgRNA デザイン ツールに移動します。
- 興味のイントロン領域の塩基配列を入力、関連する参照ゲノムを指定し、目的 Protospacer 隣接するモチーフ (PAM) を選択します。送信をクリックします。
- 特異性スコア順予測 sgRNAs、29のスコア予測効率を持つ 1 つまたは複数の sgRNAs を選択します。
- オプション: 効果的な sgRNA を使用しての可能性を最大限に最初の in vitro アッセイ30、いくつかのトップ得点 sgRNAs の開裂の効率をテストし、生体内で最も効率的な sgRNA を続行します。
- 着陸パッド、補足図 1 a B、sgRNA サイト31 をカットに対応する 60 ベース相同の腕によって両側で例示としてピット (ターゲット遺伝子の前核インジェクション ベース) を含む DNA テンプレートをデザインします。.
注: 着陸パッド 2 つの有性loxPサイト (JT15 と Lox2272) が含まれています、2 段階のアプローチを使用して大規模なシーケンスのターゲット カーソルを有効にこの挿入の接合が不可解なスプライス サイトを作成しないことを必ず。また、Repron シーケンスを直接挿入する胚性幹細胞 (ESC) - 基づくノック - 戦略を使用できます。 - 着陸パッド、sgRNA、Cas9 蛋白質と一本鎖 DNA のテンプレートの準備および確立したプロトコル32,33によると (B6C3F1/J マウスまたはその他の必要なひずみ) から受精卵に microinject。
- 着陸パッド ノックイン マウスの画面。
- 相補的な PCR プライマーを設計 genomic 位置、 Dnmt1の補足図 1に示されているように相同性の腕によって対象地域の外。プライマーを設計する際は、ゲノム シーケンスを繰り返しを避けます。
- 確立したプロトコル34に従ってマウスの尾クリップから DNA を抽出します。
- PCR を使用して、着陸パッド挿入してマウスを識別するために電気泳動のゲルします。
- ノックで成功した PCR 産物の配列によってを確認します。
注: 不要な大規模な削除や再編成を CRISPR/Cas935, オフのターゲットを編集するため検診前に進む35,36,37ので注意して導入できます。
- 本院 mRNA38と JTZ17 と Lox2272 組換えサイト31,39,40、が並ぶ Repron シーケンスを含む組換えプラスミド microinject 着陸パッドのマウス受精卵を使用して、41によると設立方法38,42,43です。
- Repron カーソルとマウスの画面。
- Repron 挿入外の genomic 位置に相補的な PCR プライマーを設計します。プライマーを設計する際は、ゲノム シーケンスを繰り返しを避けます。
- 確立したプロトコル34に従ってマウスの尾クリップから DNA を抽出します。
- PCR を使用して、ゲルの電気泳動 Repron カーソルとマウスを識別するために。
- ノックでは PCR 産物の配列によって成功したを確認します。
2. リモート制御によるアップレギュレーションの興味の遺伝子を変更します。
- 以下のガイドラインを使用して、テトオペレータ シーケンスの挿入時にプロモーターの機能を混乱させるようである興味の遺伝子の促進者の地域を識別します。興味の遺伝子のための代替のプロモーターを認識して、成績に応じて制御するプロモーターを選択 (すなわちすべての成績証明書または 1 つによって共有プロモーター目的のトラン スクリプトに固有)。
- 興味のプロモーターのゲノムの配列を取得します。
- UCSC のゲノムのブラウザーの16,17に移動し、マウスのゲノム (マウス GRCm38/mm10 出版時点で)、[ゲノム] タブでは、現在の最新の下書きを選択します。
- 遺伝子のトラン スクリプトを表示するには、検索バーに名前または興味の遺伝子の記号を入力します。Goをクリックします。
- 興味の遺伝子のため希望のトラン スクリプトのバリアントを選択します。
- (暗いボックスに以前に選択したコピーの遺伝子の記号になります) 興味のトラン スクリプトのバリアントの横の遺伝子記号をクリックします。
- シーケンスとツールとデータベースへのリンクのバナーの下ゲノム配列のリンクをクリックします。
- シーケンス取得地域オプションプロモーター/上流で 1000 拠点のみを選択します。シーケンスの書式設定オプション(反復配列を隠そう) N が繰り返されマスクを選択します。送信をクリックします。
- ドキュメントまたは注釈することができますプログラムでこのプロモーターを保存します。
- これらのシーケンスを中断としての推定転写因子結合部位の無料ですが、選択した領域は、内因性遺伝子の発現を変更できます。
- UCSC のゲノムのブラウザーに移動し、マウスのゲノムの最新バージョンを開きます。
- マッピングとシーケンスのバナー上ハブをトラックを選択します。
- Mm10 JASPAR 2018 TFBS (または最新の JASPAR バージョン) のハブの名の横にあるをクリックします。
- 遺伝子のトラン スクリプトを表示するには、検索バーに名前または興味の遺伝子の記号を入力します。Goをクリックします。
- 興味の遺伝子のため希望のトラン スクリプトのバリアントを選択します。
- JASPAR 2018 TFBSバナー スクロールし、スキッシュなど、トラックの適切な表示オプションを選択する] ドロップダウン矢印をクリックします。更新をクリックします。
- 興味の遺伝子のプロモーター領域にズームし、JASPAR トラックによると転写因子結合部位の自由 (または比較的自由) 領域を識別します。これらの地域の染色体の座標を記録します。
- 検索バーに入力して行くをクリックしてこれらの染色体の座標のゲノムの配列を取得します。[表示] ドロップ ダウン メニューでDNA、しマスクが繰り返され Nをクリックします。DNA を取得] をクリックします。
- 元のシーケンスのファイルでこれらのシーケンスをオーバーレイし、転写因子結合の不足のため対象とする理想的なプロモーター領域としてこれらの注釈を付けます。
- これらのシーケンス内で上流が興味の遺伝子の転写開始部位の近くにある perturbable のプロモーター領域を選択します。
注: に近すぎる転写開始部位はプロモーター活性を損なうことのチャンスを高めるかもしれないが挿入があまりにも遠くにある挿入アップレギュレーションのレベルを減らすかもしれない。転写開始部位の上流約 200 ヒトをもたらした 2 つのプロモーターの堅牢なアップレギュレーションテトオペレータ シーケンスを挿入する (見なさい議論)10をテストしました。
- 興味のプロモーターのゲノムの配列を取得します。
- 高い特異性と予測効率スコアの地域 sgRNA を識別するためにオンライン sgRNA デザイン ツールを使用して選択したプロモーター領域を画面します。
- CRISPOR29など選択したオンライン sgRNA デザイン ツールに移動します。
- 関心領域のシーケンスを入力、関連する参照ゲノムを指定し、目的 Protospacer 隣接するモチーフ (PAM) を選択します。送信をクリックします。
- 特異性スコア順予測 sgRNAs、29のスコア予測効率を持つ 1 つまたは複数の sgRNAs を選択します。
- オプション: 効果的な sgRNA を使用しての可能性を最大限に最初の in vitro アッセイ30、いくつか sgRNAs の開裂の効率をテストし、生体内で最も効率的な sgRNA を続行します。
- カット サイト31,33sgRNA に対応する 60 ベース相同の腕によって両側テト演算子を含む DNA テンプレートをデザインします。
注:テトオペレーター数はカスタマイズできます。タンデムで 2 ~ 4テトオペレータ シーケンスの挿入が以前有効性が示されているが、原則として以上のオペレーターがより高い発現を駆動するため望ましい。また、戦略ノックで ESC ベースはテト演算子を挿入するのには使用できます。- 省略可能: 提案された変更、おそらく興味の遺伝子の内在性転写活性は中断されません、実験的証拠のクローン (pGL3-Basic など)、ホタルのルシフェラーゼのベクトルに設計されたプロモーターとルシフェラーゼ アッセイを用いた元のプロモーターにその効果を比較します。
- SgRNA、Cas9 蛋白質とテトオペレータ シーケンスを含む ssDNA テンプレートを準備し、確立したプロトコル32,33によると (B6C3F1/J マウスまたはその他の必要なひずみ) から受精卵に microinject。
注: 繰り返しシーケンスの合成の複雑さのための in vitro 転写/逆転写ベースのアプローチは、二本鎖 DNA (dsDNA) プラスミド44から ssDNA テンプレートを合成するお勧めします。また、マイクロインジェクション、dsDNA テンプレート可能性があります使用、ノックの効率減少45があります。 - テト演算子のノックイン マウスの画面。
- 相同性腕の対象地域外の genomic 位置に相補的な PCR プライマーを設計します。プライマーを設計する際は、ゲノム シーケンスを繰り返しを避けます。
- 確立したプロトコル34に従ってマウスの尾クリップから DNA を抽出します。
- PCR を使用して、テト演算子を挿入したマウスを識別するために電気泳動のゲルします。
- ノックで成功した PCR 産物の配列によってを確認します。
注: 不要な大規模な削除や再編成を CRISPR/Cas935, オフのターゲットを編集するため検診前に進む35,36,37ので注意して導入できます。
3. 活性化および抑制因子発現マウスを開発します。
- 興味の tissue(s) またはセル型の力強く表現するプロモーターを識別します。
注: 文献検索、組織固有のプロモーター配列データベース46このようなプロモーターを識別するのに役立ちますがあります。 - 指定された拡張ラックのリプレッサーまたは組換えコンストラクトを生成する目的のプロモーターの下流にテト活性化シーケンスを配置します。
- 使用して標準的な遺伝子導入手順42,43,47トランスジェニック マウスの行を生成します。また、位置の影響を避けるために、単一コピーの遺伝子挿入31,48を許可するように、部位特異的遺伝子導入アプローチを使用できます。
- 創設者を反映し、表現パターンそれぞれの創業者の子孫の遺伝子のレベルを決定します。さらなる繁殖のため意図した組織型に堅牢な式の行を選択します。
- 野生型マウスに創設者を繁殖させます。
- 活性化および/またはリプレッサーの挿入を検出する PCR プライマーを設計します。
- 確立したプロトコル34によると子孫の尾クリップから DNA を抽出します。
- PCR を使用して、カーソルとマウスを識別するために電気泳動のゲルします。
- PCR の製品の配列による遺伝子の挿入を確認します。
- Propogate トランスジェニック ライン。
- 各ラインからいくつかの子犬を犠牲にし、qRT PCR、免疫組織化学、および/またはターゲット組織型に興味の遺伝子/蛋白質の表現を分析する西部のしみのための興味の組織を収集します。
- セクション 4 で興味の組織で最強の式で行を選択します。
4. 生体内で遺伝子発現を操作します。
- セクション 3 に従って確立された繁殖プラクティス49から発現トランスジェニック マウスを興味 (セクション 1 または 2) の変更された遺伝子を持つマウスを繁殖させます。最大式コントロールの変更された対立遺伝子の homozygosity にマウスを繁殖します。
- 返還またはターゲット遺伝子の抑圧の調整、飲料水に IPTG を管理します。
- 使用する IPTG の投与量の実験的決定、治療線量の範囲の 1 つに適切な遺伝子型とコントロールのマウス (範囲の開始をお勧めします: 0-400 mM IPTG) の少なくとも 1 つの週50,51。治療グループごとに少なくとも 3 つのマウスがあり、年齢や将来計画の実験に最も関連するマウスの性別を選択します。注: マウスの繁殖ペアは13日を希望する場合は、子孫に IPTG の発達の露出を提供する IPTG 水で扱うことができるまたはマウスはいつでも出生後の治療を始めることができます。
- 政権の日に滅菌蒸留水に IPTG の目的の固まりを溶かし、5 分または完全に溶解するまで攪拌棒でかき混ぜます。
- 箔とボトルを包む、光で保護されたボトルに IPTG 水を管理します。週に 2 回交換してください。マウス 0 mM IPTG を受信する水の源は同じを提供します。
- 少なくとも 1 週間後、マウスを犠牲にし qRT PCR、免疫組織化学、および/または西部にしみが付くことを使用してターゲット tissue(s) の興味の遺伝子の表現を分析します。
- 野生型コントロールの興味の遺伝子の発現を復元する線量を識別し、この用量を使用して、今後の実験で遺伝子の正常な発現を達成するために。
- 使用する IPTG の投与量の実験的決定、治療線量の範囲の 1 つに適切な遺伝子型とコントロールのマウス (範囲の開始をお勧めします: 0-400 mM IPTG) の少なくとも 1 つの週50,51。治療グループごとに少なくとも 3 つのマウスがあり、年齢や将来計画の実験に最も関連するマウスの性別を選択します。注: マウスの繁殖ペアは13日を希望する場合は、子孫に IPTG の発達の露出を提供する IPTG 水で扱うことができるまたはマウスはいつでも出生後の治療を始めることができます。
- 遺伝子発現の誘導、食事のドキシサイクリン (Dox) を管理します。
- 実験管理に Dox の濃度で判断、適切な遺伝子型と範囲の Dox 集中の 1 つを使用してコントロールのマウスを扱う (範囲の開始をお勧めします: 0-5000 mg/kg ドキシサイクリン Hyclate) 少なくとも 1 つの週52 、53, 治療群ごとに少なくとも 3 つのマウスを含みます。Dox を含む商用ベンダーからマウス食料を購入します。
注:5455,,を希望する場合は、子孫に Dox の発達の露出を提供する Dox フードとマウスのつがいを扱うことができるまたはマウスはいつでも出生後の治療を始めることができます。 - 週に 1 回食事を交換してください。Dox 無料食品を受信マウスに同じ基本食事を提供します。
- 少なくとも 1 週間後、マウスを犠牲にし qRT PCR、免疫組織化学、および/または西部にしみが付くことを使用してターゲット tissue(s) の興味の遺伝子の表現を分析します。
- 目的のレベルに興味の遺伝子の表現を高める線量を識別し、この用量を使用して、今後の実験で遺伝子の過剰発現を達成するために。
- 実験管理に Dox の濃度で判断、適切な遺伝子型と範囲の Dox 集中の 1 つを使用してコントロールのマウスを扱う (範囲の開始をお勧めします: 0-5000 mg/kg ドキシサイクリン Hyclate) 少なくとも 1 つの週52 、53, 治療群ごとに少なくとも 3 つのマウスを含みます。Dox を含む商用ベンダーからマウス食料を購入します。
結果
リモート コントロール システムの抑制機能は、2 つの異なるアプローチでこれまで実証されています。最初のアプローチでは、 lacリプレッサー結合部位は内因性Dnmt1遺伝子プロモーターで挿入されました。このプロトコルの推薦する 2 番目の方法でリプレッサー結合部位が挿入によるプロモーターの機能に影響を及ぼす潜在的なリスクを避けるために、それによりリモート制御の適用を簡素化する下流のイントロンに挿入されました。システム。両方のアプローチは、成功した抑圧 (図 2A、B 、図 3 a-c)10で起因しました。Dnmt1の式は、プロモーターを用いたアプローチ (図 2A) を使用して無秩序なレベルの 15% に鎮圧されました。この厳しい弾圧は、IPTG (図 2A) の変化量とマウスを扱うことにより用量依存的に逆転されました。観測Dnmt1の抑圧は、タンパク質レベルで免疫染色 (図 2B) によって認可されました。Dnmt1の間Dnmt1式で任意の顕著な違いは見られなかった+/+およびDnmt1LO/LOマウス、通常プロモーターが私たちlacオペレーター挿入が中断されることはありませんを確認します。関数10。達成イントロン ベースのアプローチよりも事業者から 90% 抑制、転写伸長 (図 3A, B)10を減衰させることによって転写開始部位の下流数 kilobases を位置しています。このイントロン ベースのアプローチは 7 追加堅牢なプロモーター (図 3C) でさらに検証されました。必ず厳しい弾圧は、すべてのテスト プロモーターから実現しました。残留式レベルとプロモーターの強度との相関は認められず, 我々 は (テスト イントロンに基づく抑圧体制の抑圧能力がすべて堅牢なプロモーターの転写の力を超えていることを示唆図 3C)。
リモート コントロール システムの体内アップレギュレーション機能Dnmt1遺伝子に明らかとなった。発現のダウンレギュレーションするエフェクターによって蛋白質が存在を許可するDnmt1プロモーターラックオペレータ シーケンスと共に、テト演算子の 2 つのコピーを導入しました。堅牢なアップレギュレーションと 2 桁 (10% 〜 650%) に近い、 Dnmt1式のダウンレギュレーションが変更された内因性Dnmt1遺伝子 (Dnmt1LGT) (図 4A) を含む Esc で達成された10.両方の規制が完全に元に戻せる、IPTG と Dox の治療によって誘引可能なそれぞれ (図 4A)。次に、リモート コントロール システムの生体内で発現する機能をテストするマウス生殖細胞にDnmt1LGT変更を導入しました。中心部に検出可能なアップレギュレーションは (図 4B)7を認めなかったに対し、 Dnmt1の強いアップレギュレーションが肝臓、脾臓、腎臓、観察されました。Dnmt1の細胞周期依存性発現パターンと中心部における増殖細胞の希少性がこの観測10,56の根底にあります。それは、活性化、またはその結合部位数の発現レベルを増やすことによって、この制限を克服できるかどうか見られることを残る。
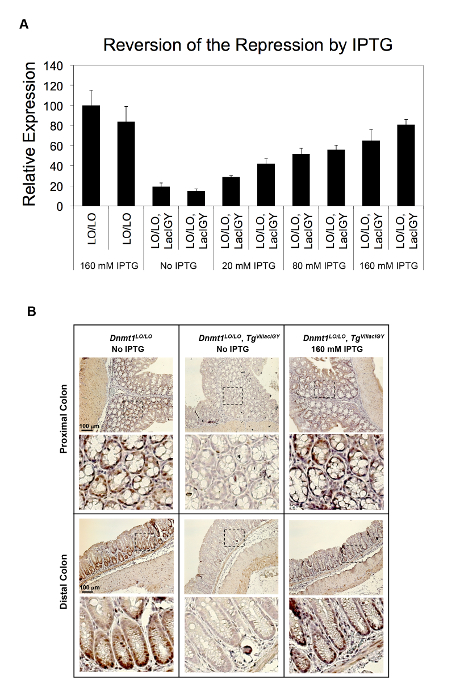
図 2: 生体内でLacIGY リプレッサーによってDnmt1の抑圧します。Dnmt1のプロモーター、 LacIGY発現の有無に挿入lacオペレーター (LO) と (A) マウスは IPTG の様々 な用量で扱われました。Dnmt1式の qRT PCR 解析は、IPTG 処理による生体内でDnmt1抑圧の用量依存性逆転を示しています。各バーは、別のマウスからのデータを表します。データを表す平均 ± SEM (n = 3)。(B) マウスの体液で Dnmt1 タンパク質の染色は、3 週間の 160 mM IPTG の有無に飲料水を提供しました。この図は、李ら10から変更されているこの図の拡大版を表示するのにはここをクリックしてください。
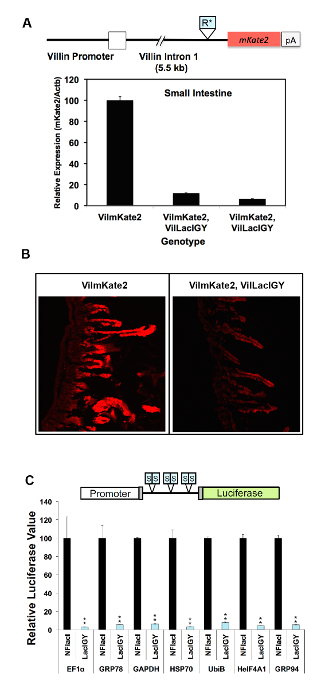
図 3: 生体内でリモート コントロール システムによって様々 なプロモーターの in vitro における抑圧と。(A) Repron シーケンス (R *) の初期のバージョンが、イントロンは、ビリンビリン mKate2トランスジェニック マウス (VilmKate2) プロモーターの下流に挿入されました。LacIGYリプレッサーの有無とマウスの小腸でmKate2式の qRT PCR 解析が表示されます。各バーは、別のマウスからのデータを表します。LacIGY式と小腸の (B) 共焦点 mKate2 画像。(C) 六つの対称 lac オペレーター (S) は、様々 なプロモーターとルシフェラーゼ レポーター間に挿入されました。記者 (50 ng/96 ウェル プレートでも) とリプレッサー プラスミドを 1:1 のモル比で NIH/3T3 細胞に導入されました。ルシフェラーゼの値は、トランスフェクション後評価 24 h をしました。これらの in vitro のデータを表すLacIGYのルシフェラーゼ発現率-非機能的なラッチ(NFlacI) を表現するものを基準にして細胞を表現します。T テストは、統計的有意性を決定するために使用されました。データを表す平均 ± SEM (n = 3)。P ≦ 0.05 * *P ≤ 0.01。この図は、李ら10から変更されているこの図の拡大版を表示するのにはここをクリックしてください。

図 4: ダウンおよびDnmt1発現の in vitro および in vivo。(A)培養 Esc で遺伝子をターゲットとエレクトロポレーションのアプローチによって設計され完全なリモート コントロール システム。Dnmt1式の最大の抑圧は、IPTG と Dox の両方の処理によって達成された最大活性化しながら無治療で達成されました。データを表す平均 ± SEM (n = 3)。P ≦ 0.05 * *P ≤ 0.01 (ウェルチのt-テスト)。(B)生体内での活性化Dnmt1リモコン マウスから様々 な組織における Dnmt1 蛋白の免疫染色で示されるようにリモート コントロール システムによって。LGT対立遺伝子は、プロモーター lacオペレーターとテト活性剤結合部位を含むDnmt1の変更を表します。マウスは 1 ヶ月間 (5000 mg/kg ドキシサイクリン Hyclate) は通常または Dox を含む食事療法と扱われました。この図は、李ら10から変更されているこの図の拡大版を表示するのにはここをクリックしてください。
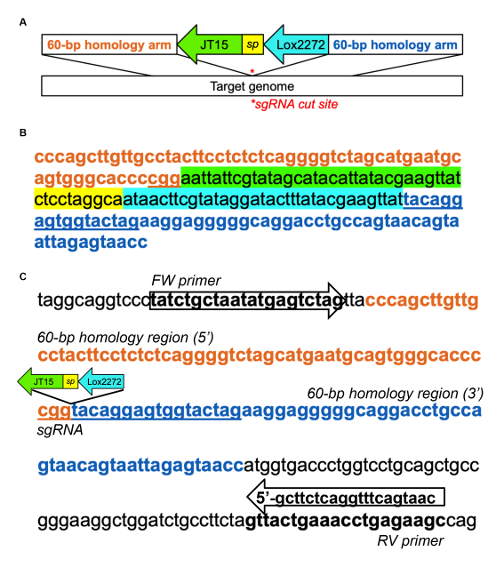
補足図 1: マウスDnmt1イントロン 1 にパッド挿入を着陸の例。(A) 着陸パッド挿入、クアドロスら (2015)31から適応のための DNA のテンプレートの模式図。JT15 と Lox2272、有性loxPサイト、短いスペーサー シーケンス (はsp) で区切られ、ターゲットのゲノム領域に相同な DNA の 60 bp が両側に並ぶ。次の sgRNA を使用してDnmt1イントロンにパッド挿入を着陸の DNA のサンプル (B) テンプレート: CTAGTACCACTCCTGTACCG (これは逆鎖を対象)。選択されているイントロン領域だった一歩 1.1 通知 bioinformatically と、sgRNA は、CRISPOR29を使用して識別されました。(C) 着陸パッドの挿入を評価するための PCR プライマー設計の例です。PCR のプライマーは、内因性Dnmt1の統合を確認するテンプレートの相同性腕外設計されていた。野生型 PCR 増幅は 213 bp;291 になれば、挿入時に跪くこの図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
重要なステップとリモート コントロール システムの潜在的な制限は、ターゲット遺伝子の発現に影響を与えずにリプレッサーおよび/または活性剤結合部位のカーソルに関連付けられている課題です。抑圧の元取り組みDnmt1遺伝子に適用されるプロモーターの転写活性クリティカル領域内にあるlacリプレッサー結合部位の挿入に関与しています。プロモーターの機能に影響を与えるとこのようにリスクを軽減するためにリモート制御システムの一般的な適用性を改善し、抑圧のイントロン ・ ベースのアプローチを開発しました。強化されたラックシステムの効力では、緊密に位置する演算子でテスト我々 すべての強力なプロモーターの転写を抑制することができました転写のいくつか kilobases 下流に数百サイト (図 3A から C) を開始10します。 重要なのは、抑圧のレベルはプロモーター (図 3A から C)10の転写の強みの独立していた。これはイントロンに基づく抑圧体制の抑圧能力がテストのプロモーターの転写強度を超えることを示唆しています。このイントロン ベースのアプローチの抑圧は 2 つのコンポーネント、転写伸長機械と lac リプレッサー57との物理干渉が媒介なりそうです。この単純な抑圧のメカニズムとイントロン手法の実証の堅牢性このアプローチの異なる遺伝子、組織、および有機体に一般的に適用されるレンダリング可能性があります。
リモート コントロール システムによって発現プロモーターの機能に影響を及ぼすリスクを伴いますターゲット遺伝子のプロモーターに近接するトランス結合塩基配列が必要です。しかし、我々 は、シーケンスを結合の位置が重要な発現調節領域の外することができますを発見します。Dnmt1とEF1αプロモーターは、テト演算子から誘導位置数百塩基上流転写開始サイト10の確実だった。この制約が緩和大幅プロモーターの転写活性化の不在でターゲット遺伝子の機能に影響を及ぼす可能性が減ります。シーケンス結合数の増加および/またはより強い transactivators の使用は、転写の開始部位から離してサイトからアップレギュレーションを有効にすることによってリスクを軽減を助けることができます。
リモート管理体制レベル、タイミング、および内因性遺伝子の発現、表現型の可逆性とによって容易に達成可能ではない異なった表現のレベルの結果のテストを可能にする場所のエレガントなコントロールを提供します。現在 in vivo 遺伝子発現制御技術。私たちを含めたほとんどの遺伝子発現解析に式の値がその中ではかなりの変動を見つけることができますセルの人口の平均を表すことに注意してくださいすることが重要です。この不均一性58分化やアポトーシスなどの細胞の意思決定プロセスに影響を与える可能性があります。付加的な遺伝的回路工学59の遺伝子発現制御の精度がさらに改善される見通し、現在のシステムの観察力できるようになります遺伝子機能の役に立つ調査多くの生物学的文脈で。さらに、ターゲットの特異性の高度は規制コンポーネント60元の種と哺乳類の大規模な進化距離と同様、演算子のシーケンスの複雑さのためになっています。さらに、トランスジェニック マウス リプレッサー活性剤の行数を開発し、任意の内因性遺伝子を採用できます。たとえば、既存テト転写活性化マウス モデルは目的のマウス体内の標的遺伝子の発現を達成するために合わせることができます。我々 は最近車Hipp11軌跡48 lacIGY遺伝子導入することにより既存の Cre 線と組み合わせれば複数の組織型で私たちの強化されたラックのリプレッサーの堅牢な組織特異的発現トランスジェニック ラインを開発(未発表) Lox 停止 Lox 要素の制御の下で。この行が大幅にリモート コントロール システムの組織固有のアプリケーションを容易にします。
リモート コントロール システムによって遺伝子の発現は、現在の誘引可能な遺伝子導入アプローチと比較していくつかの利点を提供します。これは内因性の軌跡を活用して、カーソルの位置の影響をテストする複数の遺伝子組換え行の生成は必要ありません。さらに、このアプローチは強い基準式と遺伝子の発現に適してそれは、すでに強固なプロモーターから発現を高めるためし最小限のウイルス プロモーターに頼る従来のトランスジェニック モデル。最後に、組織特異性、細胞周期制御、およびターゲット遺伝子のスプライシングバリアントは保有されますアップレギュレーションに我々 のアプローチとして生来cisなど自然な規制の要素が保持されます-規制要素。CRISPR/Cas を介した遺伝子ターゲティング技術の出現は大幅多様なモデル システムでこの技術の応用を促進します。
開示事項
PWL を科学的なアドバイザリー ボードの AnchorDx と Progenity、株式会社に提供しています
謝辞
我々 は後半の Dr ハイジ Scrable ラッチ哺乳類遺伝子コンストラクト (メイヨー クリニック、ロチェスター、ミネソタ) の彼女の寛大な贈り物に感謝博士ダニエル Louvard (Institut キュリー、パリ、フランス) ビリン プロモーターを提供するため、Grusby-ジャクソン博士・ ローリー (こども病院、ボストン、MA) この技術開発の初期段階への彼女の貢献のため。トランスジェニック、ノックアウト マウスを生成に彼らの支援のため博士ナンシー呉と Dr ロバート Maxson 感謝しております。我々 は役に立つ議論のレアード研究室のメンバーに感謝し、サポートします。この作品は、国立衛生研究所 [R01 CA75090 R01 DA030325 R01 CA157918、P.W.L. に R01 CA212374 と N.A.V.S に 1F31CA213897 01A1] によって支えられました。
資料
| Name | Company | Catalog Number | Comments |
| B6C3F1/J | The Jackson Laboratory | 100010 | https://www.jax.org/strain/100010 |
| Cas9 Protein | PNA Bio | CP04 | http://www.pnabio.com/products/CRISPR_Cas9.htm?gclid=EAIaIQobChMIsoG8pLL33QIVBr7ACh0naQ4dEAAYAiAAEgKyHvD_BwE |
| CRISPOR | Haeussler et al. 2016 | http://crispor.tefor.net/ | |
| Doxycycline-Containing Mouse Diet | Envigo | Varies by concentration | https://www.envigo.com/products-services/teklad/laboratory-animal-diets/custom-research/doxycycline-diets/ |
| ENCODE Database | Stanford University | https://www.encodeproject.org/ | |
| iCre mRNA synthesis plasmid (pBBI) | Addgene | 65795 | https://www.addgene.org/65795/ |
| IPTG | GoldBio | I2481C | https://www.goldbio.com/search?isSearch=Y&q=iptg |
| pGL3-Basic | Promega | E1751 | https://www.promega.com/products/reporter-assays-and-transfection/reporter-vectors-and-cell-lines/pgl3-luciferase-reporter-vectors/?catNum=E1751 |
| SVM-BPfinder | Regulatory Genomics, Pompeu Fabra University | http://regulatorygenomics.upf.edu/Software/SVM_BP/ | |
| TiProD: Tissue specific promoter Database | Department of Bioinformatics, UMG, University of Göttingen | http://tiprod.bioinf.med.uni-goettingen.de | |
| UCSC Genome Browser | University of California Santa Cruz | https://genome.ucsc.edu/ |
参考文献
- Jackson-Grusby, L., et al. Loss of genomic methylation causes p53-dependent apoptosis and epigenetic deregulation. Nature Genetics. 27 (1), 31-39 (2001).
- David, G., Turner, G. M., Yao, Y., Protopopov, A., DePinho, R. A. mSin3-associated protein, mSds3, is essential for pericentric heterochromatin formation and chromosome segregation in mammalian cells. Genes & Development. 17 (19), 2396-2405 (2003).
- Sumi-Ichinose, C., Ichinose, H., Metzger, D., Chambon, P. SNF2beta-BRG1 is essential for the viability of F9 murine embryonal carcinoma cells. Molecular and Cellular Biology. 17 (10), 5976-5986 (1997).
- Premsrirut, P. K., et al. A rapid and scalable system for studying gene function in mice using conditional RNA interference. Cell. 145 (1), 145-158 (2011).
- Qiu, S., Adema, C. M., Lane, T. A computational study of off-target effects of RNA interference. Nucleic Acids Research. 33 (6), 1834-1847 (2005).
- Gilbert, L. A., et al. Genome-Scale CRISPR-Mediated Control of Gene Repression and Activation. Cell. 159 (3), 647-661 (2014).
- Konermann, S., et al. Genome-scale transcriptional activation by an engineered CRISPR-Cas9 complex. Nature. 517 (7536), 583-588 (2015).
- Peng, H., Ivanov, A. V., Oh, H. J., Lau, Y. F., Rauscher, F. J. Epigenetic gene silencing by the SRY protein is mediated by a KRAB-O protein that recruits the KAP1 co-repressor machinery. The Journal of Biological Chemistry. 284 (51), 35670-35680 (2009).
- Groner, A. C., et al. KRAB-zinc finger proteins and KAP1 can mediate long-range transcriptional repression through heterochromatin spreading. PLOS Genetics. 6 (3), 1000869 (2010).
- Lee, K. H., Oghamian, S., Park, J. A., Kang, L., Laird, P. W. The REMOTE-control system: a system for reversible and tunable control of endogenous gene expression in mice. Nucleic Acids Research. 45 (21), 12256-12269 (2017).
- Gossen, M., Bonin, A. L., Bujard, H. Control of gene activity in higher eukaryotic cells by prokaryotic regulatory elements. Trends in Biochemical Sciences. 18 (12), 471-475 (1993).
- Hu, M. C., Davidson, N. The inducible lac operator-repressor system is functional in mammalian cells. Cell. 48 (4), 555-566 (1987).
- Cronin, C. A., Gluba, W., Scrable, H. The lac operator-repressor system is functional in the mouse. Genes & Development. 15 (12), 1506-1517 (2001).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Council, N. R. . Guide for the Care and Use of Laboratory Animals: Eighth Edition. , (2011).
- Casper, J., et al. The UCSC Genome Browser database: 2018 update. Nucleic Acids Research. 46 (1), 762-769 (2018).
- Church, D. M., et al. Lineage-specific biology revealed by a finished genome assembly of the mouse. PLOS Biology. 7 (5), 1000112 (2009).
- Creyghton, M. P., et al. Histone H3K27ac separates active from poised enhancers and predicts developmental state. Proceedings of the National Academy of Sciences of the United States of America. 107 (50), 21931-21936 (2010).
- Heintzman, N. D., et al. Histone modifications at human enhancers reflect global cell-type-specific gene expression. Nature. 459 (7243), 108-112 (2009).
- Heintzman, N. D., et al. Distinct and predictive chromatin signatures of transcriptional promoters and enhancers in the human genome. Nature Genetics. 39 (3), 311-318 (2007).
- Rada-Iglesias, A., et al. A unique chromatin signature uncovers early developmental enhancers in humans. Nature. 470 (7333), 279-283 (2011).
- Handoko, L., et al. CTCF-mediated functional chromatin interactome in pluripotent cells. Nature Genetics. 43 (7), 630-638 (2011).
- Splinter, E., et al. CTCF mediates long-range chromatin looping and local histone modification in the beta-globin locus. Genes & Development. 20 (17), 2349-2354 (2006).
- The ENCODE Project Consortium. An integrated encyclopedia of DNA elements in the human genome. Nature. 489 (7414), 57-74 (2012).
- Rosenbloom, K. R., et al. ENCODE data in the UCSC Genome Browser: year 5 update. Nucleic Acids Research. 41, 56-63 (2013).
- Murray, J. I., Voelker, R. B., Henscheid, K. L., Warf, M. B., Berglund, J. A. Identification of motifs that function in the splicing of non-canonical introns. Genome Biology. 9 (6), 97 (2008).
- Taggart, A. J., et al. Large-scale analysis of branchpoint usage across species and cell lines. Genome Research. 27 (4), 639-649 (2017).
- Corvelo, A., Hallegger, M., Smith, C. W., Eyras, E. Genome-wide association between branch point properties and alternative splicing. PLOS Computational Biology. 6 (11), 1001016 (2010).
- Haeussler, M., et al. Evaluation of off-target and on-target scoring algorithms and integration into the guide RNA selection tool CRISPOR. Genome Biology. 17 (1), 148 (2016).
- Grainger, S., et al. CRISPR Guide RNA Validation In Vitro. Zebrafish. 14 (4), 383-386 (2017).
- Quadros, R. M., Harms, D. W., Ohtsuka, M., Gurumurthy, C. B. Insertion of sequences at the original provirus integration site of mouse ROSA26 locus using the CRISPR/Cas9 system. FEBS Open Bio. 5, 191-197 (2015).
- Harms, D. W., et al. Mouse Genome Editing Using the CRISPR/Cas System. Current Protocols in Human Genetics. 83, (2014).
- Miura, H., Quadros, R. M., Gurumurthy, C. B., Ohtsuka, M. Easi-CRISPR for creating knock-in and conditional knockout mouse models using long ssDNA donors. Nature Protocols. 13 (1), 195-215 (2018).
- Laird, P. W., et al. Simplified mammalian DNA isolation procedure. Nucleic Acids Research. 19 (15), 4293 (1991).
- Kosicki, M., Tomberg, K., Bradley, A. Repair of double-strand breaks induced by CRISPR-Cas9 leads to large deletions and complex rearrangements. Nature Biotechnology. 36 (8), 765-771 (2018).
- Akcakaya, P., et al. In vivo CRISPR editing with no detectable genome-wide off-target mutations. Nature. 561 (7723), 416-419 (2018).
- Lazzarotto, C. R., et al. Defining CRISPR-Cas9 genome-wide nuclease activities with CIRCLE-seq. Nature Protocols. 13 (11), 2615-2642 (2018).
- Ohtsuka, M., et al. Improvement of pronuclear injection-based targeted transgenesis (PITT) by iCre mRNA-mediated site-specific recombination. Transgenic Research. 22 (4), 873-875 (2013).
- Ohtsuka, M., et al. Pronuclear injection-based mouse targeted transgenesis for reproducible and highly efficient transgene expression. Nucleic Acids Research. 38 (22), 198 (2010).
- Lee, G., Saito, I. Role of nucleotide sequences of loxP spacer region in Cre-mediated recombination. Gene. 216 (1), 55-65 (1998).
- Thomson, J. G., Rucker, E. B., Piedrahita, J. A. Mutational analysis of loxP sites for efficient Cre-mediated insertion into genomic DNA. Genesis. 36 (3), 162-167 (2003).
- Cho, A., Haruyama, N., Kulkarni, A. B. Generation of Transgenic Mice. Current Protocols in Cell Biology. , (2009).
- Pu, X. A., Young, A. P., Kubisch, H. M. Production of Transgenic Mice by Pronuclear Microinjection. Methods in Molecular Biology. 1874, 17-41 (2019).
- Murgha, Y., et al. Combined in vitro transcription and reverse transcription to amplify and label complex synthetic oligonucleotide probe libraries. Biotechniques. 58 (6), 301-307 (2015).
- Quadros, R. M., et al. Easi-CRISPR: a robust method for one-step generation of mice carrying conditional and insertion alleles using long ssDNA donors and CRISPR ribonucleoproteins. Genome Biology. 18 (1), 92 (2017).
- Chen, X., Wu, J. M., Hornischer, K., Kel, A., Wingender, E. TiProD: the Tissue-specific Promoter Database. Nucleic Acids Research. 34, 104-107 (2006).
- Haruyama, N., Cho, A., Kulkarni, A. B. Overview: Engineering transgenic constructs and mice. Current Protocols in Cell Biology. , (2009).
- Tasic, B., et al. Site-specific integrase-mediated transgenesis in mice via pronuclear injection. Proceedings of the National Academy of Sciences of the United States of America. 108 (19), 7902-7907 (2011).
- JoVE Science Education Database. Lab Animal Research. Fundamentals of Breeding and Weaning. Journal of Visualized Experiments. , (2018).
- Wyborski, D. L., DuCoeur, L. C., Short, J. M. Parameters affecting the use of the lac repressor system in eukaryotic cells and transgenic animals. Environmental and Molecular Mutagenesis. 28 (4), 447-458 (1996).
- Wyborski, D. L., Short, J. M. Analysis of inducers of the E.coli lac repressor system in mammalian cells and whole animals. Nucleic Acids Research. 19 (17), 4647-4653 (1991).
- Traykova-Brauch, M., et al. An efficient and versatile system for acute and chronic modulation of renal tubular function in transgenic mice. Nature Medicine. 14 (9), 979-984 (2008).
- Michel, G., Mosser, J., Fauran, F. Serum kinetics of doxycycline polyphosphate in dogs. European Journal of Drug Metabolism and Pharmacokinetics. 4 (1), 43-48 (1979).
- Bertocchi, I., et al. Regulatory functions of limbic Y1 receptors in body weight and anxiety uncovered by conditional knockout and maternal care. Proceedings of the National Academy of Sciences of the United States of America. 108 (48), 19395-19400 (2011).
- Plageman, T. F., Lang, R. A. Generation of an Rx-tTA: TetOp-Cre knock-in mouse line for doxycycline regulated Cre activity in the Rx expression domain. PLOS One. 7 (11), 50426 (2012).
- Mollova, M., et al. Cardiomyocyte proliferation contributes to heart growth in young humans. Proceedings of the National Academy of Sciences of the United States of America. 110 (4), 1446-1451 (2013).
- Ptashne, M. Principles of a switch. Nature Chemical Biology. 7 (8), 484-487 (2011).
- Balazsi, G., van Oudenaarden, A., Collins, J. J. Cellular decision making and biological noise: from microbes to mammals. Cell. 144 (6), 910-925 (2011).
- Nevozhay, D., Zal, T., Balazsi, G. Transferring a synthetic gene circuit from yeast to mammalian cells. Nature Communications. 4, 1451 (2013).
- Labow, M. A., Baim, S. B., Shenk, T., Levine, A. J. Conversion of the lac repressor into an allosterically regulated transcriptional activator for mammalian cells. Molecular and Cellular Biology. 10 (7), 3343-3356 (1990).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved