このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
数と明るさの分析と組み合わせた全内部反射蛍光顕微鏡による生細胞における細胞表面受容体のオリゴマー化ダイナミクス
要約
生細胞の形質膜におけるリガンド結合によって誘導されるmEGFPタグ付き受容体オリゴマーの平均オリゴマー状態の測定のためのイメージングアプローチについて説明する。このプロトコルは、数と明るさ(N&B)分析と組み合わせた全内部反射蛍光(TIRF)顕微鏡に基づいています。
要約
受容体オリゴマー化の重要性とユビキタスにもかかわらず、クラスタリングイベントを検出し、クラスタリングの程度を測定するための方法はほとんどありません。ここでは、生細胞の膜におけるMEGFPタグ付き受容体ホモ複合体の平均オリゴマー状態を決定するイメージングアプローチについて説明する。このプロトコルは、数と明るさ(N&B)分析と組み合わせた全内部反射蛍光(TIRF)顕微鏡に基づいています。N&Bは、蛍光相関分光法(FCS)および光子計数ヒストグラム(PCH)に似た方法で、照明の中で拡散する蛍光強度の変動の統計的分析に基づいています。観測時間中の体積。特に、N&BはPCHの簡素化であり、オリゴマー混合物中のタンパク質の平均数に関する情報を得る。強度変動振幅は、蛍光色素の分子輝度と照明体積内の蛍光色素の平均数によって記述される。したがって、N&Bは振幅分布の第1と第2のモーメント、すなわち平均強度と分散のみを考慮します。これは、同時に、方法の強さと弱さである。2つの瞬間しか考慮されないため、N&Bは混合物中の未知のオリゴマーのモル分率を決定することはできませんが、混合物の平均オリゴマー化状態を推定するだけです。それにもかかわらず、蛍光強度の時間変動を監視するだけで、生細胞の画像の比較的小さな時系列(他のモーメント法と比較して)にピクセル単位で適用することができます。ピクセルあたりの有効時間を数マイクロ秒に短縮し、高速オリゴマー化動態に必要な秒からミリ秒までの時間範囲での取得を可能にします。最後に、大きな細胞領域と細胞下コンパートメントを探索することができます。
概要
我々は、受容体アセンブリの連結を目指し、生細胞の形質膜における受容体分子の平均オリゴマー状態を決定するための全内部反射蛍光数と輝度(TIRF-N&B)イメージングアプローチを記述する。タンパク質の生物学的機能に対するダイナミクス (図 1)
細胞外リガンド結合の際、受容体は、その立体構造、オリゴマー化、潜在的な共受容体および膜組成に応じて細胞内シグナル伝達を開始する。受容体オリゴマー化の重要性とユビキタス性にもかかわらず、細胞シグナル伝達1、2、3、4、5、6の重要な事象として認識される。 7、クラスタリングイベントを検出し、実験的にクラスタリングの程度を測定できる方法はほとんどありません。共焦点体積(x,y≥ 300 nm,z≥900 nm)は、分子相互作用および動物化測定を証明するために十分に解決されていないが、画像復元アルゴリズム10による最適化後も。タンパク質オリゴマーのサブユニット組成は、PALM11、STORM12、STED13などの20〜70nmのX、y分解能法であっても、純粋に空間的に分解することはできません。さらに、時間分解能 (画像あたりの分単位) は、秒単位のキネティクスに従うことはできません。単分子ステップ漂白は、それらが不動である場合にのみタンパク質オリゴマーのムチオメトリーを解決する。
単一画像内の蛍光タグ付きタンパク質の密度とオリゴマー化を測定する最も汎用性の高い方法の1つは、空間サンプリングに依存する空間強度分布解析(SpIDA)です。これは、化学的に固定された細胞と生細胞の両方に適用可能であり、標準蛍光顕微鏡15を用いて細胞の目的のいくつかの領域の分析を同時に可能にする。あるいは、蛍光相関分光法(FCS)16、フォトン計数ヒストグラム(PCH)17、数と明るさ(N&B)18、19などのモーメント法は、定量的オリゴマーに適している測定。これらの方法は、蛍光体が照明体積の間で拡散する時間内に観察できる蛍光強度変動を分析する。強度変動の振幅は、蛍光色素の分子輝度(ε)と照明音量17内の蛍光色素(n)の平均数によって一意に記述することができる(図2)。典型的には、蛍光体の拡散係数および照明容積内の分子の平均数(G(0)値に逆作用する)は、FCS20によって得ることができる。しかし、拡散時間は質量の立方根のみでスケールするので、FCSは分子量21の変化を検出するのに十分な感受性を持たない。実際には、単色FCSは膜受容体の二量体化を検出できない。PCHは異なるオリゴマーの混合物を正確に解決する。振幅分布の2回以上の瞬間を使用して、同じ照明ボリュームを占める異なる明るさの分子を検出します。分子輝度(pCOMB)アプローチ23の興味深い対相関などの走査FCS22および開発は、生物学的システムにおける蛍光相関法の適用範囲を広げるために導入された24、セルの広い領域での高速測定の能力を欠いている単一点法のままであり、各ピクセルで多くの連続した観測値を必要とし、秒単位でデータを取得する必要があります。
N&B は、蛍光分布の振幅の最初と 2 番目のモーメント、すなわち平均強度、、および分散 σ2 (図 2)18、19 のみを考慮する PCH の簡略化されたバージョンです。そして、そのために、混合物中の未知のオリゴマーのモル分率を決定することはできないが、混合物の平均オリゴマー化状態を推定するだけである。それにもかかわらず、N&Bは、蛍光強度の時間の変動を監視するだけで、PCHよりも比較的小さな時系列の生細胞画像をピクセル単位で操作できるという利点があります。N&B はピクセルあたりの時間を数マイクロ秒に短縮するため、大きなセル領域に対する高速オリゴマー化動態に従うことができ、ラスター スキャン顕微鏡 (共焦点、2 光子など) およびミリ秒で数秒のタイム スケールで画像を取得できます。カメラベースの顕微鏡検査(例えば、TIRFM)で。
いくつかの報告は、拡張細胞領域をイメージングすることによってタンパク質クラスター内のサブユニットの数を定量化するN&Bの能力を実証している。Paxillin-EGFPクラスターはCHO-K1細胞25の接着部位で検出され、かつ病原性Httex1pペプチドの細胞内凝集はCOS-7細胞26に記載した。N&Bは、ErbB受容体27のリガンド駆動オリゴマー化に続いて適用し、HeLa細胞28におけるクロトゴブ(KLB)およびFGFR1cに対するリガンドFGF21の効果を適用した。TIRFイメージングとN&B分析の組み合わせは、ダイナミン-2が主に細胞膜29全体にわたって四量体であることを示すために使用された。我々は、uPARおよびFGFR1細胞膜受容体30、31のリガンド駆動二量体化を証明するために、ラスタースキャンとTIRF画像の両方にN&Bを適用した。
N&B、FCS、PCHなどの蛍光相関法は、オープンボリュームでは粒子の職業数がポアソン分布に従るという概念に基づいています。蛍光体が放出するフォトンのみが検出できるので、画像のピクセルにおける測定された蛍光強度と時間の平均値は、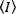 照明体積における蛍光体の平均数の積であり、n、分子輝度, ε17:
照明体積における蛍光体の平均数の積であり、n、分子輝度, ε17:
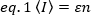
ここで ε は、分子が照明ボリュームの中心にある場合に、分子あたりの時間単位あたりの光子の数 (従来は 1 秒あたり) として表されます。
明るさは、所定の取得設定における各蛍光色素の特性であり、強度はすべての蛍光色素からのすべての寄与の合計です。生物学的コンテストでは、一緒に変動するフルオロフォアの数の増加に伴って明るさが増加し、蛍光タグ付きタンパク質のオリゴマー化状態に関する情報が与られます。特定のピクセルの変動振幅は、蛍光シグナルσ2の分散から測定されます。
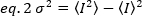
強度の二乗の平均、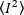 および強度の平均の二乗は、
および強度の平均の二乗は、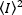 各フレームの各ピクセルの個々の強度値から計算されます。
各フレームの各ピクセルの個々の強度値から計算されます。
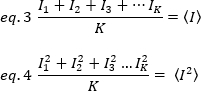
ここで、Kは時系列の合計フレーム数です。実験的には、平均強度値の周囲の単一の画像の各ピクセルにおける個々の強度値の散乱を記述する分散を画像シリーズ全体に対して計算する必要があります。分散には、異なる原点のすべての変動が含まれます。第1近似では、照明体積中の拡散粒子による分散、σ20、検出器ショットノイズによる分散から分離することができる、σ2d。2 つの分散は独立しています。したがって、合計分散は合計で与えられます。
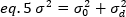
この分散は、検出体積の分子変動に起因して、分子の明るさと強度に直線的に依存します。
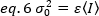
eq. 1 に従って eq. 6 を並べ替える:
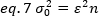
蛍光相関分光法における典型的な概念によれば、式7は、変動数による分散が粒子輝度の二乗に依存することを示す。
そして、検出器の変動による分散は、検出された強度の線形関数であり、検出器がその飽和限界19以下で動作することを前提とする。
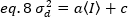
フォトン計数検出器a=1 およびc=0 の場合、検出器の分散は平均強度と等しくなります。
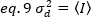
これらの概念を生細胞の実際の測定値に適用するために、Gratton と同僚18は、各ピクセルの見かけの明るさ B を平均強度に対する分散の比率として定義します。
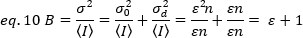
Bは実験的に測定されるパラメータである。本研究では、HeLa細胞の形質膜におけるFGFR1受容体の時系列画像をTIRF顕微鏡で捉え、平均見かけ明るさBをN&B分析により決定する。次いで、FGF2を添加した後、公索リガンドによる受容体の刺激後の膜表面における受容体分子の自己集合の変化に従って連続した時系列が捕捉される。
しかし、TIRF顕微鏡の検出器はEMCCDカメラであるため、見かけの明るさの発現を19として変更する必要があります。
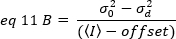
ここで、オフセットは検出器設定の特性である検出エレクトロニクスの強度オフセットです。アナログ検出器の分散と平均強度は、それぞれ次のように求められています。
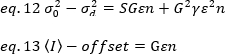
ここで、Gはデジタルレベル(DL/フォトン)のアナログゲインであり、S、フォトン19あたりのデジタルレベルは、一定の強度(時間的変動なし)を持つ光源の強度対分散プロットの傾きによって与えられます。γ因子は、画素検出ボリュームの形状に関連する。Hassler et al.32によれば、γ因子は、検出カメラ19の最大ゲインで動作するTIRFイメージングに対して0.3に等しい。オフセット、SおよびGパラメータは、カメラおよび顕微鏡の特性である。見かけの明るさBは、eq. 12および13に従ってeq. 11を並べ替えることによって得られる。
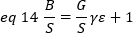
実験的には、εはレーザー強度とシステムの検出効率の複雑な関数です。それにもかかわらず、B/Sはεに直線的に依存しているため、特定の検出モードのεの相対値を決定することが重要です。
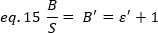
ここでε'は ε に比例します。それでも、キャリブレーションは内部参照を使用して実行されます。
プロトコル
1. サンプル調製
- 1日目。ガラス底皿の100,000-200,000細胞/mLの濃度で完全な培地中の種子HeLa細胞。シード6-8は料理を複製します。
注:この例では、培地は10%熱不活性化胎児ウシ血清(FBS)、1mMピルビン酸ナトリウム、100 U/100 μgペニシリン/ストレプトマイシンで補充される。いくつかの複製料理が用意されています。 - 2-3日目。細胞が亜コンフルエンスの場合、タンパク質プラスミドで食器の半分をトランスフェクトし、後半を参照プラスミド(モノマーおよびダイマー)で、無血清培地でトランスフェクトする。
注:トランスフェクションは、フェノールレッドなしで、抗生物質、0.1%ウシ血清アルブミンおよび25 mM HEPES緩衝液を補充した血清フリー培地で行われる。 - 3-4日目。トランスフェクトされた細胞が皿の底に付着し、細胞膜が蛍光を発していることを確認します。過剰に生えた細胞や非常に低い蛍光を持つ料理を廃棄します。
注:細胞が過剰に成長しないようにしてください。細胞は十分に分布し、皿のガラス領域に付着する必要があります(図1A)。プレコーティングされたガラス底の皿は細胞の付着を支持するために使用することができる。細胞培養は、実験の前にマイコプラズマ汚染について試験される。この例では、細胞は(A207K)mEGFP-FGFR1プラスミドでトランスフェクトされ、基準細胞は標準プロトコルを用いてGPI-(A207K)mEGFPおよびGPI-(A207K)mEGFP-(A207K)mEGFPプラスミドでトランスフェクトされる。生細胞顕微鏡では、インジケーターフリーの培地をお勧めします。イメージング中のpH変化を防ぐために25 mM HEPESバッファが追加されます。
2. TIRFイメージング — レーザーラインのアライメントとTIRF照明の最適化
- 実験の4時間前に、顕微鏡の温度インキュベーターを37°Cで活性化する。
- 顕微鏡、コンピュータ、カメラの電源を入れ、カメラが適切な作業温度に達するのを待ちます。
注:本研究で使用したカメラの動作温度は-75°Cです。 - 目的に油を少し滴置きます。サンプル皿を所定の場所に置きます。インキュベーターのドアを閉め、皿の温度を平衡化させます(約10分)。
- エピ蛍光ランプと488 nmレーザーをオンにします。
- エピ蛍光コントラストモードを選択してサンプルを探索し、眼から焦点を合わせる細胞を検索します。
注:眼のトラフを細胞を探索するための蛍光灯の使用は必須ではありません。代わりに適切なレーザーラインを使用することができます。 - 顕微鏡カメラ(バンドパスEx 490/20(500)バンドパスEm 525/50、または同様の)を介して緑色の放出を収集するための適切なフィルタを選択します。
- エピ蛍光モードで眼からカメラポート(図1のカメラ#1)に切り替え、フォーカスを調整してTIRFモードに変更します。エピ蛍光およびTIRFモードは、顕微鏡のブランドに応じて異なる命名法で命名することができる。
注:カバースリップインターフェースに蛍光マーカーがない場合は、レーザーの焦点合わせや位置合わせに問題がある可能性があります。レーザーを適切に位置合わせするには(良好なTIRFに不可欠)、カバースリップに焦点を当てます。カバースリップに焦点が合っているかどうかを判断することは非常に困難な場合がよくあります。提案として、セルの端に焦点を当てます。 - TIRF顕微鏡の指示に従って自動整列を有効にします。
注:簡単に説明すると、2.4から2.8までのステップでは、まず眼を通して細胞を見つけて焦点を当て、次にTIRF顕微鏡のカメラポートに発光を送り、顕微鏡コンピュータ画面に細胞を再焦点を合わせ、レーザーアライメントの手順を有効にします。アライメントは、イルミネーションがエバネッセントになる臨界角度を見つけることです(図3)。商業顕微鏡はわずかに異なるアライメントプロトコルを有し、また完全に自動化される可能性があります。他の人は、臨界角条件の視覚化を容易にするための小さなカメラを持っているかもしれません。 - 適切な照明深さを選択し、エバネッセントフィールドの方向を最適化します(図3)。
注:浸透深さは、すべてのコントロールとサンプルに対して一定に保たれます。
3. TIRFイメージング:時系列のキャプチャ
- 256 x 256 ピクセル以上の対象領域 (ROI) を定義します。
注:この設定では、カメラのみを直接制御するソフトウェアの下でカメラ #2でキャプチャが行われます (図 1 の凡例を参照)。 - 露出を 1 ミリ秒、EM ゲインを 1,000 に設定します(これは eq. 12 および 13 の G 係数です)。このような速度では、レーザーパワーを調整または増加させる必要があるかもしれません。ここでレーザーパワーは0.5 mWです。
注:カメラの種類とタンパク質の拡散係数、蛍光強度、背景によって課される制限に応じて、レーザーパワーを設定するための一般的な基準は、検出器を飽和させ、光漂白を最小限に抑え、次のようにキャプチャすることではない。合理的なS/Nで可能な限り速く。EM ゲインは常にカメラの最大値に設定されます(「はじめに」を参照)。 - 初期条件下で最初のトライアル シーケンスを実行し、S/N 値を大まかに見積もります。条件は、最初の時系列の最初のフレームで測定された S/N = 2-3 以上で許容されます。
- カメラ #2を顕微鏡に接続する発光分割システムのスライダーを使用して、画像の側面をマスクします(図1B、図4A-B)
注:このセットアップでは、マルチチャンネルイメージングコネクタをカメラ#2に設置し、2つの空間的に同一の画像を同時に取得できるようにします。システムは異なった放出フィルターを取付けるためのスライドが装備されている。スライダの 1 つは、イメージの側面を覆うために黒いマスクを取り付けます。マスクされた領域は、各時系列の内部キャリブレーションに使用され、カメラパラメータ(eq. 12およびeq. 13)を決定する。このようにして、独立したキャリブレーションステップは不要であり、重要なことに、キャリブレーションは各時系列のキャプチャと並行して行われます。このシステムがない場合、カメラは公開されたプロトコル33を適用して較正することができる。 - カメラファイルの自動保存オプションを選択します。
- 画像シリーズの取得を開始します。最低S/N比2で最低700フレームを取得します。
注:分析に必要なフレームの数は、光脱白に対するサンプルの安定性とデータの分散によって異なります。したがって、各時系列の品質は、N&B 分析中に評価されます。 - 顕微鏡から皿を取り出さずに、リガンドを加えます。
- 明るい蛍光膜を持つ細胞を選択し、すぐに運動学的実行の最初の時系列を開始します。
注:リガンドの添加が迅速に行われる場合、この最初の捕捉は、リガンド動態の点=0時間を設定する。ソフトウェアは、キャプチャの正確な時間を登録します。 - 2 番目のセルを検索し、動力学の 2 番目の時間ポイントを取得します。
注:ポイント訪問ルーチンはX,Y,Z電動段階が装備されているいくつかの顕微鏡で利用できる。これらは、細胞皿上の複数の位置の暗記を可能にし、異なる細胞上の画像系列間のより一定の時間間隔を維持するのに役立ちます。 - キネティックランの各時点の新しいセルをキャプチャします。
注:キャプチャ後、セルは部分的にフォトブリーチされ、再画像化することはできません。このため、動力学は、多くの細胞の時系列を組み合わせることによって得られ、それぞれが異なる時点で捕捉される。 - 新しい料理ごとに、手順 2.3 から 3.9 のプロトコルを繰り返します。
注:参考料理の場合は、リガンドに使用した車両と同等の量の車両(0.01%ウシ血清アルブミンを添加)を追加します。
4. 数値と明るさ(N&B):時系列の品質チェック
- 変換して 名前を付けて保存します。カメラ ソフトウェア (この例では .sif ファイル) で取得したファイルを TIFF します。
- インポート。N&B グラフィカル ユーザー インターフェイス (GUI) MATLAB をアクティブにして、分析ソフトウェア ルーチン内の TIFF ファイルを作成します。
注:カスタマイズされた Matlab 実行可能 N&B ルーチンがここで使用されます (https://www.cnic.es/en/investigacion/2/1187/tecnologiaでの N&B 分析)。インポートした を開く。TIFFファイルは、ルーチンが平均強度画像、平均強度プロファイルを生成し、フレームごとにシリーズフレームを検査することを可能にする(補足図1)。その他のソフトウェアは、N&B分析(SimFCSソフトウェアなど)に利用できます。 - 平均強度プロファイルが10%以上の光脱白を示す廃棄系列と、取得時に明らかな細胞膜歪みまたは翻訳があったシリーズ。
- 明らかに焦点が合っていないフレームをトリミングします。
注:トリミング ツールは、イメージ シリーズ内の 1 つまたは複数のフレームを破棄するルーチンに実装されています。この操作は、フレーム間の時間が重要でないのに対し、ピクセルの住み込み時間 (露出時間) が重要であるために許可されます (ディスカッションを参照)。 - 少なくとも 500 時間枠の解析系列のみを保持します。
5. 数値と明るさ(N&B):カメラパラメータ(オフセット、σ、S)の決定
- ルーチンキャリブレーションカメラをアクティブにします。
- 検出器ノイズ領域で少なくとも20 x 50ピクセルの領域を選択します(図4)。
注:ルーチンは、値のヒストグラム(デジタルレベル、DLも定義)を生成し、周波数対デジタルレベルの対数プロットを返します。 - 対数周波数対デジタルレベルプロットで、線形赤カーソルを移動してガウスと曲線の直線部分を区切ります。
注:赤いカーソルは曲線の2つのセクションを分割し、カメラ応答のガウス関数の中心であるオフセット、ガウスフィットのσ、およびカメラのリコンポーズの直線部分の傾きであるS因子を返すルーチンをアクティブにします。e (図 4C-D)
6. 数値と明るさ (N&B): 選択した対象地域 (ROI) における B 値の計算
- Bキーをアクティブにします。
注:このアクションは、平均強度イメージ(図5、最初の列)と、個々のB値が画像内の関連ピクセルに関連付けられているBイメージを生成します(補足図1)。 - 最小ビン分割(2 2)を適用してデータの分散を減らし、B-Iヒストグラムを生成します(図5、2列目)。
注:B-I ヒストグラムは、画像のすべてのピクセルとピクセル強度の B 値の分布を表します。Y = B/S;X =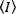 ( - オフセット)/S (補足図 1および eq. 11 および 15)。
( - オフセット)/S (補足図 1および eq. 11 および 15)。 - インタラクティブな正方形カーソルを使用して、B-Iヒストグラムを検査します。
- 分析用の正方形 ROI を選択します (図 5、3列目)。
注:カーソルは、平均強度イメージ上のモバイル マスクを同期し、正方形のカーソル領域内で選択されているピクセルを強調表示します (補足図 1)。この検査により、非常に強度の低い背景や領域を解析から除外することができる。 - 選択した ROI の B マップを生成します (図 5、4列目)。
- 選択範囲に関連付けられた B 値の ASCII ファイルを保存します。
- グラフィックソフトウェアにASCIIファイルをインポートしてデータの周波数分布を計算し、平均B値±S.E(図5、5列目)を取得します。
注:データが均質な場合、B値の周波数分布はガウス分布に近似します。 - eq. 15 を適用して、キ
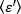 ネ
ネ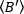 ティックランの各時点における各セルの平均輝度 = - 1 [(カウント/分子)]を各セルに導出します。次の方法に従ってデータを正規化します。
ティックランの各時点における各セルの平均輝度 = - 1 [(カウント/分子)]を各セルに導出します。次の方法に従ってデータを正規化します。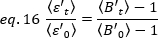
ここで、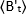 リガンド添加後の時間「t」で測定した平均B値、
リガンド添加後の時間「t」で測定した平均B値、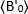 及び時間t=0(リガンド添加後10〜20s)で測定した平均B値である。
及び時間t=0(リガンド添加後10〜20s)で測定した平均B値である。
注:結果の正規化により、異なる日に行われる実験の直接比較が可能になります。レーザーパワーや技術的な変動による測定された明るさの違いを補正します。 - 正規化平均輝度と集録時間をプロットして、運動ランを構築します(図6)。
結果
同じ培養皿に播種された2つの代表的なHeLa-mEGFP-FGFR1細胞の結果を図5および補足表1に示す。2つの細胞は、FGF2リガンドを添加した後、時間0分(図5A、上)および7分(図5A、下)で捕捉した。
図5はまた、...
ディスカッション
N&B では、セル モデルとラベリング戦略を選択する際に、いくつかの予防措置が必要です。画像のキャプチャ時間中に安定して付着したままの生細胞にのみ適用できます。セル全体の剛性変位による余分な変動は、適切な画像復元アプローチ38で処理され得る。しかしながら、一般に細胞が移動すると、細胞膜も変形し、構造変形が起き、大きな余分な分散を生じ、膜タンパ...
開示事項
著者たちは何も開示する必要はない。
謝辞
CNICは、シエンシア省、イノバシオン・イ・ウニベルシダーデス、プロCNIC財団の支援を受けており、セベロ・オチョア・センター・オブ・エクセレンス(SEV-2015-0505)です。また、欧州地域開発基金(FEDER)「ウナ・マネラ・デ・ハーサー・エウロパ」の支援を受けています。UCは、アソシアツィオーネ・イタリアン・リケルカ・スル・カンクロ、国際がん研究協会(現在は世界がん研究)、イタリア保健省の支援を認めています。A.T.は、PVフェローシップ「プロゲット・プロイリタ・イヴァーノ・ベッキ」2011-2012で彼の作品を部分的にサポートした「フォンダツィオーネ・バンカ・デル・モンテ・ディ・ロンバルディア」を認めます。
資料
| Name | Company | Catalog Number | Comments |
| 3-Colour Fast TIRF Leica AM TIRF MC inverted microscope, with smi-automatic TIRF alignment. The microscope is equipped with a diode 488 nm laser, a 100x 1.46 oil TIRF objective, Ex/Em Bandpass filters at 490/20 and 525/50, temperature/CO2 incubator and Andor DU 8285 VP EMCCD camera. The microscope is operated by Leica LIF software. | Leica Microsystems, Wetzlar, Germany | ||
| Albumin from Bovine Serum 98% minimun | Sigma-Aldrich, St. Louis, MI, USA | A7906-100G | |
| DMEM without Phenol Red with 25 mM HEPES | GIBCO Thermo Fisher Scientific,Waltham, MA, USA | 21063029 | Used serum free for microscopy |
| DMEM high-glucose GlutaMAX I | GIBCO Thermo Fisher Scientific,Waltham, MA, USA | 10566-016 | Used for complete medium |
| Dulbecco's Phosphate Buffered Saline 10x (PBS) | Biowest, Nuaillé, France | X0515-500 | |
| Emission splitting system Photometrics DV2 | TeledynePhotometrics, Tucson, AZ, USA | ||
| Fetal Bovine Serum, qualified, Brazil | GIBCO Thermo Fisher Scientific,Waltham, MA, USA | 10270106 | 10% inactivated supplement for complete medium |
| Glass bottom 35 mm sterile 1.5 dishes | MatTek, Ashland, MA, USA | P35G-0.170-14-C | uncoated, glass thickness 0.17 microns |
| GraphPad Prism | GraphPad Software Inc., San Diego, CA, USA | ||
| Human cervical carcinoma (HeLa), serum-free animal component (AC) cells | Millipore-Sigma ECACC, Darmstadt, Germany | CB_08011102 | |
| iXonEM+ 897 EMCCD (back-illuminated) ANDOR camera controlled by ANDOR Solis software | Oxford Instruments, Andor TM Technology, Abingdon-on-Thames, UK | This camera, installed in an additional port of the microscope, is used for acquiring the N&B time series | |
| Matlab Executable N&B routine | Unit of Microscopy and Dynamic Imaging, CNIC, Madrid, Spain | download at https://www.cnic.es/en/investigacion/2/1187/tecnologia | |
| MatLab v.2018b | The MathWorks, Inc. Natick, MA, USA | https://www.mathworks.com/products/matlab.html | |
| Penicillin:Streptomycin for tissue culture 100x | Biowhittaker Inc. Walkersville, MD, USA | LONZA 17-602E | supplement for medium at Penicillin/Streptomycin 100 U/100µg. |
| pN1-mEGFP-FGFR1 expression vector | Unit of Gynecological Oncology Research, European Institute of Oncology IRCCS, Milan, Italy | Zamai et al., 2019 | |
| pN1-N-Gly-mEGFP-GPI expression vector | Unit of Microscopy and Dynamic Imaging, CNIC, Madrid, Spain | Hellriegel et al., 2011 | |
| pN1-N-Gly-mEGFP-mEGFP-GPI expression vector | Unit of Microscopy and Dynamic Imaging, CNIC, Madrid, Spain | Hellriegel et al., 2011 | |
| Recombinant FGF2 | PeproTech EC, Ltd., London, UK | Ligand solution: 20 ng/mL of FGF2 in PBS supplemented with 0.01%BSA. | |
| Sodium pyruvate GIBCO | ThermoFisher Scientific | 11360070 | 1 mM supplement for medium |
| TransIt-LT1 Transfection Reagent | MirusBio LLC, Madison, WI, USA | MIR 2300 | |
| Trypsin-EDTA (0.25%), phenol red | GIBCO Thermo Fisher Scientific,Waltham, MA, USA | 25200056 | |
| Type F Immersion liquid 10 mL | Leica Microsystems, Wetzlar, Germany | 11513 859 | |
| UltraPure BSA (50 mg/mL) | ThermoFisher Scientific | AM2618 | 0.1% supplement for medium without phenol red used for transfections |
参考文献
- Agwuegbo, U. C., Jonas, K. C. Molecular and functional insights into gonadotropin hormone receptor dimerization and oligomerization. Minerva Ginecologica. 70 (5), 539-548 (2018).
- Ferre, S., et al. G protein-coupled receptor oligomerization revisited: functional and pharmacological perspectives. Pharmacological Reviews. 66 (2), 413-434 (2014).
- Marsango, S., Ward, R. J., Alvarez-Curto, E., Milligan, G. Muscarinic receptor oligomerization. Neuropharmacology. 136 (Pt C), 401-410 (2018).
- Oishi, A., Cecon, E., Jockers, R. Melatonin Receptor Signaling: Impact of Receptor Oligomerization on Receptor Function. International Review of Cell and Molecular Biology. 338, 59-77 (2018).
- Thelen, M., Munoz, L. M., Rodriguez-Frade, J. M., Mellado, M. Chemokine receptor oligomerization: functional considerations. Current Opinion in Pharmacology. 10 (1), 38-43 (2010).
- Van Craenenbroeck, K. GPCR oligomerization: contribution to receptor biogenesis. Subcellular Biochemistry. 63, 43-65 (2012).
- Wnorowski, A., Jozwiak, K. Homo- and hetero-oligomerization of beta2-adrenergic receptor in receptor trafficking, signaling pathways and receptor pharmacology. Cell Signaling Technology. 26 (10), 2259-2265 (2014).
- Fricke, F., Dietz, M. S., Heilemann, M. Single-molecule methods to study membrane receptor oligomerization. Chemphyschem. 16 (4), 713-721 (2015).
- Vidi, P. A., Ejendal, K. F., Przybyla, J. A., Watts, V. J. Fluorescent protein complementation assays: new tools to study G protein-coupled receptor oligomerization and GPCR-mediated signaling. Molecular and Cellular Endocrinology. 331 (2), 185-193 (2011).
- Trussell, H. J., et al., Trussell, J., et al. . Academic Press Library in Signal Processing. 4, 3-9 (2014).
- Betzig, E., et al. Imaging intracellular fluorescent proteins at nanometer resolution. Science. 313 (5793), 1642-1645 (2006).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nature Methods. 3 (10), 793-795 (2006).
- Nagerl, U. V., Willig, K. I., Hein, B., Hell, S. W., Bonhoeffer, T. Live-cell imaging of dendritic spines by STED microscopy. Proceedings of the National Academy of Sciences of the United States of America. 105 (48), 18982-18987 (2008).
- Tsekouras, K., Custer, T. C., Jashnsaz, H., Walter, N. G., Presse, S. A novel method to accurately locate and count large numbers of steps by photobleaching. Molecular Biology of the Cell. 27 (22), 3601-3615 (2016).
- Godin, A. G., et al. Revealing protein oligomerization and densities in situ using spatial intensity distribution analysis. Proceedings of the National Academy of Sciences of the United States of America. 108 (17), 7010-7015 (2011).
- Qian, H., Elson, E. L. Distribution of molecular aggregation by analysis of fluctuation moments. Proceedings of the National Academy of Sciences of the United States of America. 87 (14), 5479-5483 (1990).
- Chen, Y., Muller, J. D., So, P. T., Gratton, E. The photon counting histogram in fluorescence fluctuation spectroscopy. Biophysical Journal. 77 (1), 553-567 (1999).
- Dalal, R. B., Digman, M. A., Horwitz, A. F., Vetri, V., Gratton, E. Determination of particle number and brightness using a laser scanning confocal microscope operating in the analog mode. Microscopy Research and Technique. 71 (1), 69-81 (2008).
- Unruh, J. R., Gratton, E. Analysis of molecular concentration and brightness from fluorescence fluctuation data with an electron multiplied CCD camera. Biophysical Journal. 95 (11), 5385-5398 (2008).
- Hess, S. T., Huang, S., Heikal, A. A., Webb, W. W. Biological and chemical applications of fluorescence correlation spectroscopy: a review. Biochemistry. 41 (3), 697-705 (2002).
- Muller, J. D., Chen, Y., Gratton, E. Fluorescence correlation spectroscopy. Methods in Enzymology. 361, 69-92 (2003).
- Levi, V., Ruan, Q., Kis-Petikova, K., Gratton, E. Scanning FCS, a novel method for three-dimensional particle tracking. Biochemical Society Transactions. 31 (Pt 5), 997-1000 (2003).
- Hinde, E., et al. Quantifying the dynamics of the oligomeric transcription factor STAT3 by pair correlation of molecular brightness. Nature Communications. 7, 11047 (2016).
- Waithe, D., et al. Optimized processing and analysis of conventional confocal microscopy generated scanning FCS data. Methods. 140-141, 62-73 (2018).
- Digman, M. A., Dalal, R., Horwitz, A. F., Gratton, E. Mapping the number of molecules and brightness in the laser scanning microscope. Biophysical Journal. 94 (6), 2320-2332 (2008).
- Ossato, G., et al. A two-step path to inclusion formation of huntingtin peptides revealed by number and brightness analysis. Biophysical Journal. 98 (12), 3078-3085 (2010).
- Nagy, P., Claus, J., Jovin, T. M., Arndt-Jovin, D. J. Distribution of resting and ligand-bound ErbB1 and ErbB2 receptor tyrosine kinases in living cells using number and brightness analysis. Proceedings of the National Academy of Sciences of the United States of America. 107 (38), 16524-16529 (2010).
- Ming, A. Y., et al. Dynamics and Distribution of Klothobeta (KLB) and fibroblast growth factor receptor-1 (FGFR1) in living cells reveal the fibroblast growth factor-21 (FGF21)-induced receptor complex. Journal of Biological Chemistry. 287 (24), 19997-20006 (2012).
- Ross, J. A., et al. Oligomerization state of dynamin 2 in cell membranes using TIRF and number and brightness analysis. Biophysical Journal. 100 (3), L15-L17 (2011).
- Hellriegel, C., Caiolfa, V. R., Corti, V., Sidenius, N., Zamai, M. Number and brightness image analysis reveals ATF-induced dimerization kinetics of uPAR in the cell membrane. FASEB J. 25 (9), 2883-2897 (2011).
- Zamai, M., et al. Number and brightness analysis reveals that NCAM and FGF2 elicit different assembly and dynamics of FGFR1 in live cells. Journal of Cell Science. 132 (1), (2019).
- Hassler, K., et al. Total internal reflection fluorescence correlation spectroscopy (TIR-FCS) with low background and high count-rate per molecule. Optics Express. 13 (19), 7415-7423 (2005).
- Di Rienzo, C., Gratton, E., Beltram, F., Cardarelli, F. From fast fluorescence imaging to molecular diffusion law on live cell membranes in a commercial microscope. Journal of Visualized Experiments. (92), e51994 (2014).
- Beenken, A., Mohammadi, M. The FGF family: biology, pathophysiology and therapy. Nature Reviews Drug Discovery. 8 (3), 235-253 (2009).
- Joubert, J., Sharma, D. Light microscopy digital imaging. Current Protocols in Cytometry. , (2011).
- Gell, C., Berndt, M., Enderlein, J., Diez, S. TIRF microscopy evanescent field calibration using tilted fluorescent microtubules. Journal of Microscopy. 234 (1), 38-46 (2009).
- Burghardt, T. P. Measuring incidence angle for through-the-objective total internal reflection fluorescence microscopy. Journal of Biomedical Optics. 17 (12), 126007 (2012).
- Trullo, A., Corti, V., Arza, E., Caiolfa, V. R., Zamai, M. Application limits and data correction in number of molecules and brightness analysis. Microscopy Research and Technique. 76 (11), 1135-1146 (2013).
- Caiolfa, V. R., et al. Monomer-dimer dynamics and distribution of GPI-anchored uPAR are determined by cell surface protein assemblies. Journal of Cell Biology. 179 (5), 1067-1082 (2007).
- Campbell, R. E., et al. A monomeric red fluorescent protein. Proceedings of the National Academy of Sciences of the United States of America. 99 (12), 7877-7882 (2002).
- Cutrale, F., et al. Using enhanced number and brightness to measure protein oligomerization dynamics in live cells. Nature Protocols. 14 (2), 616-638 (2019).
- Dunsing, V., Chiantia, S. A Fluorescence Fluctuation Spectroscopy Assay of Protein-Protein Interactions at Cell-Cell Contacts. Journal of Visualized Experiments. (142), (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved