Method Article
酵素結合免疫吸着アッセイ用エレクトロウェッティングベースのデジタルマイクロ流体プラットフォーム
要約
エレクトロウェッティングベースのデジタルマイクロ流体は、マイクロリットル体積液滴の見かけの接触角の電圧駆動変化を利用して、その操作を容易にする技術です。これを機能化された磁気ビーズと組み合わせることで、酵素結合免疫測定アッセイ(ELISA)を用いた複数の実験ユニット操作を組み合わせて、サンプル調製と病原体の同定を可能にします。
要約
エレクトロウェッティングは、表面電荷に露出した液滴の接触角を変更する効果です。エレクトロウェッティングオン誘電体(EWOD)は、薄い絶縁体フィルムの誘電特性を利用して電荷密度を高め、電気濡れ効果を高めます。電荷の存在は、疎水性表面全体に意図的な操作を可能にする液滴の電気的に誘発された広がりをもたらす。ここでは、酵素結合免疫吸着アッセイ法(ELISA)法の2種類を用いて、自動表面作動プラットフォームを用いて、4つのカテゴリーの抗原のサンプル処理と検出のためのEWODベースのプロトコルを実証する。ELISAは、特定の抗原を標的に選択できる固定化一次抗体を用いて磁気ビーズに対して行われる。HRPに結合した抗体は抗原に結合し、捕捉された病原体の定量のためにH2O2/ルミノールと混合される。6~10分の間のアッセイ完了時間が達成され、試薬の体積は微量に利用された。
概要
この提案された方法は、デジタルマイクロ流体(DMF)および磁気泳動分離を用いたEWODベースのアプローチを用いた抗原の定量的検出を用いたELISAの自動サンプル調製を容易にすることを目的とする。DMFが磁気ペーシスと組み合わせて、液体処理用途1に対する興味深い代替手段であることを複数の生物学的用途に対して実証されている。より具体的には、病原体の検出は、多くの分野において暗黙の側面であり、医療2から農業、環境3、4、国家安全保障5に至るまでである。病原体の脅威に対処できる検出技術は、高スループット(例えば、短時間のアッセイ時間)、効率(検出の低い限界 - LoD - と高感度)、および機能性6に対する特異性(標的病原体タイプ)を備えている必要があります。
これまで、EWODベースのDMFは、逆転写ポリメラーゼ連鎖反応(RT-PCR)、抗生物質耐性病原体(メチシリン耐性黄色ブドウ球菌またはMRSA)の検出、M.肺炎およびC.albicansに低予算のプリント基板チップと磁気opess7を使用して正常に実装されてきた。この技術は、ピローズケンシングおよび化学発光検出8を介したデオキシリボ核酸(DNA)変異の検出にも適用した。EWODベースのプラットフォームは、免疫測定アプリケーションの機能性も拡大し、単一の統合プラットフォーム内で同時にサンプルの回収と検出を可能にします。例えば、単一のEWODチップ設計は、全血サンプルからの心臓トロポニンIのビーズベースの免疫アッセイとMRSA検出のための別の実験RT-PCRの両方に対するポイントオブケアテストのためのDMFプラットフォームで成功を実証した。このチップは、液滴の蒸発を防止し、ナノリットルのボリュームの信頼性の高い自動操作を容易にする油フィラーを利用しています。多目的なバイオアプリケーションは、アッセイパラメータ最適化のための実験(DoE)試験の設計を含む、定量的均質および不均一な免疫アッセイ9、10をカバーする同様のDMFアプローチの実施と共に調査された。
微量の作業量による強化を処理する明らかなメリットにもかかわらず、油で満たされたDMFプラットフォームは困難であり、操作には一定の専門知識が必要です。油入れシステムは、密閉された部品を必要とするため、システムの輸送性が重要な特定の現場での用途には理想的ではありません。さらに、ZhaoおよびCho12、ヨンソン・ニジョウカら、Foatら14によって提案されたような表面上の乾燥材料収集を利用して、いくつかの特定の用途に使用することは不可能でない場合、油系システムは非常に困難であろう。これに対し、オイルフリーシステムは統合が簡単で、チップツーチップのサンプル翻訳が容易なという利点があります。これらの理由から、提案された方法は、油を必要としないDMFにEWODベースの免疫アッセイを提供し、効果的にデバイス操作を簡素化するために開発されました。
この貢献では、イムノアッセイのためのオーダーメイドの自立型完全自動DMFプラットフォームの使用について報告し、生体分子の迅速な検出のためのプロトコル、すなわちタンパク質、栄養細菌、細菌胞子およびウイルスについて詳しく説明します。EWODチップと磁性粒子の組み合わせにより、サンプル調製および免疫沈降を自動化し、さらに不一致のMS測定15を用いて実証されている。最近、はしかおよび風疹IgGに対する現場診断は、ウィーラーグループ16によってケニア北西部の遠隔地の人口で実証されている。ウィーラーと私たちのシステムの両方が、輸送可能で自己完結型であり、オンチップ、リアルタイムの化学発光測定を含めて完全に自動化され、利用可能な最も先進的なDMFバイオ検出システムの中で間違いなくです。
2つのシステムは非常に異なった適用を念頭に置いて設計されていた。ウィーラーのシステムは、バイオマーカーをターゲットにして患者にバイオメディカル診断を可能にしますが、バイオ検出システムは、以前に空気からサンプリングされた病原体を直接検出するための防御要件に基づいて構築されています。両者の類似性は、EWODベースの技術が影響を与えることができる生命に影響を与えるセクターの広い範囲を示す液滴作動の根底にある原則です。すなわち、DMFベースの検出プラットフォームと関連するEWODシステムは、健康(生物医学的診断)に重要な意味を見つけることができます。軍事および民間の保護(脅威の検出);アグリテック(作物モニタリング)と作業安全(制御環境モニタリング)
当社のDMFプラットフォームの性能は、ヒト血清アルブミン(HSA、球状タンパク質)、大腸菌(大腸菌、栄養細菌)、バチルスアトロファエウス(BG、細菌胞)およびMS2(バクテリオファージウイルス)の完全自動検出に対して評価されます。さらに重要なことに、提案されたDMF法は、捕獲抗体を交換して、この記事で考慮されている4つの抗原とは異なる他の抗原の検出を標的にすることができるという意味で非常に汎用性がある。抗体ベースのセンシングを完全に回避すると、DMFプラットフォームは、磁気ビーズがヌクレオチドの捕獲および/または検出のための特定のアプタマーを運ぶアプタマーバイオセンシングに基づいて潜在的なアプリケーションに構築することができます。高電圧波形発生器や駆動エレクトロニクスを含む統合された完全自収容型DMFプラットフォームを構成する異なるコンポーネントの設計と実現は、他の場所6に開示されている。
プロトコル
1. アッセイに必要な予備措置
注(重要):汚染を避けるために、すべての予備措置は無菌環境で行う必要があります。それはわさびペルオキシダーゼ(HRP)酵素の活性を阻害するであろうように、アジドナトリウムは、貯蔵のために使用すべきではありません。
- ランニングバッファー(100 mM HEPES、pH 7.5)を準備し、(4-(2-ヒドロキセチル)ピペラジン-1-エタンスルホン酸を使用し、Tween 80を0.01%(v/v)の濃度に加えます。
- サプライヤーが提供するプロトコルに従って、NHS活性磁気マイクロビーズの表面に一次抗体(捕捉抗体)を固定化する。磁気 IP/Co-IP キット (材料テーブル) プロトコルは、次の手順を含みます。
- アリコート 0.2 mL のビーズ (2 mg) をプラスチックチューブに入れ、上清を除去します。
- 1 mLの氷冷1mM HClを加えてビーズを洗います。
- 選択した抗体(抗ヒト血清アルブミン[15C7]、Rb抗BGポリクローナル、Rb抗大腸菌MRE 162ポリクローナルまたはヤギ抗MS2ポリクローナル)を結合し、67mMボレート緩衝液中の40μg/mL、37°Cで振盪するビーズに共有する。表1は、現在のプロトコルおよび抗原病原体6とで使用されるすべての抗体のリストを含む。
- 非結合抗体を0.8 mLの溶出バッファーで2回洗浄します。
- 1時間のクエンチングバッファーの1 mLで反応をクエンチ.
- 変更されたボレートバッファーでビーズを1回、IP Lysis/Washバッファで1回洗浄します。
- ビーズをIP Lysis/Washバッファーの0.5 mLに再サスペンドし、使用が必要になるまで4°Cで保管します。
注:最良の結果を得るために、マイクロビーズの新鮮なバッチは、EWOD分離およびELISAオンチップの前日に抗体に結合されます。しかしながら、一次抗体に結合したマイクロビーズは、1ヶ月までの4°Cで保存することができる。凝集が起こる場合は、バイアルをタップして沈殿物を破壊し、溶液中のビーズを再懸濁する。 - マイクロビーズを一晩ブロックし、マイクロビーズに最終濃度4 mg/mLを使用し、100 mMリン酸緩衝生理食塩基(PBS)のブロッカーカゼイン(1%w/v)でブロックします。
注:ブロッキングステップは、常にバイオ検出アッセイの実行の前日に行われます。 - 磁石を使用してブロッカーケービンからビーズを分離し、上清を取り除きます。
- ランニングバッファの1 mLで再サスペンドし、1分間混合します。
- 磁石を使ってビーズを分離し、上清を取り除きます。
- 上記の洗浄手順(1.2.10と1.2.11)を2回繰り返します。
注:3つの洗浄ステップは、表面へのビーズの付着を減らし、液滴の自由な動きを容易にするのに十分です。 - 2.5 mg/mLの濃度で、ランニングバッファー中のビーズを再懸濁します。マイクロビーズのこの溶液は、EWODチップで使用する準備ができています。
- ノイトラビジン結合西洋ワサビペルオキシダーゼ(HRP)と二次ビオチン化抗体の溶液をランニングバッファで1μg/mLのそれぞれについて最終濃度に調製する(BG検出6に使用)。
注:抗原(表1)の様々な濃度の二次ビオチン化抗体を標的とし、0.5〜4.0μg/mLの範囲で試験に成功した。 - アッセイを実行する直前に、ルミノールの等量を過酸化水素溶液と混合する
注:ルミノールは、抗原を標的とする二次抗体(例えば病原体)に共有結合されるHRP酵素に基づいて結合事象の数を定量するために使用される。しかしながら、化学発光とルミノールの代わりに検出17に対して、異なる報告分子および戦略を用いることができる。
2. EWODチップ部品の製造と表面処理
注:EWODチップは、パターン化されたクロム電極を備えた作動板で構成され、液滴の見かけの接触角とカバープレートを交互に切り替え、液滴の高さを定義します。
- 標準CADソフトウェアを使用して、2Dで電極とコネクタの設計を描きます。使用した溶剤を収納するために5 x 5mm2の寸法を持つ廃棄物収集パッドも含めます(図1)。
注:液滴を操作するためには、47個の電極を使用し、それぞれ1.7 x 1.7 mm2の寸法を持つ。この電極サイズは、1.5 μL から 3 μL までの液滴容積を収容します(500 μm のギャップ)。経験から、500 μmのギャップで作業する場合、1.5 μLは、作動可能な最小液滴サイズです。これは、正方形のパッドに外接している液滴(投影)輪郭に大まかに対応しています。しかし、流体の体の抵抗(摩擦)によって生じる以外に、理論的な制限はない。それでも、500 μmのギャップを使用して信頼性の高い作動のために、ボリュームが3μLを超えないようにすることをお勧めします。電極は48チャンネルの電子工学によって演説される。
注: パッドの設計寸法とサイズは、目的のボリュームと、プロトコルを構成するラボユニット操作(LUO)によって異なる場合があります。 - クロムマスクをガラス基板に印刷するためのマスク製造サービスに設計図面を送信します。クロム層の厚さは100nmである。
注:EWODチップの基板として使用されるフォトマスク上のクロム層は、定義上不透明である。各電極の設計には、半透明を確保するためのグリッドレイアウトが含まれています。 - 精密CNCダイシング/カッティングソーで56 x 56 mm2のサイズにプレートをカットします。
- 2つのコーティングステップでそれらを分離するために、電気接点の上にマスキングテープを貼り付けます。
- 表面に6μmのパリレン-Cを堆積させることで、プレートクロムガラス板を誘電体層でコーティングします。ゴーハムプロセス18は、パリレン蒸着システム(材料の表)でDPX-Cの7.4 gと使用されています。
- スピンコートアモルファスフルオロポリマー(材料表)をプレートの上に30sのスピンコーターで1500 rpmで使用し、140°Cで30分間焼きます。
注: これにより、サーフェスが疎水化されます。水滴を表面に置くことで、コーティングが正常に堆積したかどうかを検証できます。液滴とプレートの接触角度は110ºの領域でなければなりません。 - 電気接点からマスキングテープを取り外します。
- スピンコートアモルファスフルオロポリマー(材料表)は、4-inシリコンウエハーの上に30sのスピンコーターを1500 rpmで使用し、140°Cで30分間焼きます。
注:アッセイ中の離散液滴の滑らかな移動を容易にするために、作動プレートとカバープレートの表面の両方が疎水性である必要があります。
3. DMFプラットフォーム上でのEWODチップのロード、組み立て、および操作
注:EWODチップは、作動板と導電性の接地カバープレートとの間に0.5mmの正確に定義されたギャップを有するパラレルプレート構成を使用して動作します。このサンドイッチアセンブリは、現在のセクションで説明されています。
- DMFプラットフォーム6から蓋を取り外し、ベンチに置きます。
メモ:暗いファラデーケージチャンバーは、検出中に迷子の光や電磁干渉を防ぐために必要です。蓋にインターロックがないので、プラットフォームは私たちが液滴の動きを観察することを可能にします。 - 回転ステージにクリーンな作動板を置き、クロムを上向きにします。プレートは、凹んだステージの左上の角に揃える必要があります(図2A)。
- 47の接触ピンが付いたパネルを使用して、上から作動板をクランプします。これにより、プレートが所定の位置に固定され、接触ピンとの位置合わせが容易になります。
- 0.5 mmシムと2mmポリメチルメタクリレート(PMMA)セパレータを回転ステージ上に置き、作動とカバープレートの間に制御された隙間を提供します。
注:必要に応じて、次のステップの前に液滴を分ける前に、ウィッキングペーパーを廃棄物処理パッドに置くことができます。アッセイが進むにつれて、廃棄物は直接、アッセイの終了時に除去することができる紙に吸収される。 - 提案されたローディングパッドに液滴をロードします(図1)。
- ランニングバッファからB-、A-、R-、E-表記のパッドに4つの2.5μLの液滴をアリクォートし、各パッドに1滴。
- ルミノールのアリコート2.5 μL:H2O2(1:1、v/v)溶液をDで示すパッドに入れた。
- ノイトラビジンのアリコート2.5μLをHRP(1μg/mL)に結合してF表記のパッドにします。
- G-表記パッド上のビオチン化二次抗体(1μg/mL)のアリコート2.5μL。
- 共役一次抗体(2.5mg/mL)を有するマイクロビーズのアリコート2.5μLは、I表記のパッドに入ります。
- アリコート2.5 μLの未知試料をC-表記パッドに。
注: 提案されたロードパターンは実験的なレイアウトの一例に過ぎませんが、これらの変更がソフトウェアで定義された順序に一致する限り、ロードパターンはユーザのニーズに合わせて変更することができます(補足ファイル1)。
- カバープレートをリグの表面に、丸い凹部の領域の他に置き、凹部と作動板の上に横にスライドさせます(図2B)。
- カバープレートの上に永久磁石を置き、2つのラッチをスライドさせて固定します(図2C)。
- ステージを180°回転させ、ロードされた液滴がまだ所定の位置にある場合は、視覚的に検査します(図1C)。
注: 透明な段階と作動プレートの背面を通して、液滴の位置と形状を目で合わせることができるはずです(図2D)。ローディング電極パッドの上に丸い液滴が見られる場合、アッセイは実行する準備ができています。場合には、液滴が変位して磁石とカバープレートを取り外し、きれいなピペットで変位した液滴を回収し、再度ローディングパッドに置く。 - 各液滴のロード位置がソフトウェアのプログラムされた作動シーケンスと一致することを確認します(ソフトウェアの詳細については、補足ファイル1を参照)。
メモ:液滴の位置を視覚的に確認するには、光検出器をマウント解除する必要があります(図2D)。 - 「缶」を選んだ光検出器を回転ステージのスロットに配置します。
メモ:光検出システムは、光を追加することなく光収集を最大化するために大きな収集領域(10 x 10 mm2)を有するフォトダイオードの周りにピボットし、さらにノイズを最小限に抑えるためにトランスインピーダンスアンプ6を使用します。しかし、システムは非常に敏感であり、微分信号を収集することができます。騒音レベルを低減するために、多くのエレクトロニクスベースの戦略が実施されました(例えば、光検出システムは、スクリーニングされた「缶」と呼ばれる金属ケーシングであるファラデーケージに入れることによって保護されました)。 - 「缶」をスクリーニングした光検出器にケーブルを接続します。
注:EWODチップが光検出器と一致すると、DMFプラットフォームは完全に組み立てられ、動作する準備が整いました。 - DMFプラットフォームの上に蓋を置き、ハートフォードシャー大学で開発されたソフトウェアインターフェイスを使用してプログラムシーケンスを開始します。
注: CSV ファイルで時間の関数として液滴からルミネッセンスを読み取り、記録するために追加のソフトウェアが使用されます(補足ファイル 2を参照)。- プログラムされたシーケンス (補足ファイル 1を参照) プロンプト メッセージがインターフェイスに表示され、オペレーターに「ルミノール液滴は抽出された磁気ビーズを収集する準備ができている」または「検出液滴は検出部位に移動する準備ができている」ことを知らせます。どちらの場合も、順序を続行するには、オペレーターからの確認が必要です。
4. ビジュアルモードでの操作(プロトコルの最適化にはオプション)
注: 必要に応じて、すべての液滴ベースの動作を視覚化するために、アッセイはステップ 3.10-3.12 をスキップし、次の操作で置き換えることによって操作できます。
- ソフトウェア・インターフェースを使用して、プログラム・シーケンスを開始します。
注:ドロップレットの動きは、プロトコルの最適化時に便利なビジュアルモードでの動作中に観察することができます。まず、磁気分離動作の再現性を確認する。例えば、使用するビーズの量が少なすぎると、磁気分離が起こらないし、その逆もまた、ビーズの量が多すぎる場合、液滴はビーズペレットによって固定化され得る。第二に、ある液滴製剤として新しいアッセイの信頼性を確かめるために、観察によって検出できる作動障害を引き起こす可能性がある。 - プロンプトが表示されたら、回転ステージのスリットにスクリーニングされた光検出器「缶」をマウントします。
- ソケットにピンを挿入して、ケーブルをスクリーンリングされた光検出器に接続します。
- DMFプラットフォームの上に蓋をして、アッセイを再開します。
注:CSVファイルで時間の関数として液滴からの発光を読み取り、記録するための追加のソフトウェアを使用してください(補足ファイル2を参照)。
5. 液体廃棄物の除去とチップの洗浄
注意: クリーニングの前に、機器の電源がオフになっているか、電源 (コンピュータ、メイン) から切断されていることを確認してください。チップから生物学的サンプルを除去する際には、手袋、ラボコート、ゴーグル保護ガラス(PPE)を着用してください!
- 作動板上の電極および使用溶媒にアクセスするには、DMFプラットフォームの蓋を開き、ステージを180°回転させます。
- マグネットケースをアンヒンし、回転ステージから磁石を取り外し、ベンチに置きます。
- カバープレート、シリコンウェーハを取り外し、一対のピンセットでスリットから、DI水で洗い流し、圧縮空気で乾燥させ、ウエハーを貯蔵して再利用できるペトリ皿に入れます。
- マイクロピペットを使用して、表面に触れることなく、パッドから液体廃棄物を移動します。
- 吸水性紙(ろ材)を使用して、作動板から液体を拭き取って表面を洗浄します。
注:サーフェスをそのまま維持すると、作動プレートの寿命が長くなり、複数の用途が可能になります。 - クリーンなピペットを使用して、電極の表面を清潔なDI水滴で穏やかに掃いて、作動板を洗浄します。次に、ウィッキングペーパー(ろ材)で液滴を取り除きます。
注意:生体廃棄物で汚染された組織、書類、ピペットのチップ、手袋をバイオゴミ箱に処分してください。 - 別のアッセイには作動プレートを使用するか、DMFプラットフォームから取り外して保管またはリサイクルします。
結果
アッセイを行う最適条件を解明するために、作動電圧の衝撃を調べた。バッファからの液滴を様々な作動電圧で駆動し、その動きを記録した。この知見は、(図3)、二乗平均二乗作動電圧(Vrms)と平均速度との間に相関が存在したことを示した。しかし、Vrmsに対して高い値を使用すると、作動板の寿命が減少した。これらの結果に基づいて、標準作動電圧として105Vrmsが選択され、120Vrmsは抽出LUOに対してH2O2/ルミノール液滴に対して最も効果が得られ、165Vrmsが実現した。これらの電圧は、自動プログラミングシーケンス(補足ファイル1)に含まれていました。
2つのイムノアッセイ(図4)は、4つの異なる病原体に対してDMFプラットフォームを用いてEWODチップを使用して正常に試験した(表1)。EWODチップは、ローディングパッドから混合領域、そして最後に廃棄物への液滴の連続的な移動を促進しました。ELISAを完成させるためにプロトコル全体で繰り返された2つの基本的なLUOsがありました。最初は抽出 LUO です。ここで簡単に説明すると、懸濁ビーズを含む液滴を混合ゾーンの途中で分離部位に駆動し、磁石を自動的に活性化してチップに近づき、磁気ビーズをペレットにプールする(図5)。次に、液滴を廃棄物パッドの方へ移動させ、ビーズを作動プレートに残し、LUOの抽出を終えた。ミキシングは、EWODチップ上で行われる次のキーLUOでした。未知の濃度の病原体を有する検体サンプルを、エレクトロウェットによってビーズ上に移動した。次いで、混合領域(合計10パッド)上に束ビーズを持つ液滴を移動させてビーズを再懸濁した。これら2つのLUは、6~10分で病原体を連続して検出した小型で迅速かつ再現性の高いサンプル処理を促進するため不可欠でした。
必要なレベルの自動化を満たすために、プロトコルのバリエーションを導入することができます。例えば、ビーズを抗原枯渇液滴から分離し、その後、廃棄物パッドに移し、基本的な抽出LUOを繰り返した。この段階では、プロトコルは、検出抗体が既にHRPに結合したかどうかに応じて分岐し、異なる抗原の検出に合計8つのLUOsを効果的に使用した(図7A-C)。これらの場合、検出抗体を用いた液滴をビーズに持ち込み、次いで作動により混合した。あるいは、ノイトラビジン-HRPコンジュゲートへの検出抗体の結合は、EWODチップ上でシーケンシャルに行うことができ、大腸菌の定量について実証された(図7D)。両プロトコルは、8段階および10段階のELISA(図4)により、抗原の再現性検出を生じさせた。
インキュベーション時間およびコンジュゲート濃度を変化させ、アッセイに最適な条件を実験的に見つけ出した(図7A)。160sのインキュベーション時間と2μg/mLのコンジュゲート濃度は、信号強度の36%の増加とバックグラウンドノイズレベルの変化をほとんど伴う最高の信号対雑音比を達成したことがわかりました。代表的な結果セクションで使用されたすべての数値とデータは、以前の作業6から修正されました。
| 一次/捕獲抗体 | 検出抗体 | 抗原 |
| 抗ヒト血清アルブミン [15C7] (アンチHSA, アブカム ab10241) | 馬大根ペルオキシダーゼ(HRP)タグ付きアンチHSA [1A9] (Abcam ab24438) | ヒト血清アルブミン(HSA、アブカム) |
| Rb抗BGポリクローナル | ビオチン化Rb抗BGポリクローナル | B. グロビギ(BG)胞子 |
| Rb抗大腸菌MRE 162ポリクローナル | ビオチン化Rb抗大腸菌162 MREポリクローナル | 大腸菌 MRE 162 |
| ヤギの抗MS2ポリクローナル | ビオチン化Rb抗MS2ポリクローナル | MS2バクテリオファージウイルス |
表1:このプロトコルで試験した抗原および抗体。4種類の病原体抗原を用いて、DMFプラットフォームを用いたEWODチップの能力を実証した。
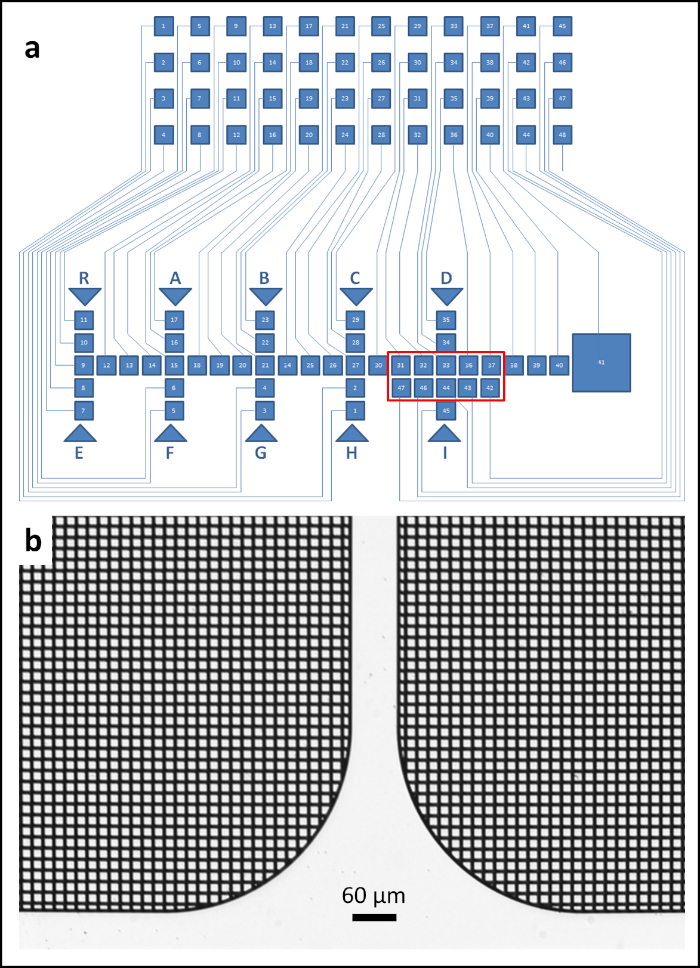
図1:EWODプレートの設計()EWOD作動板の概略表記法と、電極(正方形、底部)にリンクされたコネクタ(正方形、上)を用いたもの各パッドには番号が割り当てられ、ソフトウェアコード(補足ファイル1)からアドレス指定できます。ローディング電極パッドは矢印でマークされ、各パッドの上または下に大文字で示されます。DMFプラットフォームの主な機能は、10個のパッド(No.31、32、33、36、37、42、43、44、46、47)で構成されるミキシングゾーンです。視覚的なガイドとして、ミキシングゾーンは赤い長方形でマークされています。(b) パッドのマイクログリッド設計の顕微鏡写真。この図の大きなバージョンを表示するには、ここをクリックしてください。

図 2: デジタルマイクロ流体システム(DMF)アセンブリのコンポーネントと主要なステージ(A)EWOD作動板を固定し、回転ステージにシムを置き、液滴を積み込みます。(B)カバープレートを配置します。(C)マグネットケースを取り付け、ラッチを固定し、ステージを180°回転させます。(D)自動磁石が下向きになっている。液滴の位置と形状を調べ、プリント回路基板(PCB)ピンがEWODチップの接点と合っていることを確認し、光検出器を接続して光検出器スロットに入れます。制御エレクトロニクスをコンピュータに接続した後、システムはアッセイを実行する準備ができています。この図の大きなバージョンを表示するには、ここをクリックしてください。
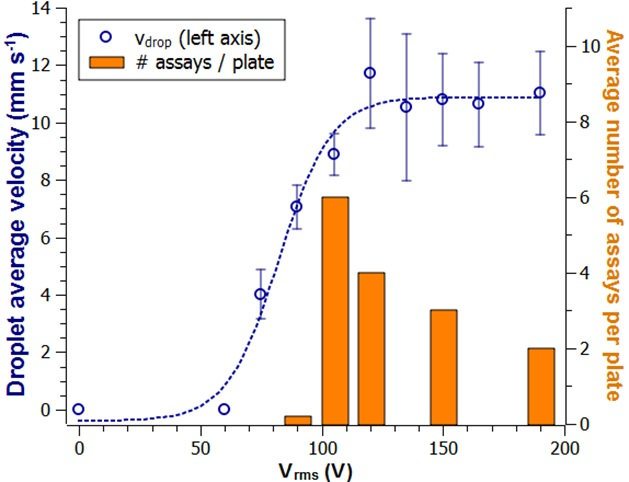
図3:作動プレートの繰り返し使用と作動電圧への影響ランニングバッファからの液滴の平均速度は、作動電圧(青い円)と3つの独立した測定値からの標準偏差(N =3)の関数としてプロットされます。ここでは、プレート当たりのアッセイ数(灰色の棒)は、より高い電圧での表面の高い減衰を示します。この図の大きなバージョンを表示するには、ここをクリックしてください。
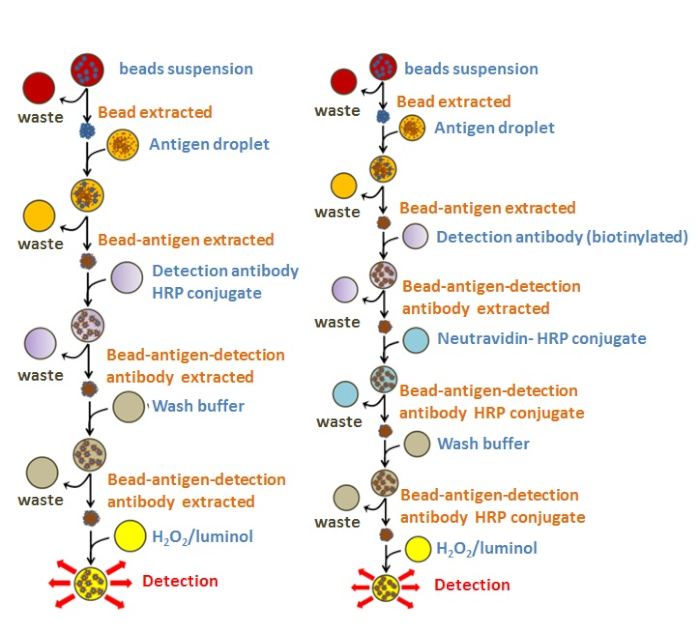
図4:EWODで試験した免疫アッセイの図この図の各円は、EWODチップにロードされた2.5 μLの体積を表しています。最初のプロトコル(左側)は、プレミックスされた抗体-HRPコンジュゲートを使用する8つのLUを示しています。一方、第2のプロトコルは、10のLUを包含し、ビオチン化検出抗体を別途添加し、ビオド抽出およびノイトラビジン-HRP共役体の連続結合を含む。この図の大きなバージョンを表示するには、ここをクリックしてください。

図5:磁気ビーズ抽出このプロセスは、(a-c)に分解され、混合ゾーンの中央にある磁気分離部位に懸濁した磁気ビーズを用いて液滴を作動させる(パッド33)、(d,e)磁石がビーズに焦点を合わせた位置に移動し、(f,g,h)ビーズは磁力によって所定の位置に保持され、液滴はEWODによって取り除かれる(41パッド)。 この図の大きなバージョンを表示するには、ここをクリックしてください。

図6:EWODを用いた完全な免疫測定配列は、試薬、サンプルローディングおよび実験室単位操作を示す。各行には、ドロップレットに対する特性操作のサンプルイメージのシーケンスが含まれます。操作は列に分割されます。混合は、黒い破線によって提示された懸濁液中のビーズのために行われません。液滴の方向は青い矢印で示され、ビーズはオレンジ色の矢印で画像の1つで強調表示されます。灰色のボックス(右下隅)は、検出領域の動きと位置を表す2つの画像を区切り、破線の円が検出領域を強調します。この図の大きなバージョンを表示するには、ここをクリックしてください。
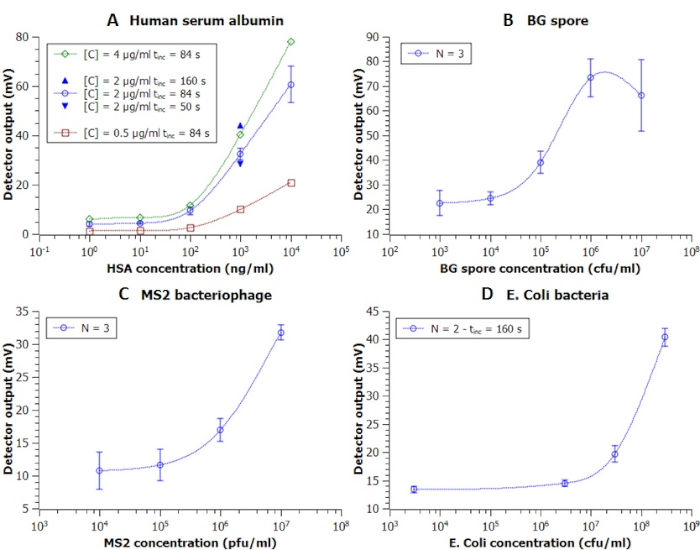
図7:DMFプラットフォームを用いたEWODチップ上で行われた免疫測定法の較正曲線以前に報告された6つの出力電圧(mV)対濃度が示されるように:(A)ヒト血清アルブミン、 コンジュゲート抗体濃度[C]とインキュベーション時間の効果を研究するために使用されるtincは、ビーズと既知のアナライトとの混合から抽出LUOまで、(B)B.アトロプヘウス(BG)胞子を示す免疫学的免疫、(C)MS2細菌ファージ免疫、および100-10種のプロトコール(100-DOs)の効果を測定した。 大腸菌.略称:コロニー形成ユニット(cfu)、プラーク形成ユニット(pfu)、独立実験数(N)、実験室単位操作(LUO)。前のパブリケーションから変更された図6.この図の大きなバージョンを表示するには、ここをクリックしてください。
補足ファイル 1: コンジュゲートとして Neutravidin-HRP を使用して自動 ELISA アッセイの DMF プラットフォームを実行するシーケンスを完了します。このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル2:化学発光測定用のGUIと、ソフトウェアを用した測定からの例を示す。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
EWOD免疫測定プロトコルは柔軟であり、試薬の種類、安定性およびアッセイプロトコルによって定義される使用要件に応じて、様々な数の実験室単位操作(例えば、捕捉抗原、混合、インキュベーション、ビーズ抽出、洗浄)を含むことができる。原理の証明として、現在の記事では、2つの免疫測定プロトコルが、記載されたEWODチップを用いて8または10のLUOs(図4)の実装を示していると考えられる。このような微細化のメリットは、マイクロリットルから、試薬の使用量を両方減らすことによりELISAの有効性を増大させる試薬/検体の離散量、操作当たりの所要時間、本質的には、実験時間の合計(6〜10分)である。さらに、アッセイは、変動を減少させ、免疫測定法17の精度を向上させる液滴の時限操作で自動化される。現在の形式では、実験は各アッセイの開始時に液滴を手動で処理することを含み、これは次のセクションでのさらなる議論のポイントです。
現在のDMF法における重要なステップの1つは、液滴をEWODチップの表面に分配することです。通常、使い捨てチップを持つマイクロピペットは、正確な容積を測定し、それをロードするために使用されます。しかし、使い捨て先端の液滴と荷電面との相互作用のために、作動板の疎水性表面上の液滴を固定化することは困難になる可能性がある。その結果、液滴はプレート上に残るのではなく、先端の外側の表面に従って撃つことができます。これを避けるために、マイクロピペットは、チップ表面に垂直な直立位置に、それに触れることなく、液滴を表面に接触させることによってローディングパッドに分配する必要があります。液滴がピペットチップに付着した場合は、それをストック液に戻し、チップを交換し、新鮮な液滴を再デポジットします。現在の概念実証システムのさらなる発展において、液滴の自動送達が想定される。
もう一つの重要なステップは、アッセイを実行する前に、平行版アセンブリの蓋を閉じることである。プロトコルで前述したように、蓋は作動板の上に滑らなければなりません。ふたの疎水性表面は、作動板に座っている液滴の歪みおよび変位を防ぐ。液滴の滑らかな動きを保証するために、手付かずの作動板、液滴およびチップアセンブリの正しいローディングを使用することを強く推奨する。作動性の版の再利用性は可能である;しかし、サイクル数は、作動電圧(図3)および表面への検分/試薬堆積、別名バイオフロンに依存する。提示されたプラットフォームは、クロム印刷されたEWODチップを利用し、各実験後に120Vの動作電圧と中間プレート洗浄で最大4回の連続測定に確実に再利用することができました。プレートをリサイクルし、実験あたりのコストを削減するために、バイオファウルされた非晶質フルオロポリマー(材料表)コーティングを除染(完全にすすくう前に希釈されていない洗浄剤で表面をブラッシング)し、プレートの上に新鮮なものをスピンコーティングした。しかし、作動板のリサイクルには、手動処理、高価な試薬(アモルファスフルオロポリマー(材料表))および特殊な機器(スピンコーター)が必要です。代替EWODチップは、紙19、アセテートフィルムまたはプリント基板(PCB)20、21などのコスト効率の高い基板で正常に調査される。このような使い捨て消耗品は、DMFプラットフォームの信頼性の高い手頃な価格の使用を容易にし、バイオフッキングの問題を回避する手段を提供することができます。
バイオフリングは、生物学的用途のためのEWODの主な制限22,23である。DMFに関する以前の研究では、バイオフォーフェリングに寄与する2つのメカニズム、すなわち疎水性相互作用による受動吸着、および電界が適用されたときに現れる静電駆動吸着法24が同定された。現在の記事の知見は、高い作動電圧での作動性プレートの再利用性の低下を文書化したので、この理論と一致している。考えられる説明の1つは、タンパク質がフルオロポリマーコーティングされた(テフロン様)表面に容易に吸着し、手付かずの表面24と比較して汚れた上でより速く凝集することである。その結果、DMFに関するタンパク質関連アッセイは定量化が困難であり、検体の喪失、クロスコンタミネーション、および減少した精度17を経験する可能性がある。最悪のシナリオは、重要な量のタンパク質吸着がデバイスを役に立たないことを示す場合です。バイオファウリングを最小限に抑えるために、チップ上の液滴の滞留時間を最小限にすることから、コーティング23を通じて、生体材料を含む液滴6,22への添加剤(すなわち、界面活性剤またはプルロン酸)への様々なアプローチが検討されている。したがって、EWODのイムノアッセイアッセイの重要な側面は、目の前の特定のプロトコルと互換性のある抗バイオフロン戦略を選択することです。
自動DMFプラットフォームは、試薬と検物質の両方にマイクロリットルボリュームを使用しながら、1回の実行につき1つのサンドイッチELISAテストを実行するように設計されています。それが必要とされる場合、従来のサンドイッチELISAキットは、予備コーティングされた96ウェルまたは384ウェルプレートに基づいて存在し、補助実験装置と組み合わせて、1回あたりのスループットが高くなります。試薬価格のみに基づき、アッセイ/ウェルあたりの概算コストはそれぞれ6.04 USD (580 USD/96) および 0.33 USD (2×580 USD/384) です。これにより、一元化されたラボ施設で訓練を受けた技術者によって通常処理される多数のサンプルに最適な従来のELISA法が実現します。しかし、遠隔地では、環境モニタリングのためのELISAの詳細なコスト分析では、資本コスト(すなわち、実験室の運営コスト、繰り返しコスト、サンプル輸送、物資および人員)がELISA当たりの実際の価格が含まれ、そのうち34 USDはサンプル25あたり供給のためであった。対照的に、提案されたDMFプラットフォームはポータブルであり、操作するために最小限の訓練を必要とし、事前にコーティングされたビーズで数分でサンプルから回答の分析を提供することができる。したがって、提示された技術は、必要なポイントの場所に展開し、他の方法で集中研究所で利用可能な分析を補完することができます。
代表的な結果セクションでは、自動DMF免疫測定プラットフォームを防御用途の病原体の直接検出に使用しました。DMFプラットフォームの他の可能なアプリケーションは、バイオ診断、連続監視および自動サンプリングを包含するが、これらに限定されない。DMFは、パーソナライズされた医療のためのポイントオブケアから、空中病院取得感染からの患者の保護のための制御された環境監視、農業のための作物監視システム、および食糧生産。
開示事項
著者たちは開示するものは何もない。
謝辞
マイクロ流体・マイクロエンジニアリング研究グループの、機械設計とシステム統合に関する研究に関する協力を受けていただき、ご協力をお受けいたします。著者らは、DMF技術とそのアプリケーションをさらに発展させる過去および進行中のプロジェクトに対する、彼らの貴重な支援と財政的貢献に対するDstl Porton Downに感謝したいと思います。
資料
| Name | Company | Catalog Number | Comments |
| (4-(2-Hydroxyethyl)piperazine-1-ethanesulfonic acid, HEPES | Sigma-Aldrich | H9897 | |
| Anti-Human Serum Albumin [15C7] | Abcam | ab10241 | |
| Anti-Human Serum Albumin [1A9] (HRP) | Abcam | ab24438 | |
| B. atrophaeus (BG) spores | Dstl, UK | N/a | |
| Biotinylated Rb anti-BG polyclonal | Dstl, UK | N/a | |
| Biotinylated Rb anti-E. coli MRE 162 polyclonal | Dstl, UK | N/a | |
| Biotinylated Rb anti-MS2 polyclonal | Dstl, UK | N/a | |
| Blocker Casein | Thermo Scientific | TFS 37582 | |
| CNC Dicing/Cutting Saw | MTI Corp, USA | SYJ-400 | |
| Cytop | AGC, Japan | CTL-809M | Amorphous fluoropolymers. This is a two component coating. |
| E. coli MRE 162 | Dstl, UK | N/a | |
| Goat anti-MS2 polyclonal | Dstl, UK | N/a | |
| Hamamatsu photodiode | Hamamatsu, Japan | S9270 | |
| Hidrochloric acid (32%) | Sigma-Aldrich | W530574 | |
| Mask manufacturing service | Compugraphics, Scotland, UK | N/a | |
| MS2 virus | Dstl, UK | N/a | |
| Parylene-C, DPX-C | Specialty Coating System, USA | CAS No.: 28804-46-8 | |
| Pierce Direct Magnetic IP/Co-IP Kit | Thermo Scientific | 88828 | Contains all buffers and reagents required for enzyme immobilisation. Store at 4 °C. |
| Rb anti-BG polyclonal | Dstl, UK | N/a | |
| Rb anti-E. coli MRE 162 polyclonal | Dstl, UK | N/a | |
| Recombinant Human Serum Albumin protein, HAS | Abcam | ab201876 | |
| SCS Parylene Deposition System | Specialty Coating System, USA | 2010 | |
| Silicon wafer, 4'', p-type, <100>, 1–10 Ωcm | Pi Kem Ltd | N/a | |
| Spin Coater | SÜSS MicroTec AG, Germany | ||
| SuperSignal ELISA Femto Maximum Sensitivity Substrate | Thermo Scientific | 37075 | It contains 50 mL of Luminol/ Enhancer and Stable Peroxide solutions. Store at 4 °C. |
| Tween 80 | Thermo Scientific | 28328 | The manifacturer is Surfact-Amps Detergent Solution. |
参考文献
- Kokalj, T., Pérez-Ruiz, E., Lammertyn, J. Building bio-assays with magnetic particles on a digital microfluidic platform. New Biotechnology. 32 (5), 485-503 (2015).
- Sista, R., et al. Development of a digital microfluidic platform for point of care testing. Lab on a Chip. 8 (12), 2091-2104 (2008).
- Starodubov, D., et al. Compact USB-powered mobile ELISA-based pathogen detection: design and implementation challenges. Advanced Environmental, Chemical, and Biological Sensing Technologies VIII. 8024, 80240 (2011).
- Delattre, C., et al. Macro to microfluidics system for biological environmental monitoring. Biosensors and Bioelectronics. 36 (1), 230-235 (2012).
- Gooding, J. J. Biosensor technology for detecting biological warfare agents: Recent progress and future trends. Analytica Chimica Acta. 559 (2), 137-151 (2006).
- Coudron, L., et al. Fully integrated digital microfluidics platform for automated immunoassay; A versatile tool for rapid, specific detection of a wide range of pathogens. Biosensors and Bioelectronics. 128, 52-60 (2019).
- Hua, Z., et al. Multiplexed Real-Time Polymerase Chain Reaction on a Digital Microfluidic Platform. Analytical Chemistry. 82 (6), 2310-2316 (2010).
- Zou, F., et al. real-time chemiluminescent detection of DNA mutation based on digital microfluidics and pyrosequencing. Biosensors and Bioelectronics. 126, 551-557 (2019).
- Ng, A. H. C., Choi, K., Luoma, R. P., Robinson, J. M., Wheeler, A. R. Digital microfluidic magnetic separation for particle-based immunoassays. Analytical Chemistry. 84 (20), 8805-8812 (2012).
- Vergauwe, N., et al. A versatile electrowetting-based digital microfluidic platform for quantitative homogeneous and heterogeneous bio-assays. Journal of Micromechanics and Microengineering. 21 (5), (2011).
- Choi, K., et al. Automated digital microfluidic platform for magnetic-particle-based immunoassays with optimization by design of experiments. Analytical Chemistry. 85 (20), 9638-9646 (2013).
- Zhao, Y., Cho, S. K. Microparticle sampling by electrowetting-actuated droplet sweeping. Lab on a Chip. 6 (1), 137-144 (2006).
- Jonsson-Niedziołka, M., et al. EWOD driven cleaning of bioparticles on hydrophobic and superhydrophobic surfaces. Lab on a Chip. 11 (3), 490-496 (2011).
- Foat, T. G., et al. A prototype personal aerosol sampler based on electrostatic precipitation and electrowetting-on-dielectric actuation of droplets. Journal of Aerosol Science. 95, 43-53 (2016).
- Seale, B., et al. Digital Microfluidics for Immunoprecipitation. Analytical Chemistry. 88 (20), 10223-10230 (2016).
- Ng, A. H. C., et al. A digital microfluidic system for serological immunoassays in remote settings. Science Translational Medicine. 10 (438), 6076-6088 (2018).
- Wild, D., Davies, C. Immunoassay fundamentals. The Immunoassay Handbook: Theory and Applications of Ligand Binding, ELISA and Related Techniques. , 1-26 (2013).
- Gorham, W. F. A New, General Synthetic Method for the Preparation of Linear Poly-p-xylylenes. Journal of Polymer Science Part A-1: Polymer Chemistry. 4 (12), 3027-3039 (1966).
- Soum, V., et al. Affordable fabrication of conductive electrodes and dielectric films for a paper-based digital microfluidic chip. Micromachines. 10 (2), (2019).
- Abdelgawad, M., Wheeler, A. R. Low-cost, rapid-prototyping of digital microfluidics devices. Microfluidics and Nanofluidics. 4 (4), 349-355 (2008).
- Jain, V., Devarasetty, V., Patrikar, R. Study of Two-Dimensional Open EWOD System using Printed Circuit Board Technology. Global Journal of Researches in Engineering: Electrical and Electronics Engineering. 17 (6), (2017).
- Luk, V. N., Mo, G. C. H., Wheeler, A. R. Pluronic additives: A solution to sticky problems in digital microfluidics. Langmuir. 24 (12), 6382-6389 (2008).
- Latip, E. N. A., et al. Protein droplet actuation on superhydrophobic surfaces: A new approach toward anti-biofouling electrowetting systems. RSC Advances. 7 (78), 49633-49648 (2017).
- Yoon, J. Y., Garrell, R. L. Preventing biomolecular adsorption in electrowetting-based biofluidic chips. Analytical Chemistry. 75 (19), 5097-5102 (2003).
- Dalvie, M. A., et al. Cost analysis of ELISA, solid-phase extraction, and solid-phase microextraction for the monitoring of pesticides in water. Environmental Research. 98 (1), 143-150 (2005).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved